Con el objetivo de reducir el número de resultados falsos reactivos al determinar los anticuerpos contra HTLV-1/2, se evaluaron algoritmos alternativos. De 20 210 muestras estudiadas, el 0,37 % (74/20 210) fueron reactivas por ELISA Murex Abbott. De estas, 23 se confirmaron positivas por inmunofluorescencia indirecta y 51 fueron negativas; valor predictivo positivo (VPP) 31,08 %. Al combinar ELISA Murex con aglutinación de partículas de gelatina (AP) y con ELISA MP, se obtuvieron los siguientes resultados: 26/74 resultaron reactivas por Murex y AP, VPP 88,5 %, y 32/74 reactivas con Murex y ELISA MP, VPP 71,8 %. Del análisis de la curva ROC se determinó que para un valor de RP de 4,74 por Murex, la sensibilidad, la especificidad, el VPP y el VPN son 100 %, 98,04 %, 95,8 % y 100 %, respectivamente. Proponemos que las muestras reactivas por ELISA Murex con RP ≤ 4,74 sean retesteadas por duplicado por AP, y que las que resulten concordantemente no reactivas sean definidas como negativas para HTLV-1/2.
Alternative algorithms were evaluated in order to reduce the number of false reactive results for antibodies against HTLV-1/2. From 20,210 samples tested, 0.37% (74/20,210) was reactive by ELISA Murex. Of these, 23 were confirmed as positive by the indirect immunofluorescence assay whereas 51 were negative, being the positive predictive value (PPV) 31.08%. From a combination of the ELISA Murex assay with the particle agglutination assay (PA) and ELISA MP, the following results were obtained: 26/74 were reactive by ELISA Murex and PA, PPV 88.5% and 32/74 were reactive by ELISA Murex and ELISA MP, PPV 71.8%. The ROC curve analysis determined that for an RP 4.74, the values for sensitivity, specificity, PPV and NPV by ELISA Murex were 100%, 98.04%, 95.8% and 100%, respectively. We propose that reactive samples by ELISA Murex with an RP ≤ 4.74 should be retested in duplicate by PA, and the resulting concordantly nonreactive samples should be defined as negative for HTLV-1/2.
Los virus linfotrópicos de células T humanas tipo 1 y 2 (HTLV-1/2) son retrovirus pertenecientes a la familia Retroviridae. Estos virus producen una infección persistente lenta en el huésped que infectan. El virus HTLV-1 es el agente etiológico de la leucemia/linfoma a células T del adulto (ATL) y de la paraparesia espástica tropical o mielopatía asociada al HTLV-1 (TSP/HAM)9. Está asociado, además, al desarrollo de otras entidades clínicas como artropatía inflamatoria crónica, síndrome de Sjögren, polimiositis, uveítis, alveolitis, estrongiloidiasis y dermatitis infecciosa9. Por otro lado, el virus HTLV-2 ha sido relacionado con neoplasias de células T y casos de enfermedad neurodegenerativa14, aunque su rol como agente productor de patologías permanece aún poco claro.
El HTLV-1/2 tiene una distribución mundial, se estima que en el mundo hay entre 15 y 25 millones de personas infectadas con HTLV-1 y que el riesgo de desarrollar alguna de las patologías asociadas al virus es del 3–5 %9. El HTLV-1 es endémico en Japón, especialmente en las islas del sudoeste, en determinadas regiones de África, Melanesia, en las islas Seychelles, Australia y algunos países de Sudamérica como Brasil, Venezuela, Colombia, Perú, Surinam, Guayana Francesa, Chile, Paraguay y Argentina. El virus HTLV-2 es endémico entre aborígenes de América Latina y algunas tribus de África9. En Argentina, se demostró que hay una región endémica para el virus en el norte del país, donde la prevalencia en donantes de sangre es entre 0,6 % y 1 % (Jujuy 1 %, Salta 0,7 %, Formosa 0,6 %), y otra región no endémica en el centro y sur del país, donde la prevalencia en donantes de sangre varía entre 0,01 % y 0,2 %8.
El diagnóstico de las infecciones por HTLV-1/2 se realiza mediante la detección de anticuerpos específicos en suero o plasma utilizando ensayos de tamizaje: inmunoensayo ligado a enzimas [enzyme linked immunosorbent assay (ELISA)] o aglutinación de partículas de gelatina (AP). Todas las muestras repetidamente reactivas por las pruebas de tamizaje requieren la confirmación de la presencia de anticuerpos específicos para HTLV-1/2 por metodologías confirmatorias. El Western blot (Wb) es la técnica de referencia para la confirmación de la infección y es la que define un resultado positivo o negativo para anticuerpos contra HTLV-1/29.
Existen diferentes criterios para clasificar una muestra como positiva; así, de acuerdo a la Organización Mundial de la Salud, una muestra es positiva para anticuerpos anti-HTLV-1 si presenta alguna banda específica correspondiente a las proteínas de los genes env, gp46 o gp62/68, y alguna de las bandas de las proteínas específicas de los genes gag, p19, p24 o p53. Por otro lado, el criterio de la Red Europea de Investigación es más estricto al definir una muestra como positiva, ya que es necesaria la presencia de las bandas correspondientes a p19 y p24 del gen gag, como así también las bandas correspondientes a las proteínas de la envoltura viral rgp21 y rgp46-I15.
Una proporción importante de muestras con resultados reactivos por ELISA para HTLV-1/2 resulta en un patrón de bandas insuficiente por Wb, presentando las muestras reactividad hacia uno o más de los antígenos incorporados en la prueba, pero con un perfil de bandas insuficiente para ser consideradas como positivas. Los individuos que presentan estos resultados son categorizados serológicamente como indeterminados. Estos perfiles indeterminados por Wb para HTLV-1/2 han sido descritos en todo el mundo y son más frecuentes en áreas tropicales1,9.
El agente o los agentes causales y la trascendencia médica del estado de indeterminado para HTLV-1/2 están en la actualidad poco claros. Se han sugerido varias explicaciones posibles, incluyendo: (I) reactividad cruzada con otros agentes infecciosos (por ejemplo, Plasmodium sp.), (II) infección con partículas de HTLV-1 defectivas, (III) infección con retrovirus nuevos que tienen alta homología con HTLV-1, y (IV) infección con HTLV-1 en individuos que presentan cargas virales que están por debajo del alcance de los métodos que se utilizan para la detección1.
Por otro lado, es importante mencionar que en la población de donantes de sangre es muy frecuente encontrar resultados falsos reactivos por las técnicas de tamizaje para HTLV-1/23,12, los cuales deben ser posteriormente confirmados por Wb y que en su mayoría resultan indeterminados. La frecuencia de los resultados indeterminados por Wb varía según la prevalencia del virus en la región, desde 0,02 % en áreas no endémicas a 10–50 % en áreas endémicas4,11,12. Debido a esto, resulta necesario evaluar y seleccionar el mejor algoritmo de tamizaje de anticuerpos contra HTLV-1/2 disponible en los bancos de sangre, con el objeto de reducir los resultados falsos reactivos que deben ser confirmados. Se han propuesto recientemente algoritmos alternativos de tamizaje para este virus, los cuales ya se están utilizando en bancos de sangre de otros países; estos algoritmos incorporan técnicas moleculares en el screening serológico2.
En nuestra experiencia, los resultados falsos reactivos por ELISA Murex Abbott que presentan en promedio una relación de positividad (RP = DO muestra/cut-off) de hasta 2, aproximadamente, resultan frecuentemente indeterminados persistentes por Wb. En un individuo con perfil indeterminado persistente por Wb, las técnicas de screening continúan resultando reactivas y el Wb indeterminado en muestras sucesivas obtenidas a diferentes tiempos, por lo que el diagnóstico permanece inconcluso. Esto se ha descrito frecuentemente en poblaciones como las de donantes de sangre2,11. Además, la presencia de dichos perfiles de Wb indeterminados en áreas no endémicas generalmente no estaría asociada a una infección por HTLV-1/21,2,11.
Con el objetivo de reducir el número de muestras reactivas que requieren ser confirmadas, en el presente trabajo se propone modificar el algoritmo de diagnóstico para HTLV-1/2 que se utiliza actualmente en nuestra institución, considerando en el algoritmo el valor del RP de la técnica de tamizaje utilizada en conjunto con la combinación de dos o más técnicas de tamizaje complementarias.
Desde octubre de 2011 a setiembre de 2012, en el Laboratorio de Serología Pre-transfusional del Laboratorio Central de la Provincia de Córdoba, Ministerio de Salud, se estudió un total de 20 210 muestras de suero correspondientes a donantes de sangre. La detección de anticuerpos específi cos contra el virus HTLV-1/2 en dichas muestras se realizó utilizando la técnica ELISA de Murex Abbott (HTLV-I+II, Murex Diagnostics, Datford, Reino Unido). Las muestras que resultaron reactivas por ELISA de Murex fueron retesteadas por las técnicas de aglutinación de partículas de gelatina (Serodia HTLV-1, Fujirebio Inc., Tokio, Japón) y ELISA (MP HTLV-I/II 4.0,MP Diagnostics), como técnicas de tamizaje complementarias. Todas las técnicas fueron realizadas y sus resultados interpretados siguiendo estrictamente las instrucciones del fabricante. La confirmación de las muestras con resultados reactivos por tamizaje se realizó por la técnica de inmunofluorescencia indirecta in house (IFI)5. Esta última técnica fue realizada siguiendo el procedimiento descrito previamente5.
De las 20 210 muestras estudiadas, el 0,37 % (74/20 210) fue reactivo por ELISA Murex. De estas, 23 fueron confirmadas como positivas por IFIy 51 como negativas, lo que resulta en un valor predictivo positivo (VPP) de la prueba de 31,08 % (23/74).
Al combinar la técnica de ELISA de Murex con las otras metodologías utilizadas, se obtuvieron los siguientes resultados: 26/74 muestras resultaron concordantemente reactivas por ELISA Murex y aglutinación de partículas de gelatina. De ellas, 23 fueron positivas por IFIy 3 negativas, lo que originó un VPP de 88,5 %. Al combinar el ELISA Murex con el ELISA MP, 32 muestras resultaron concordantemente reactivas. De ellas, 23 resultaron positivas por IFIy 9 negativas, lo que arroja un VPP de 71,8 %.
Al evaluar los valores de RP obtenidos por la técnica de ELISA Murex, se observó que de las 74 muestras reactivas, las 23 que resultaron positivas por IFItenían un RP entre 7,18 y 13,03. La mayoría de las muestras que se confirmaron como negativas tenían valores de RP bajos (entre 0,97 y 4,74), mientras que para una sola muestra negativa se obtuvo un RP de 9,33.
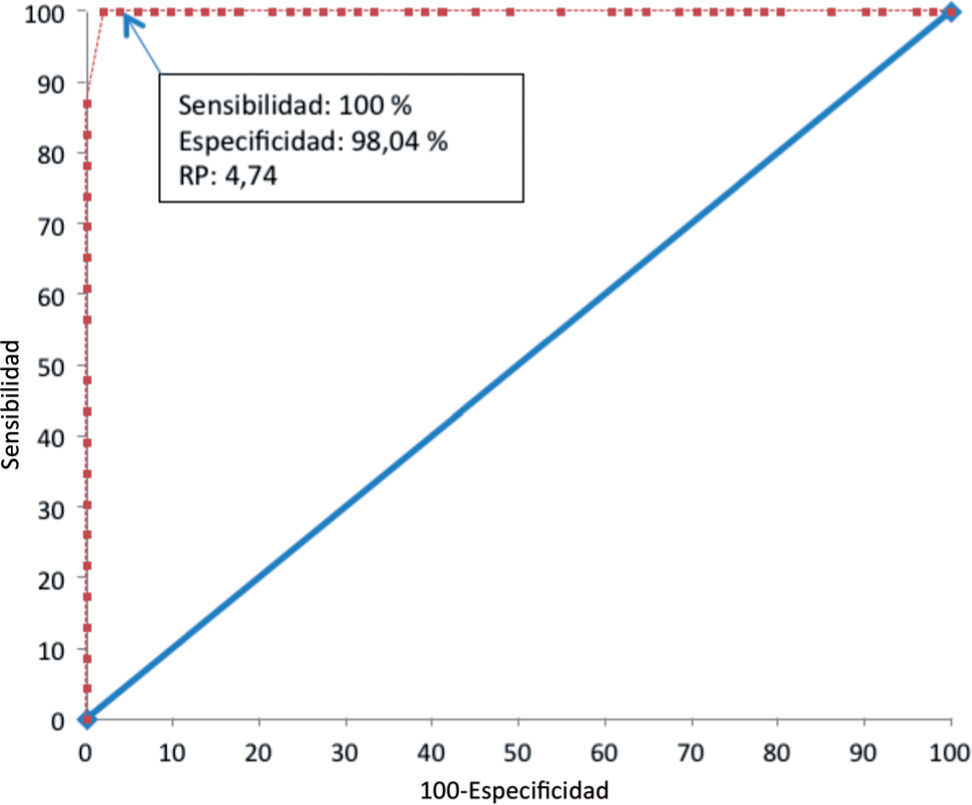
Se realizó un análisis estadístico basado en curva ROC utilizando el software MedCalc versión 12.3.0.0 (fig. 1). En este análisis se identificó el valor de RP de ELISA Murex para el cual la técnica alcanza una sensibilidad y una especificidad óptimas; se definió así el valor de RP por debajo del cual se encuentran la mayoría de los valores correspondientes a falsos positivos. En este análisis, para un valor de RP por ELISA Murex de 4,74, la sensibilidad fue de 100 % (IC 95 %: 85,2–100), especifi cidad 98,04 % (IC 95 %: 89,6–100), VPP 95,8 % (IC 95 %: 78,9–99,9) y el VPN de la prueba fue de 100 % (IC 95 %: 92,9–100).
Curva ROC para diferentes valores de RP de la técnica de ELISA Murex Abbott en la detección de anticuerpos contra HTLV-1/2. La sensibilidad y especificidad (95 % IC) son 100 % (85,2%–100 %) y 98,04 % (89,6 %–100 %) para un RP de 4,74. El área debajo de la curva es 0,997 (p<0,0001). RP: relación de positividad.
Los resultados reactivos por ELISA con perfiles de Wb indeterminados son muy frecuentes en poblaciones de bajo riesgo como los donantes de sangre, los cuales a menudo resultan ser falsos reactivos1,11,12. Esto genera un estado de ansiedad importante en el donante, ya que para definir el diagnóstico con frecuencia es necesario realizar un seguimiento serológico o recurrir a técnicas moleculares.
Actualmente en Argentina existen muchos inconvenientes para realizar la confirmación del diagnóstico de infección por los retrovirus HTLV-1/2. Esto se debe a que hay una escasa disponibilidad de equipos de Western blot comerciales y a que los equipos que se encuentran disponibles tienen un precio muy elevado. Estudios previos realizados en nuestro país demostraron la utilidad de la IFIcomo una sencilla y robusta técnica alternativa para la confirmación de la infección por HTLV-1/26,7,13,15.
En este trabajo se demostró que el valor predictivo positivo utilizando diferentes metodologías de tamizaje es mayor al combinar el ELISA de Murex con la técnica de AP (88,5 % vs. 31,08 %, p < 0,001), con lo que disminuye signifi cativamente el porcentaje de resultados falsos reactivos que surgen al utilizar solo la técnica de Murex. Además, se determinó que para un valor de RP de 4,74 por ELISA Murex, la sensibilidad del tamizaje es óptima, con una muy buena especificidad (98,04 %).
Por lo tanto, considerando los resultados obtenidos en el presente trabajo, se propone modificar el algoritmo para definir el estatus serológico de HTLV-1/2 que se utiliza actualmente, ya que mediante la combinación de metodologías de tamizaje es posible disminuir el número de muestras que requieren ser confirmadas. Las muestras que resulten reactivas por ELISA Murex para HTLV con valores de RP comprendidos entre 0,97 y 4,74 serán retesteadas por duplicado por AP como técnica de tamizaje complementaria. Así, las muestras que resulten no reactivas por AP serán consideradas con resultado final no reactivo, y no necesitarían ser confirmadas posteriormente. La técnica de AP tiene una alta sensibilidad y especificidad para la detección de anticuerpos contra HTLV-1 y HTLV-23,10,13.
El algoritmo aquí propuesto no solo permitirá una más rápida definición del diagnóstico y la reducción del porcentaje de diagnósticos inconclusos, sino que también contribuirá a evitar el estado de ansiedad y angustia que se genera en el donante de sangre al citarlo para informarle acerca de un estado serológico indefinido y de la necesidad de hacer estudios continuados en el tiempo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Dra. Silvia Barzón por su asesoramiento en el análisis estadístico realizado en este trabajo.