En un estudio exploratorio de roedores de la especie Rattus norvegicus de la provincia de Buenos Aires, se observó que ciertos metacestodos de tenias se encontraban enquistados en el hígado del hospedador. Nuestro objetivo fue identificar esta forma larval, basándonos en estudios morfológicos y moleculares. Para la caracterización molecular del parásito, se amplificó y secuenció el ADN ribosomal (28S) y mitocondrial (COI). Sobre la base de los datos tanto morfológicos como moleculares, y utilizando herramientas bioinformáticas, el metacestodo se identificó como Cysticercus fasciolaris. La forma adulta (Taenia taeniaeformis) comúnmente infecta hospedadores mamíferos félidos y cánidos. Esta es la primera vez que se caracteriza molecularmente este helminto, aislado de roedores de la provincia de Buenos Aires.
In a rodent (Rattus norvegicus) survey in Buenos Aires province, metacestodes of tapeworms were found encysted in the liver of the host. The aim of this work was the morphological and molecular identification of this parasite. To achieve the molecular characterization of the parasite, ribosomal (28S) and mitochondrial (COI) DNA were amplified and sequenced. Based on both morphological and molecular data using bioinformatic tools, the metacestode was identified as Cysticercus fasciolaris. The adult form of this tapeworm (Taenia taeniaeformis) commonly infects felid and canid mammalian hosts. This is the first report on the molecular identification of Cysticercus fasciolaris in Buenos Aires province (Argentina).
Entre los años 2008 y 2011, en un estudio exploratorio de roedores de la especie Rattus norvegicus realizado en los partidos de San Andrés de Giles, General Las Heras, Cañuelas, Exaltación de la Cruz y Marcos Paz (provincia de Buenos Aires), se observó que ciertos metacestodos de tenias se encontraban enquistados en los tejidos del hígado en el 39,5 % de los hospedadores recolectados (n=279). En la presente investigación nuestro objetivo fue identificar esta forma larval, basándonos en estudios morfológicos y moleculares.
Las relaciones filogenéticas de los cestodos ténidos se han construido utilizando la morfología, la especificidad de hospedador y los rasgos biológicos. Sin embargo, sigue siendo difícil llegar a una conclusión fiable sobre la relación filogenética entre los miembros de la familia Taeniidae7. En cuanto a la caracterización molecular, diversos estudios demostraron la existencia de variaciones interespecíficas para caracteres moleculares que resultan útiles para la definición de especies de Taenia. Mediante el empleo de técnicas de biología molecular, se han caracterizado muchas especies y genotipos nuevos de tenias2,5. El estudio del ADN ribosomal ha sido ampliamente utilizado para estudios taxonómicos. Los genes mitocondriales también se han utilizado para estudiar las relaciones filogenéticas, ya que tienen una tasa rápida de evolución6.
En el presente trabajo, el examen morfológico se realizó mediante la observación de la estructura de un ejemplar con una lupa Nikon, modelo SMZ800, a 4X. Para la caracterización molecular del parásito, se aisló y purificó el ADN genómico del quiste parasitario utilizando el DNAeasy Tissue Kit (QIAgen, Hilden, Alemania) siguiendo las instrucciones del fabricante. Se analizaron por PCR y posterior secuenciación dos secuencias de ADN: una región de la subunidad 1 citocromo c oxidasa del gen mitocondrial (COI) y una región de ADN ribosomal 28S (ADNr 28S). Para la amplificación por PCR de la COI, se utilizaron los siguientes cebadores: COI 1 (sentido): 5’-TTTTTTGGGCATCCTGAGGTTTAT-3’ y COI 2 (antisentido): 5’-AAAGAAAGAACATAATGAAAATG-3’1, y en la amplificación por PCR de la región de ADNr 28S, los cebadores fueron los siguientes: JB 10 (sentido): 5’ GATIACCCGCTGAACTTAAGCATAT3’ y JB9 (antisentido): 5’ GCTOCATTCACAAACACCCCGACTC 3’2. Para la detección de los productos de amplificación de ambas reacciones de PCR, se separaron 10 μl de amplicones mediante electroforesis en gel de agarosa al 1,5 %, los que fueron teñidos con bromuro de etidio. Luego, estos fueron purificados usando Wizard® SV Gel y PCR Clean-Up System (Promega, Madison, WI, EE.UU.). La secuenciación (ambos sentidos) se llevó a cabo usando un equipo ABI 3500×L Genetic Analyzer (Applied Biosystem) en el laboratorio de secuenciación de INTA Castelar (Buenos Aires, Argentina). Las secuencias obtenidas se analizaron utilizando los programas bioinformáticos BLAST y ClustalW2. La secuencia de ADNr 28S se presentó al GenBank para obtener su número de entrada. Los árboles filogenéticos del metacestodo se construyeron utilizando la plataforma Phylogeny. fr (http://www.phylogeny.fr/).
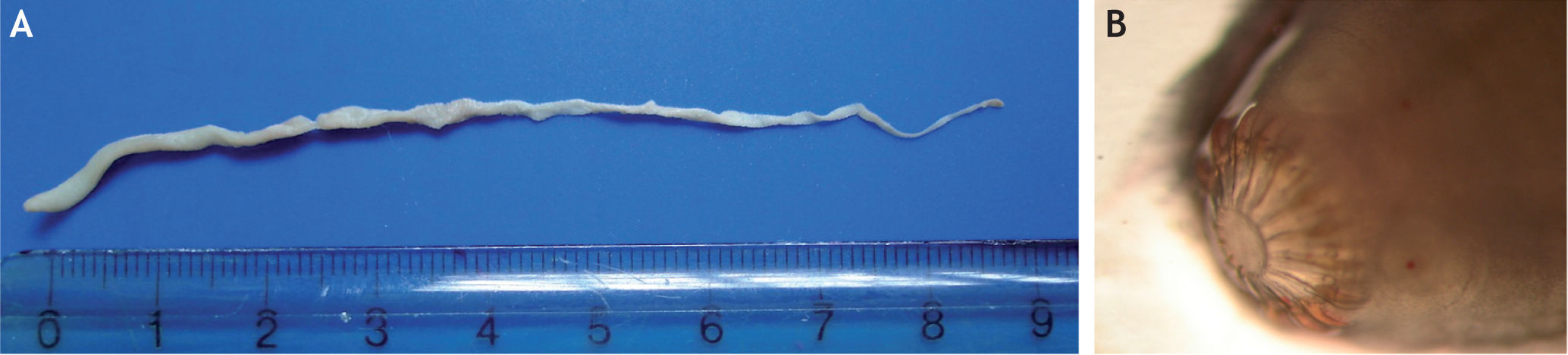
El examen morfológico del helminto reveló características típicas de un metacestodo estrobilocerco (familia Taeniidae) 8: el cuerpo medía 9cm de longitud, poseía un gran escólex de 0,9mm de largo y 1,1mm de ancho, cuatro ventosas laterales prominentes, rostelo armado con doble hilera de 32 ganchos, la hilera exterior de ganchos más grandes (0,40mm de longitud), la hilera interior de ganchos más pequeños (0,24mm), y el estróbilo segmentado terminaba con una vejiga (figs. 1A y 1B).
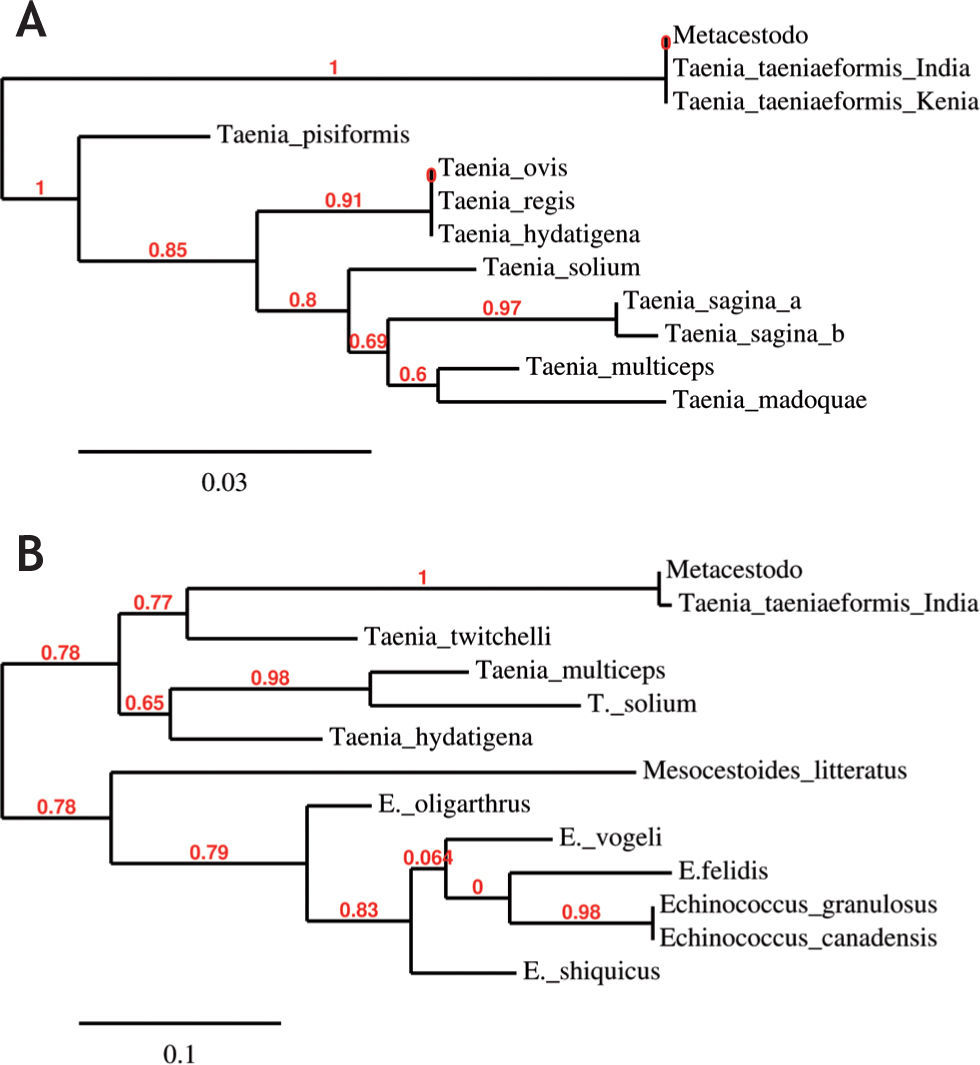
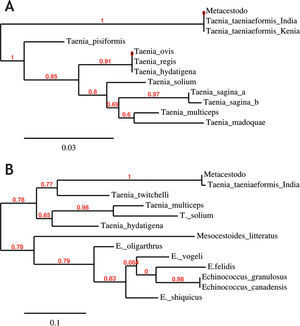
La amplificación por PCR del ADNr 28S y COI mostró, para cada uno de ellos, una única banda de 276 pb y 399 pb, respectivamente. Las secuencias de nucleótidos obtenidas a partir de los productos de PCR fueron comparadas con otras secuencias de cestodos disponibles en el GenBank. El resultado del BLAST para ambas secuencias (ADNr 28S y COI) mostró que el metacestodo estaría más cerca de las especies de Taenia, con máxima similitud con Taenia taeniaeformis (100 % y 99 % de identidad para las secuencias del ADNr 28S y COI, respectivamente). Los árboles filogenéticos se obtuvieron mediante la comparación de las secuencias analizadas con las de otras especies de cestodos, utilizando el método de máxima verosimilitud. Dichos árboles muestran una agrupación perfecta del metacestodo en estudio con T. taeniaeformis (figs. 2A y 2B). En el árbol construido para el ADNr 28S, la secuencia obtenida del metacestodo se coloca en el mismo grupo con los aislamientos de T. taeniaeformis de India (JN020350.1, JN020349.1) y Kenia (AM503314.1), con valores de bootstrap de 1 (fig. 2A).
Árboles filogenéticos del metacestodo en estudio para (A) ADNr 28S (Taenia pisiformis: AM503311.1, Taenia hydatigena: AM503305.1, Taenia saginata: AF096224.2, Taenia ovis: AM503310.1, Taenia regis: AM503309.1, Taenia taeniaeformis INDIA: JN020350.1, Taenia taeniaeformis KENIA: AM503314.1, Taenia taeniaeformis INDIA: JN020349.1, Taenia solium: AM503313.1, Taenia multiceps: AM503312.1, Taenia hydatigena: AM503305.1, Taenia madoquae: AM503307.1, Taenia saginata: AM503308.1) y (B) COI (Taenia taeniaeformis: FJ939135.1, Taenia twitchelli: AB731759.1, Echinococcus shiquicus: JF906151.1, Taenia multiceps: HM143884.1, Taenia hydatigena: JQ710605.1, Echinococcus granulosus: HQ231399.1, Mesocestoides litteratus: JF268517.1, Taenia solium: JN084224.1, Echinococcus felidis: EF558356.1, Echinococcus canadensis: AF525457.1, Echinococcus oligarthrus: ECCMTSEQK, Echinococcus vogeli: ECCMTSEQJ.) Los números sobre las ramas indican el valor del bootstrap.
El tamaño y el número de ganchos son características importantes para la identificación de especies de la familia Taeniidae. El metacestodo en estudio mostró claramente la presencia de dobles filas de ganchos y cuatro ventosas laterales, que son caracteres distintivos de T. taeniaeformis6 (fig. 1B).
Sobre la base de los datos tanto morfológicos como moleculares, y utilizando herramientas bioinformáticas, se pudo concluir que el helminto hallado en los quistes del hígado de R. norvegicus en el área de estudio es el metacestodo Cysticercus fasciolaris. La forma adulta, T. taeniaeformis, comúnmente infecta hospedadores mamíferos félidos y cánidos.
La importancia del presente trabajo radica en que es la primera vez que se caracteriza molecularmente este helminto, que infecta roedores que habitan en la provincia de Buenos Aires. El uso de la biología molecular para la caracterización de cestodos ha permitido obtener conclusiones fiables sobre la relación filogenética entre los miembros de la familia Taeniidae, en muchos casos difícil de obtener mediante el estudio morfológico únicamente7. Estos resultados son esperables, dado que existen informes previos de caracterizaciones morfológicas en la ciudad de Buenos Aires, donde se lo ha hallado con una frecuencia del 35 % en R. norvegicus3. Por otro lado, teniendo en cuenta el potencial zoonótico de T. taeniaeformis4, sería recomendable el control de los animales domésticos que puedan tomar contacto con los roedores que actúan como reservorio del parásito.
NotaLos datos de la secuencia de nucleótidos informados para la región de ADNr 28S de este trabajo se depositaron en el GenBank con el número de acceso JX419380.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue financiado por el laboratorio de Enfermedades Parasitarias del Instituto de Patobiología CICVyA. INTA Castelar y los subsidios UBACyT X609 y PICT-2007-01432.