Este trabajo tuvo como objetivo evaluar el efecto de rotaciones arroceras sobre la población de cianobacterias durante el ciclo de cultivo. El estudio se condujo en Entre Ríos (Argentina). Se evaluaron cuatro rotaciones: arroz-soja (AS); arroz-soja-maíz-soja (ASMS): arroz-arroz (AA) y arroz-pradera (AP). Muestras de suelo y agua se tomaron en cuatro estados del cultivo: implantación, macollaje, panoja embuchada y madurez fisiológica. El número potencial de cianobacterias fue menor en relación a otras áreas arroceras. Los menores recuentos se registraron en el período de implantación y los mayores en el de panoja embuchada. El análisis estadístico no mostró efecto de las rotaciones sobre el número de cianobacterias, aunque AA presentó la mayor abundancia. Se reconocieron un total de 13 géneros de cianobacterias Lyngbya, Oscillatoria,Plectonema, Spirulina, Anabaena, Nostoc, Aulosira, Calothrix, Gloeotrichia, Aphanocapsa,Croococcus, Mycrocystis y Gloeocapsa. La rotación AP registró la riqueza de géneros.Las rotaciones AS y AA presentaron mayor proporción de cianobacterias filamentosas. Los valores de biodiversidad de Simpson fueron bajos. Se concluyó que las rotaciones arroceras evaluadas tuvieron efecto sobre la proporción de cianobacterias unicelulares a filamentosas, los géneros presentes y la riqueza.
The aim of this study was to evaluate the effect of different rice rotations on cyanobacteria populations during the growing season. The study was conducted in Entre Ríos (Argentina). Four crop rotations were evaluated: rice-soybean (AS); rice-soybean-corn-soybean (ASMS); rice-rice (AA) and rice-pasture (AP). Soil and water samples were collected in 4 stages: implantation, tillering, booting and physiological maturity. The potential number of cyanobacteria population was lowerin relation to other rice sites previously reported. The lowest counts were recorded during implantation whereas the highest counts were obtained during booting. The statistical analysis showed no effect of rotation on the variable number of cyanobacteria, although AA was the most abundant. A total of 13 taxa were identified: Lyngbya, Oscillatoria, Plectonema, Spirulina, Anabaena, Nostoc, Aulosira, Calothrix, Gloeotrichia, Aphanocapsa, Croococcus, Mycrocystis and Gloeocapsa. AP rotation recorded the lowest number of genera. AS and AA had a higher proportion of filamentous cyanobacteria. Simpson's index was low. It was concluded that crop rotations had a differential effect on some aspects of cyanobacteria population such as the proportion of unicellular to filamentous cyanobacteria, genera presence and richness.
Las cianobacterias son procariotas autotróficos distribuidos en una variedad de ecosistemas. En arrozales contribuyen a la fertilidad del suelo por el proceso de fijación biológica de N15.
Diversos estudios dan cuenta de cómo el manejo de un lote y el crecimiento del arroz afectan la abundancia de las cianobacterias11. Sin embargo, poco se conoce sobre cómo influyen las rotaciones arroceras sobre estos microorganismos. En Entre Ríos (Argentina), el cultivo de arroz se realiza en suelos de los órdenes Vertisol y Alfisol, durante 2 o 3 años en el mismo lote, el cual permanece inundado gran parte del tiempo. Para evitar la disminución de los rendimientos, se realiza frecuentemente con pasturas, maíz y soja1.
Se ha documentado que las rotaciones tienen un efecto diferencial sobre algunas variables biológicas del suelo (N de la biomasa microbiana y potencial de mineralización de N por incubaciones anaeróbicas)1. Este trabajo tuvo como objetivo evaluar el efecto de las rotaciones que incluyen arroz sobre el número y la diversidad de cianobacterias nativas durante el ciclo del cultivo.
El estudio se condujo en un campo experimental del Departamento San Salvador (31°37’25.54”S 58°30’17.87”O), en Entre Ríos, Argentina, durante la campaña 2003-2004. La zona pertenece a la región climática templada húmeda de llanura. El suelo corresponde a un Vertisol, clasificado como Hapludert típico12. Se trabajó en un lote que luego de sembrarse con arroz en la campaña 99-00 se dividió en cuatro parcelas, en las que se implementaron las diferentes rotaciones: arroz-soja (AS); arroz-soja-maíz-soja (ASMS); arroz-arroz (AA) y arroz-pradera (AP). El agua de riego del cultivo fue de pozo. Las características físico-químicas de estos lotes fueron descriptas con anterioridad1. La siembra del arroz se realizó en octubre de 2003, y se efectuaron dos fertilizaciones: una de base y otra entre macollaje e inicio de diferenciación de panoja.
Durante el ciclo del cultivo se realizaron muestreos de suelo y agua. Se muestreó en cuatro etapas del cultivo: implantación (7 días de sembrado el cultivo), macollaje (34 días de sembrado el cultivo), panoja embuchada (75 días de sembrado el cultivo) y madurez fisiológica (136 días de sembrado el cultivo). Se trabajó con muestras compuestas tomadas al azar entre líneas del cultivo. Se tomaron tres muestras por situación. El muestreo de implantación se realizó cuando el suelo estaba seco5. Cuando el cultivo estaba inundado, se siguió la metodología propuesta para evaluar cianobacterias en arroceras10.
La abundancia potencial de cianobacterias se evaluó empleando la técnica del número más probable5,10. Se realizó una repetición por muestra. Los tubos sembrados fueron incubados a 25°C, con intensidad lumínica de 3.700lux y 12h de fotoperiodo, durante 21 días5,10.
Los resultados fueron expresados en cianobacterias/ml de agua y en cianobacterias/cm2 de suelo.
Los recuentos fueron transformados a logaritmo decimal para su análisis estadístico. Se usó el paquete estadístico InfoStat3 y se aplicó un análisis de la varianza de una vía y el test de mínima diferencia significativa (α≤0,05) de comparaciones múltiples. Se realizaron dos análisis, uno para establecer si existían diferencias entre las rotaciones para un mismo momento de muestreo (en las figuras se consigna con letras minúsculas); el otro para establecer si existían diferencias entre momentos de muestreo para una misma rotación (en las figuras se consigna con letras mayúsculas).
La identificación de los géneros se realizó sobre la base de las características morfológicas observadas en un microscopio trinocular Olympus CX31, de acuerdo con la bibliografía disponible7,8,14. Se realizaron tres observaciones por muestra. Para evaluar la biodiversidad se aplicó el índice de Simpson. La riqueza se calculó como el número de géneros diferentes observados en cada muestreo. Para el análisis de la composición florística, las cianobacterias se agruparon en unicelulares, filamentosas heterocísticas y filamentosas no heterocísticas14. La abundancia de cianobacterias mostró un patrón similar a lo largo del ciclo del arroz en todas las rotaciones, tanto en el agua como en el suelo.
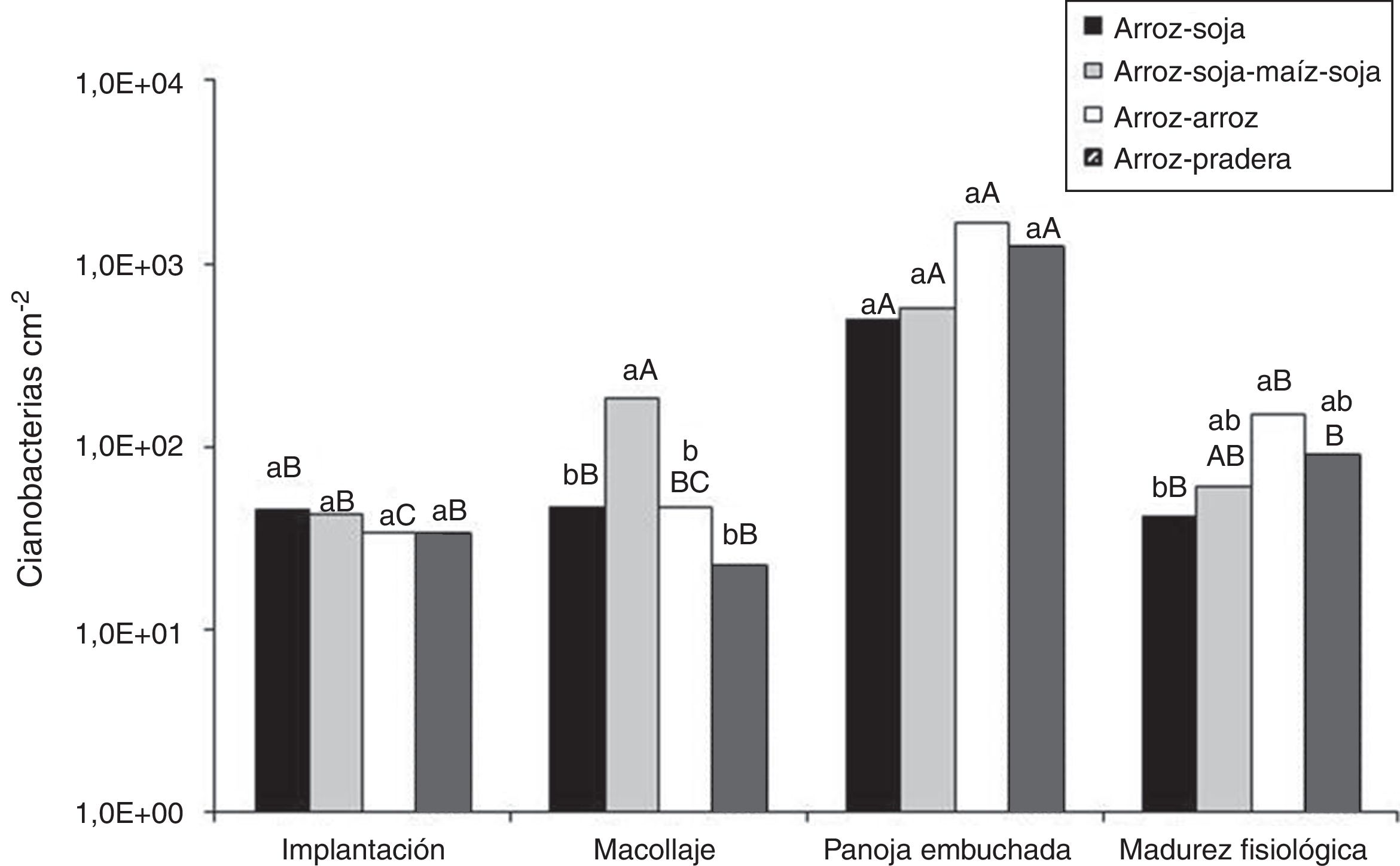
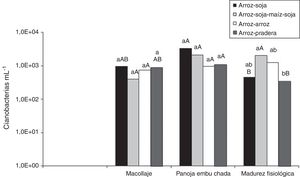
La figura 1 muestra la abundancia potencial de la población de cianobacterias en el suelo a lo largo de las diferentes etapas fenológicas del cultivo de arroz. Los menores valores se registraron en implantación y los mayores en panoja embuchada. En madurez fisiológica, los recuentos declinaron respecto de los de panoja embuchada, en proporciones entre el 89% y el 97%.
Evolución de la población de cianobacterias en el suelo a lo largo de las diferentes etapas fenológicas del cultivo de arroz. Letras minúsculas diferentes señalan diferencias significativas entre rotaciones para un mismo momento de muestreo (p≤0,05). Letras mayúsculas diferentes señalan diferencias significativas entre momentos de muestreo para una misma rotación (p≤0,05).
No se hallaron diferencias significativas (p≤0,05) del número de cianobacterias entre las diferentes rotaciones en la etapa de implantación. En el macollaje, el número de cianobacterias en la rotación ASMS fue significativamente superior que en las otras rotaciones analizadas. Si bien en las siguientes etapas fenológicas el análisis estadístico no mostró efecto de las rotaciones sobre el número de cianobacterias, la rotación AA fue la que presentó mayor abundancia en los dos últimos muestreos.
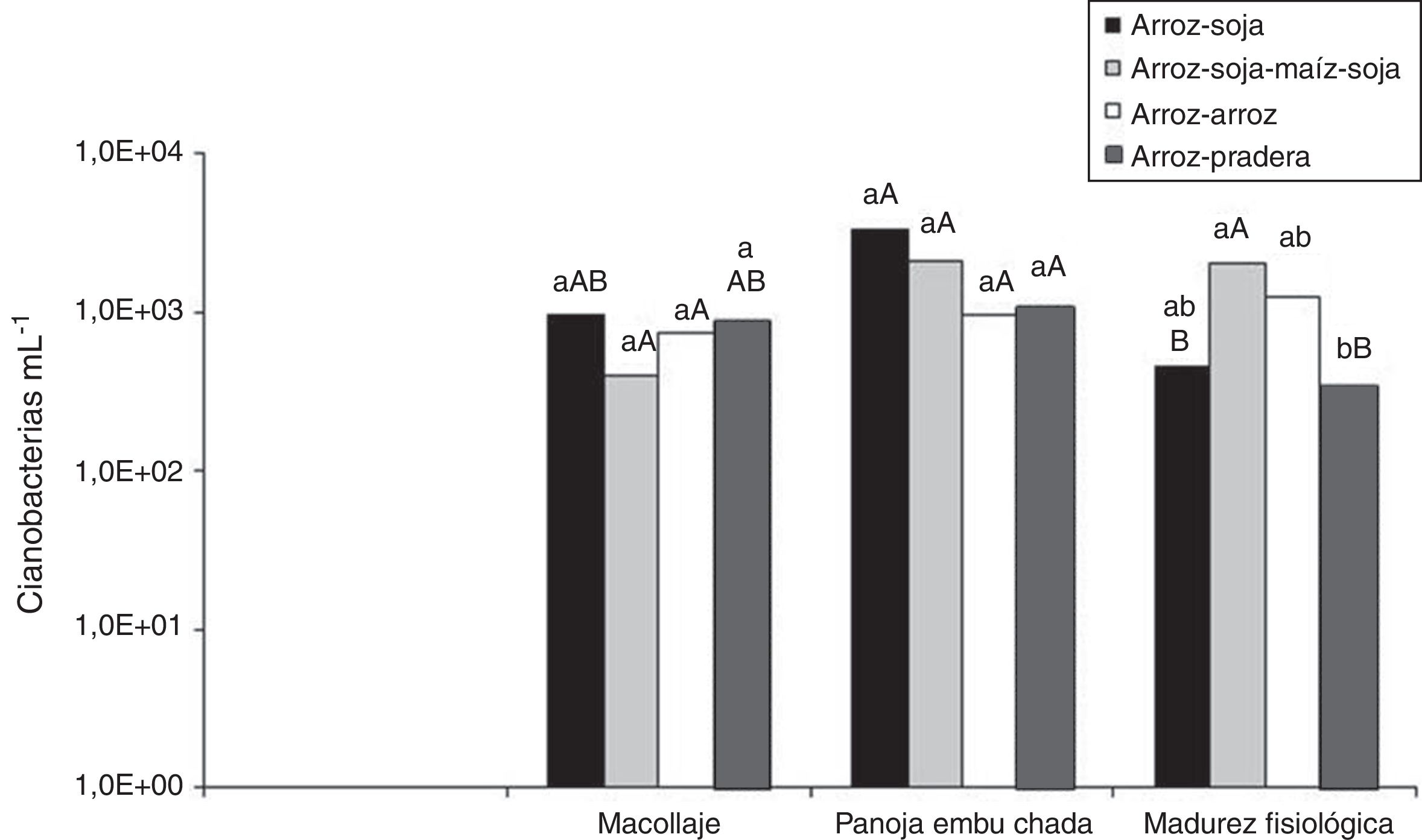
La figura 2 muestra los recuentos de cianobacterias en el agua de riego en las rotaciones. No hubo diferencias significativas (p≤0,05) asociadas a la rotación sobre la población de cianobacterias en el agua, aunque en madurez fisiológica, la rotación ASMS superó en número de cianobacterias en el agua a la rotación AP. Los recuentos aumentaron en panoja embuchada respecto de macollaje, aunque sin diferencias significativas, y disminuyeron en madurez fisiológica. En esta última etapa, los recuentos de las rotaciones AS y AP fueron significativamente inferiores respecto de los registrados en panoja embuchada.
Evolución de la población de cianobacterias en el agua en a lo largo de las diferentes etapas fenológicas del cultivo de arroz. Letras minúsculas diferentes señalan diferencias significativas entre rotaciones para un mismo momento de muestreo (p≤0,05). Letras mayúsculas diferentes señalan diferencias significativas entre momentos de muestreo para una misma rotación (p≤0,05).
Se reconocieron un total de 13 géneros, descriptos como propios de arroceras. Los géneros filamentosos no heterocísticos hallados fueron Lyngbya, Oscillatoria, Plectonema y Spirulina. Entre las filamentosas heterocísticas se identificaron Anabaena, Nostoc, Aulosira, Calothrix y Gloeotrichia, y los géneros unicelulares fueron Aphanocapsa, Chroococcus, Microcystis y Gloeocapsa.
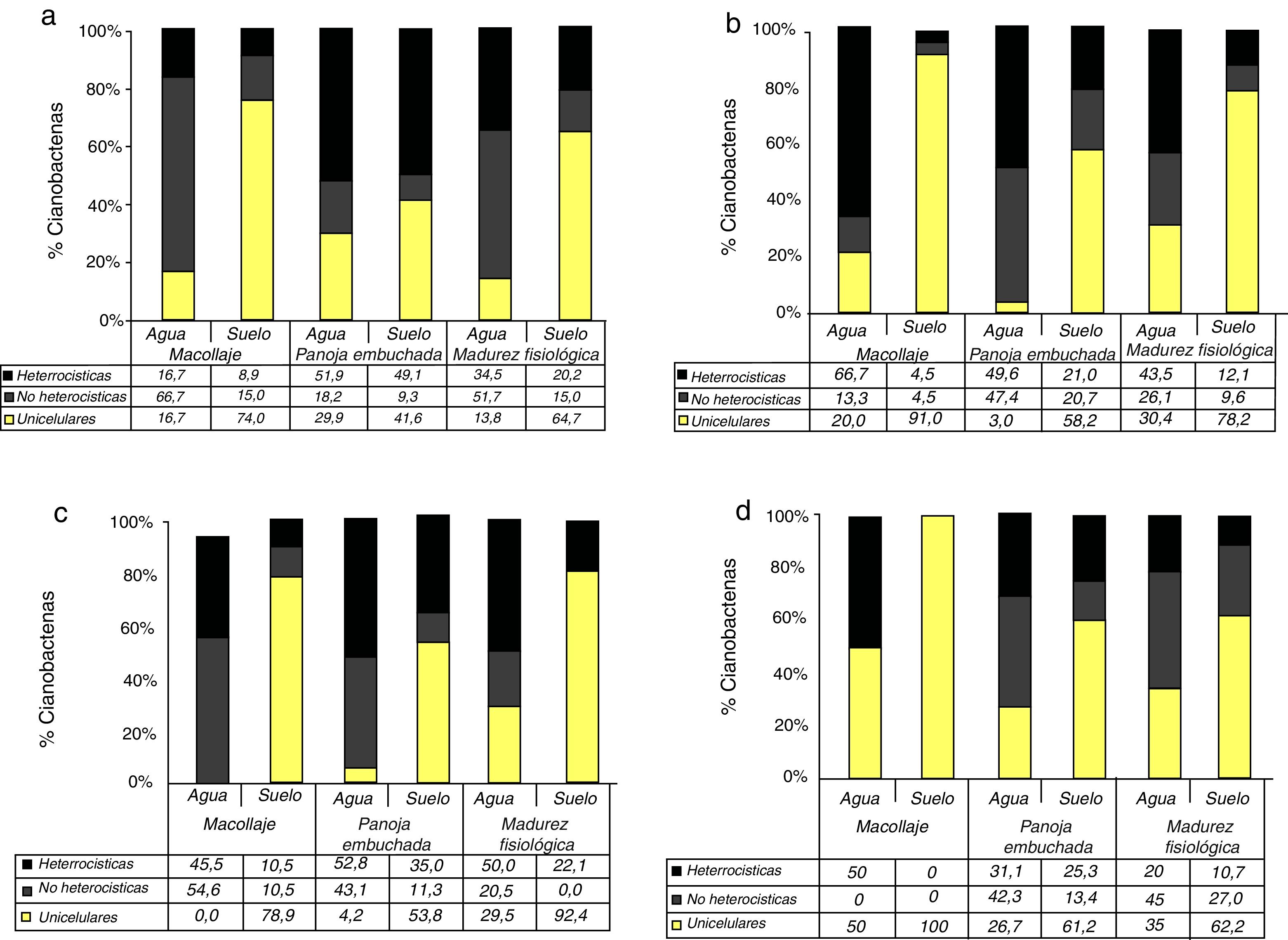
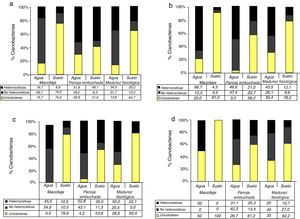
La figura 3 muestra los cambios en la distribución de los distintos grupos morfológicos de cianobacterias a lo largo del ciclo del arroz en el suelo y en el agua, en las diferentes rotaciones. En el suelo, al inicio del estudio la distribución de grupos fue similar en todas las rotaciones, con predominio de unicelulares. Este grupo experimentó una disminución en panoja embuchada y un posterior incremento al final del ciclo.
La rotación AP se caracterizó por presentar la mayor proporción de cianobacterias unicelulares, mientras que las rotaciones AS y AA fueron las que presentaron, en general, mayor proporción de cianobacterias filamentosas. Los valores de biodiversidad de Simpson hallados fueron bajos (menores de 0,6). En todas las rotaciones, la riqueza de géneros fue variable durante el ciclo del arroz, con un aumento a medida que el ciclo avanzaba. La rotación AA presentó la mayor riqueza de géneros, mientras que la rotación AP registró la menor.
Los géneros Calothrix y Spirulina aparecieron en forma esporádica. Gloeotrichia se encontró solo en la rotación AA, en los estadios de panoja embuchada y madurez fisiológica del arroz.
En el suelo fueron dominantes las cianobacterias unicelulares en la mayoría de los estadios. Entre las filamentosas, Anabaena se destacó por su abundancia en macollaje en las rotaciones AS, ASMS y AP. En la rotación AA, este género registró la mayor abundancia en madurez fisiológica, con un recuento de 1,1×103 cianobacterias/cm2.
En el agua, los géneros filamentosos fueron dominantes en casi todos los estadios del arroz, excepto en la rotación AP. En esta última, Chroococcus registró un recuento de 3,3×102 cianobacterias/ml. En macollaje, fueron dominantes en la rotación AA Lyngbya y Anabaena (6,7×102 y 5×102 cianobacterias/ml, respectivamente). En panoja embuchada, en la rotación AS fueron dominantes Anabaena y Lyngbya (5,5×103 cianobacterias/ml y 3×103 cianobacterias/ml, respectivamente). En el mismo estadio, con la rotación ASMS estos géneros alcanzaron recuentos de 1,2×104 cianobacterias/ml y 1,6×104 cianobacterias/ml, respectivamente, mientras que con la rotación AP, los recuentos de estos microorganismos fueron menores: 1,3×103 cianobacterias/ml y 2,7×103 cianobacterias/ml, respectivamente. En madurez fisiológica, Nostoc fue el género dominante en la rotación AA (2,8×103 cianobacterias/ml).
La población de cianobacterias en el suelo en arroceras de zonas templadas es un aspecto poco explorado6. Los datos hallados en Entre Ríos fueron bajos en comparación con lo reportado en zonas arroceras tradicionales y son atribuidos, entre otros factores, al pH del suelo. Los lotes analizados en este estudio presentaron valores entre 5,85 y 6,733, a diferencia de los sistemas evaluados en Italia, cuyos pH oscilaron entre 7,28 y 8,0315.
La dinámica de la población de cianobacterias se caracteriza por ser fluctuante a lo largo del ciclo del cultivo, tal como se describe en arroceras de Tailandia2, España9 y Uruguay4. En implantación, el laboreo y la desecación del suelo afectaron a las cianobacterias. El aumento de la población en macollaje respecto de la etapa de implantación se atribuye a las condiciones de humedad generadas por el riego. En las áreas arroceras de Tailandia, el número de cianobacterias es más fluctuante en relación con otros ecosistemas y está sujeto al régimen de precipitaciones2. El descenso de la población en madurez fisiológica se atribuye a la cobertura del cultivo, que dificulta la llegada de luz a los microorganismos2.
La abundancia de cianobacterias depende del manejo del sistema de producción del arroz. A diferencia de lo hallado en este estudio, en España, los recuentos más elevados coincidieron con el estadio de cosecha, lo que fue vinculado con las condiciones de saturación del suelo9. En Filipinas, donde la producción del arroz se realiza bajo inundación permanente, la máxima cantidad se alcanza en iniciación de panícula11, estadio anterior al analizado en el presente trabajo.
La mayor cantidad de cianobacterias en panoja embuchada y en madurez fisiológica en la rotación AA es atribuida al número de años que se cultiva el arroz en un mismo lote. Los lotes agrícolas en los que se cultiva el arroz de manera frecuente son los que presentan mayor número de cianobacterias, comparado con otros ecosistemas2,6. Sin embargo, en Italia se encontró que los lotes que tienen mayor número de cianobacterias son los que registran menores disturbios antrópicos (pasturas o campos abandonados)15.
Los recuentos en agua en el sistema tradicional (AA) fueron menores respecto de arroceras de España, donde se emplea agua superficial para el riego. Por las características fisiológicas de las cianobacterias, en agua superficial estos microorganismos se desarrollan antes de la inundación del lote9. En la rotación AP se observaron valores similares a los hallados en campos de arroz del Uruguay, que incluyen pasturas en su rotación4.
En general, la composición florística de cianobacterias hallada en Entre Ríos presenta similitudes con la descripta en otras zonas productoras13. De los 13 géneros reconocidos, 10 fueron identificados como componentes de campos de Corrientes (Argentina)8, lo que sugiere que estos microorganismos tienen gran capacidad de adaptación. La cantidad de géneros hallados en la rotación AA sugiere un efecto positivo del monocultivo de arroz sobre la riqueza de cianobacterias, de manera similar a lo que se informó en trabajos realizados en Tailandia2.
La preparación del suelo también afecta la distribución y sucesión de las cianobacterias en arroceras13,15. En este estudio, en la etapa de implantación se desarrollaron únicamente cianobacterias del grupo de las unicelulares.
La proporción de heterocísticas en la rotación AA contrasta con lo que informa un estudio realizado en España, en el que el 95% de las especies identificadas pertenecían a este grupo9.
Los valores de biodiversidad de Simpson hallados en este trabajo son indicadores del predominio de un género en relación con el resto. La menor riqueza de cianobacterias hallada en la rotación AP se atribuye a una evolución diferencial de la población microbiana, en la que pudieron haberse visto favorecidos otros grupos microbianos. Esta rotación presentó los mayores valores de C y N de la biomasa microbiana1.
A diferencia del sistema arroz-pasturas de Uruguay, no se encontró Gloeotrichia en la rotación AP de este estudio. La presencia de dicha especie en el citado informe fue atribuida al deterioro provocado por el pisoteo de los animales4. Cabe señalar que, en este trabajo, la pastura se destinó al corte y no al pastoreo.
Los resultados obtenidos permiten concluir que el número de cianobacterias totales en los arrozales no se vio afectado de manera significativa por las rotaciones. Los géneros identificados son los mencionados como propios de arroceras de Asia y España. La riqueza en cianobacterias se incrementó en relación con la frecuencia de cultivo del lote, de modo que la rotación AA fue la que presentó el mayor número de géneros, con predominio de cianobacterias filamentosas.
FinanciamientoEste trabajo fue financiado por la Universidad Nacional de Entre Ríos (UNER).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.