Las toneladas de residuos orgánicos que se generan anualmente en la agroindustria pueden aprovecharse como materia prima para la producción de metano. Para que los residuos orgánicos se puedan convertir a metano a gran escala, es importante que previamente se realicen sobre ellos pruebas de biodegradabilidad; un parámetro importante que conviene establecer es su potencial bioquímico de metano. En el presente trabajo se estudió la biodegradabilidad, la producción de metano y el comportamiento de poblaciones de eubacterias y arqueobacterias durante la digestión anaerobia de residuos de plátano, mango y papaya provenientes de la agroindustria, adicionando un inóculo microbiano. Los residuos de mango y plátano tenían mayor contenido de materia orgánica (94 y 75%, respectivamente) que el residuo de papaya con base en su relación sólidos volátiles/sólidos totales. Después de 63 días de tratamiento, la mayor producción de metano se observó en la digestión anaerobia del residuo de plátano: 63,89ml de metano por g de demanda química de oxígeno del residuo. Los resultados del potencial bioquímico de metano demostraron que el residuo de plátano tiene el mejor potencial para ser usado como materia prima en la producción de metano. A través de un análisis por PCR-DGGE con oligonucleótidos específicos se logró evaluar el tamaño y la composición de las poblaciones de eubacterias y arqueobacterias presentes en la digestión anaerobia de residuos agroindustriales a lo largo del proceso.
The tons of organic waste that are annually generated by agro-industry, can be used as raw material for methane production. For this reason, it is important to previously perform biodegradability tests to organic wastes for their full scale methanization. This paper addresses biodegradability, methane production and the behavior of populations of eubacteria and archaeabacteria during anaerobic digestion of banana, mango and papaya agroindustrial wastes. Mango and banana wastes had higher organic matter content than papaya in terms of their volatile solids and total solid rate (94 and 75% respectively). After 63 days of treatment, the highest methane production was observed in banana waste anaerobic digestion: 63.89ml CH4/per gram of chemical oxygen demand of the waste. In the PCR-DGGE molecular analysis, different genomic footprints with oligonucleotides for eubacteria and archeobacteria were found. Biochemical methane potential results proved that banana wastes have the best potential to be used as raw material for methane production. The result of a PCR- DGGE analysis using specific oligonucleotides enabled to identify the behavior of populations of eubacteria and archaeabacteria present during the anaerobic digestion of agroindustrial wastes throughout the process.
En México se generan anualmente cerca de 76 millones de toneladas de residuos orgánicos de frutas (limón, peras, manzanas, papaya, piña, plátano, naranja) y vegetales (maíz, caña de azúcar, frijol, col, zanahoria, tomate, lechuga, papa)11,24. Estos residuos, provenientes de la industria de alimentos así como del sector agroindustrial y doméstico, entre otros, pueden ser aprovechados a través de la tecnología de la digestión anaerobia12,24,26,27.
La digestión anaerobia es un proceso que involucra la transformación de la materia orgánica en biogás (metano, 60-70%; dióxido de carbono, 30-40%)2. Durante este proceso participan varios grupos de microorganismos que llevan a cabo un metabolismo coordinado en cuatro etapas: la primera es la hidrólisis, donde la materia orgánica es fermentada, produciendo compuestos sencillos (monómeros); la segunda es la acidogénesis, que produce ácidos orgánicos; la tercera es la acetogénesis, caracterizada por la formación de acetatos, propionatos y butiratos, y finalmente, la cuarta etapa es la metanogénesis, donde microorganismos producen metano a través de la ruta acetotrófica e hidrogenotrófica7,16,27.
Durante estas etapas, los principales factores ambientales que gobiernan el proceso son la temperatura, que debe ajustarse a un régimen mesofílico (25 a 40°C) o termofílico (45 a 60°C)17; el potencial rédox, que debe ser negativo (−220mV); y el pH, que debe estar entre 6,7 y 7,49,13. La composición bromatológica de los residuos orgánicos también influye sobre la eficiencia de producción de metano, ya que el contenido en hidratos de carbono (azúcares reductores, almidón, celulosa, hemicelulosa y lignina), lípidos (ácidos grasos volátiles)26 y proteínas estará en función del tipo y origen del residuo4,21,23.
De acuerdo con lo anterior, el comportamiento de la microbiota responsable de la digestión anaerobia (DA) puede variar dependiendo de las condiciones ambientales y del tipo de residuo orgánico, por esta razón es importante su estudio17. Aplicando el método de PCR-DGGE se ha estudiado la dinámica poblacional microbiana durante la DA de residuos orgánicos, sin alterar el microecosistema10,14,15,22,28.
En esta investigación, el estudio de la DA fue abordado mediante la aplicación de una prueba respirométrica conocida como potencial bioquímico de metano o biochemical methane potential (BMP). El BMP es un índice de biodegradabilidad anaerobia de los residuos orgánicos que determina el valor experimental de producción máxima de metano generado con una cantidad conocida de residuos orgánicos8. Esta prueba respirométrica se lleva a cabo bajo condiciones anaerobias en biorreactores en lote, es decir, la fuente de carbono se adiciona solo al inicio de la cinética. Mediante este ensayo se cuantifica el volumen de metano producido por gramo de residuo orgánico, expresado este último en unidades de demanda química de oxígeno (DQO) o sólidos volátiles (SV)6.
Asimismo, a través del cálculo del BMP es posible evaluar el desempeño de digestores anaerobios e identificar procesos de inhibición microbiana por sobrecarga orgánica o por exceso acumulado de ácidos grasos3,18,27.
En el presente estudio se pretendió comparar el potencial de producción de metano durante la digestión anaerobia de residuos de mango (RMA), de papaya (RPA) y de plátano (RPL) a través del cálculo del potencial bioquímico de metano; los tratamientos incluyeron la adición de un inóculo microbiano. Adicionalmente se analizó el tamaño y la composición de la población bacteriana presente en los residuos a lo largo de la digestión por el método de PCR-DGGE.
Materiales y métodosOrigen de los residuos agroindustriales y del inóculo microbianoLos RMA, RPA y RPL se colectaron del mercado «5 de mayo», Tuxtla Gutiérrez, Chiapas. Dichos residuos fueron homogenizados por separado con una licuadora industrial hasta obtener una pasta homogénea, posteriormente se almacenaron a 4°C. El inóculo microbiano fue colectado del lodo residual de una planta semipiloto para producción de biogás a partir de plátano macho de la Universidad Politécnica de Chiapas.
Caracterización fisicoquímicaLos residuos agroindustriales utilizados en este estudio fueron caracterizados mediante análisis fisicoquímicos tales como determinación de pH, de DQO y de sólidos totales (ST) y SV, de acuerdo con los procedimientos establecidos por las normas oficiales mexicanas para aguas residuales (NMX-AA-030-SCFI-2001, NMX-AA-034-SCFI-2001)19,20. Cabe resaltar que todos los análisis fueron hechos por triplicado.
Experimentos de digestión anaerobiaSe realizaron experimentos a escala laboratorio en biorreactores en lote, es decir, los residuos agroindustriales se adicionaron solamente al inicio del experimento. Se usaron botellas serológicas de 120ml de capacidad con un volumen de trabajo de 80ml de una solución de micronutrientes que contenían disueltos los RMA, los RPA o RPL. Estas botellas se inocularon al 8% (v/v) con lodo residual proveniente de un proceso previo de estabilización de dos meses bajo condiciones anaeróbicas de metanización de residuos de plátano. Cada biorreactor cumplió con una relación biomasa: residuo de 1g SV/l:2g DQO/l. Todos los biorreactores fueron sellados con septos de caucho y anillos de aluminio. El espacio de cabeza de los biorreactores fue purgado con N2 para proporcionar condiciones anaerobias; estos se incubaron durante 63 días en agitación constante a 120rpm y 35 ±1°C.
Se prepararon tres tratamientos por duplicado: RMA (biorreactor alimentado con residuos de mango), RPA (biorreactor alimentado con residuos de papaya) y RPL (biorreactor alimentado con residuos de plátano). A fin de comparar el BMP de los tratamientos con residuos agroindustriales con un sustrato de composición conocida, se elaboró un control positivo (RC+) que consistió en un biorreactor alimentado con una solución de micronutrientes y moléculas fácilmente biodegradables: 22,1g/l de CH3COONa; 4ml/l de CH3CH2OH; 4,16g/l de CH3CH2COONa; 1,41g/l de C6H12O6; 1,2g/l de CH3CH2CH2COONa y 1,26g/l de C5H10O5 (grado reactivo). También se elaboró un control negativo (RC−), es decir, un biorreactor alimentado con una solución de micronutrientes y lodo anaerobio, pero sin residuo agroindustrial ni agregado químico alguno, para descartar eventualmente el biogás producido a partir de la materia orgánica residual contenida en el lodo anaerobio adicionado como inóculo.
Cuantificación de biogás y metanoEl biogás así como el metano fueron monitorizados de manera simultánea a lo largo de toda la cinética colectando muestras diariamente durante 63 días. El biogás fue cuantificado midiendo la presión manométrica (en milibares) de cada uno de los biorreactores con un manómetro digital (marca Dwyer 475). El metano fue cuantificado por cromatografía de gases en un equipo Clarus 500 (Perkin Elmer), equipado con un detector de ionización de llama y una columna capilar (Supel-Q PLOT 30m X 0,32mm X 40μm). Se usó hidrógeno como gas transportador, el horno estuvo a una temperatura de 40°C, el inyector a 50°C y el detector de ionización de llama a 250°C. Se construyó una curva de calibración con gas metano como estándar de referencia (R2=0,9913). Todas las lecturas se hicieron por duplicado, tras inyectar 15μl de muestra con una jeringa GASTIGHT™ de 100μl de capacidad.
Cálculo de BMPEl valor de BMP fue calculado en función del volumen de metano producido por gramo de DQO de los residuos, como se muestra en la ecuación 1.
donde BMP=potencial bioquímico de metano (ml CH4 * g SV−1); X=producción diaria de metano (ml); n=unidad de tiempo (d); y S=cantidad de sustrato inicial (g DQO).El volumen de metano fue convertido a condiciones normales de presión y temperatura (0°C, 1 atm y 22,4 l gas*/mol), de acuerdo con la ley de los gases ideales. Se graficaron los valores de BMP en función del tiempo de DA, esto se realizó a lo largo de 63 días.
Extracción de ADNCon base en ensayos previos que consistieron en la estandarización de métodos y condiciones de trabajo de digestión anaerobia de los residuos, se decidió realizar la extracción de ácidos nucleicos en tres momentos representativos del proceso cinético general: en la fase inicial (días 0 a 15), en la fase exponencial (días 16 a 45) y en la fase estacionaria (días 46 a 63) del experimento. Partiendo de 0,25g de muestra, se realizó la extracción del ADN total con el kit ZR Soil Microbe DNA Mineprep™, de acuerdo a las instrucciones del fabricante (Zymo Research Corporation, CA, EE. UU.). El ADN purificado fue almacenado a−20°C para su posterior análisis por PCR con oligonucleótidos específicos.
Amplificación del gen 16S del ADNrEl ADN extraído de las muestras de los biorreactores fue utilizado como templado para la amplificación del gen 16S ribosomal por PCR con los oligonucleótidos para bacterias F984GC y R1378. La amplificación de dicho gen en arqueobacterias se realizó por una PCR anidada, para aumentar la sensibilidad y especificidad de la amplificación del ADN. Esto se debe a que tras la primera ronda de PCR es poco probable que los eventuales productos inespecíficos sean suficientemente complementarios de los cebadores anidados y puedan servir de ADN molde para la amplificación posterior, y así, lo que se amplifica es la secuencia diana.
La primera amplificación se realizó con los oligonucleótidos Arch21F y Arch958R, el producto de la amplificación fue utilizado como templado para la segunda amplificación con los oligonucleótidos Parch519F y Arch915R. Cada mezcla contenía 1μl de templado; 0,20 picomoles/μl de los oligonucleótidos; 0,20mM/μl de dinucleótidos trifosfatados (dNTP); 1,5mM de MgCl2 y 0,5 U/μl de Taq ADN polimerasa (Invitrogen), en un volumen final de 20μl; las condiciones para la amplificación por PCR fueron descritas previamente5,25.
En primer término se analizaron alícuotas de 2μl de los productos de amplificación por electroforesis en geles de agarosa. Posteriormente los productos de PCR fueron analizados por electroforesis en gel con gradiente de desnaturalización (DGGE), utilizando geles con gradiente de 20-40% urea-formamida (100% corresponde a 7M de urea y 40% v/v de formamida). Una vez cargadas las muestras, se corrió la electroforesis a 90 voltios durante 8 horas 30 minutos, a una temperatura de 60°C. Para la tinción del gel, se adicionó 1μl de colorante (SYBR Green) a 50ml de agua desionizada y se dejó actuar durante 30 minutos.
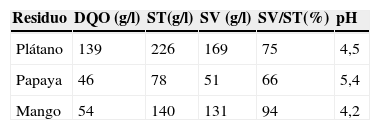
ResultadosCaracterización de los residuos agroindustrialesLos resultados de la caracterización fisicoquímica de los residuos agroindustriales se muestran en la tabla 1. De acuerdo con la relación SV/ST, el contenido de materia orgánica fue de 94, 75 y 66% en los residuos de mango, plátano y papaya, respectivamente. Estos valores indican la cantidad de materia orgánica que puede ser metanizada.
Caracterización fisicoquímica de los residuos agroindustriales
| Residuo | DQO (g/l) | ST(g/l) | SV (g/l) | SV/ST(%) | pH |
|---|---|---|---|---|---|
| Plátano | 139 | 226 | 169 | 75 | 4,5 |
| Papaya | 46 | 78 | 51 | 66 | 5,4 |
| Mango | 54 | 140 | 131 | 94 | 4,2 |
DQO: demanda química de oxígeno; ST: sólidos totales; SV: sólidos volátiles; SV/ST: porcentaje de materia orgánica.
El residuo de plátano tuvo 139g de DQO/l, este valor fue mayor que el obtenido en los residuos de papaya y de mango. Sin embargo, la DQO obtenida para cada uno de los residuos no indica que la materia orgánica contenida en estos sea ciento por ciento biodegradable. Por esta razón se realizaron pruebas de biodegradabilidad anaerobia a través del cálculo del BMP, para establecer las diferencias.
Cinética de digestión anaerobia de residuos agroindustrialesDurante la cinética de DA se monitorizó el comportamiento de la presión manométrica como indicador de la producción de biogás y se cuantificó el volumen de metano producido. En todos los tratamientos evaluados hubo producción de biogás (fig. 1 a); en la digestión anaerobia de residuos de plátano y mango se observó la mayor presión de biogás, que fue de alrededor de 10000 mbar a los 63 días, momento en que finalizó este análisis cinético. El control negativo con el inóculo (lodo anaerobio) produjo biogás; sin embargo, esta producción no fue significativa con respecto al biogás producido en los tratamientos con los residuos orgánicos, es decir, que el biogás es producido principalmente a partir de la transformación de los residuos orgánicos de las frutas.
En todos los tratamientos hubo producción de metano (fig. 1 b). Se obtuvieron volúmenes entre 150 y 250ml de metano desde los 15 días y hasta los 63 días de la cinética de digestión anaerobia de los residuos de mango, de plátano y de papaya. El control positivo tuvo menor volumen de metano.
Potencial bioquímico de metanoEl BMP es una prueba respirométrica que indica la biodegradabilidad anaerobia de un sustrato. En la figura 2 se muestra el BMP expresado en ml de CH4 respecto de los gramos de DQO provenientes del residuo durante la cinética de digestión anaerobia de los tres residuos agroindustriales estudiados. Como se puede observar, el BMP de los tratamientos con los residuos son similares entre sí, pero mayores que el BMP del control positivo. Este resultado es congruente, ya que el control positivo contiene una mezcla de fuentes de carbono fácilmente biodegradables y que fueron adicionadas a concentraciones limitadas; es probable que en los residuos agroindustriales el contenido de la materia orgánica sea mayor y, por lo tanto, esto se vea reflejado en el valor de BMP.
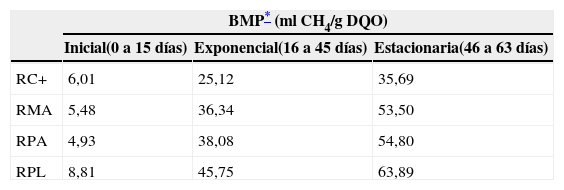
A fin de esclarecer diferencias en el BMP entre los diferentes residuos agroindustriales, en la tabla 2 se comparan los tratamientos durante las tres fases de la digestión anaerobia (inicial, exponencial y estacionaria). En la fase estacionaria (46 a 63 días) se aprecia claramente que el mayor BMP se obtuvo con el residuo de plátano: 63,89ml CH4/g DQO. Este resultado indica que los residuos de plátano son fácilmente biodegradables y que son transformados a metano.
Potencial bioquímico de metano (BMP) durante la digestión anaerobia de residuos agroindustriales
| BMP* (ml CH4/g DQO) | |||
|---|---|---|---|
| Inicial(0 a 15 días) | Exponencial(16 a 45 días) | Estacionaria(46 a 63 días) | |
| RC+ | 6,01 | 25,12 | 35,69 |
| RMA | 5,48 | 36,34 | 53,50 |
| RPA | 4,93 | 38,08 | 54,80 |
| RPL | 8,81 | 45,75 | 63,89 |
RC+: control positivo; RMA: residuos de mango; RPA: residuos de papaya; RPL: residuos de plátano.
La composición de la población (bacterias y arqueobacterias) durante el proceso de la digestión anaerobia de los residuos agroindustriales de mango, papaya y plátano fue monitorizada por análisis de PCR-DGGE, para lo cual se utilizó el ADN total extraído en la fase inicial, exponencial y estacionaria de la cinética, que en total duró 63 días (figs. 3 y 4).
Perfiles DGGE de fragmentos del gen 16S amplificado por PCR con oligonucleótidos para arqueobacterias. RC−: control negativo; RC+: control positivo; RMA: biorreactor con residuos de mango; RPA: biorreactor con residuos de papaya; RPL: biorreactor con residuos de plátano macho. Los números corresponden a la cantidad de bandas halladas en cada muestra.
Perfiles DGGE de fragmentos del gen 16S amplificado por PCR con oligonucleótidos para eubacterias. RC−: control negativo; RC+: control positivo; RMA: biorreactor con residuos de mango; RPA: biorreactor con residuos de papaya; RPL: biorreactor con residuos de plátano macho. Los números corresponden a la cantidad de bandas halladas en cada muestra.
En el carril del inóculo (fig. 3) no se observa una banda definida, es probable que la población microbiana en la fase inicial haya sido baja, por lo que la cantidad de ADN presente al inicio del proceso tal vez no fue suficiente para que se obtenga un producto de amplificación.
Con el ADN obtenido de las poblaciones de microorganismos que se encontraban en el proceso de digestión de los residuos agroindustriales se realizó la amplificación por PCR del gen 16S ribosomal, los productos de amplificación obtenidos fueron analizados por DGGE. La intensidad de las bandas obtenidas por la amplificación con los oligonucleótidos para arqueobacterias y bacterias se incrementó conforme transcurrieron los días de la digestión anaerobia. Esto se atribuye a que a medida que avanza la fermentación anaerobia, las poblaciones de bacterias crecen en ambientes con ausencia de oxígeno y una atmósfera rica en metano. También se producen cambios en las poblaciones de bacterias, esto se puede observar en la figura 4, donde se aprecian diferentes huellas con el análisis de PCR-DGGE. Sin embargo, con la población de arqueobacterias no se observan diferentes huellas genómicas, esto es indicativo de que existe una población predominante, como lo evidencia el único perfil que se aprecia en la figura 3.
DiscusiónLos porcentajes de materia orgánica (SV/ST) de los residuos de plátano, papaya y mango estimados son congruentes con los reportados por Balat y Balat2; estos autores informaron contenidos de materia orgánica en residuos de mango y de plátano de 87 y 98%, respectivamente. Por su parte, Hosseini et al.12 informaron 89% de materia orgánica en la relación SV/ST de residuos del procesamiento industrial del jugo de frutas. En los reportes de Ganesh et al.9 y Scano et al.18, para la mezcla de residuos de plátano, manzana, zanahoria, lechuga y papa se obtuvo un valor de SV/ST de 85-87%, lo que es muy similar a lo obtenido en el presente trabajo.
Angelidaki et al.1 mencionan que el valor del BMP puede estar influenciado por varios factores, como el tamaño de partícula y el tipo de sustrato, o la actividad metanogénica del inóculo, entre otros, y que cuando se trata de conocer la biodegradabilidad de un residuo sólido orgánico, la prueba del BMP es la más adecuada dado que es una prueba práctica, reproducible y confiable. Se advierte en la tabla 2 que, con respecto al control positivo, los valores de BMP se van incrementando gradualmente en los tratamientos con los residuos agroindustriales en las distintas fases, y que la mayor diferencia se aprecia en la fase estacionaria. Adicionalmente, la expresión del BMP en ml CH4/g DQO permitió conocer el rendimiento de metano.
Con base en el análisis molecular por PCR-DGGE, cabe suponer que el mayor número de perfiles observados en la digestión anaerobia del plátano probablemente se deba a su alto contenido de azúcares, celulosa, almidón y proteínas. En una primera etapa el residuo es hidrolizado y convertido en azúcares, que son utilizados por microorganismos que realizan el proceso de fermentación16. Particularmente en este tratamiento se favoreció la presencia de la población de bacterias metanogénicas, por esta razón es probable que en el tratamiento del residuo de plátano se haya producido mayor cantidad de metano que en los otros residuos agroindustriales utilizados en este estudio.
Las poblaciones de bacterias fueron distintas en cada uno de los tratamientos de digestión anaerobia debido a la diferente capacidad de la población microbiana para metabolizar cada residuo agroindustrial.
García et al.10 evaluaron la digestión anaerobia de residuos de zanahoria y observaron que la composición de eubacterias estaba conformada por Bacilli (31-45,3%), Porphyromonadaceae (12,1-24,8%) y Spirochaetales (12,5-18,5%); la composición de las arqueas fue menos diversa: solo estuvo representada por Methanosarcina mazei.
En este estudio no se determinaron las secuencias a las que correspondía cada perfil; sin embargo, se puede proponer con base en los resultados de la PCR-DGGE, que existe diferencia en el comportamiento de las poblaciones de eubacterias y arqueobacterias, lo cual depende del residuo agroindustrial utilizado en la digestión anaerobia.
En conclusión, los residuos agroindustriales de plátano, papaya y mango pueden ser aprovechados como materia prima en la digestión anaerobia para producir biogás y metano. A través del estudio del BMP se pudo conocer la biodegradabilidad y el potencial de metanización de cada residuo. La técnica de PCR-DGGE permitió evidenciar huellas genómicas diferentes entre los tres tratamientos; específicamente, en la digestión anaerobia de los residuos de plátano, la población de arqueobacterias metanogénicas fue la predominante. Los resultados obtenidos apoyan la tecnología de la digestión anaerobia como una alternativa sustentable para el aprovechamiento de los residuos agroindustriales que genera el sector agrícola; al mismo tiempo es una opción ante la búsqueda de recursos energéticos renovables que puedan ser utilizados como combustibles.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Programa de Mejoramiento del Profesorado, Secretaría de Educación Pública, por el financiamiento otorgado para la realización del presente trabajo. A la Universidad Politécnica de Chiapas, por el apoyo en la gestión para la presente publicación.