La alelopatía es un fenómeno que involucra la producción de metabolitos secundarios que influyen en el crecimiento de las plantas, pero este potencial alelopático ha sido poco estudiado en la simbiosis rizobio-leguminosa. Esta investigación tuvo los siguientes objetivos: 1) evaluar el potencial alelopático de lixiviados acuosos de Ipomoea purpurea L. Roth en la germinación de semillas y en el crecimiento radical de plántulas de frijol (Phaseolus vulgaris L.); 2) determinar el efecto de estos lixiviados en el crecimiento in vitro de Rhizobium tropici CIAT899, y 3) evaluar el potencial alelopático de I. purpurea en el crecimiento, la fisiología y la nodulación de frijol en simbiosis con R. tropici. Tanto el lixiviado acuoso de raíz como el de la parte aérea de I. purpurea estimularon la germinación de semillas de frijol y la elongación radical. El crecimiento in vitro de R. tropici fue inhibido al aplicar los 2 tipos de lixiviado. La presencia de I. purpurea tuvo un efecto negativo en el crecimiento y en las respuestas fisiológicas de las plantas de frijol, que fue atenuado cuando las plantas fueron inoculadas con Rhizobium tropici; no obstante, la nodulación asociada a esta bacteria fue afectada en presencia de la planta alelopática. Los resultados indican que la simbiosis de rizobios en las raíces de frijol es un elemento importante en la atenuación de los daños producidos por la planta alelopática I. purpurea.
Allelopathy is a phenomenon that involves the production of secondary metabolites that influence the growth of plants and microorganisms; however, this alellopathic effect has been scarcely studied on the rhizobia-legume symbiosis. The aims of this research were 1) to assess the allelopathic potential of aqueous extracts of Ipomoea purpurea L. Roth on seed germination and root length of common bean seedlings (Phaseolus vulgaris L.), 2) to determine its effects on the in vitro growth of Rhizobium tropici CIAT899, and 3) to evaluate the allelopathic potential of I. purpurea on the growth, nodulation and physiology of common bean plants inoculated with R. tropici. After 48h, 15% of the aqueous root extract of I. purpurea stimulated seed germination, whereas 4% of the aqueous shoot extracts stimulated such germination. Both the root or shoot extracts stimulated seed germination and e root length. In vitro growth of R. tropici was inhibited as a result of the application of both aqueous extracts. The presence of I. purpurea negatively affected both the growth and physiological responses of common bean plants, and this effect was attenuated after the inoculation of R. tropici; nevertheless, this allelopathic plant affected root nodulation. Our results suggest that the symbiosis of rhizobia and roots of common bean plants is an important element for attenuating the negative effects caused by the allelopathic plant.
La alelopatía es un fenómeno biológico característico de algunas plantas, algas, bacterias, corales y hongos, mediante el cual se producen y se liberan al medio sustancias bioquímicas que influyen en el crecimiento y el desarrollo de otros organismos27. La alelopatía funciona como una interferencia química en la cual la planta o el organismo productor libera compuestos químicos que ejercen un efecto en sus plantas asociadas. Estos fitoquímicos son metabolitos secundarios que no tienen influencia directa en el crecimiento de las plantas; sin embargo, funcionan como aleloquímicos al estar involucrados en el sistema de defensa de la planta en su interacción con el ambiente2.
La fuente de aleloquímicos puede proceder de diversas partes de la planta, como hojas, tallos, semillas y flores, entre otros22. La liberación de estos compuestos es variable y ocurre de maneras diversas. Las principales formas de liberación son por lixiviación de las partes aéreas de la planta; por volatilización a través de las hojas; por liberación de compuestos a partir de la descomposición microbiana de restos orgánicos (hojarasca o raíces muertas) seguida de su lixiviación; y, por último, por exudación a través de las raíces2,3,20.
Los aleloquímicos logran influir de diferentes maneras, por ejemplo, en el establecimiento de las comunidades vegetales a través de los efectos que ejercen en la diversidad vegetal13. Afectan el ciclo de los nutrientes e intervienen en las propiedades del suelo11. Influyen en los procesos fisiológicos de las especies receptoras, inhibiendo o estimulando la tasa de germinación y el crecimiento de plántulas15,17,24. Inhiben la fotosíntesis a través de las interacciones con los componentes del fotosistema II (PSII)33; dentro de las comunidades microbianas, afectan a los hongos micorrícicos, a las bacterias fijadoras de nitrógeno y a los agentes patógenos presentes en el suelo34.
Por otro lado, las leguminosas representan un grupo muy diverso de plantas que contribuyen a la fertilidad del suelo a través de la fijación de nitrógeno, al formar simbiosis con los rizobios. Entre las leguminosas de importancia agrícola destaca el frijol común (Phaseolus vulgaris), en cuyo cultivo ha sido reportada la presencia de malezas del género Ipomoea9.
El género Ipomoea pertenece a la familia Convolvulaceae y se caracteriza por incluir especies con diversas propiedades terapéuticas, así como alelopáticas. En las zonas tropicales de México, los agricultores han promovido el crecimiento de la especie Ipomoea tricolor, entre otras del mismo género, para proteger el suelo y controlar el crecimiento de malezas4. En Ipomoea purpurea se ha reportado la presencia de resinas glucosídicas, también la biosíntesis exclusiva de alcaloides ergolínicos como la ergina, la isoergina, el ácido lisérgico, la ergosina y la ergosinina, todo ellos compuestos tóxicos para el humano6. Los lixiviados radicales de I. purpurea pueden inhibir significativamente la germinación de esporas de hongos micorrícicos arbusculares5. Sin embargo, sus efectos en leguminosas y en bacterias simbióticas han recibido poca atención.
El presente trabajo determinó el efecto de los lixiviados acuosos de la raíz o de la parte aérea de I. purpurea en la germinación de semillas y en la elongación de radículas de frijol (Phaseolus vulgaris L.) y en el crecimiento in vitro de Rhizobium tropici, simbionte natural de dicha leguminosa. Además, se evaluó el potencial alelopático de I. purpurea en el crecimiento, la nodulación y la respuesta fisiológica de P. vulgaris solo o inoculado con R. tropici.
Materiales y métodosMaterial biológicoLas semillas de frijol correspondieron a la variedad Flor de Mayo, de origen comercial, y las semillas de I. purpurea se recolectaron en las inmediaciones del Colegio de Postgraduados (Texcoco, México). La cepa bacteriana para frijol fue Rhizobium tropici CIAT899.
Efecto de lixiviados acuosos de Ipomoea purpurea en la germinación de semillas y en la elongación de radículas de frijolLas semillas de I. purpurea se desinfestaron durante 5min con una solución de NaClO al 10% (elaborada a partir de hipoclorito de sodio comercial). Posteriormente se enjuagaron con agua destilada estéril para eliminar los residuos de dicha solución y se sembraron en una bandeja que contenía agrolita estéril (121°C, 3h) como sustrato. Se dejaron crecer durante 4 meses en una cámara bioclimática Sherer-Gillett Co. Marshall Mich (modelo n.o 3714), con un fotoperíodo de 12h luz/12h oscuridad, a 25°C, con un 56% de humedad relativa y una intensidad luminosa de 137μmol/m2/s.
La obtención de los lixiviados se basó en lo propuesto por Anaya3 y consistió en colocar por separado, en matraces Erlenmeyer, 20g de la parte aérea (tallos y hojas) y 20g de la raíz fresca de varias plantas de I. purpurea, luego se adicionaron 100ml de agua destilada estéril y se dejó reposar durante 3h para extraer los compuestos hidrosolubles, agitando vigorosamente cada 60min. El extracto resultante se filtró primero por papel Whatman n.o 4 y posteriormente a través de membrana Milipore Millex®-GS de 0,20μm, para obtener un lixiviado estéril. Antes de su aplicación, los lixiviados fueron conservados en refrigeración a 2°C.
La germinación de frijol se ensayó con semillas desinfestadas con una solución de NaClO al 10% durante 3min y luego enjuagadas con agua destilada estéril. Las semillas de frijol se germinaron en cajas de Petri con una mezcla de agar al 2% y cada uno de los lixiviados acuosos de I. purpurea diluidos al 8, 16 y 30%, para obtener las concentraciones finales en el soporte de germinación del 4, 8 y 15%, respectivamente. Como grupo control se empleó agar al 2%. Una vez solidificado el agar, se colocaron 12 semillas en cada caja, con 3 repeticiones por tratamiento (n=36). Las cajas fueron selladas con Parafilm e incubadas a 28°C en total oscuridad. Se llevó a cabo el conteo de semillas germinadas, así como la medición de las radículas, a las 24 y a las 48h. Todo el procedimiento se realizó en campana de flujo laminar marca VECO®, para mantener condiciones estériles.
Efecto de lixiviados acuosos de Ipomoea purpurea en el crecimiento in vitro de Rhizobium tropici CIAT899En cajas de Petri con medio de cultivo ELMARC (extracto de levadura, manitol y rojo congo) se vertieron y diseminaron con una espátula de Drigalsky 100μl de inóculo bacteriano de R. tropici CIAT899 previamente cultivado en medio caldo de extracto levadura y manitol. Luego en cada placa se realizaron 3 pozos con ayuda de un sacabocados, para después depositar en cada uno de ellos 50μl de lixiviado a evaluar. Tanto el lixiviado acuoso de la raíz como el de la parte aérea se prepararon a las concentraciones del 4, 8 y 15%, y se hicieron 3 repeticiones (3 cajas) por tratamiento. Las placas se incubaron a 28°C por 3 días y posteriormente se tomaron 2 medidas perpendiculares con un vernier sobre los halos de inhibición del crecimiento bacteriano. De ambas lecturas se sacó un promedio y se restó el área ocupada por el pozo (8mm de diámetro), para conocer el área (halo) de inhibición.
Crecimiento, respuesta fisiológica y nodulación de frijol inoculado con rizobios, en interacción con Ipomoea purpureaAntes del establecimiento del experimento, las semillas de frijol previamente desinfestadas siguiendo el protocolo ya señalado se pregerminaron en placas con papel de filtro humedecido con agua destilada estéril. Asimismo, las semillas de I. purpurea se desinfestaron con el mismo procedimiento, se sembraron en una bandeja con agrolita estéril (121°C, 3h) como sustrato y se dejaron crecer durante un mes.
El establecimiento del experimento estuvo basado en lo propuesto por Rodríguez-Mendoza30. Una vez germinadas las semillas de frijol, estas se trasplantaron a macetas (0,5l) que contenían agrolita estéril (121°C, 3h), a razón de una por maceta, y luego se incorporó en cada maceta una plántula de I. purpurea, ajustándose a los tratamientos previstos. En aquellos tratamientos con inoculación, se adicionó 1ml de un inóculo de R. tropici CIAT899 con una carga bacteriana de 7,3×1011UFC/ml. Dicho inóculo bacteriano se obtuvo luego de centrifugar a 1.200rpm un cultivo bacteriano de 48h desarrollado en caldo de extracto levadura y manitol; el pellet bacteriano se resuspendió en agua destilada estéril (se inoculó con una suspensión celular en agua para evitar posibles interferencias de los metabolitos bacterianos liberados en el medio de cultivo sobre el crecimiento de las plantas).
En este experimento las plantas de frijol se mantuvieron durante 35 días en una cámara bioclimática Sherer-Gillett Co. Marshall Mich (modelo n.o 3714), con fotoperíodo de 12h luz, temperatura de 25°C, humedad relativa del 56% e intensidad luminosa de 137μmol/m2/s. El riego de las plantas consistió en la aplicación de 20ml de agua destilada estéril 2 veces por semana; también se adicionaron a cada maceta 20ml de solución nutritiva de Jensen, una vez a la semana. Al cabo del tiempo indicado, se determinó la altura, el diámetro de los tallos, el volumen radical, la biomasa seca total (obtenida a 70°C, 72h) y el área foliar de las plantas de frijol en cada uno de los tratamientos; además, se contabilizaron los nódulos en las raíces de las plantas inoculadas.
Las variables fisiológicas del frijol que se determinaron fueron la concentración de clorofila total (mg/g peso fresco), la tasa fotosintética (Pn, μmol/m2/s), la tasa de transpiración (E, mmol/m2/s) y la conductancia estomática (gs, μmol/m2/s). La clorofila total se determinó siguiendo el método propuesto por Harborne16, que utiliza acetona como disolvente; el resto de las variables citadas se determinaron con el equipo CIRAS 2 (Portable Photosynthesis System). La fluorescencia de la clorofila α se determinó con un fluorómetro OS30p, Opti-Sciences, tras mantener las hojas en oscuridad por 20min. Todas las determinaciones se realizaron en la tercera hoja de la planta (contando desde el ápice hacia la base), con lecturas entre las 9 y las 10 a.m.
La actividad nitrogenasa del sistema radical de los tratamientos inoculados se midió con la prueba de reducción de acetileno a etileno (nM C2H4), tomando 3 plantas de cada tratamiento. Las muestras fueron procesadas en un cromatógrafo de gases Hewlett Packard 5890 (Series II Gas Chromatograph), con detector de ionizador de llama. Luego de la incubación del sistema radical en la prueba anterior, los nódulos fueron separados de la raíz para llevar a cabo su recuento y colocados en viales de vidrio para secarlos a 70°C, para determinar la biomasa seca nodular.
Diseño experimental y análisis estadísticoPara conocer el efecto de los lixiviados de raíz o de la parte aérea de I. purpurea en la germinación y el crecimiento inicial del frijol, se efectuó un análisis de varianza y una prueba de comparación de medias (Tukey, α=0,05), analizando por separado los efectos observados a las 24 y a las 48h. Con respecto al crecimiento in vitro de R. tropici expuesto a los lixiviados de I. purpurea, el diseño experimental fue completamente al azar; se comparó la respuesta por separado de cada uno de los lixiviados a las 72h de crecimiento bacteriano, para lo cual se realizó un análisis de varianza seguido de una prueba de comparación de medias (Tukey, α=0,05).
En el caso de la evaluación del crecimiento y la respuesta fisiológica del frijol inoculado con rizobios y su interacción con I. purpurea, el experimento consistió en un factorial 2×2 cuyos factores de estudio fueron, por un lado, la inoculación bacteriana (es decir, frijol crecido con o sin inóculo de R. tropici CIAT899), y por otro, la presencia de I. purpurea (es decir, frijol crecido en presencia o en ausencia de la planta alelopática), conformándose así 4 tratamientos que tuvieron 12 repeticiones cada uno, en una distribución completamente al azar. El análisis estadístico incluyó el análisis de varianza y la prueba de comparación de medias (Tukey, α=0,05). En todos los análisis estadísticos se utilizó el programa SAS, versión 9.4.
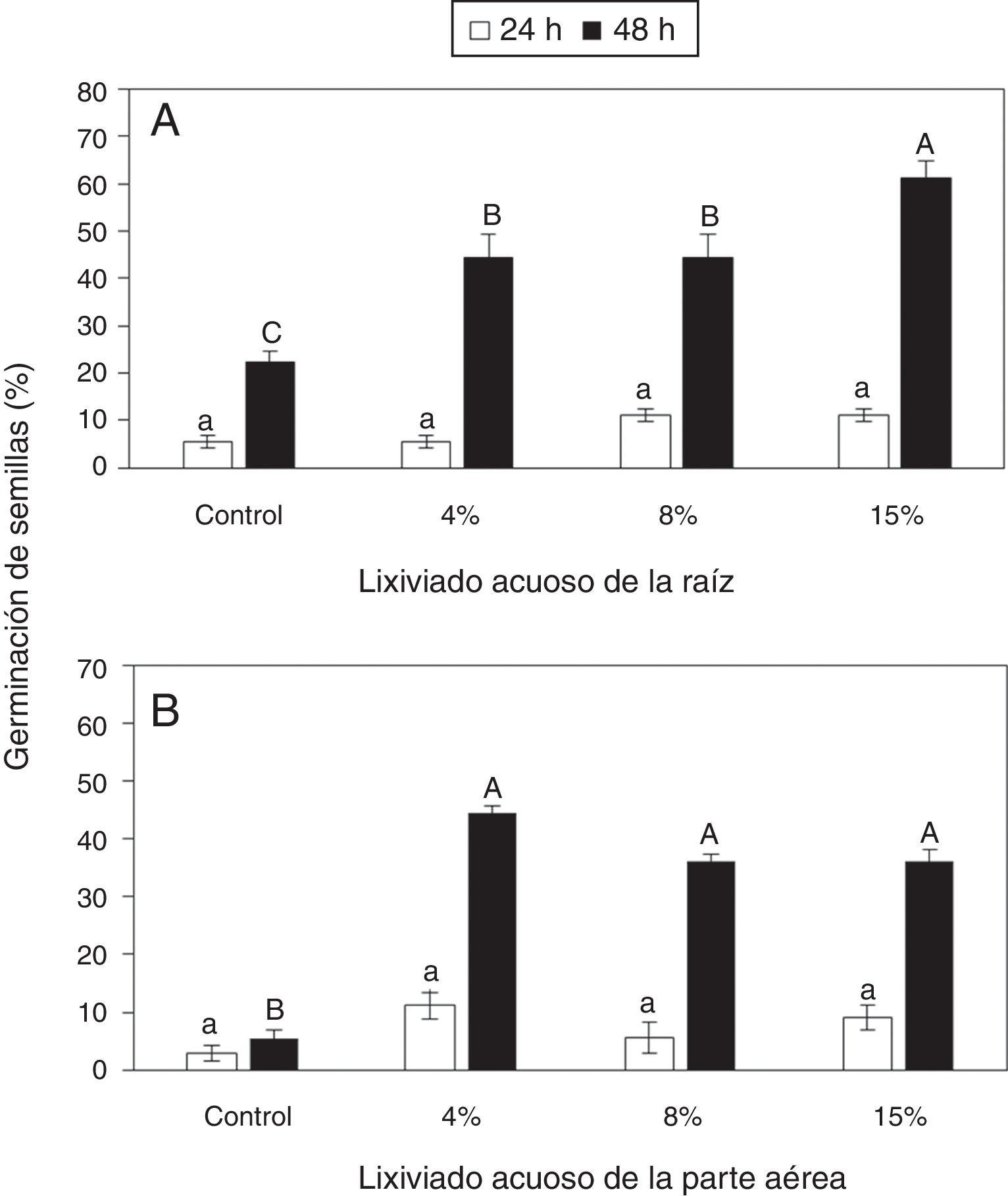
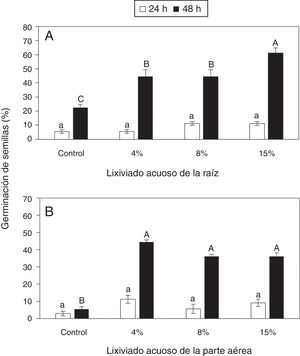
ResultadosEfecto de lixiviados acuosos de Ipomoea purpurea en la germinación de semillas y elongación de radículas de frijolLa aplicación del lixiviado acuoso de la raíz de I. purpurea no ejerció efectos significativos en la germinación de las semillas del frijol a las 24h (fig. 1A). Sin embargo, a las 48h, la proporción de semillas germinadas fue significativamente mayor cuando se aplicó el lixiviado en el soporte de germinación, en especial la concentración del 15%, estimuló significativamente la germinación con respecto al control (fig. 1A). Asimismo, la aplicación del lixiviado de la parte aérea no mostró efectos significativos a las 24h; pero a las 48h, todas las concentraciones del lixiviado estimularon significativamente la germinación con respecto al control (fig. 1B).
Dinámica de germinación de semillas de frijol en presencia de diferentes cantidades de lixiviados acuosos de raíz (A) o de parte aérea (B) de Ipomoea purpurea. Promedio±error estándar de la media. Letras distintas a un mismo tiempo indican diferencias significativas (Tukey, p=0,05).
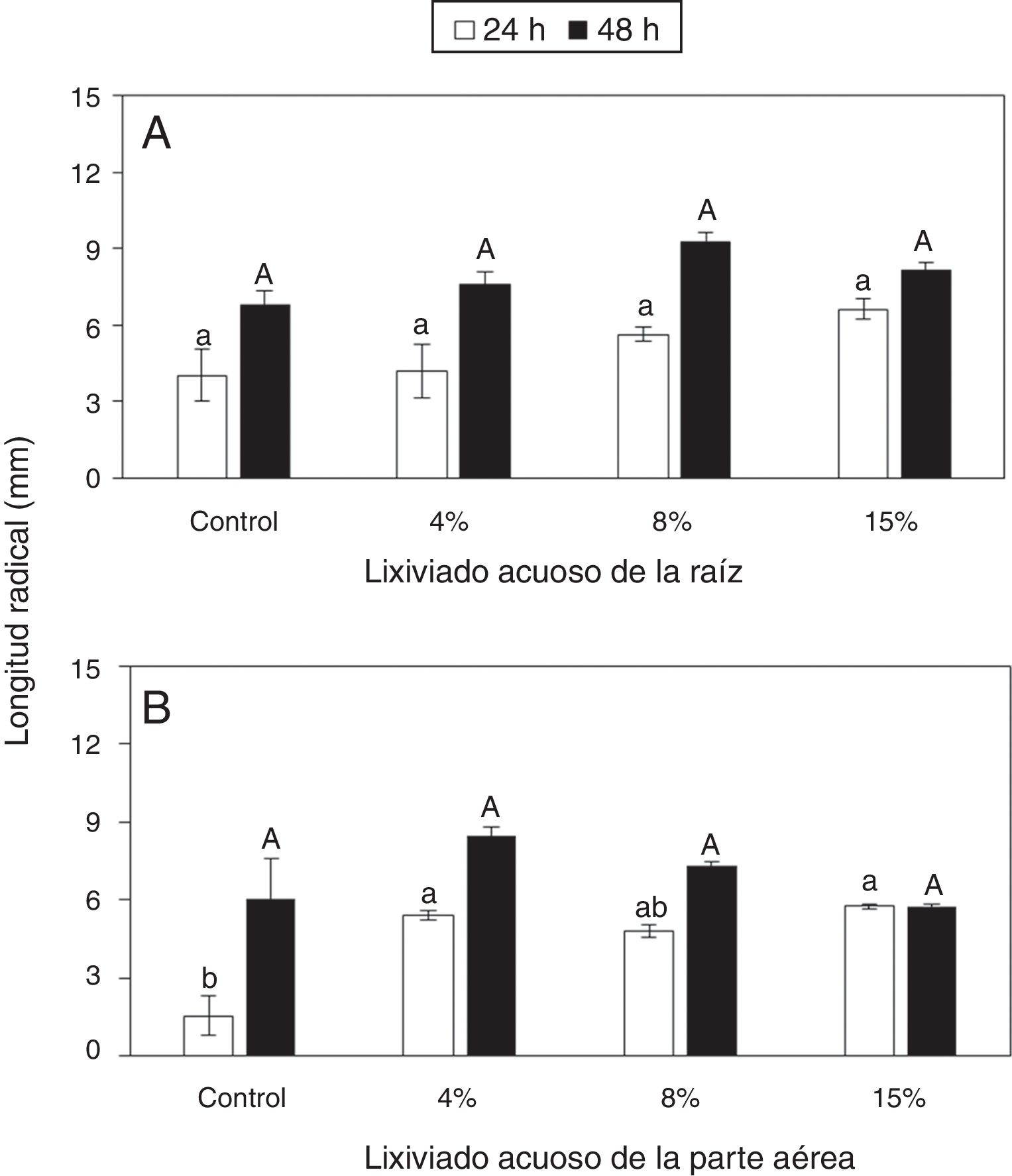
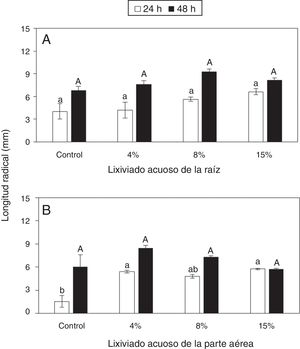
En general existió una tendencia al incremento de la longitud de las radículas de las plántulas de frijol conforme aumentó la concentración del lixiviado de raíz; sin embargo, la respuesta no fue significativa ni a las 24 ni a las 48h con dicho lixiviado (fig. 2A). En contraste, la aplicación del lixiviado acuoso de la parte aérea al 4% y al 15% aumentó significativamente la longitud de las radículas a las 24h (fig. 2B). Sin embargo, a las 48h, las diferencias no fueron significativas (fig. 2B).
Dinámica del crecimiento radical de plántulas de frijol germinadas en presencia de diferentes cantidades de lixiviados acuosos de raíz (A) y de parte aérea (B) de Ipomoea purpurea. Promedio±error estándar de la media. Letras distintas a un mismo tiempo indican diferencias significativas (Tukey, p=0,05).
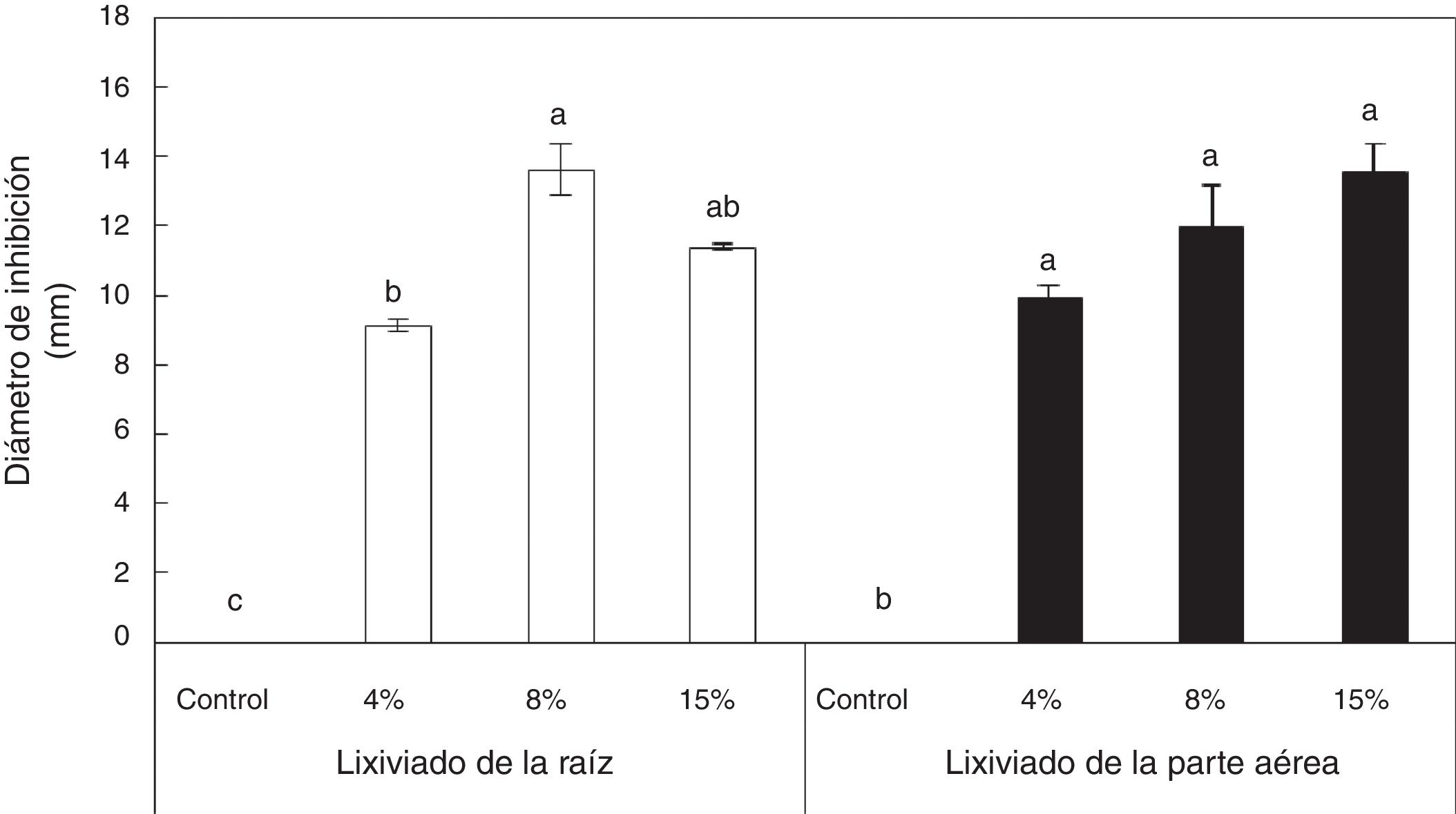
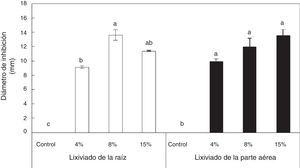
Los lixiviados acuosos tanto de la raíz como de la parte aérea de I. purpurea inhibieron significativamente el crecimiento de R. tropici CIAT899. La concentración del 8% del lixiviado de la raíz fue la que mayor inhibición del crecimiento bacteriano produjo. La aplicación del lixiviado de la parte aérea produjo mayor inhibición bacteriana conforme la concentración del lixiviado en el medio de cultivo aumentó (fig. 3).
Inhibición del crecimiento in vitro de Rhizobium tropici CIAT899 en presencia de diferentes concentraciones de lixiviados acuosos de raíz o de la parte aérea de Ipomoea purpurea aplicados en pocillos, después de 72h de cultivo. Promedio±error estándar de la media. n=3. Letras distintas indican diferencias significativas (Tukey, p=0,05).
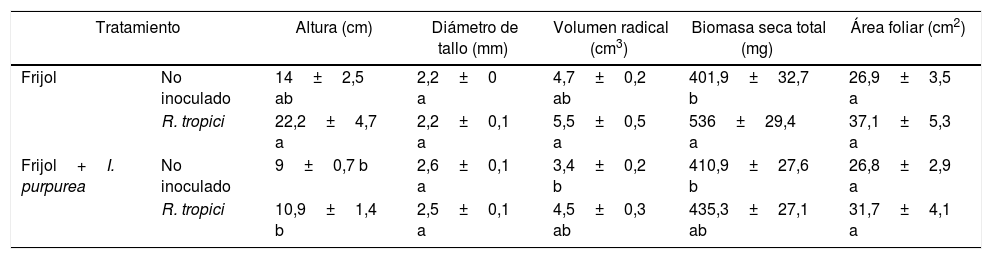
En ausencia de I. purpurea, la inoculación de R. tropici produjo incrementos en la altura y la biomasa seca total de las plantas de frijol (tabla 1). En contraste, la presencia de I. purpurea disminuyó la altura y el volumen radical de las plantas de frijol en comparación con las plantas que no crecieron en presencia de I. purpurea, aunque sin mostrar diferencias significativas (tabla 1). No se observaron cambios significativos en el diámetro del tallo ni en el área foliar de las plantas de frijol por efecto de R. tropici ni por efecto de la presencia de I. purpurea (tabla 1).
Parámetros de crecimiento de plantas de frijol de 35 días desarrolladas bajo diferentes condiciones en cámara de ambiente controlado
| Tratamiento | Altura (cm) | Diámetro de tallo (mm) | Volumen radical (cm3) | Biomasa seca total (mg) | Área foliar (cm2) | |
|---|---|---|---|---|---|---|
| Frijol | No inoculado | 14±2,5 ab | 2,2±0 a | 4,7±0,2 ab | 401,9±32,7 b | 26,9±3,5 a |
| R. tropici | 22,2±4,7 a | 2,2±0,1 a | 5,5±0,5 a | 536±29,4 a | 37,1±5,3 a | |
| Frijol+I. purpurea | No inoculado | 9±0,7 b | 2,6±0,1 a | 3,4±0,2 b | 410,9±27,6 b | 26,8±2,9 a |
| R. tropici | 10,9±1,4 b | 2,5±0,1 a | 4,5±0,3 ab | 435,3±27,1 ab | 31,7±4,1 a | |
Promedio±error estándar de la media. Letras diferentes en la misma columna indican diferencias significativas (Tukey, α=0,05). n=12.
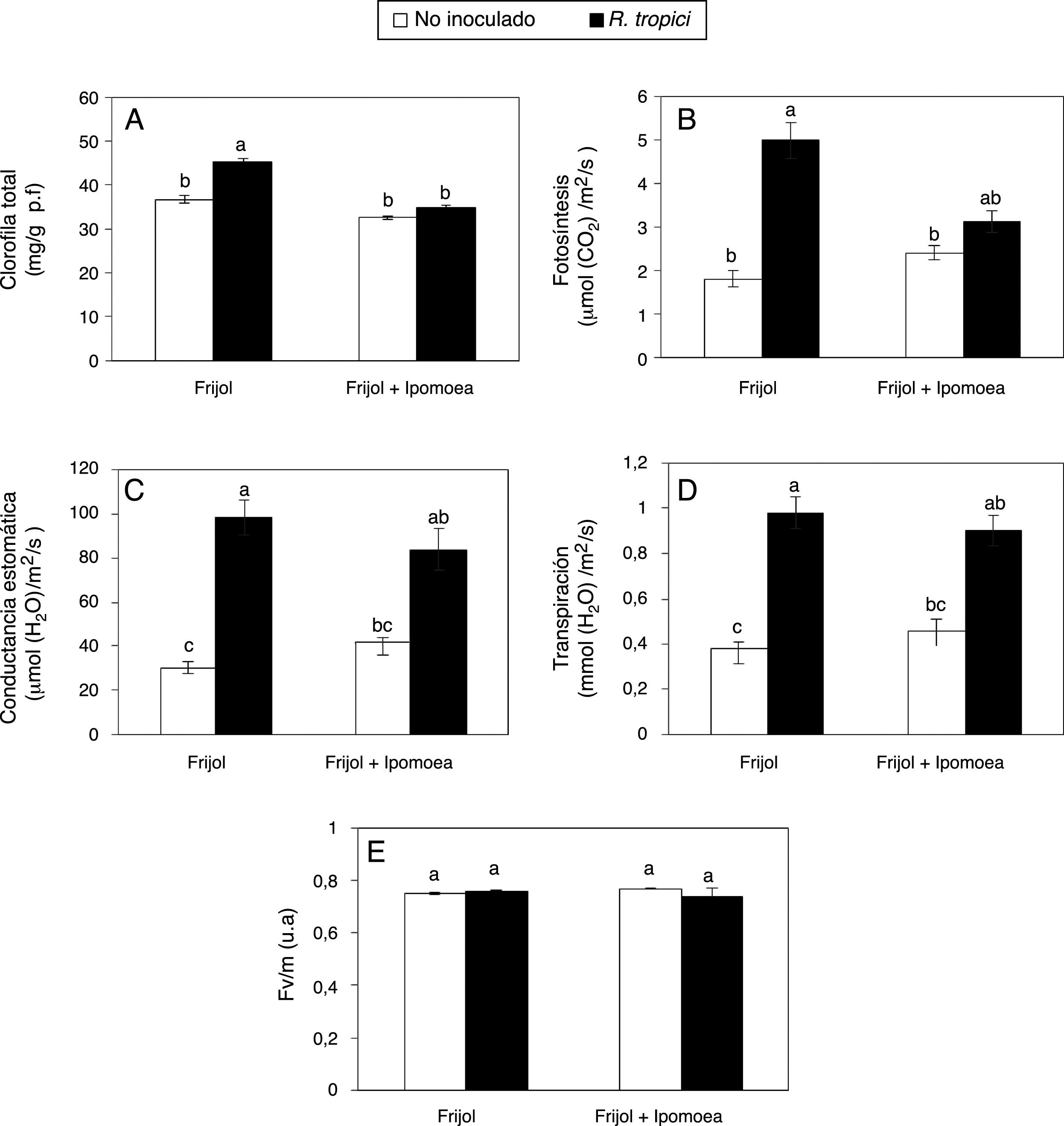
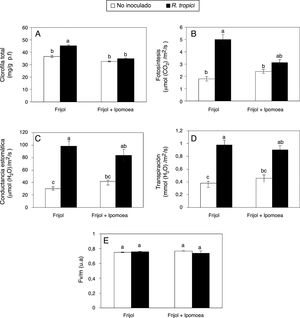
Entre los parámetros fisiológicos, la concentración de clorofila total (fig. 4A), la tasa fotosintética (fig. 4B), la conductancia estomática (fig. 4C) y la transpiración (fig. 4D) fueron significativamente estimulados por la inoculación de R. tropici. No obstante, la presencia de Ipomoea disminuyó, aunque no significativamente, la concentración de clorofila total (fig. 4A), la fotosíntesis (fig. 4B), la conductancia estomática (fig. 4C) y transpiración (fig. 4D); sin embargo, estos efectos negativos fueron menores en presencia de R. tropici. La eficiencia del fotosistema II, medida con base en la relación entre la fluorescencia variable y la fluorescencia máxima (Fv/m), no mostró diferencias significativas entre tratamientos (fig. 4E).
Efecto de la presencia de Ipomoea purpurea en el contenido de clorofila total (A), el intercambio gaseoso (B-D) y la eficiencia cuántica del PSII (E) en plantas de frijol de 35 días inoculadas con Rhizobium tropici CIAT899. Promedio±error estándar de la media. n=5. Letras distintas indican diferencias significativas (Tukey, p=0,05).
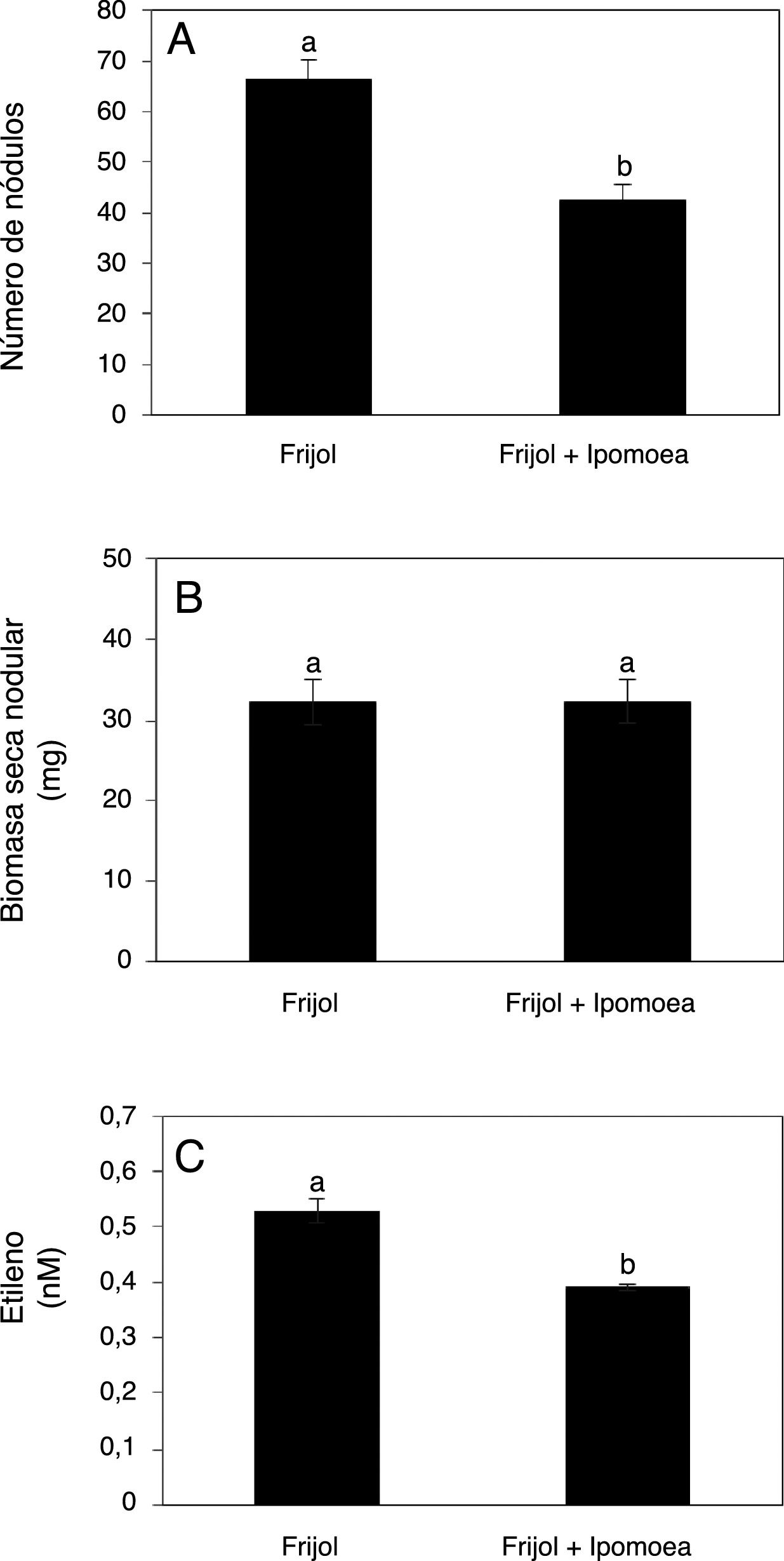
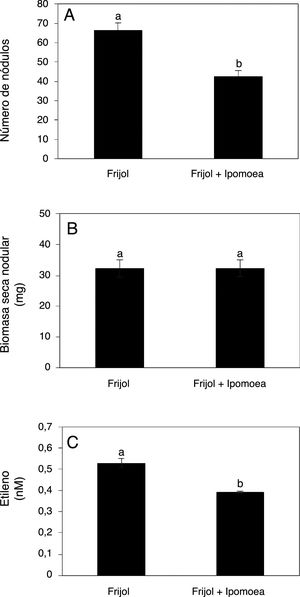
El número de nódulos por planta en los tratamientos inoculados con R. tropici CIAT899 fue significativamente menor en presencia de I. purpurea (fig. 5A); sin embargo, la biomasa seca nodular no mostró diferencias significativas (fig. 5B). Un resultado destacable es que la actividad nitrogenasa del sistema radical de las plantas de frijol inoculadas se vio significativamente inhibida por la incorporación de I. purpurea (fig. 5C).
Efecto de la presencia de Ipomoea purpurea en el número de nódulos (A), el peso seco nodular (B) y la actividad de la nitrogenasa estimada a partir de la producción de etileno (C) en plantas de frijol de 35 días inoculadas con Rhizobium tropici CIAT899. Promedio±error estándar de la media. n=3. Letras distintas indican diferencias significativas (Tukey, p=0,05).
Los lixiviados acuosos de raíz o de parte aérea de Ipomoea purpurea estimularon la germinación de las semillas de frijol (fig. 1) o favorecieron la elongación de las radículas (fig. 2B). Lo anterior contrasta con lo observado por Torres-García et al.32, quienes describieron la inhibición de la germinación de semillas de frijol por efecto de un extracto acuoso de Ipomoea batatas (L.), y también con lo informado en relación con el extracto acuoso foliar de Ipomoea cairica, que tuvo efectos negativos en la germinación de semillas de Bidens pilosa, Echinochloa crus-galli, Euphorbia heterophylla e Ipomoea grandifolia31. En otras investigaciones se ha indicado la ausencia de cualquier efecto positivo o negativo en la germinación de semillas de frijol con la aplicación de extractos de Guadua angustifolia, Bambusa vulgaris y Dendrocalamus strictus29. Los lixiviados de plantas alelopáticas están asociados, generalmente, con efectos negativos en diversas plantas; sin embargo, a veces se observan efectos benéficos o estimulantes, tal como ocurrió en el presente trabajo con la germinación de semillas de frijol en contacto con lixiviados de raíz o de la parte aérea, a las 48h de tratamiento.
La estimulación de la germinación de semillas de frijol así como del crecimiento de radículas en presencia de lixiviados acuosos de I. purpurea podría asociarse a la presencia de ciertos compuestos químicos, como alcaloides o resinas glucosídicas6. Aun cuando las plantas de I. purpurea eran de 4 meses, los compuestos presentes en sus lixiviados acuosos fueron suficientes para generar un efecto positivo. Existe la posibilidad de que los compuestos alelopáticos de Ipomoea tengan una función biológica similar a ciertas fitohormonas involucradas en el crecimiento y el desarrollo de las plantas. Sin embargo, se necesita más investigación para conocer aquellos compuestos químicos involucrados y dilucidar sus efectos en diversas plantas de importancia agrícola, con diferente etapa fenológica.
Los efectos de plantas alelopáticas sobre microorganismos benéficos de vida libre o simbióticos han sido poco estudiados. Dawson y Seymour10 indican que la aplicación de juglona (5-hidroxi-1,4-naftoquinona) en concentraciones bajas (0,001 y 0,0001M) afectó significativamente el crecimiento in vitro de Bradyrhizobium japonicum 71; estas concentraciones pueden estar en la solución del suelo y, por lo tanto, inhibir su simbiosis con leguminosas. El presente trabajo demostró una inhibición por parte del extracto acuoso de la raíz y de la parte aérea de I. purpurea en el crecimiento in vitro de R. tropici CIAT899. La inhibición promedio de las 3 concentraciones estudiadas fue del 11,4 y 11,8%, respectivamente (fig. 3).
Ipomoea purpurea puede ser una fuente de aleloquímicos que potencialmente pueden ser liberados al ambiente edáfico, y con ello, tener efectos negativos en los microorganismos del suelo. No obstante, los compuestos alelopáticos pueden ejercer ciertos efectos benéficos en los microorganismos simbióticos. Al respecto, Alford et al.1 demostraron que el crecimiento in vitro de 4 cepas silvestres de rizobios (Rm1021, USDA 3174, USDA 4882 y WU425) puede ser favorecido por compuestos presentes en los extractos de Acroptilon repens (Asteraceae) y Centaurea maculosa (Asteraceae), como la benzoflavona y la (±)-catequina.
La inoculación de rizobios provee beneficios a través de la fijación de nitrógeno, lo que mejora el crecimiento y el desarrollo de leguminosas14. En esta investigación, la inoculación de R. tropici CIAT899 llevó a incrementos en la altura, el volumen de la raíz y la biomasa seca total de plantas de frijol (tabla 1). Y a pesar de que las diferencias no fueron significativas, nuestros resultados indican que R. tropici puede atenuar los efectos negativos causados por la presencia de I. purpurea en el crecimiento de P. vulgaris (tabla 1).
Los compuestos aleloquímicos derivados de plantas alelopáticas reducen el crecimiento de las plantas receptoras36. Por ejemplo, El-Khatib et al.12 demostraron que el extracto acuoso foliar de Calotropis procera (Apocynaceae) redujo el peso seco y el área foliar del pepino, el trigo y el tomate, especialmente cuando se aplicó en concentraciones elevadas. De manera similar, en este estudio se observó un efecto negativo en la altura y el volumen radical de plantas de frijol en presencia de I. purpurea (tabla 1).
Aunque la disminución del contenido de clorofila total en las plantas de frijol por la presencia de I. purpurea no fue significativa (fig. 4A), se conoce que los compuestos derivados de plantas alelopáticas reducen la acumulación de clorofila en las plantas receptoras36,37. Por ejemplo, Portales-Reyes et al.28 reportaron que compuestos como el isotiocianato (AITC) y el bencilisotiocianato (BITC) disminuyeron el contenido de clorofila en la leguminosa Amphicarpaea bracteata. Por otra parte, los compuestos aleloquímicos pueden afectar el rendimiento de la fotosíntesis, al alterar procesos importantes como la entrada de CO2 a través de los estomas, el transporte de electrones y el ciclo de Calvin; sin embargo, los mecanismos en los que intervienen los compuestos aleloquímicos son poco claros36. Lorenzo et al.23 comprobaron que los lixiviados acuosos de Acacia dealbata disminuyeron la fotosíntesis de Hedera hibernica, Dicranum sp., Dactylis glomerata y Leucobryum sp.
En el presente trabajo se muestra que I. purpurea es una fuente potencial de aleloquímicos que influyen en el intercambio gaseoso de las plantas vecinas (v. gr., el que ocurre en la fotosíntesis), ya que diversos parámetros fotosintéticos se vieron afectados en plantas de frijol desarrolladas en presencia de esta especie (figs. 4B-D). Los compuestos alelopáticos con frecuencia reducen la conductancia estomática de ciertas plantas36. En plantas de frijol inoculadas, los valores más altos de conductancia estomática se obtuvieron en ausencia de Ipomoea (fig. 4C). Al respecto, Zhu et al.37 indicaron que los extractos acuosos y etanólicos de corteza de raíz de Prunus persica redujeron significativamente la conductancia estomática.
La transpiración involucra la pérdida de agua en forma de vapor a través de las hojas y es una variable que puede ser afectada por compuestos alelopáticos. Marchiosi et al.25 indicaron la drástica disminución de la transpiración en soja expuesta al compuesto L-DOPA (L-3,4-dihidroxifenilalanina) de Mucuna pruriens. Asimismo, Mishra26 indica una disminución de la transpiración de Ficus religiosa, F. benghalensis y Syzgium cumini al aumentar la concentración del extracto acuoso de hojas de Lantana camara. Contrariamente, en este estudio la transpiración, aumentada por la inoculación con R. tropici no fue significativamente modificada por Ipomoea (fig. 4D).
La alta sensibilidad del PSII a la influencia de los factores bióticos y abióticos hace que a través de la medición de la fluorescencia de la clorofila se pueda conocer la respuesta de las plantas a los cambios ambientales21. Al respecto, los exudados de raíz de plantas como B. pilosa o la aplicación de compuestos alelopáticos que son abundantes en el suelo, como el ácido cinámico y el ácido p-hidrobenzoico (1,5mM), han llevado a la reducción de la eficiencia del PSII de Pteris multifida, Lactuca sativa y D. glomerata18,19. Sin embargo, estos efectos negativos no son siempre perceptibles. Por ejemplo, Marchiosi et al.25 indicaron que el extracto acuoso de Mucuna pruriens disminuyó la fotosíntesis y la conductancia estomática, pero no se obtuvieron cambios en la relación Fv/m. Tampoco en el presente estudio se hallaron cambios significativos en la eficiencia del PSII de plantas de frijol asociados a la presencia de I. purpurea (fig. 4E). En concordancia con este dato, se registró similar concentración de clorofila en las plantas de todos los tratamientos (fig. 4A), lo cual implica similar absorción, transferencia y transformación de la energía luminosa en energía química35.
Estas observaciones acerca del crecimiento y la respuesta fisiológica de frijol indican que los exudados de la raíz de I. purpurea interfieren en el crecimiento y el desarrollo de frijol, así como en la simbiosis con rizobios, según lo observado en plantas de frijol inoculadas. En este sentido, es probable que la edad de I. purpurea (un mes) haya sido un factor determinante en la limitada respuesta, al producir su raíz menor cantidad de exudados. Lo anterior indica la importancia de llevar a cabo estudios de mayor duración, con el fin de evaluar más acertadamente los posibles efectos negativos de una planta alelopática, teniendo en cuenta la fenología tanto de la planta de importancia agrícola como la de la planta alelopática. Cabe señalar que factores como el genotipo de la planta alelopática u otros factores bióticos y abióticos (tipo de suelo, por ejemplo) pueden también influir en la síntesis y liberación de exudados de la raíz en plantas alelopáticas7, con el consiguiente impacto sobre el crecimiento de plantas de importancia agrícola.
Por su parte, se ha informado que ciertos compuestos aleloquímicos pueden ejercer un efecto inhibitorio en la producción de nódulos en leguminosas como A. bracteata, Cicer arietinum y Pisum sativum8,28. Lo anterior concuerda con la inhibición del número de nódulos formados por R. tropici CIAT899 en las plantas de frijol en presencia de I. purpurea (fig. 5A), así como con la reducción de la actividad nitrogenasa en el sistema radical de dichas plantas (fig. 5C). Con base en estos resultados, se considera que los exudados de I. purpurea interfieren negativamente en la fijación biológica del nitrógeno atmosférico en frijol. Por tal motivo es importante investigar qué clase de compuestos son los responsables de este efecto adverso y en qué cantidad son liberados al ambiente edáfico.
A manera de conclusión, puede afirmarse que los lixiviados acuosos de I. purpurea, por un lado, estimulan la germinación de semillas y el crecimiento de radículas de P. vulgaris, pero por otro, inhiben el crecimiento in vitro de la bacteria R. tropici CIAT899, que forma nódulos en la raíces del frijol. Asimismo, se detectaron algunas diferencias significativas en ciertos parámetros fisiológicas de frijol en presencia de I. purpurea, hecho que indica efectos negativos sobre el desempeño de este cultivo. Es importante señalar que, aun cuando I. purpurea redujo la nodulación de R. tropici y la actividad de nitrogenasa del sistema radical de frijol, la simbiosis de esta bacteria puede atenuar los efectos negativos que ejerce la planta alelopática. Por lo anterior, es importante llevar a cabo más estudios que corroboren los efectos de plantas con potencial alelopático en la germinación de semillas y el crecimiento vegetal, así como en la nodulación y en la respuesta fisiológica de leguminosas en simbiosis con rizobios. De igual manera, se requiere identificar los compuestos potencialmente alelopáticos de I. purpurea y su actividad biológica. Además, es recomendable evaluar los efectos directos de plantas alelopáticas en simbiosistemas que se llevan a cabo entre microorganismos simbióticos y plantas de interés agrícola, ya que aunque el establecimiento de estos simbiontes en el sistema radical puede resultar inhibido, al mismo tiempo son elementos biológicos importantes en la atenuación de los efectos dañinos causados por plantas alelopáticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece el apoyo del CONACYT durante los estudios de maestría de P.J. Pérez-Peralta.