Pseudomonas aeruginosa es un bacilo gram negativo capaz de desarrollarse en ambientes húmedos y tejido animal. El interés en esta bacteria surge de su capacidad para producir enfermedades oportunistas en pacientes con fibrosis quística e infecciones asociadas a la atención de la salud (IAAS). El objetivo de nuestro trabajo fue caracterizar el perfil de resistencia a antimicrobianos de un conjunto de cepas aisladas en nuestra comunidad (zona de Mexicali, México) causantes de IAAS. Este fue un estudio descriptivo, prospectivo y transversal. Las cepas se aislaron entre enero de 2019 y diciembre de 2021 en una unidad asistencial privada dependiente de la Universidad Autónoma de Baja California (UABC). Se empleó espectrometría de masas por desorción/ionización láser asistida por matriz (MALDI-TOF) para la identificación. La detección de resistencia a betalactámicos se efectuó según los criterios Clinical and Laboratory Standard Institutes (CLSI), documento M100-S27. Se obtuvieron 649 muestras en el período mencionado, 335 de expectoración, 119 de orina y 91 de herida como los sitios mayoritarios. La proporción de cepas resistentes a los carbapenémicos comprendió un 38,94% resistente a meropenem y un 21,97% a imipenem. Para el caso de las cefalosporinas, se encontró un 21,05% resistente a cefepima, un 22,9% a ceftazidima y un 24,78% a ceftolozano-tazobactam. La resistencia a los antimicrobianos se ha vuelto más prevalente a lo largo del tiempo en este agente infeccioso, lo que puede atribuirse tanto a la presión selectiva como a la evolución de los propios microorganismos.
Pseudomonas aeruginosa is a Gram-negative bacillus capable of developing in humid environments and animal tissue. The interest in this bacterium lies in its ability to cause opportunistic diseases in patients with cystic fibrosis and healthcare-associated infections (HAIs). The objective of our study was to characterize the resistance profile of strains causing HAIs isolated in hospitals within our community, from January 2019 to December 2021. This descriptive, prospective, and cross-sectional study involved the isolation of strains from January 2019 to December 2021 at the Autonomous University of Baja California (UABC). The identification of the strains was carried out using Matrix-Assisted Laser Desorption/Ionization-Time of Flight (MALDI-TOF) mass spectrometry, and the detection of beta-lactam resistance was performed according to the criteria of the Clinical and Laboratory Standards Institute as stipulated in the CLSI M100-S27 document. A total of 649 samples were obtained from January 2019 to December 2021, including sputum (335 samples), urine (119 samples), and wounds (91 samples). Resistance to carbapenems was 38.94% for meropenem and 21.97% for imipenem. For cephalosporins, there was a 21.05% resistance rate for cefepime, 22.9% for ceftazidime, and 24.78% for ceftolozane-tazobactam. The prevalence of antimicrobial resistance has increased over time, which is attributable to both selective pressure and the evolution of the microorganisms themselves.
Pseudomonas aeruginosa es un bacilo gram negativo, aerobio y móvil, capaz de desarrollarse en ambientes húmedos como suelos, pantanos, plantas, zonas costeras, lechos de ríos y tejido animal. Puede generar en todos los ambientes una capa compleja de limo, que le permite construir una biopelícula muy adherente y resistente5.
El interés por esta bacteria ubicua abarca desde aspectos positivos, como su posible aplicación en biorremediación de áreas contaminadas con petróleo, hasta la necesidad de erradicarla o controlarla dada su capacidad de producir enfermedades oportunistas en pacientes con fibrosis quística e infecciones asociadas a la atención de la salud (IAAS). Las infecciones por P. aeruginosa se asocian, por lo general, a pacientes inmunocomprometidos y son comunes en tejidos dañados, como en heridas (principalmente en pacientes quemados) y en el tracto urinario; también se las ha vinculado con meningitis, septicemias e infecciones respiratorias11.
El tratamiento contra este microorganismo ha sido un gran reto debido a la resistencia intrínseca a la mayoría de los antibacterianos de uso diario en la práctica clínica, así como a la adquisición de mecanismos de resistencia a estos compuestos. Los carbapenémicos son un subgrupo de antibacterianos betalactámicos con mayor espectro y actividad en contra de P. aeruginosa; sin embargo, para poder ejercer su efecto, deben atravesar la membrana externa y llegar hasta las proteínas fijadoras de penicilina (PBP, por sus siglas en inglés), en la pared celular4. En los últimos años, se ha observado un aumento de P. aeruginosa resistentes a carbapenémicos (PARC), con mecanismos de resistencia clasificados en 4 tipos: 1) bombas de eflujo de amplio espectro (bombas MexAB-OprM), 2) pérdida y cierre de porinas de la membrana externa (canales OprD), 3) producción de carbapenemasas mediadas por plásmidos12 y 4) inactivación enzimática por producción de betalactamasas cromosómicas AmpC8.
Actualmente, la Organización Mundial de Salud posicionó a las enterobacterias, P. aeruginosa y Acinetobacter baumannii causantes de infección como microorganismos de prioridad alta (crítica) para la vigilancia epidemiológica y el desarrollo de nuevos antibacterianos y de investigación que esclarezca los mecanismos de resistencia.
En el panorama epidemiológico de México, la resistencia a antibióticos betalactámicos fue alta para los carbapenémicos antiseudomonas (meropenem [MER] e imipenem [IMI]) en comparación con la resistencia a las penicilinas y cefalosporinas con actividad antiseudomonas3. En un reporte breve publicado en la Gaceta Médica Mexicana10, se informó una sensibilidad del 72,7% frente a las cefalosporinas con actividad antiseudomonas (ceftolozano/tazobactam y ceftazidima/avibactam) usadas en la ciudad de Mexicali.
Entre otros antecedentes, en la zona norte de dicha ciudad, colindante con el condado imperial del estado de California, EE. UU., se ha detectado contaminación con P. aeruginosa en cuerpos de agua para riego; también en las tuberías con agua para consumo humano proveniente de los deltas del río Colorado2 y en un estudio epidemiológico demostró la aparición de cepas extremadamente resistentes (XDR) de P. aeruginosa en la ciudad vecina de Tijuana, en pacientes operados de cirugía bariátrica6.
El fin último es proveer información que colabore con un adecuado control de estas infecciones y permita reforzar las medidas terapéuticas y la administración supervisada de antibacterianos.
Las muestras fueron recolectadas de pacientes atendidos entre enero de 2019 y diciembre de 2021 en el sector privado del Área de Microbiología Clínica del Laboratorio de Microbiología y Parasitología de la UABC, según protocolos establecidos. Criterio de inclusión: aislados provenientes de pacientes con diagnóstico de infección nosocomial y con P. aeruginosa como único germen aislado.
Las muestras fueron procesadas según métodos estandarizados, dependiendo del tipo. Se recibieron muestras de secreción bronquial por aspiración, secreción de herida, urocultivo, exudado faríngeo, secreción ótica y biopsias. Con pipetas Pasteur, se inocularon cajas de Petri con medios de cultivo generales, como agar nutritivo (MCD, México), y con el medio selectivo para gram negativos compuesto de eosina azul de metileno y agar MacConkey (MCD, México). Estas inoculaciones se realizaron por el método de estría, utilizando un ansa calibrada de 10μl. Las placas se incubaron a 36°C por 24h en una incubadora estacionaria (Norcom Lab Supplies, EE. UU.). Cuando se obtuvo desarrollo bacteriano, se realizó la tinción de gram (BD Diagnostics, Gram Stain Kit) para visualizar la morfología bacteriana correspondiente a P. aeruginosa.
Tras la detección por este método, se pasó a la identificación por pruebas bioquímicas tradicionales (Sistema API-20 non-Enterobacteriaceae gram-negative, Biomerieux). Adicionalmente, las cepas se repicaron a agar cetrimida (Agar Cetrimida Base, Britania) con glicerol (grado reactivo, Baxter reactivos) para la detección de pigmentos.
A la par de la identificación por el sistema API, se efectuó la identificación mediante espectrometría de masas con desorción/ionización láser asistida por matriz - tiempo de vuelo (Microflex® MALDI-TOF, Bruker), siguiendo las indicaciones del fabricante para la adecuada extracción de proteínas.
El antibiograma de los aislamientos se efectuó con el equipo Vitek®2 Compact (BioMerieux, Francia) utilizando los cartuchos para la detección de resistencia a los antibióticos (AST Cards, non-fermentatives), siguiendo las indicaciones del manual de trabajo.
Los valores de referencia se tomaron del documento M100 del Clinical and Laboratory Standard Institutes (CLSI), tomando como criterio de inclusión aquellas bacterias que presentaron un perfil de resistencia a betalactámicos. Como un agregado a nuestro trabajo, incluimos en este análisis otros antimicrobianos usados contra P. aeruginosa cuando se define que existe multidrogorresistencia (MDR), es decir, cuando el aislado es resistente a un antimicrobiano en 3 grupos de antimicrobianos o más.
Con los resultados obtenidos se elaboraron bases de datos en el programa Excel® (Windows, Silicon Valley, California, EE. UU.). La información fue procesada en el paquete estadístico Statistix® v 9.0 (Analytical Software, Tallahassee, Florida, EE. UU.) y graficada en GraphPad Prism® v. 8.0. (Dotmatics, Boston, Massachusetts, EE. UU.).
Se estudiaron un total de 649 aislados de pacientes: 335 provenían de secreciones bronquiales, 91 de heridas, 47 de sangre, 119 de orina, 28 de tejidos, 13 de faringe y los restantes de otras muestras. Se obtuvieron aislados microbianos en 399 varones y 250 mujeres.
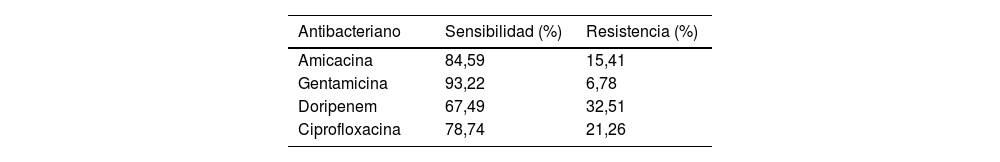
Se detectaron 199 aislados (30,66%) MDR (fig. 1). Con respecto al porcentaje de resistencia a carbapenémicos, el 38,94% fue resistente a MER y el 21,97% a IMI. También se observó resistencia a cefepima (FEP) en el 21,05% de las cepas, a ceftacidima (CAZ) en el 22,05% y a ceftolozano/tazobactam (CTZ) en el 24,78%. Entre las penicilinas con actividad antiseudomonas evaluadas, se observó un 20,18% de resistencia a piperacilina (PIP)/tazobactam (PTZ), un 35,49% a ticarcilina (TIC) y un 38,46% a PIP. Los porcentajes de aislamientos sensibles y resistentes a otros antimicrobianos no betalactámicos y a doripenem, pese a que su uso es limitado en dicha región, se muestra por separado en la tabla 1.
El perfil de resistencia antimicrobiana en las cepas estudiadas en esta investigación coincide con los perfiles de resistencia documentados en otras partes de nuestro país3. Para el manejo de las infecciones de la comunidad y de las intrahospitalarias, el diseño de la terapéutica empírica debe considerar los resultados que se encuentran para la localidad o la región en donde se está realizando la vigilancia de la farmacorresistencia, no solo las recomendaciones de las guías americanas o europeas.
La alta resistencia a MER en comparación con IMI se puede explicar por los diferentes mecanismos de resistencia que hay entre los mismos carbapenémicos, la producción de bombas de eflujo como la mexAB que está muy relacionada con la resistencia a MER, y la producción de porinas OprD que se observa en la resistencia a IMI.
La incidencia de cepas de P. aeruginosa de difícil tratamiento, incluyendo cepas con resistencia a carbapenémicos, se mantiene en un nivel similar a los registrados en México. Este mismo fenómeno se ha informado en diferentes partes del mundo, como en España, país que actualmente reporta una alta incidencia de cepas resistentes a carbapenémicos que producen enzimas13, al igual que en países altamente desarrollados, como EE. UU., donde se ha encontrado una alta tasa de resistencia en hospitales públicos14.
El problema es particularmente notorio en los países desarrollados de Europa. Un consenso reveló la elevada incidencia de estas cepas, altamente resistentes, en la Unión Europea y en los países adheridos a la Red de Vigilancia Europea, que también colabora con el Centro de Control de Enfermedades Europeo (ECDC)9. Esto marca la necesidad de continuar la vigilancia de estas cepas, y no solo en los países desarrollados, sino también en los países asiáticos. En ese sentido, cabe destacar un estudio realizado en China, en el que se encontró una incidencia de aislamientos resistentes a carbapenémicos muy parecida a la hallada en Mexicali, en pacientes internados en las áreas de terapia, con la excepción de MER que presento menor resistencia a los resultados analizados en la ciudad fronteriza7. Otro estudio realizado por la Universidad de Palestina describe un aumento considerable en las infecciones por estas cepas de P. aeruginosa MDR y reporta resistencias muy similares a las halladas en nuestro estudio a ciprofloxacina y aminoglucósidos, pero más baja al comparar el porcentaje de resistencia a MER15. Otro estudio realizado en Etiopía informa hasta el 60% de casos de cepas resistentes a carbapenémicos; sin embargo, principalmente presentaban resistencia a IMI sobre MER1.
Para explicar estos fenómenos de resistencias contrastantes entre antibacterianos de la misma familia (cepas resistentes a MER y sensibles a IMI, o viceversa), proponemos 2 hipótesis posibles: 1) El turismo medico ha facilitado la adquisición de cepas que posean mecanismos transmisibles como plásmidos y otros elementos móviles que están en contacto con las cepas residentes y 2) Los mecanismos de resistencia de las bacterias de nuestro estudio posean mutaciones importantes como en los genes reguladores o en el gen AmpC para cefalosporinas como ceftolozano y ceftazidima, cuyos productos génicos también son carbapenemasas débiles.
Es necesario adecuar la vigilancia epidemiológica de estas cepas que se encuentran en esta ciudad. El turismo médico es una de las principales «atracciones» en esta región por la facilidad en realizarse los procedimientos y costos, comparada con la practica médica de EE. UU. Consideramos importante investigar los mecanismos de resistencia a antimicrobianos que se encuentran en los aislamientos de esta ciudad, para adecuar las guías de manejo de manera personalizada tomando la información y los datos que observamos en la comunidad.
Es necesario seguir actualizando las guías de recomendaciones para evitar el uso excesivo de antibióticos y considerar que, dependiendo de cada caso, podemos desescalar y continuar con el uso de antibióticos como las penicilinas antiseudomonas y cefalosporinas disponibles en la ciudad, antes de recurrir al uso de los carbapenémicos, para que estos sean, de nuevo, los antibióticos de último recurso ante las infecciones causadas por microorganismos MDR4.
Responsabilidades éticasEl siguiente estudio es del tipo observacional, por lo que el Comité de ética de la UABC ha confirmado que no requiere como tal de su aprobación.
AutoríaRicardo Delgadillo Valles se encargó del procesamiento de las muestras y análisis de datos; Gerson Ney Hernández Acevedo se encargó del desarrollo de materiales y métodos durante la investigación; Antonio Rechy Iruretagoyena y Edwin Barrios Villa se encargaron de la corrección y el asesoramiento en este artículo; Jonathan Arauz Cabrera y Dolores Márquez Salazar se encargaron del manejo de las tablas para el procesamiento de los datos para su posterior análisis. Todos los autores participaron en el desarrollo de esta investigación en concepto y diseño.
FinanciaciónNinguno de los autores en este proyecto ha obtenido financiación u apoyo de otro tipo durante la preparación del manuscrito.
Agradecimientos al Dr. Rafael Martínez Miranda a cargo del área de Microbiología Clínica del Laboratorio Dorado para la identificación complementaria de las muestras procesadas en este estudio y su solidaridad en el desarrollo de este artículo.