Determinar si la realización de un mayor número de muestras según el valor del antígeno prostático específico (PSA) incrementa la detección del cáncer prostático (CaP).
Materiales y métodosSe estudió transversalmente a 994 pacientes sometidos a una biopsia prostática transrrectal ecodirigida randomizada (BPTE), con sospecha de CaP. Los casos fueron divididos en dos grupos: A (esquema de 8 muestras y ampliado) con protocolo normal (n=819) y B (esquema de 12 muestras o más) con protocolo extendido (n=175). Estos se subdividieron de acuerdo con el valor del PSA en tres niveles (< 3,9ng/ml, 4-9,9ng/ml y>10ng/ml) y se evaluó la tasa de detección de CaP en cada subgrupo. Los datos clínicos fueron analizados con las pruebas T de student, chi-cuadrado y regresión logística, tomando como estadísticamente significativo un valor inferior a 0,05.
ResultadosLa tasa de detección de CaP en el grupo A fue mayor que la del B: 43,71% vs. 34,29%; p=0,022. Al analizar los resultados, teniendo en cuenta la subdivisión de los valores de PSA, no encontramos diferencias estadísticamente significativas para la detección de malignidad entre los dos grupos.
ConclusiónAumentar el número de muestras en la BPTE no incrementó la tasa de detección de CaP de forma independiente ni en cada subgrupo de PSA, así como tampoco en los subgrupos de volumen prostático. Por otro lado, a mayor edad y PSA, hubo más detecciones de CaP.
To determine whether obtaining a larger number of core specimens, depending on the PSA value, increases the detection of prostate cancer.
Materials and methodsA cross-sectional study was conducted on 994 patients with suspected prostate cancer who underwent transrectal ultrasound-guided prostate biopsy. The patients were divided into group A with a standard protocol (8 core specimens or more scheme) and group B with an extended protocol (12 core specimens or more scheme), and subdivided according to the PSA values into three groups (<3.9ng/ml, 4 to 9.9ng/ml, and >10ng/ml). The prostate cancer detection rate was evaluated in each subgroup. Clinical data was analysed using the Student t and chi-squared tests and logistic regression analysis, taking a P<0.05 as statistically significant.
ResultsThe detection rate of prostate cancer in the group A was higher than group B: 43.71% vs. 34.29%; P=0.022. When analysing the results, taking into account the sub-division of PSA results, no significant statistical differences were found in the detection of malignancy in the two groups of patients evaluated.
ConclusionIncreasing the number of core specimens in transrectal ultrasound-guided prostate biopsy, does not increase the overall detection rate of prostate cancer in either of the PSA sub-groups, or in either of the of prostate volume sub-groups. On the other hand, the older the patient and the higher the PSA value, the greater the detection of prostate cancer.
El cáncer de próstata (CaP) es uno de los principales tumores malignos en la población masculina y continúa siendo una de las principales causas de muerte a nivel mundial1. En la Argentina, su incidencia se aproxima a los 11.202 casos por año, un número equivalente al 20,4% de todas las neoplasias reportadas en hombres y al 9,7% de todos los tumores informados en ambos sexos. Ocupa el tercer puesto de distribución absoluta y se calculan alrededor de 3.783 muertes al año a causa de esta patología, según los datos oficiales del Ministerio de Salud de la República Argentina del año 20122.
Según el National Cancer Institute, en Estados Unidos el número de nuevos casos de cáncer de próstata fue de 137,9/100.000 hombres por año y el número de muertes fue de 21,4/100.000 hombres por año, según las cifras ajustadas por edad y basadas en casos y muertes del período 2008-20123.
En nuestro país, el cribado se realiza mediante tacto rectal (TR) y dosaje del antígeno prostático específico (PSA), cuyo valor de corte para sospecha de CaP es de 4ng/ml. En algunos casos, se complementa con una ecografía prostática o resonancia magnética (RM). Esta últimamente se ha convertido en un método imagenológico importante debido a que permite la combinación de información morfológica y funcional de la próstata4. Teniendo en cuenta los resultados de los estudios previamente mencionados, se lleva a cabo la biopsia prostática transrectal ecodirigida (BPTE) para la confirmación5.
En la práctica clínica diaria de los últimos 10 años, en nuestra institución, y de acuerdo al esquema de randomización vigente en el momento de la solicitud, se han practicado desde biopsias por sextante hasta biopsias por saturación, por lo que nos preguntamos si los esquemas superiores a 8 muestras incrementan la tasa de detección del adenocarcinoma y su relación con el valor del PSA. Por ello, en este estudio nos proponemos determinar si la realización de un mayor número de muestras según el valor del PSA incrementa la detección del adenocarcinoma.
Materiales y métodosEn este estudio transversal se revisaron los resultados anatomopatológicos, el PSA, la edad, el volumen y la presencia de nódulo prostático reportado en la ecografía de la BPTE de 1090 hombres derivados de la consulta externa durante el período comprendido entre marzo de 2001 y noviembre de 2014. Se excluyeron 83 casos con biopsia sextante (6 muestras) y 13 con biopsias por saturación (protocolos de 36 muestras) o segunda biopsia, por lo que el número final fue de 994 pacientes. Todos ellos firmaron un consentimiento informado donde aceptaban que sus datos fueran utilizados con fines investigativos y el Comité de Ética de la institución analizó y aprobó el trabajo.
Los criterios de inclusión fueron: valores aumentados de PSA según criterio del médico tratante, tacto rectal anormal y/o previa ecografía transrectal patológica.
Los datos fueron recolectados por los médicos residentes de 4.° año que rotaban en la subespecialidad de intervencionismo cada 3 meses. Para el registro, se usaron planillas prediseñadas que mensualmente se ingresaban a una matriz de Excel.
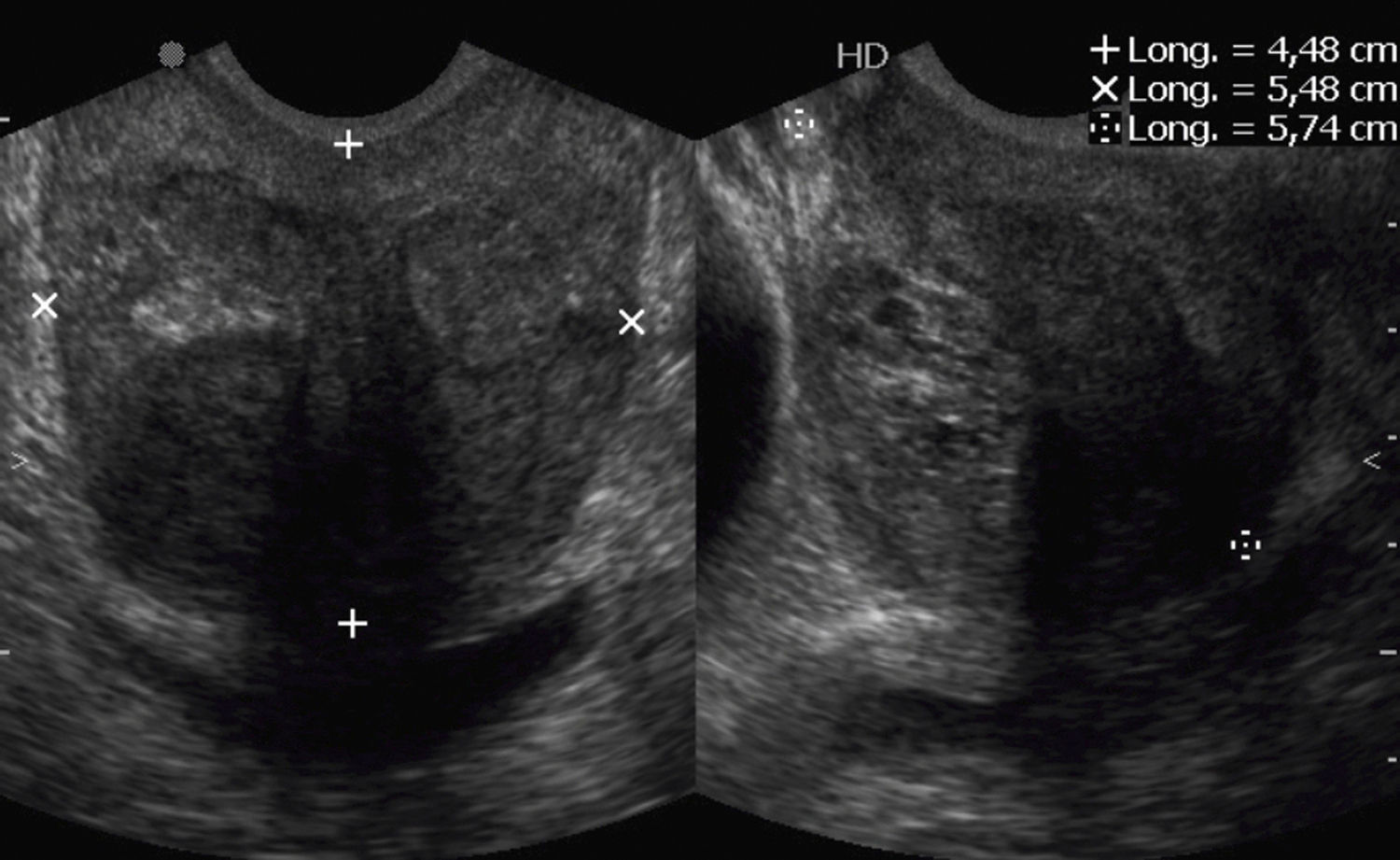
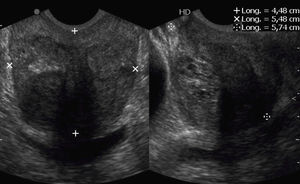
Se verificó el PSA libre en ng/ml reportado por el laboratorio no más de 2 meses después de la fecha de la biopsia. La edad del paciente fue registrada en años y el peso prostático en gramos (g), de acuerdo con la fórmula: medida longitudinal x medida transversal×medida anteroposterior×0,000523 (fig. 1).
Para la realización de la biopsia se utilizó un ecógrafo Philips Envisor, con transductor endocavitario de 5MHz y guía para punción, una pistola automática ProMag y una aguja ProMag de 18 Gauge (18×20). Antes del procedimiento se constató la correcta hemostasia sanguínea mediante estudios de coagulación y se indicó medicación profiláctica con ciprofloxacina cada 12 horas desde el día previo hasta 5 días después del estudio. Además, 2 horas antes del procedimiento se aplicó un enema evacuante osmótico y antes de la toma de muestras se llevó a cabo una ecografía prostática transrrectal con medición de la glándula en tres diámetros, cálculo del volumen y búsqueda detallada de alteraciones focales, incluyendo la zona periférica glandular.
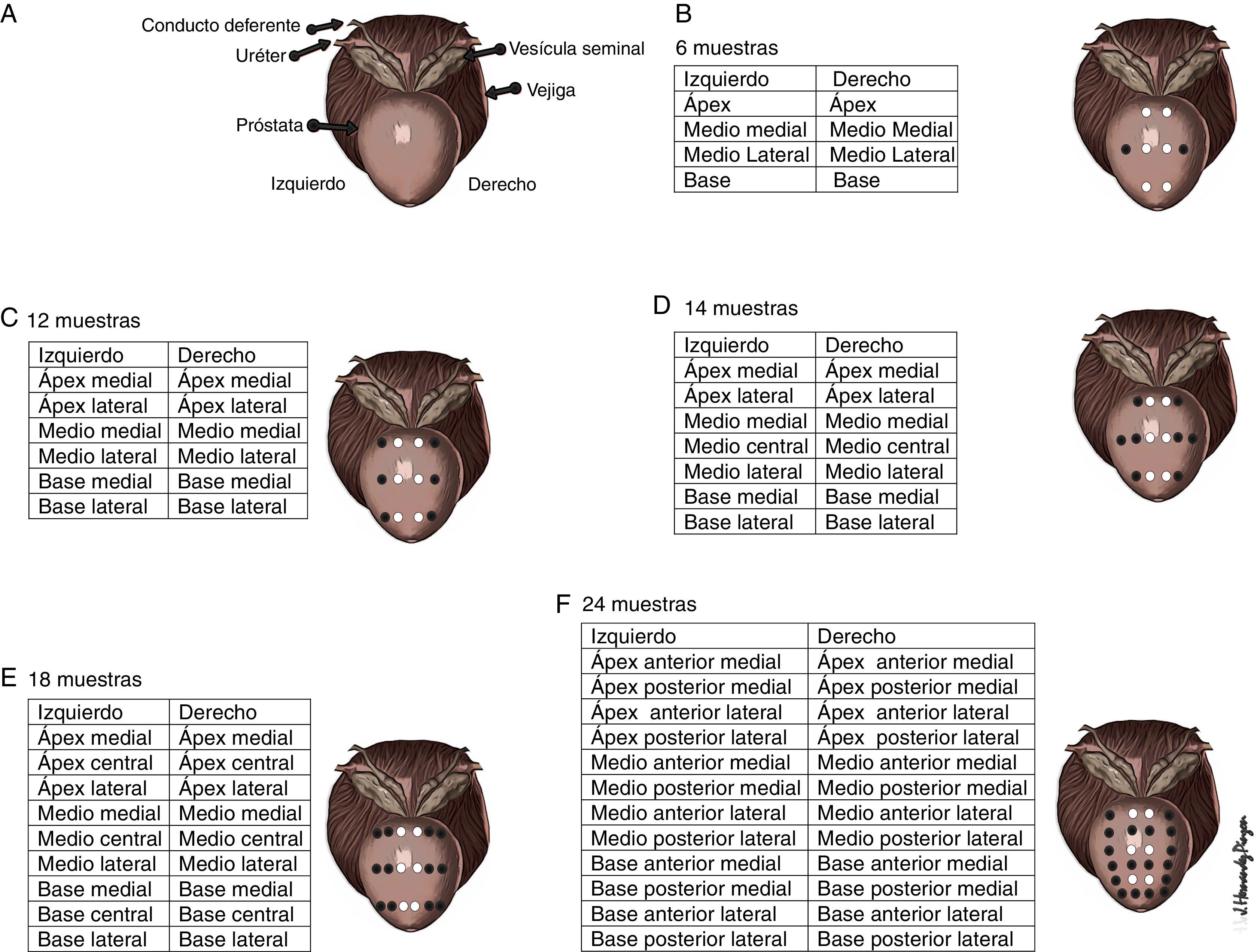
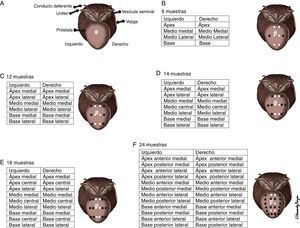
Los esquemas de randomización de las biopsias fueron de 8, 12, 14, 18 y 24 muestras (fig. 2). En el caso del protocolo de 8, se amplió a 10 (2 muestras más) ante el hallazgo de un nódulo en la zona periférica.
El material obtenido se envió al laboratorio en frascos con formol, cada uno rotulado con el nombre del paciente y la región biopsiada. Las muestras fueron analizadas por el servicio de Patología con la técnica de hematoxilina-eosina y una eventual marcación inmunohistoquímica. Los resultados estuvieron en 5 días aproximadamente.
Análisis estadísticoLa estadística descriptiva fue realizada mediante estadísticos de tendencia central. Para variables continuas se aplicó el examen T de student, mientras que para las variables nominales se utilizaron tablas de análisis de contingencia de la prueba chi-cuadrado.
Las variables continuas fueron: edad (años), número de muestras, valor del PSA (ng/ml) y peso prostático (gramos). Por su parte, las variables nominales se basaron en un protocolo dicotomizado en pacientes a los que se les realizó un esquema de 8 muestras (ampliado a 10 ante el hallazgo de un nódulo) y pacientes con un esquema de 12 o más muestras, denominándolos grupo A y B, respectivamente. A su vez, los resultados anatomopatológicos se dividieron en malignidad y benignidad, y en grupos de PSA y de volumen prostático.
Se llevó a cabo un análisis uni y multivariado con regresión logística, incluyéndose la malignidad como variable dependiente y la edad, el valor del PSA y el volumen prostático como variables independientes.
ResultadosPara el análisis, se dividió a la población en 2 grupos: el A (protocolo normal), constituido por pacientes con esquema de 8 muestras o ampliado; y el B (protocolo extendido), conformado por aquellos con protocolo de 12 o más muestras.
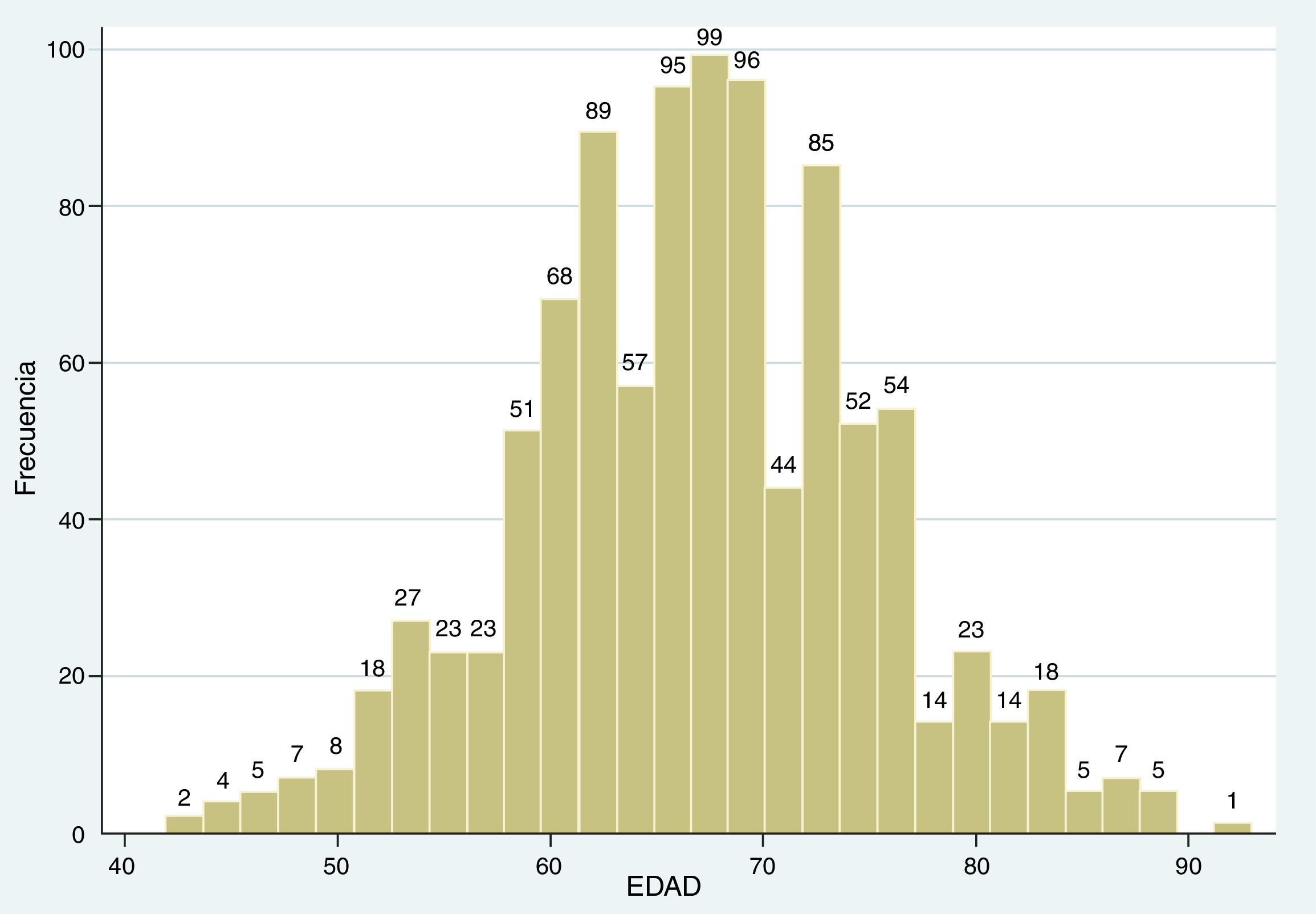
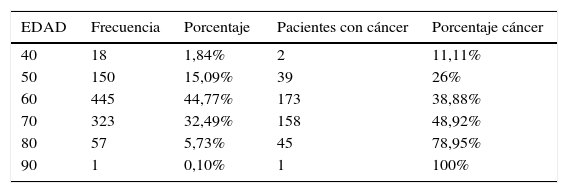
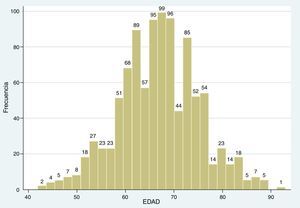
El rango de edad estuvo entre los 42 y 93 años, con una media de 66,9±8,12 de desviación estándar (SD). Al separar en decenios, el porcentaje de malignidad fue del 11,11% en los pacientes de 40–49 años, del 26% en los de 50-59 años, del 38,88% en los de 60–69 años, del 48,92% en los de 70–79 años, del 78,95% en los de 80-89 años y del 100% en los de más de 90 años (fig. 3; tabla 1).
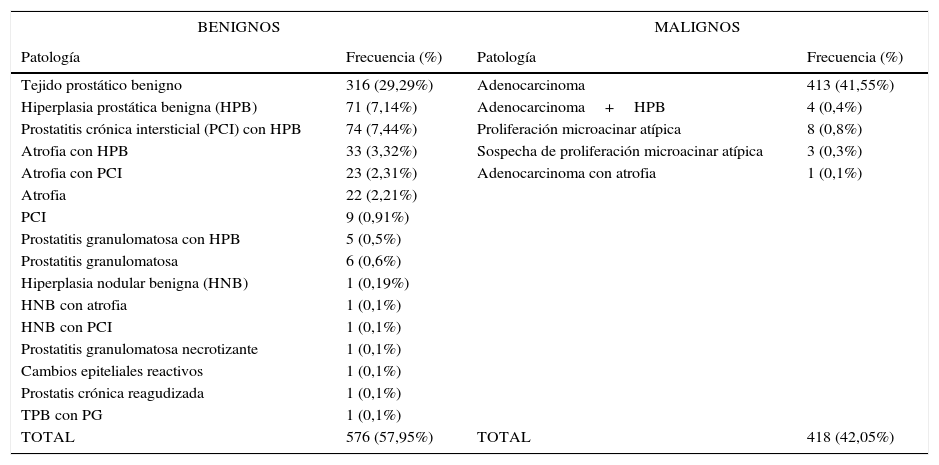
Los resultados anatomopatológicos y su frecuencia se encuentran en la tabla 2.
Frecuencia de los resultados histopatológicos
| BENIGNOS | MALIGNOS | ||
|---|---|---|---|
| Patología | Frecuencia (%) | Patología | Frecuencia (%) |
| Tejido prostático benigno | 316 (29,29%) | Adenocarcinoma | 413 (41,55%) |
| Hiperplasia prostática benigna (HPB) | 71 (7,14%) | Adenocarcinoma+HPB | 4 (0,4%) |
| Prostatitis crónica intersticial (PCI) con HPB | 74 (7,44%) | Proliferación microacinar atípica | 8 (0,8%) |
| Atrofia con HPB | 33 (3,32%) | Sospecha de proliferación microacinar atípica | 3 (0,3%) |
| Atrofia con PCI | 23 (2,31%) | Adenocarcinoma con atrofia | 1 (0,1%) |
| Atrofia | 22 (2,21%) | ||
| PCI | 9 (0,91%) | ||
| Prostatitis granulomatosa con HPB | 5 (0,5%) | ||
| Prostatitis granulomatosa | 6 (0,6%) | ||
| Hiperplasia nodular benigna (HNB) | 1 (0,19%) | ||
| HNB con atrofia | 1 (0,1%) | ||
| HNB con PCI | 1 (0,1%) | ||
| Prostatitis granulomatosa necrotizante | 1 (0,1%) | ||
| Cambios epiteliales reactivos | 1 (0,1%) | ||
| Prostatis crónica reagudizada | 1 (0,1%) | ||
| TPB con PG | 1 (0,1%) | ||
| TOTAL | 576 (57,95%) | TOTAL | 418 (42,05%) |
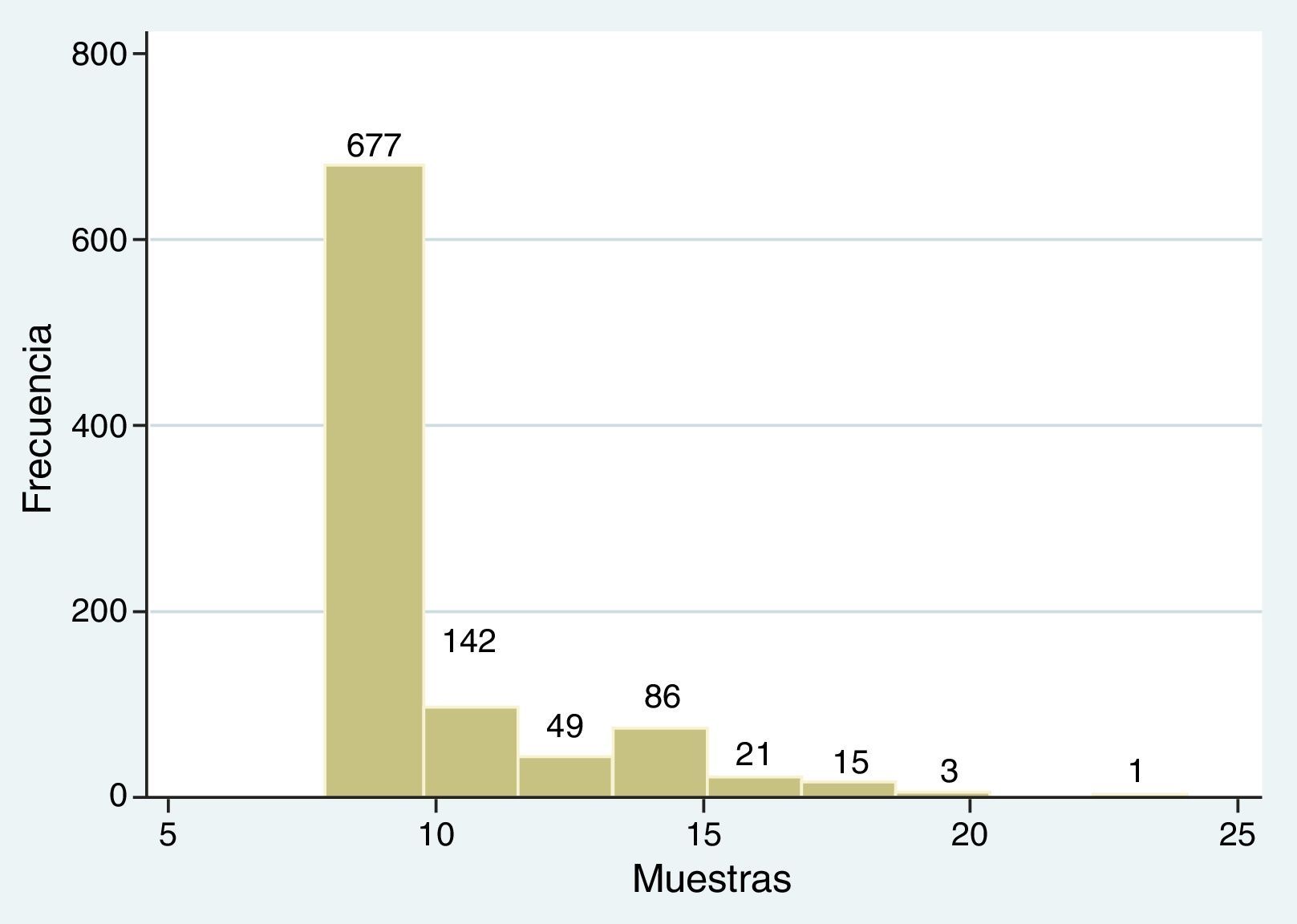
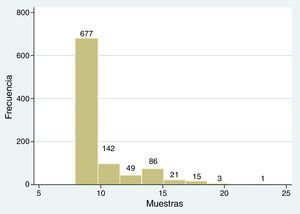
Se consideraron estudios entre 8 y 24 muestras, con una media de 9,39±2,47 SD, equivalente a 819 BPTE con protocolo normal y a 175 BPTE con protocolo extendido (fig. 4).
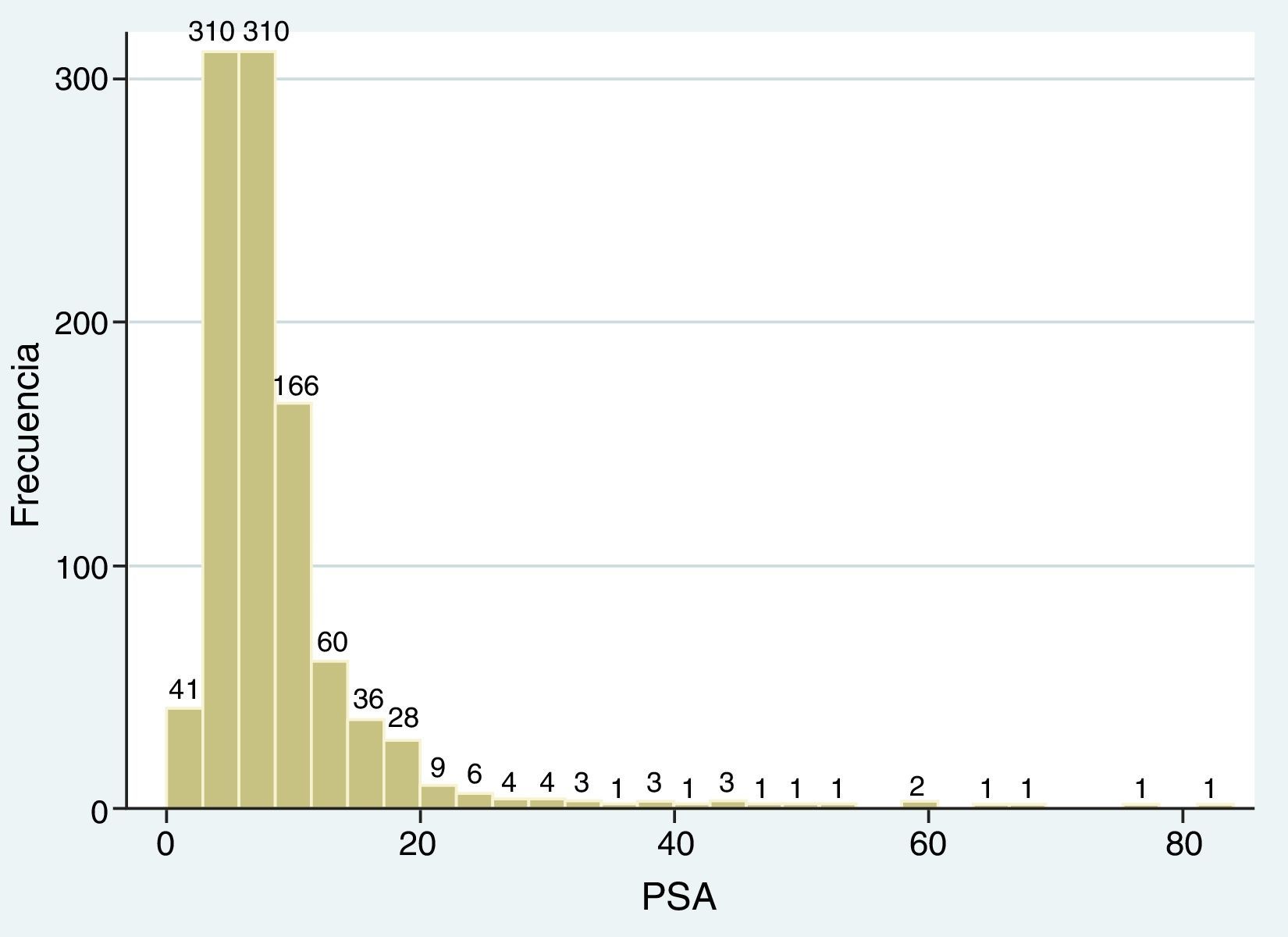
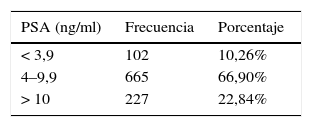
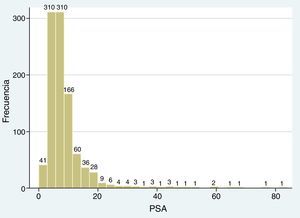
El PSA fluctuó entre 0 y 84ng/ml, con una media de 8,82±7,67 SD (fig. 5), y de acuerdo con su valor, se establecieron tres niveles: grupo A≤3,9ng/ml, grupo B entre 4 y 9,9ng/ml, y grupo C>10ng/ml (tabla 3).
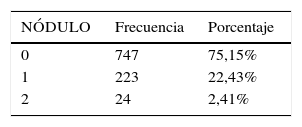
La cantidad de nódulos detectados en nuestra muestra poblacional se describen en la tabla 4.
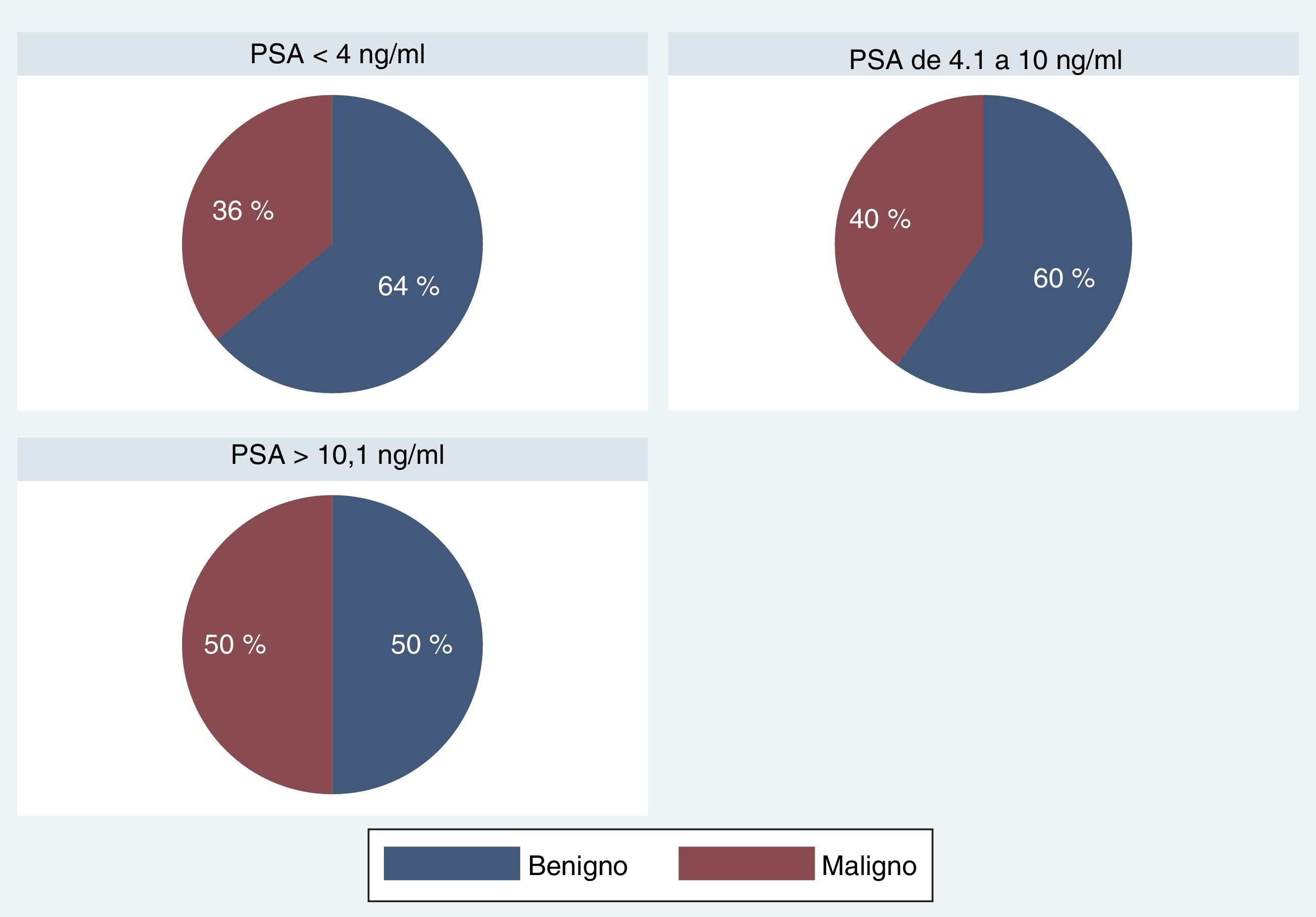
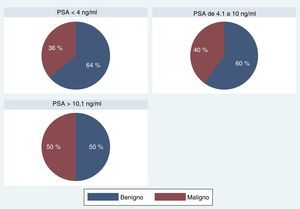
En cuanto a los pacientes con diagnóstico de malignidad, los valores de PSA en los tres grupos fueron: 37 en A (36,2%), 267 en B (40,1%), 114 en C (50,2%); chi-cuadrado de Pearson (2)=8,5993; Pr=0,014.
Además, el volumen se dividió en 5 grupos:<20g, 21–30g, 31-40g, 41–50g y>51g; presentando un porcentaje de malignidad del 75% (n=27), 65,4% (n=93), 53% (n=106), 34,86% (n=61) y 29,71% (n=131), respectivamente (chi-cuadrado de Pearson [4]=89,1996; Pr=0,0001).
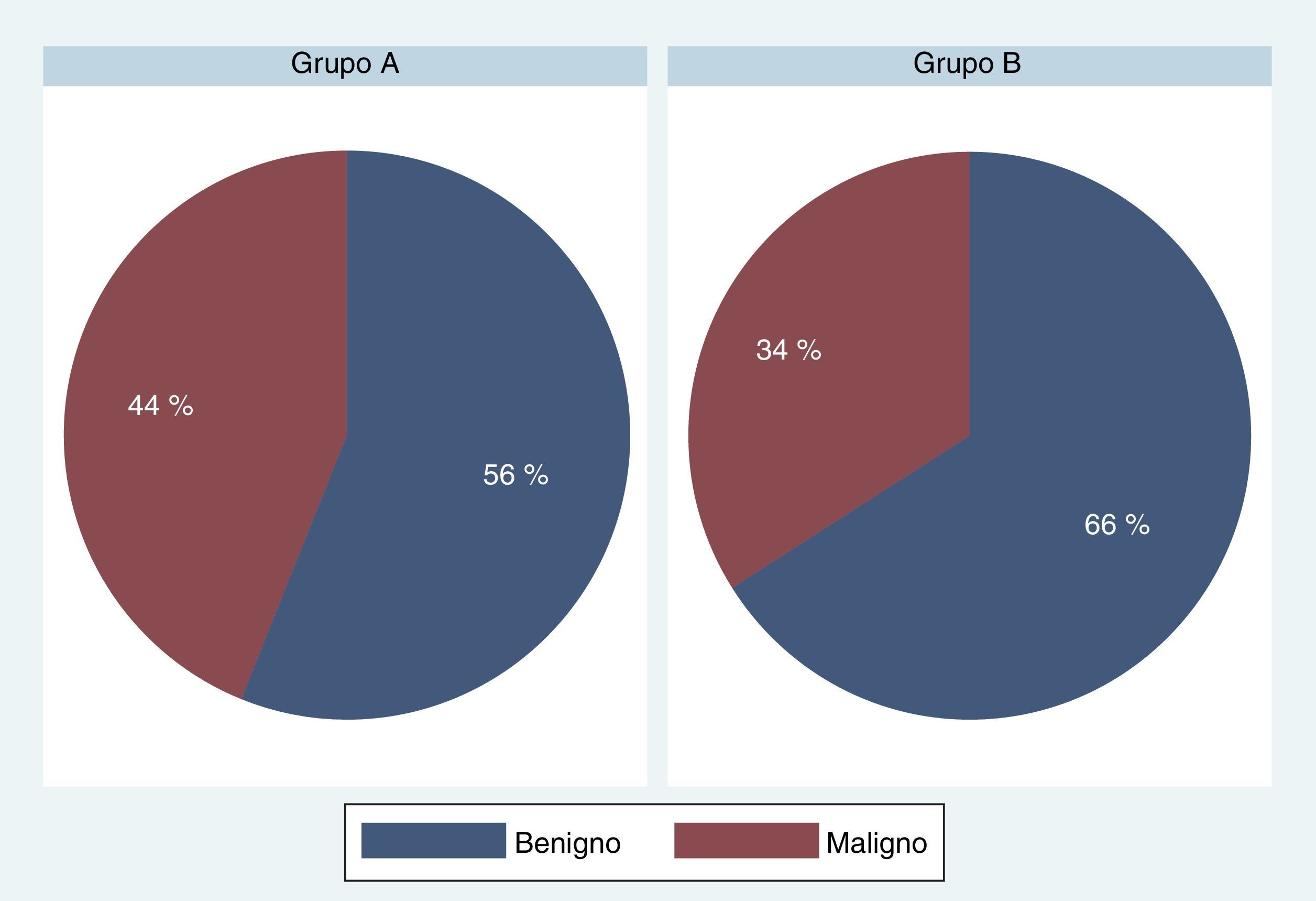
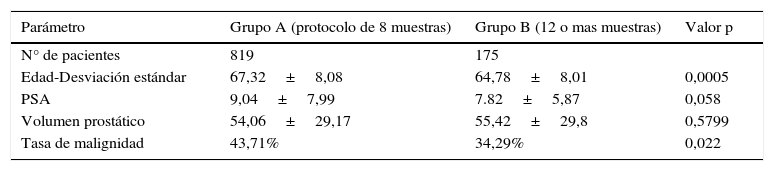
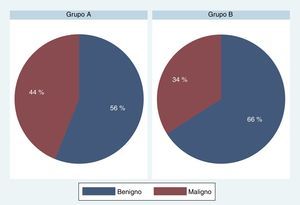
El análisis de nuestra población determinó que el grupo A (protocolo de 8 muestras y ampliado) estaba constituido por 819 pacientes con una edad media de 67,32, un PSA de 9,04ng/ml y un volumen prostático de 54,06g; mientras que el grupo B (protocolo de 12 o más muestras) contaba con 175 pacientes con una edad media 64,78, un PSA de 7,82ng/ml y un volumen prostático de 55,42g. El resultado del estudio comparativo arrojó un porcentaje de detección de CaP del 43,71% para el grupo A y del 34,29% para el B (chi-cuadrado de Pearson [1]=5,2412; p=0,022) (fig. 6).
El grupo A fue 2,34 años mayor que el B, siendo esta diferencia estadísticamente significativa (t [992]=3,4838; p=0,0005). A su vez, en el grupo A el valor del PSA fue 1,21ng/ml mayor que el del B, siendo también estadísticamente significativo (t [992]=1,8978; p=0,0580); mientras que el volumen prostático en el grupo A fue de 54,06±29,17 SD y en el B de 55,42±29,80 SD, sin diferencia significativa (t [992]=−0,5536; p=0,5799) (tabla 5).
Principales características de nuestra población agrupada por número de muestras
| Parámetro | Grupo A (protocolo de 8 muestras) | Grupo B (12 o mas muestras) | Valor p |
|---|---|---|---|
| N° de pacientes | 819 | 175 | |
| Edad-Desviación estándar | 67,32±8,08 | 64,78±8,01 | 0,0005 |
| PSA | 9,04±7,99 | 7.82±5,87 | 0,058 |
| Volumen prostático | 54,06±29,17 | 55,42±29,8 | 0,5799 |
| Tasa de malignidad | 43,71% | 34,29% | 0,022 |
Al analizar los resultados, teniendo en cuenta la subdivisión de los valores de PSA en los tres grupos, no encontramos diferencias estadísticamente significativas para la detección de malignidad en los pacientes evaluados (tabla 6; fig. 7).
La regresión logística para comprobar el efecto del número de muestras, la edad, el valor del PSA y el volumen prostático en la detección de malignidad fue estadísticamente significativa: χ2(2)=166,46; p=0,00001. Este modelo clasificó correctamente el 71,23% de los casos de malignidad. A su vez, se encontró que el número de muestras presentó: odds ratio (OR) de 0,843; p=0,694 (intervalos de confianza [IC] del 95%: 0,360-1,971). Igualmente, al ajustar el número de muestras por el PSA y la edad, los resultados fueron, respectivamente: OR de 0,991; p=0,768 (IC 95%: 0,933-1,052); y OR 1,003; p=0,05 (IC 95%: 0,999-1,006).
DiscusiónDurante muchos años el protocolo de biopsia sextante ha sido el procedimiento estándar6. Sin embargo, algunos estudios han reportado que esta estrategia no identifica aproximadamente el 20-30% de los cánceres7. Por esta razón, se ha intentado mejorar la tasa de detección mediante la adopción de esquemas de 8 o 10 biopsias, dependiendo del tamaño de la glándula8. Incluso, algunos autores proponen la toma de 14 a 18 muestras para lograr una tasa del 90%8; y ante una elevada sospecha, recomiendan biopsias por saturación de hasta 36 muestras9.
Los esquemas tradicionales de biopsia prostática de 6 muestras han evidenciado con claridad un nivel inaceptable de falsos negativos10, por lo que en los últimos años se ha optado por esquemas más agresivos de BPTE en los que se realizan entre 12 y 38 muestras. Esto ha sido respaldado por algunos estudios con un adecuado diseño metodológico que reportan que la tasa de detección del CaP incrementa al aumentar el número de muestras tomadas mediante BPTE11,12.
No obstante, la evidencia científica en los últimos años sugiere que los esquemas con más de 12 muestras no mejoran significativamente la tasa de detección del CaP. En esta discusión hacemos una revisión de las publicaciones más relevantes sobre el tema de los últimos 10 años.
En 2012 Yao et al.13, en base al análisis de 287 pacientes, demostraron que el rendimiento diagnóstico de la biopsia con 12 muestras fue significativamente mayor en comparación con el esquema de 6 (42,16 vs. 21,6%). También cotejaron las biopsias de las próstatas con un peso mayor de 50ml, con una detección de CaP en el esquema de 12 muestras del 28,1% y en el esquema de 10 muestras del 20,4% (p=0,034); por lo que establecieron que el primero es un enfoque seguro y eficaz para el diagnóstico en próstatas con mayor volumen.
Asimismo, Abd et al.14, a partir de una muestra de 1546 primeras biopsias con protocolos de 8 y 12 muestras, reportaron una tasa de biopsias positivas del 51,2% y el 49,9%, respectivamente; mientras que Jones et al.15 concluyeron que la técnica por saturación de 24 muestras como estrategia diagnóstica inicial no mejora la tasa de detección de CaP, dado que en su estudio obtuvieron una tasa del 44,6% con técnicas de saturación y de un 51,7% en pacientes sometidos a menos de 10 muestras (p=0,9). Además, no hallaron un valor de PSA para definir qué casos podrían beneficiarse con las técnicas de saturación.
Por su parte, Nomikos et al.16 realizaron un análisis retrospectivo de 379 pacientes que fueron sometidos a una primera biopsia. Su tasa de detección de CaP fue del 39,9% en aquellos que tuvieron menos de 10 muestras, mientras que el porcentaje con más de 10 muestras fue del 34,55% (p=0,24). Sin embargo, al estratificar los casos según el valor del PSA, encontraron que el grupo de PSA>10ng/ml tuvo un incremento del 13,4% en la detección de CaP Gleason 7 con la técnica de 24 muestras (p=0,16) y del 23,4% para las neoplasias intraepiteliales de alto grado (p=0,0008). En concordancia, plantearon que la toma de 24 muestras no aumenta la tasa de detección de cáncer en comparación con la de 10 muestras, pero sí incrementa la detección de la neoplasia intraepitelial de alto grado.
A su vez, Cormio et al.17 realizaron un estudio prospectivo de las primeras biopsias con 6, 10, 14 y 18 muestras de 1091 pacientes. Los resultados fueron positivos para malignidad en el 33,1, 39,2, 41,6 y 41,8%, respectivamente; por lo que estipularon que la diferencia entre el régimen de 10 y 6 muestras es significativa (p<0,005), mientras que entre el de 18 o 14 y el esquema de 10 muestras no lo es. Además, la adición de 4 muestras periféricas laterales no aumentó la tasa de detección del sistema de biopsia de 10 muestras, así como tampoco hubo ventajas diagnósticas en la población general con el esquema de 18 muestras.
Por otro lado, en 2013 Irani et al.18 hicieron un estudio con pacientes de siete instituciones médicas distintas que tenían programada su primera biopsia prostática de 12 o 20 muestras, y que además tenían valores de PSA<20ng/ml, así como ausencia de nódulos prostáticos detectables. Del total de 339 pacientes, se detectó CaP en 71 (42%) dentro del grupo de 12 muestras y en 81 (48,8%) dentro del de 20 muestras, una diferencia no significativa estadísticamente (p=0,2). Asimismo, en este estudio se dividieron los pacientes por volumen prostático sin encontrarse tampoco diferencias significativas (p=0,4).
Uno de los estudios más importantes sobre este tema según nuestra búsqueda, es el de Eichler et al.19. A partir de un metaanálisis donde evaluaron 20.698 individuos de 68 estudios, los autores concluyeron que los esquemas de 12 o más muestras no detectan significativamente más CaP.
En el medio local, los protocolos recomiendan realizar una biopsia transrrectal ecodirigida con un número no inferior a 12 muestras en los siguientes casos: un índice de PSA<18%; un PSA>10ng/ml; y/o TR sospechoso de neoplasia, independientemente del valor del PSA5.
En general, ante una primera biopsia negativa de no menos de 12 muestras, con un PSA que continúa elevado o un TR sospechoso, se recomienda una segunda biopsia a los 6 meses, que podrá ser por saturación (de 24 a 28 muestras). Si esta también es negativa y el PSA continúa elevado o el TR es sospechoso, se llevará a cabo una tercera biopsia a los 6 meses, que deberá ser por saturación, preferentemente orientada por resonancia magnética (RM) con contraste, difusión y espectroscopia5.
Dado que en nuestra experiencia no hemos notado un aumento significativo en la tasa de detección de CaP, proporcional al incremento del número de muestras solicitadas, nos preguntamos si tomar más de 8 muestras (ampliadas ante el hallazgo de un nódulo) en relación con el valor del PSA, incrementa la tasa de detección del adenocarcinoma. Según nuestros resultados, el análisis univariado demostró que, comparativamente, el grupo A fue 2,34 años mayor que el B, siendo la diferencia estadísticamente significativa (t [992]=3,4838; p=0,0005). Igualmente, el valor del PSA en el A fue 1,21ng/ml mayor que en el B, también con un resultado estadísticamente significativo (t [992]=1,8978; p=0,058). Sin embargo, en nuestro análisis de regresión logística multivariable no hubo diferencias entre el grupo A y B en cuanto a la comparación del número de muestras (p=0,694; IC 95%: 0,360-1,971), la edad de los pacientes (p=0,05: IC 95%: 0,999-1,006) y el PSA (p=0,768; IC 95%: 0,933-1,052), por lo que la hipótesis de este estudio quedó reforzada.
Con respecto al peso prostático y su relación con el adenocarcinoma, también se determinó que las próstatas de menor tamaño tuvieron una incidencia mayor que las más grandes, en concordancia con los resultados de otros trabajos18,19.
En este estudio se describen las características más importantes de los pacientes con sospecha de CaP de nuestra muestra para que los datos proporcionados sirvan en el futuro a los administradores sanitarios, epidemiólogos, clínicos, oncólogos y, en especial, a los urólogos. Somos conscientes de las desventajas de esta investigación, inherentes a la mayoría de los estudios transversales; no obstante, entre sus fortalezas vale destacar que el intervencionista que realizó las biopsias fue el mismo durante todo el estudio, por lo que se refuerza aún más la validez de nuestros resultados.
ConclusiónAumentar el número de muestras en la BPTE no aumentó la tasa de detección del CaP, independiente o dependientemente de los valores del PSA. Además, a mayor edad y mayor PSA, mayor fue la incidencia de CaP; pero, por el contrario, en relación con el volumen prostático, hubo una mayor tasa de detección de lesiones malignas en las próstatas más pequeñas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses, excepto el Dr. Kozima que declara como posible conflicto de interés ser miembro de la Comisión Directiva de la Sociedad Argentina de Radiología.