Si bien la embolización prequirúrgica de tumores hipervasculares puede ser efectiva durante la resección tumoral1, muy pocos estudios han reportado su utilidad en el hemangiopericitoma (HPC). Por ello, reportamos un caso de embolización transarterial en una paciente con diagnóstico de hemangiopericitoma de partes blandas en la región lumbosacra.
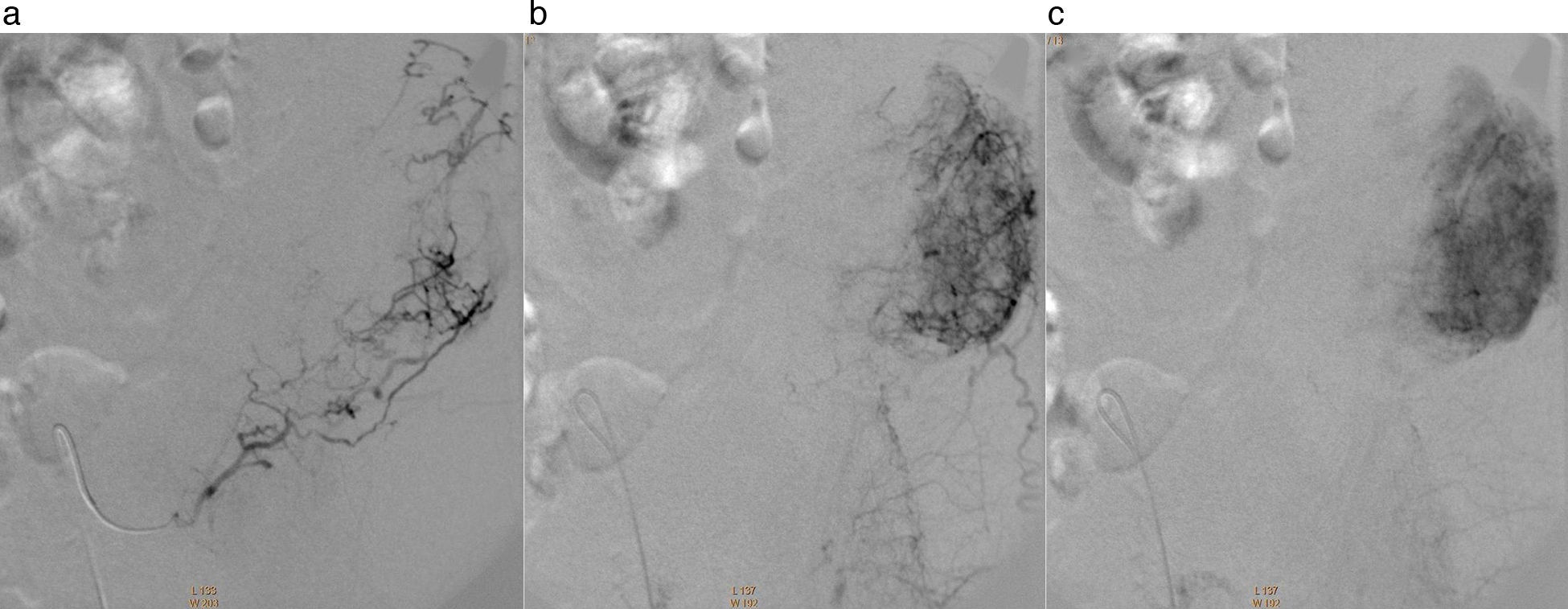
Una mujer de 44 años de edad, con antecedentes de dolor crónico en la región dorsal y una tumoración de lento crecimiento, fue remitida a nuestra institución. En el examen físico se observó en la región lumbosacra una masa no dolorosa, de bordes definidos y piel lisa, que estaba adherida a la piel y no presentaba úlceras o lesiones en su superficie. A través de la resonancia magnética (RM), se constató en el espacio celular subcutáneo una formación de 80 x 60mm, con bordes circunscriptos e hiperintensidad heterogénea en ponderación T2 (fig. 1). En el análisis histológico de una muestra de biopsia, se evidenciaron vasos grandes y arteriolas dilatados de aspecto sinusoidal y patrón mixoide, mitosis aisladas y fibrosis perivascular. El examen con inmunohistoquímica demostró reactividad para CD34, CD31 y BCL2, pero el resultado fue negativo para CD99. Una vez confirmado el diagnóstico de HPC, se planificó entre los radiólogos intervencionistas y el equipo quirúrgico una estrategia combinada de embolización percutánea (EP) y resección quirúrgica posterior. La paciente, entonces, fue remitida al servicio de Hemodinamia, donde se le realizó una angiografía diagnóstica con inyección subselectiva de contraste en la aorta abdominal y, posteriormente, se procedió a la cateterización selectiva de las arterias hipogástricas. Esta última evidenció una malformación con blush (persistencia del contraste al final de la inyección, > 40 cuadros) a nivel de la línea media, en el plano posterior de la proyección de perfil, que se asociaba a una mayor vascularidad y tortuosidad de las arterias aferentes, alimentadas principalmente por las arterias iliolumbares de ambos lados.
En la resonancia magnética (a) en ponderación T1 y (b) T2 se observa, en el sector posterior y bajo de la región lumbar, una masa de aproximadamente 80mm de longitud cefalocaudal x 60mm de diámetro anteroposterior, con hiperintensidad heterogénea en ponderación T2 y bordes netos, que ocupa el tejido celular subcutáneo, sin compromiso de estructuras profundas, musculares ni vertebrales. El canal neural se encuentra preservado. La intensidad de la señal es predominantemente de partes blandas.
La EP se llevó a cabo bajo anestesia local y sedación. Con la técnica de Seldinger se colocó un introductor 5F en la arteria femoral izquierda, mediante el cual se avanzó un catéter guía multipropósito (Terumo, Medical Corporation, Tokio, Japón) en la arteria ilíaca interna derecha. Con una guía de 0,014” se avanzó un microcatéter de 2.7 Fr Progreat® (Terumo, Medical Corporation, Tokio, Japón) hasta la porción proximal de la arteria iliolumbar derecha. La embolización selectiva de los vasos que irrigan el tumor se llevó a cabo con partículas de polivinil alcohol (PVA) Contour® (Boston Scientific, Marlborough, Massachusetts) de 355 a 500 micras de diámetro, suspendidas en 10ml de solución salina y 10ml de material de contraste no iónico. Luego, se colocó un catéter Simmons Sidewinder 1 (Terumo) dentro de la arteria ilíaca interna izquierda y con una guía de 0,014” se introdujo un microcatéter de 2.7 Fr Progreat® hasta la porción proximal de la arteria iliolumbar izquierda. De igual modo, se realizó la embolización selectiva con partículas de PVA de 355 a 500 micras de diámetro. Con este procedimiento se dio lugar a la oclusión arterial casi completa del tumor (figs. 2 y 3). No se registraron incidentes y la evolución fue favorable, con un leve dolor local como único síntoma durante la hospitalización.
La resección quirúrgica pudo completarse de forma segura y sin complicaciones al día siguiente. El tumor fue extirpado de forma completa, con resección amplia de los márgenes, incluida la piel que lo recubría (porque se comprobó su infiltración). La pérdida de sangre intraoperatoria fue insignificante, por lo que no fue necesario hacer una transfusión sanguínea, y la hospitalización transcurrió sin complicaciones. El diagnóstico histológico de hemangiopericitoma se confirmó a partir de la pieza quirúrgica y se decidió no realizar radioterapia posterior debido a la escisión quirúrgica completa. A los nueve meses de la cirugía, la paciente permanecía libre de recurrencia.
El HPC es una neoplasia mesenquimal infrecuente, que se origina en los pericitos de Zimmerman y habitualmente se localiza en los tejidos blandos. Tiene un comportamiento agresivo, con marcada tendencia a la recurrencia, y su tratamiento a menudo se complica por la vascularización significativa2. Trabajos anteriores han reportado una mayor pérdida de sangre en la cirugía de tumores hipervasculares. Durante la intervención, pueden ocurrir pérdidas sanguíneas perioperatorias de entre 550-4300 ml (media: 1832ml). No obstante, la cuantificación exacta del sangrado intraoperatorio es difícil de realizar, ya que las fuentes son múltiples y la hemorragia mayor puede ocurrir incluso durante el acceso al campo quirúrgico3. La embolización efectiva de estos tumores provoca una reducción significativa de la pérdida de sangre en la cirugía y, a la vez, la embolización produce una necrosis tumoral por la isquemia4,5.
En la actualidad se dispone de una amplia variedad de agentes embólicos para este tipo de procedimientos. En nuestro caso, hemos decidido utilizar partículas de PVA por su eficacia y biocompatibilidad6–9. La reacción aguda a estas partículas es la trombosis con posterior organización del colágeno. Los mecanismos propuestos para la vasculitis incluyen isquemia, toxicidad directa del alcohol polivinílico y reacción alérgica.
En la fase siguiente al procedimiento, hay que focalizarse en la prevención o manejo del síndrome de posembolización: dolor, fiebre (en general, por debajo de los 38,5°C) y náuseas, debido a la necrosis tisular. Una fiebre superior a los 39°C sugiere infección sobreagregada o formación de absceso. La complicación más temida es la sepsis10.
La radioterapia posoperatoria, en algunos casos, ha demostrado tener un tiempo libre de recurrencia mayor, pero a cambio, aumenta las complicaciones. Además, no confiere ninguna protección significativa contra el desarrollo de metástasis a distancia2,11. Por esta razón, y dado que la recurrencia puede manifestarse varios años después, en estos pacientes es importante tanto el control clínico a largo plazo como el seguimiento radiográfico.
En conclusión, la embolización prequirúrgica en tumores vasculares es una herramienta útil que debería aplicarse en todos los casos, porque disminuye el sangrado operatorio, acortando la duración del procedimiento y permitiendo una visualización completa del campo quirúrgico. A su vez, brinda una mayor posibilidad de lograr la resección completa del tumor y, en algunos pacientes, elimina la necesidad de transfusiones de sangre, reduciendo así la morbilidad quirúrgica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.