La presencia de una lesión de riesgo en la mama aumenta la probabilidad de desarrollar un carcinoma o puede indicar la existencia de malignidad concomitante. El manejo adecuado posterior al diagnóstico percutáneo es muchas veces controvertido, por lo que es importante que el radiólogo conozca las implicancias diagnósticas y terapéuticas de las lesiones mamarias de alto riesgo para su detección y seguimiento.
Este trabajo tiene como objetivo revisar la literatura y presentar la evidencia actual sobre el manejo de las hiperplasias atípicas ductal y lobulillar, el carcinoma lobulillar in situ, la cicatriz radiada y las lesiones columnares, papilares y de tipo mucocele, luego del diagnóstico con técnicas de intervencionismo percutáneo.
The presence of a high-risk breast lesion confers a higher probability to develop a breast tumour or may indicate concomitant malignancy. The management of such lesions after percutaneous biopsy remains controversial. Radiologists should be familiar with the diagnosis and management for the follow up of high risk lesions of the breast.
The purpose of this study is to present current evidence for the management of atypical duct hyperplasia, lobular hyperplasia, radial scar, spinal column lesions, papillary lesions and mucocele-like lesions.
Introducción
La utilización de agujas de corte y sistemas de vacío para biopsias percutáneas es una práctica establecida en el diagnóstico inicial de las lesiones mamarias palpables o subclínicas, detectadas en estudios por imágenes y bajo la guía de mamografía, ultrasonido (US) e incluso resonancia magnética1,2 (RM).
Los sistemas de tipo core biopsy, con agujas de disparo automático o semiautomático y calibre de 12 a 16 Gauge, permiten obtener varias muestras a través de múltiples entradas en el tejido, mientras que los sistemas de vacío que utilizan agujas de 8 a 14 Gauge obtienen diversas muestras de mayor peso y tamaño, mediante una única inserción de la aguja1,2.
La sensibilidad del procedimiento percutáneo depende del sistema de biopsia empleado, el tipo y calibre de la aguja, la cantidad de material obtenido y su adecuado procesamiento en el laboratorio de anatomía patológica, y finalmente de la correlación entre la imagen radiológica y el resultado histológico3,4.
Diversos estudios han demostrado que existen ciertas condiciones que aumentan el riesgo de desarrollar un cáncer de mama: además de las variables epidemiológicas y genéticas, hay un grupo de enfermedades proliferativas (también denominadas lesiones de alto riesgo), generalmente subclínicas, que se detectan en la mamografía o ecografía.
Las técnicas de intervencionismo percutáneo de mama pueden subestimar el grado de la patología en aquellas lesiones histológicas complejas que muestran diferentes grados de atipia o malignidad. Dado que la aguja extrae una pequeña cantidad de tejido proveniente de la lesión en estudio, es posible que el material no contenga las zonas de mayor patología y que éstas se evidencien después, durante el análisis de la pieza quirúrgica. La subestimación es más alta con agujas de corte que con los sistemas de vacío, independientemente del calibre de aguja que se use3,4.
Este trabajo tiene como objetivo revisar la literatura y presentar la evidencia actual sobre el manejo de las lesiones mamarias de alto riesgo: hiperplasias atípicas ductal y lobulillar, carcinoma lobulillar in situ, cicatriz radiada y las lesiones columnares, papilares y de tipo mucocele, luego del diagnóstico con técnicas de intervencionismo percutáneo.
Lesiones mamarias de alto riesgo
Hiperplasia ductal atípica
La hiperplasia ductal atípica (HDA) es la lesión de riesgo más común. Se considera que aumenta de 4 a 5 veces el riesgo de desarrollar un carcinoma invasor para ambas mamas5. Desde el punto de vista histológico, la HDA se define como una lesión proliferativa que comparte sólo algunas de las características del carcinoma ductal in situ (CDIS) de bajo grado, diferenciándose tanto en criterios cualitativos como cuantitativos6.
La definición de la Organización Mundial de la Salud7 (OMS) establece que es una proliferación de células monomórficas, distribuidas de forma regular, con un núcleo generalmente redondeado u ovoide, y un patrón de crecimiento que puede ser micropapilar, en penachos, arcos o puentes rígidos, cribiforme o sólido. Este último se caracteriza por el compromiso parcial de una unidad ducto-lobulillar en la que hay áreas con células tal cual se observan en el carcinoma ductal no invasor y áreas con zonas de hiperplasia ductal sin atipia.
Los criterios cuantitativos utilizados para diferenciar una HDA de un CDIS de bajo grado se basan en el número de ductos comprometidos o la dimensión del área afectada. Page8 considera que un solo ducto con relleno celular, que cualitativamente calificaría para CDIS, debe designarse como HDA, ya que son necesarios al menos dos ductos comprometidos para el diagnóstico de un CDIS. Otros esquemas enfatizan en la dimensión: de acuerdo con estos criterios, los focos menores de 2 mm son diagnosticados como HDA, independientemente del número de ductos involucrados e incluso si alguno de ellos califica cualitativamente para CDIS6,9.
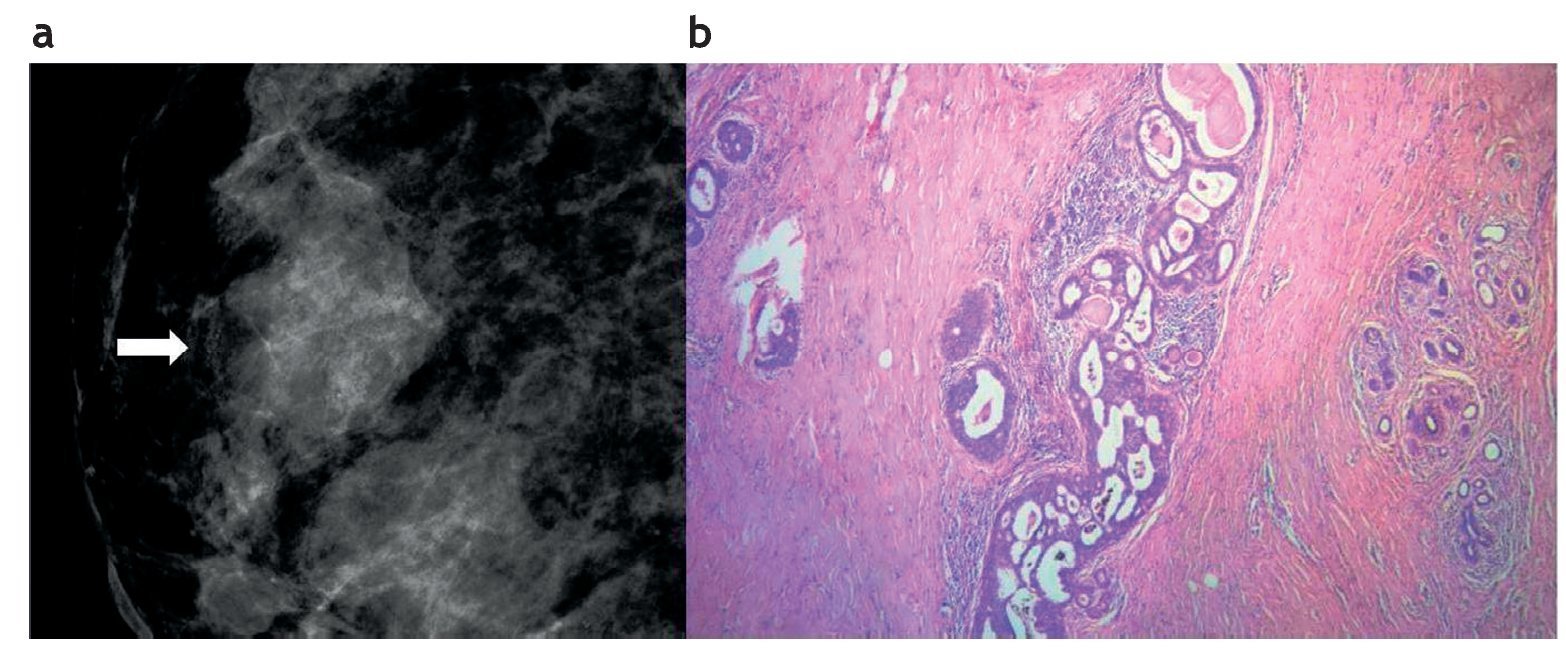
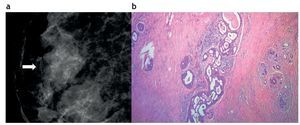
Es usual que la HDA se presente como un grupo de micro-calcificaciones heterogéneas en una mamografía, con una frecuencia de hasta el 12% en los resultados de las biopsias10,11 (fig. 1). Sin embargo, también puede formar parte de lesiones nodulares visibles en la ecografía.
Figura 1. Hiperplasia ductal atípica. (a) Mamografía digital: microcalcificaciones agrupadas y heterogéneas, categorizadas como Bi-rads 4. (b) Biopsia con guía estereotáxica y sistema de vacío con aguja 11 Gauge. Foco de hiperplasia ductal atípica: microfotografía con hematoxilina-eosina que muestra ducto mamario con relleno celular cribiforme con secreción intraluminal y microcalcificaciones asociadas.
La probabilidad de hallar una lesión histológica de mayor grado en la cirugía ronda el 10-27%, dependiendo de las series12-16, aun cuando la biopsia percutánea haya logrado remover la totalidad de la lesión mamográfica (tabla 1). Además, la HDA puede coexistir con un CDIS y carcinomas invasores en el mismo sitio o en la periferia, por lo que se considera que el hallazgo de HDA en una biopsia percutánea es indicación de biopsia quirúrgica17.
Hiperplasia lobulillar atípica y carcinoma lobulillar in situ
Estas entidades se agrupan bajo el nombre de neoplasia lobular y generalmente no tienen un correlato mamográfico, pudiendo ser un hallazgo incidental en la investigación de alguna anomalía mamográfica (por ejemplo, una masa o calcificaciones). Constituyen un marcador de riesgo para el carcinoma en ambas mamas y, en su mayoría, son multifocales y bilaterales18.
En la hiperplasia lobulillar atípica (HLA), las células de aspecto monomorfo rellenan los lóbulos, mientras que en el carcinoma lobulillar in situ (CLIS), además, distienden los acinos19.
El carcinoma lobulillar in situ de tipo pleomórfico es una variante y algunos autores lo consideran como un precursor del carcinoma intraductal. Las microcalcificaciones presentes en estos casos suelen mostrar mayor grado de heterogeneidad que las que acompañan al CLIS clásico20.
Ante el hallazgo de HLA y CLIS en una biopsia percutánea, hay que plantearse la posibilidad de una biopsia quirúrgica. La tasa de hallazgo de lesiones malignas en diferentes series ronda el 20%21-25 (tabla 2), aunque se han reportado casos en los que no se encontró subestimación en las biopsias quirúrgicas25.
Lesiones columnares
Las lesiones de células columnares (LCC) constituyen un espectro de alteraciones histológicas que afectan a las unidades ducto-lobulillares terminales (UDLTs). Estas se conocen desde hace décadas y se caracterizan histológicamente por la expansión de la UDLT con conductos revestidos por células columnares, con prolongaciones apicales citoplasmáticas (apical snouts), secreción endoluminal y calcificaciones26.
En los últimos años estas lesiones han sido objeto de renovado interés, al ser identificadas con gran frecuencia en biopsias mamarias realizadas por microcalcificaciones, habitualmente en relación con programas de diagnóstico precoz de cáncer de mama27.
Sus denominaciones han sido múltiples: Fraser et al.28 en 1998 las llamó «alteración columnar con prolongaciones apicales prominentes y secreción» (CAPSS: columnar alterations with prominent apical snouts and secretion), pero en 1979 Azzopardi las había designado carcinoma tipo «clinging», subtipo monomórfico29.
Actualmente una de las clasificaciones más aceptadas es la de Schnitt y Vincent-Salomon30. Ellos consideran a las lesiones columnares como un espectro morfológico que va desde: 1) cambios columnares, 2) hiperplasia columnar, pasando por 3) cambios columnares e hiperplasia columnar con atipia, para terminar en 4) la hiperplasia ductal atípica (HDA) o carcinoma ductal in situ (CDIS).
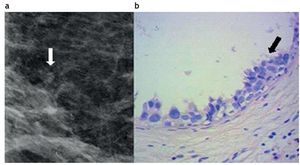
La atipia epitelial plana (AEP) se define como una alteración intraductal, caracterizada por el reemplazo de sus células epiteliales nativas por una capa simple, o bien por 3, 4 ó 5 capas de células con leve atipia. El ducto comprometido está invariablemente dilatado y habitualmente contiene microcalcificaciones intraluminales y secreción31.
La AEP frecuentemente coexiste con distintos tipos de carcinoma intraductal de bajo grado32 y hay una evidencia creciente que muestra alteraciones moleculares y genéticas similares33,34, sugiriendo que la AEP podría ser el precursor temprano del carcinoma ductal de bajo grado35.
El interrogante sobre cuándo sería necesario realizar una biopsia quirúrgica frente al diagnóstico de AEP en una biopsia percutánea todavía se mantiene. Existen algunos estudios que muestran una mayor lesión, ya sea carcinoma invasor o intraductal, en la cirugía subsecuente con una frecuencia que va del 0 al 30%36. En nuestra experiencia, la frecuencia de mayor lesión (carcinoma intraductal o invasor) fue del 12,5%. Realizamos un estudio retrospectivo de 2416 punciones percutáneas hechas en los últimos 5 años e identificamos 32 pacientes con diagnóstico de AEP pura que se realizaron biopsia quirúrgica subsecuente37. En base a nuestros resultados recomendamos la escisión en las biopsias percutáneas con diagnóstico de AEP.
Lesiones papilares
Las lesiones papilares de la mama representan un grupo heterogéneo de tumores que crecen en el interior de los conductos y se caracterizan por la presencia de un tallo fibrovascular revestido por una proliferación epitelial, con o sin células mioepiteliales acompañantes38.
Los papilomas pueden ser solitarios (compuestos por un único tumor dentro de un conducto) o múltiples (desarrollándose usualmente en ramas contiguas al árbol ductal). Las formas más comunes de presentación son el derrame sero-hemático, o bien la detección clínica de una masa palpable.
Desde el punto de vista mamográfico, pueden observarse una o varias imágenes nodulares, con o sin microcalcificaciones asociadas. Las calcificaciones pueden ser pleomórficas o groseras y heterogéneas.
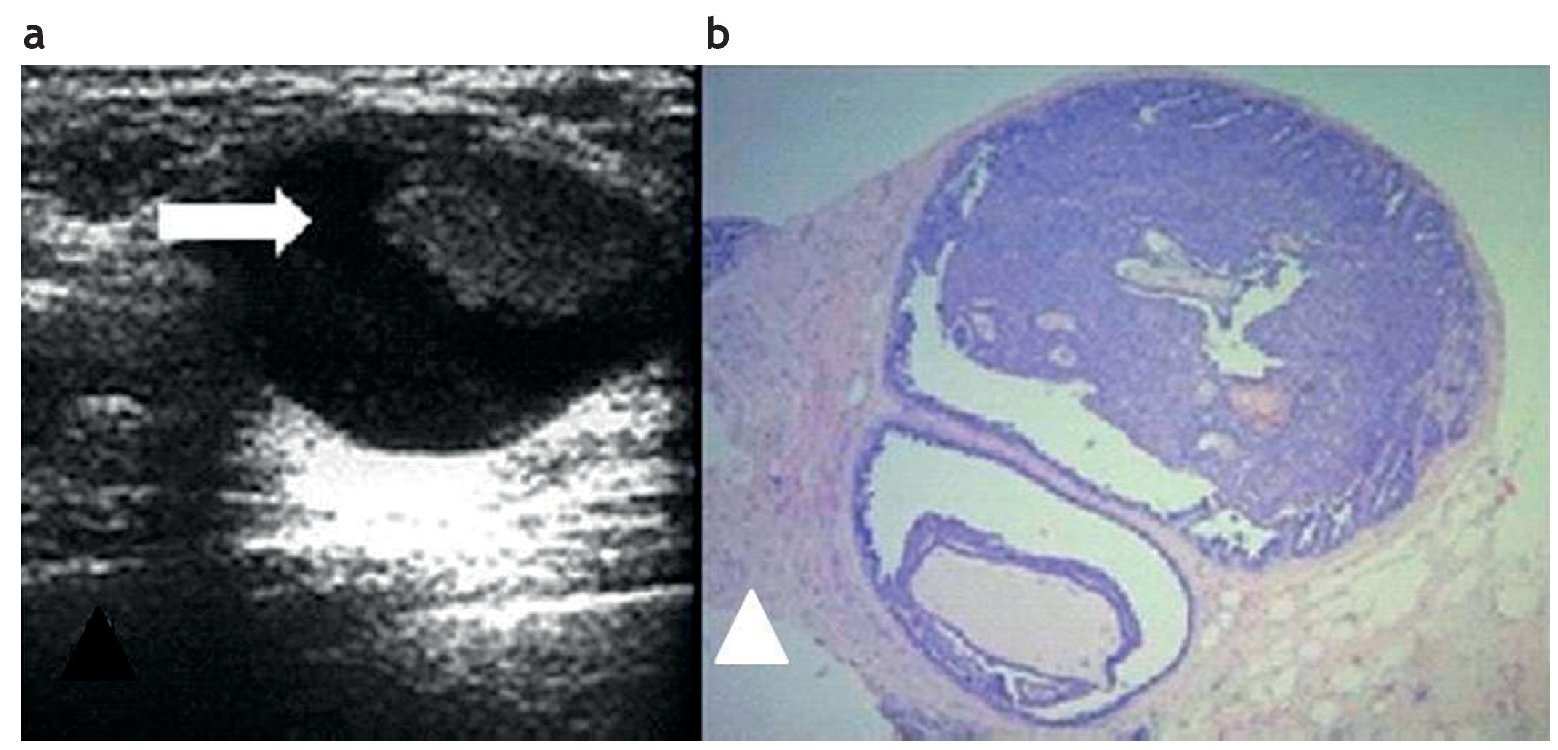
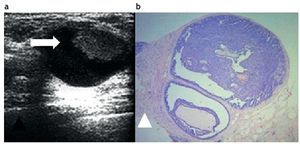
La evaluación ecográfica puede demostrar una lesión quística compleja con paredes y septos gruesos, o una masa sólida intraquística (fig. 3). Algunos papilomas pueden «borrar» el espacio quístico que los rodea y mostrarse como una masa completamente sólida y bien circunscripta39.
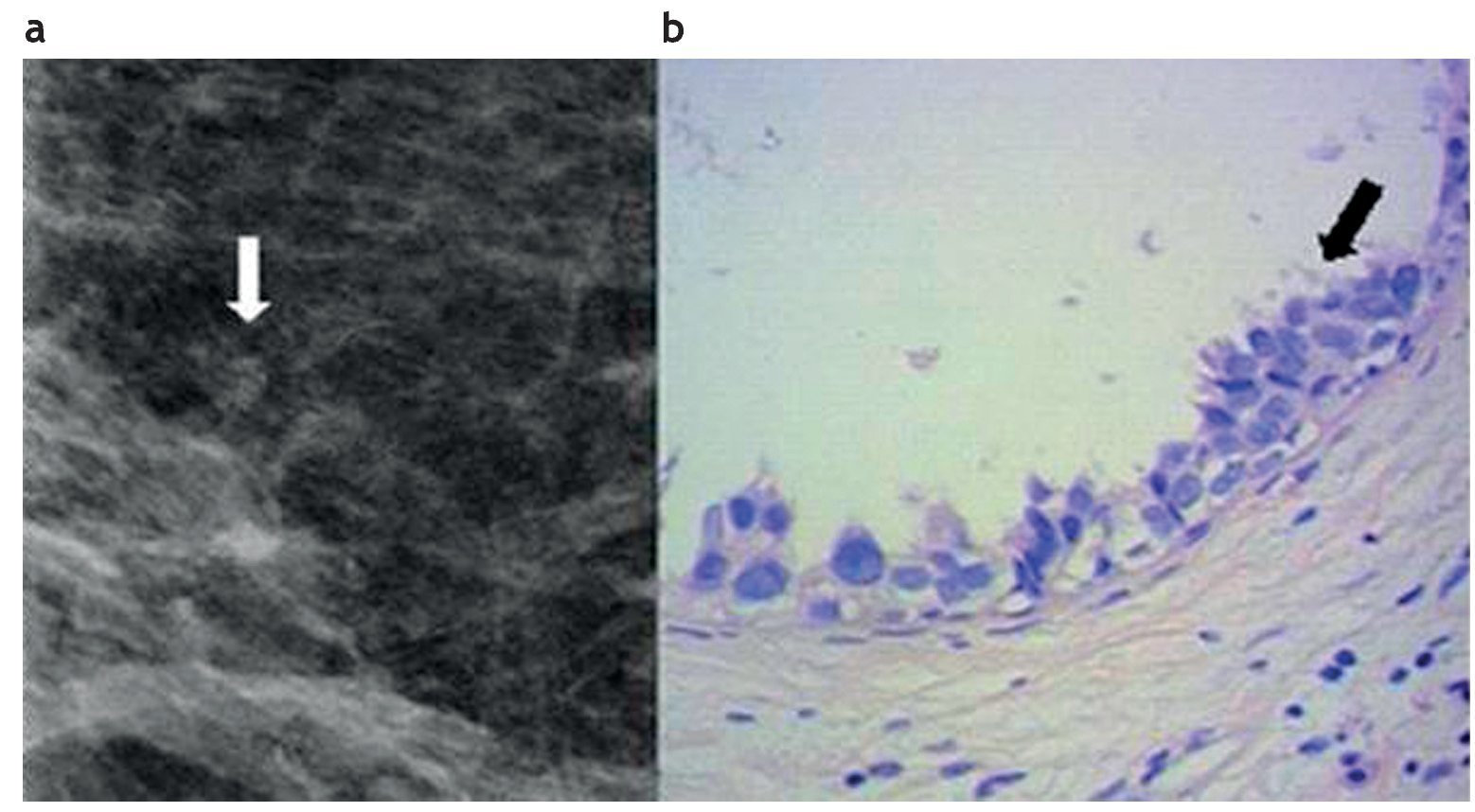
Figura 2. Atipia epitelial plana. (a) Mamografía digital. Microcalcificiones agrupadas pleomórficas, visibles a nivel retroareolar. (b) Biopsia por esterotaxia y sistema de vacío con aguja 11 Gauge. Hematoxilina-eosina 40×. Atipia epitelial plana con células que muestran proyecciones apicales (flecha).
Figura 3. Papiloma intraquístico. (a) Masa sólida (flecha) en el interior de una imagen quística, evaluada por ecografía, sobre la que se realizó una punción con aguja de disparo y aguja 14 Gauge. (b) Papiloma atípico. Hematoxilina-eosina 4×. Punción con aguja gruesa.
Las lesiones papilares se categorizan como benignas, atípicas o malignas, incluyendo en estos casos a los carcinomas intraductales y al carcinoma papilar invasor. La presencia de HDA o CDIS de bajo grado, en relación con un papiloma intraductal benigno, es denominado «papiloma atípico» por algunos autores40. Este tipo de lesiones papilares que muestran signos de atipia o presentan lesiones atípicas asociadas requieren, sin dudas, una cirugía41.
En muchos casos, el diagnóstico diferencial entre un papiloma benigno con hiperplasia florida y un papiloma con rasgos de atipia es dificultoso en muestras de biopsia percutánea (y, por ello, surge la controversia con respecto al manejo de las lesiones sin signos de atipia identificadas de este modo). Los estudios de biopsias con sistema de disparo automático muestran una tasa de subestimación de hasta el 36% y sus autores recomiendan la cirugía, aun en los casos de hallazgos completamente benignos38,41,42. Por su parte, un estudio que comparó las biopsias de lesiones papilares efectuadas con sistemas de vacío y disparo automático demostró que este último método presentaba un mayor índice de subestimación43.
La correlación de los hallazgos histológicos con las características clínicas y la expresión en imágenes de la lesión estudiada es fundamental. Algunos autores proponen que si la lesión papilar con rasgos histológicos benignos ha sido completamente removida por el dispositivo de biopsia percutánea, el control de estos pacientes puede ser con seguimiento clínico y radiológico44,45.
Lesiones tipo mucocele
Las lesiones de tipo mucocele son infrecuentes en la mama. Un tumor en forma de mucocele está compuesto por quistes que contienen mucina (algunos de ellos pueden haber sufrido ruptura, extravasando el contenido hacia el estroma). El epitelio de los quistes en los mucoceles benignos es plano o cuboidal, y también pueden tener células columnares46.
Los mucoceles pueden observarse como una masa visible por mamografía y ecografía, y es posible que contengan calcificaciones (e incluso que éstas sean su única manifestación). En un trabajo que reportó cinco lesiones de este tipo, dos se presentaron como masas definidas, una como masa irregular y dos pacientes tuvieron calcificaciones heterogéneas como único hallazgo radiológico47.
Por otra parte, en un estudio retrospectivo sobre 72 lesiones, se observó una mayor tasa de malignidad en aquellas lesiones de tipo mucocele que se presentaban como complejos de quistes, quistes con septos gruesos o masa complejas con componentes líquidos y sólidos48.
Desde el punto de vista anatomopatológico, este tipo de lesiones presentan una dificultad en aquellos casos en los que el patólogo observa conductos con material mucinoso en su interior, sin proliferación epitelial atípica en esos conductos49. Por este motivo y dada la probabilidad de subestimación en la biopsia percutánea, se sugiere la resección quirúrgica de las lesiones que contengan mucina, ante la sospecha de un carcinoma mucinoso o lesión maligna coexistente50-52.
Cicatriz radiada
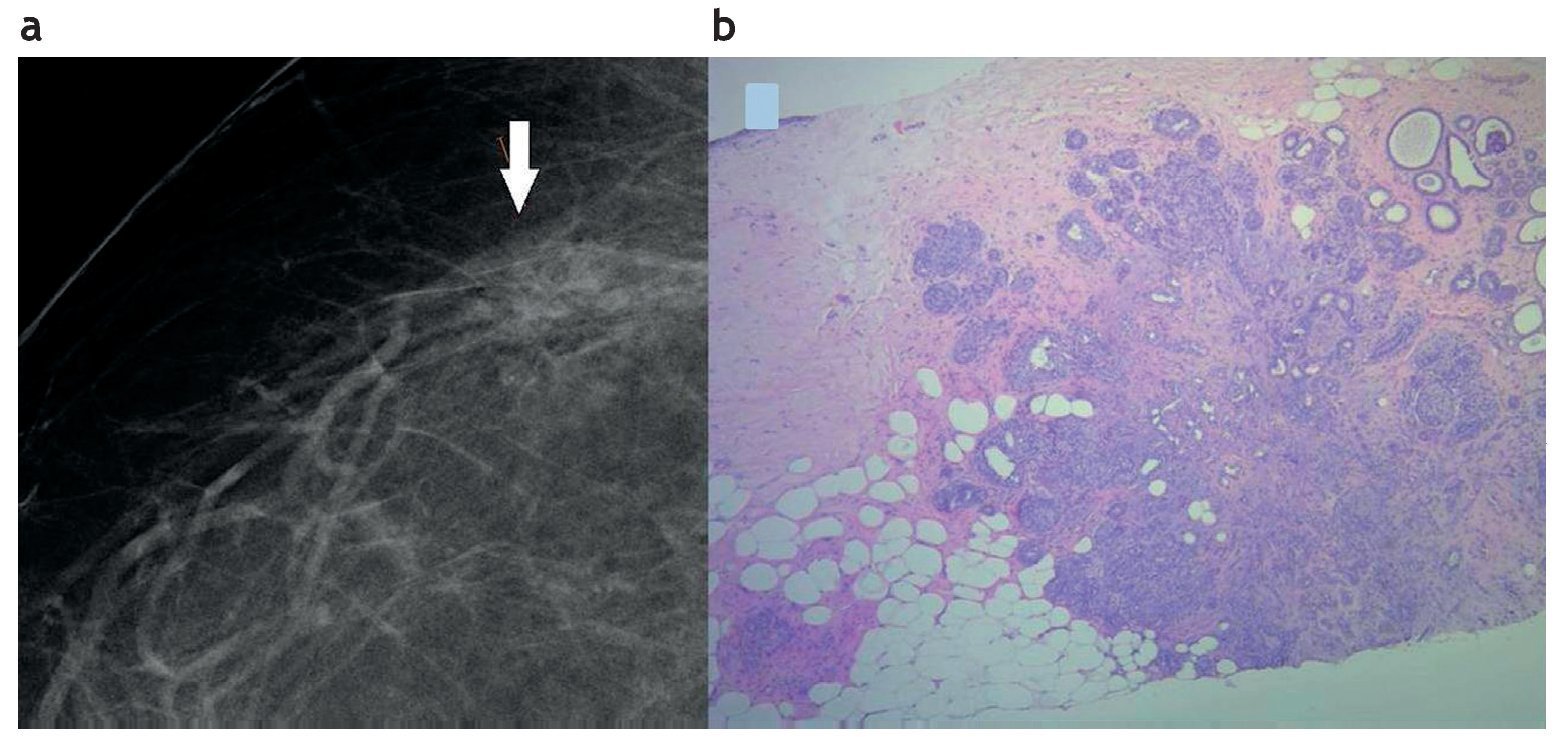
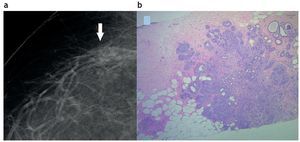
La cicatriz radiada (CR) produce en la mamografía una imagen de distorsión con espículas largas y delgadas, sin masa o densidad central. Suele ser más evidente en una de las dos incidencias realizadas (fig. 4) y puede o no tener un correlato en el examen ecográfico como una masa hipoecoica con sombra acústica. En los estudios imagenológicos es posible que simule un carcinoma53.
Figura 4. Cicatriz radiada. (a) Mamografía digital que muestra una lesión espiculada sutil con centro radiolúcido (flecha). (b) Punción por esterotaxia y sistema de vacío con aguja 11 Gauge. Cicatriz radiada con focos de hiperplasia ductal atípica. Hematoxilina-eosina 4×.
Las pacientes con este diagnóstico tienen un mayor riesgo de desarrollar un carcinoma en cualquiera de las dos mamas. En un trabajo realizado sobre 99 pacientes con diagnóstico de CR y seguimiento promedio de 12 años, se detectó un riesgo relativo de 1,854 (aproximadamente el doble de la población general). Al estratificar el análisis por tamaño, se observó que el riesgo era superior para aquellas mujeres con lesiones de mayor tamaño.
Ante la sospecha radiológica de una CR, hay que plantearse la escisión quirúrgica, ya que el diagnóstico puede ser dificultoso con la obtención de muestras parciales de la lesión usando técnicas percutáneas. Las características de la histoarquitectura de la cicatriz radiada explican la necesidad de los patólogos de contar con la totalidad del cuadro histopatológico para definir su diagnóstico diferencial.
En los casos de CR mayores de 1 cm se ha descrito una asociación con carcinomas tubulares, intraductales u otras variantes del carcinoma invasor55,56.
Ante el hallazgo incidental de una cicatriz radial de pocos milímetros en una biopsia percutánea efectuada para investigar calcificaciones con resultado benigno, no es claro que haya que realizar la biopsia quirúrgica. Tal es así que, en un trabajo realizado sobre 28 lesiones que cumplían con estas características, no se encontró malignidad concomitante57. El autor del estudio señaló que en los casos en que la CR se acompaña de HDA y se han obtenido menos de 12 muestras o la imagen es de distorsión, la posibilidad de subestimación histológica es alta. A su vez, en un trabajo reciente, se analizaron 18 cicatrices radiales microscópicas sometidas a cirugía solo por este diagnóstico y ninguna de ellas mostró malignidad en la pieza operatoria. Los autores sugieren el seguimiento por imágenes en estos casos seleccionados, donde la lesión está completamente contenida en el espécimen de biopsia y no se halla ningún signo de atipia58.
Recientemente se ha sugerido que en aquellas pacientes con CR diagnosticada por punción, sin signos de sospecha en resonancia magnética con contraste, se podría evitar la biopsia quirúrgica59.
Conclusión
No existe un acuerdo general sobre la necesidad de practicar una cirugía en la totalidad de las lesiones de riesgo identificadas mediante agujas de corte. Ante el diagnóstico de HDA, AEP y neoplasia lobulillar hay un criterio uniforme que estipula la escisión, independientemente de la extensión de la lesión y la remoción de la imagen mamográfica luego de la biopsia percutánea.
El tratamiento adecuado de las lesiones de riesgo luego de su diagnóstico en una biopsia percutánea requiere de la evaluación conjunta de un equipo interdisciplinario, compuesto por mastólogos, radiólogos y especialistas en anatomía patológica, a fin de ofrecer a cada paciente la mejor opción de manejo de acuerdo a su caso.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Recibido septiembre de 2012;
aceptado mayo de 2013
http://dx.doi.org/10.7811/rarv77n4a06
* Autor para correspondencia.
Correo electrónico:mariana.castro@hospitalitaliano.org.ar (M. Castro Barba).