El objetivo del presente artículo es demostrar la alteración de la fracción de anisotropía (FA) en la neuralgia esencial del trigémino (NET).
Materiales y métodosSe evaluaron 10 pacientes con diagnóstico de neuralgia esencial del trigémino mediante secuencias de tensor de difusión de alta densidad e imágenes anatómicas 3D en un resonador de alto campo 3 Tesla. En todos los casos se localizaron los nervios. Las imágenes obtenidas se posprocesaron para realizar la tractografía y medir la FA en 20 nervios.
ResultadosSe correlacionaron los hallazgos patológicos entre la medición de la FA y la clínica de los pacientes. De los 10 casos, 6 presentaron compresión neurovascular de lado con neuralgia y un valor de FA descendido con respecto al contralateral en rango normal; mientras que 2 mostraron compresión neurovascular bilateral, pero solo descenso del valor de FA del lado afectado clínicamente. En los otros 2 pacientes no se determinó compresión neurovascular, aunque en el lado con manifestación clínica neurálgica la FA se encontraba descendida.
ConclusiónLa realización de la difusión anisotrópica de alta densidad y la medición de la FA pueden ser una herramienta en la evaluación de la neuralgia esencial del trigémino, ya que es un método reproducible y seguro que permite estudiar la función del nervio
The objective of this article is to demonstrate the alteration of the anisotropy factor (FA) in essential trigeminal neuralgia.
Materials and methodsTen patients with essential trigeminal neuralgia were studied with sequences of high density diffusion tensor and anatomic 3D images with a high-field 3 Tesla resonator. The nerves were located in all cases studied. The obtained images were post-processed to perform tractography and FA was measured in 20 nerves.
ResultsThere was correlation of pathological findings between measuring FA and clinical presentation of the patients. Six of the ten patients studied with neurovascular compression at the neuralgia side had decreased FA values compared to contralateral normal range. Two of the ten patients showed bilateral neurovascular compression, but only abnormal values of FA were found at the clinically affected side. In the remaining two patients no neurovascular compression was determined; however the FA was lower at the clinical manifestation neuralgic side.
ConclusionThe performing of high density anisotropic diffusion and the measurement of the FA may be useful in the evaluation of Trigeminal neuralgia, since it is a safe and reproducible method that allows the study of nerve function.
La neuralgia esencial del trigémino (NET) es una patología que se caracteriza por episodios de dolor intenso, lancinante y recurrente, en las áreas sensoriales suplidas por el V par craneano. La causa más común es la irritación mecánica del nervio, originada por una compresión neurovascular en la porción cisternal1.
En los casos refractarios a los tratamientos médicos de tipo farmacológico (actualmente la carbamazepina es la indicación más habitual) se implementa, como alternativa terapéutica más frecuente, la cirugía denominada descompresión microvascular quirúrgica (MVD)2.
La tractografía con tensor de difusión de alta densidad puede detectar una alteración en la integridad de las fibras, evidenciada por la caída de los valores de la fracción de anisotropía (FA) en el nervio afectado, aportando así un dato de relevancia a la hora de decidir la conducta terapéutica.
El entrecruzamiento neurovascular también puede estar presente en casos totalmente asintomáticos o del lado contralateral al afectado en pacientes con neuralgia del V par (debiéndose interpretar esto como una variante anatómica vascular)3. El valor disminuido de la FA permitiría diferenciar entre compresiones vasculares asociadas a los síntomas y variantes vasculares anatómicas en pacientes asintomáticos.
ObjetivoDemostrar la alteración de la fracción de anisotropía en pacientes con neuralgia esencial del trigémino, mediante la utilización del tensor de difusión de alta densidad (DTI) como herramienta complementaria. Este método aporta mayor información sobre la función del nervio, ayudando a establecer el diagnóstico de la patología y la futura conducta terapéutica.
Materiales y métodosSe evaluaron 10 pacientes con diagnóstico de NET (7 mujeres y 3 hombres) con edades comprendidas entre los 30 y los 55 años. Los 20 nervios fueron estudiados en un resonador de alto campo Philips Achieva 3 Tesla con bobina SENSE–HEAD de 8 canales y las imágenes obtenidas fueron posprocesadas mediante el software VistaScan (Philips Extended Workstation).
Se realizaron secuencias de tensor de difusión de alta densidad de 32 direcciones, siendo esta cantidad una condición imprescindible para la adquisición de las imágenes y su posprocesamiento. El modelo de tensor de difusión es una matriz diagonal y simétrica de 3×3, que necesita como mínimo 6 direcciones de codificación espacial (la longitud de los tres ejes principales–λ1, λ2, λ3- define tres vectores–V1, V2, V3- y su orientación). Si tiene más de 6 direcciones, mejora la medida del tensor, ya que a mayor cantidad de direcciones en la codificación de la adquisición, mayor es la precisión que se obtiene y más fidedigna es la reconstrucción del nervio mediante la tractografía. El número de direcciones es directamente proporcional al tiempo de adquisición. Por ejemplo, 6 direcciones (considerada como de baja densidad o low) durarán aproximadamente 1min y 50 direcciones, alrededor de 20min.
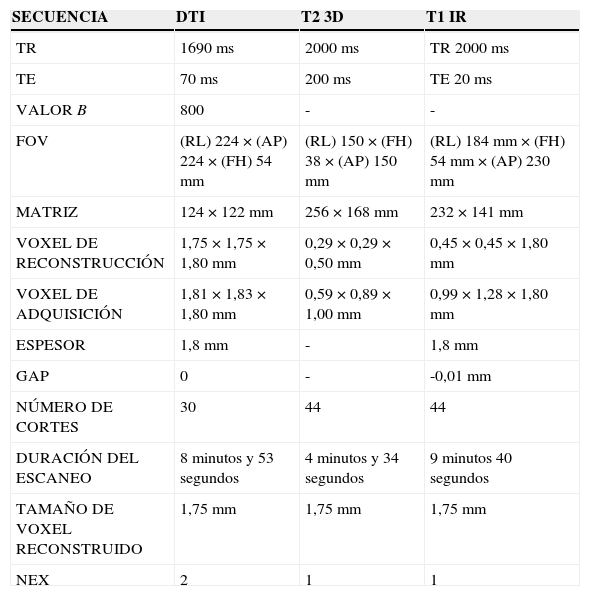
En la DTI los parámetros fueron: tiempo de repetición (TR) 1690ms, tiempo de eco (TE) 70ms, valor b 800, campo de visión (FOV) (RL) 224×(AP) 224×(FH) 54mm, matriz 124×122mm, voxel de reconstrucción 1,75×1,75×1,80mm, voxel de adquisición 1,81×1,83×1,80mm, espesor 1,8mm, GAP 0, número de cortes 30, duración del escaneo 8min y 53 s, tamaño de voxel reconstruido 1,75mm y número de excitaciones (NEX) 2.
Luego, para identificar el recorrido cisternal de los nervios se llevaron a cabo secuencias ponderadas en T2 3D (T2 TSE volumétrico), que fueron superpuestas con las imágenes obtenidas a través del tensor de difusión, con los siguientes parámetros: TE 200ms, TR 2000ms, FOV (RL) 150×(FH) 38×(AP) 150mm, matriz 256×168mm, voxel de reconstrucción 0,29×0,29×0,50mm, voxel de adquisición 0,59×0,89×1,00mm, duración del escaneo 4min y 34 s, y 1 NEX. No fue necesario el uso de contraste endovenoso.
Si bien no se utilizó en todos los casos, en 4 de los 10 pacientes se recurrió a secuencias ponderadas en T1 inversión-recuperación (IR) como reparo anatómico, y para la superposición con secuencia de tensor de difusión de alta densidad se aplicaron los siguientes parámetros: TE 20ms, TR 2000ms, FOV (RL) 184mm×(FH) 54mm×(AP) 230mm, matriz 232×141mm, voxel de reconstrucción 0,45×0,45×1,80mm, voxel de adquisición 0,99×1,28×1,80mm, espesor de corte 1,8mm, GAP -0,01mm y duración del escaneo de 9min 40 s (tabla 1).
Parámetros de adquisición de las diferentes secuencias
| SECUENCIA | DTI | T2 3D | T1 IR |
|---|---|---|---|
| TR | 1690 ms | 2000 ms | TR 2000 ms |
| TE | 70 ms | 200 ms | TE 20 ms |
| VALOR B | 800 | - | - |
| FOV | (RL) 224×(AP) 224×(FH) 54mm | (RL) 150×(FH) 38×(AP) 150mm | (RL) 184 mm×(FH) 54 mm×(AP) 230mm |
| MATRIZ | 124×122mm | 256×168mm | 232×141mm |
| VOXEL DE RECONSTRUCCIÓN | 1,75×1,75×1,80mm | 0,29×0,29×0,50mm | 0,45×0,45×1,80mm |
| VOXEL DE ADQUISICIÓN | 1,81×1,83×1,80mm | 0,59×0,89×1,00mm | 0,99×1,28×1,80mm |
| ESPESOR | 1,8mm | - | 1,8mm |
| GAP | 0 | - | -0,01mm |
| NÚMERO DE CORTES | 30 | 44 | 44 |
| DURACIÓN DEL ESCANEO | 8 minutos y 53 segundos | 4 minutos y 34 segundos | 9 minutos 40 segundos |
| TAMAÑO DE VOXEL RECONSTRUIDO | 1,75mm | 1,75mm | 1,75mm |
| NEX | 2 | 1 | 1 |
DTI: tensor de difusión; IR: inversión-recuperación; TR: tiempo de repetición; TE: tiempo de eco; FOV: campo de visión; NEX: número de excitaciones.
Se realizaron secuencias balance ponderadas en T2 (B_FFE) en todos los casos para identificar el recorrido cisternal del V par craneano. Esta secuencia es comparable a la de otras marcas comerciales, como la FIESTA (Fast Imaging Employing Steady State Acquistion, de General Electric) y CISS (Constructive Interference in Steady State, de Siemens).
Una vez obtenidas todas las secuencias, se llevó a cabo la tractografía del trigémino mediante el software de Philips Extended Workspace, utilizando la opción fibertrack. El valor de FA se fijó en 0,15, el ángulo de dirección en 27° y la longitud de las fibras en 10mm. Luego, las imágenes fueron fusionadas.
A través de la opción single point, se localizaron las fibras del V par y posteriormente se procedió a dibujar el trayecto de los nervios con la herramienta draw ROI.
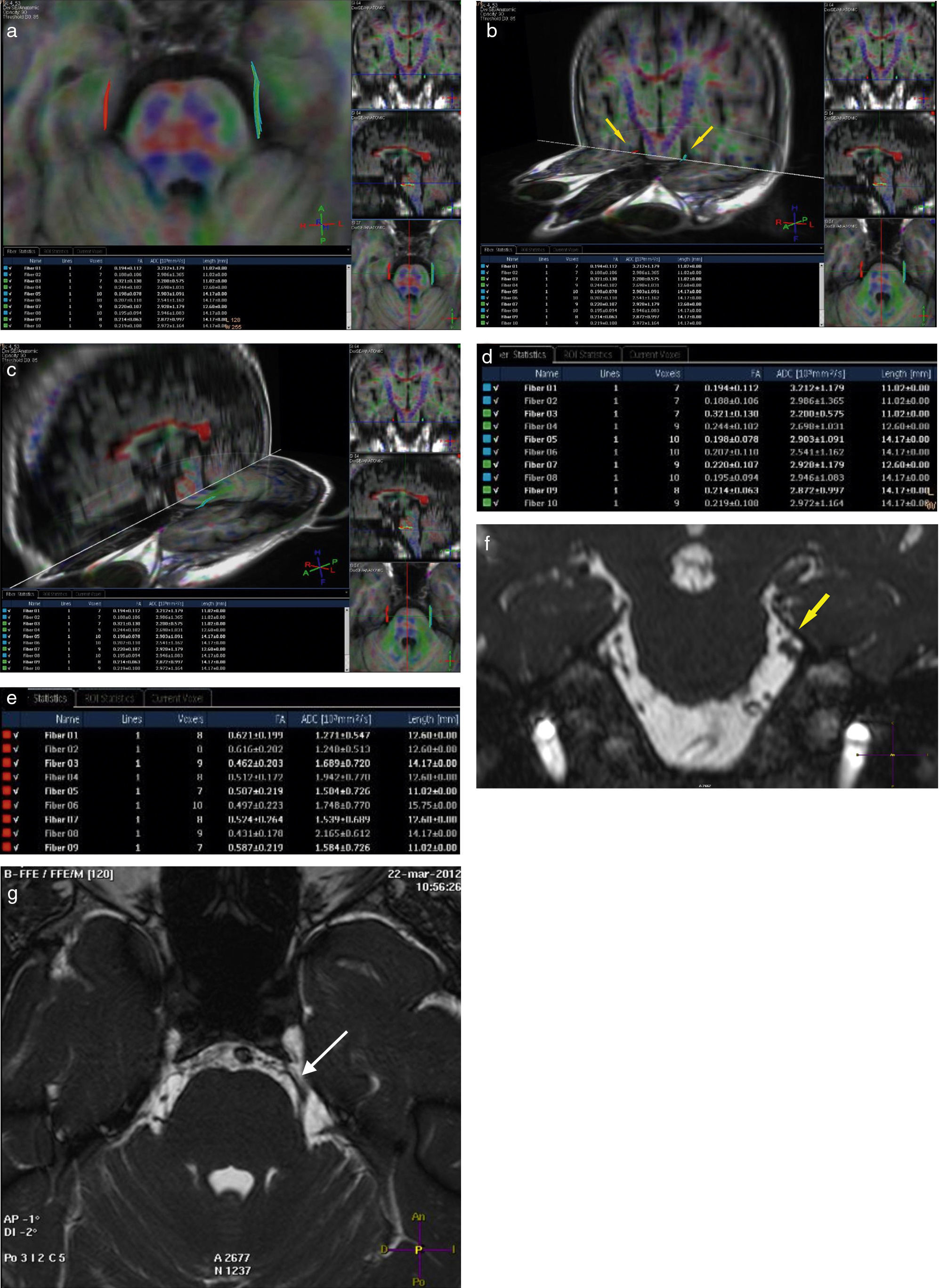
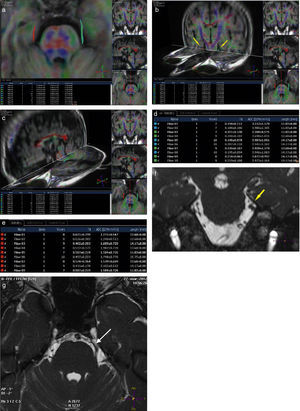
En los 10 pacientes se realizó una reconstrucción exitosa del V par del lado afectado y su contralateral, midiendo la FA de los 20 nervios (fig. 1).
Paciente de sexo masculino de 50 años de edad con neuralgia en la rama V2 del V par izquierdo, de dos años de evolución. La clínica coincide con un bajo valor de fracción de anisotropía de algunas de las fibras del nervio del lado afectado (fibras celestes en a, b, c y d). La FA del lado contralateral se encuentra conservada (fibras rojas en a, b, c y e). En las secuencias en ponderación T2 3D se visualiza una compresión neurovascular en la emergencia del trigémino homolateral (flechas en f y g).
En todos los casos se pudo obtener la tractografía y se midió la FA. Hubo correlación de los hallazgos patológicos con la clínica que presentaron los pacientes.
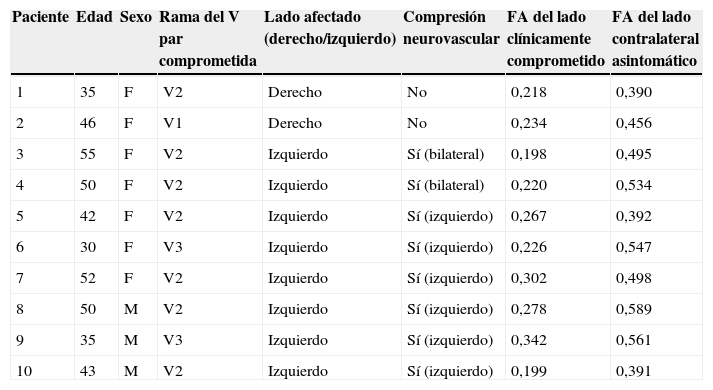
Si bien en la bibliografía no existen valores numéricos de FA absolutos y estrictos que sean considerados normales en los nervios craneales, las fibras con tendencia a 1 como valor de FA son las que conservan mayor direccionalidad como vector único y predominante. Así, se interpreta como valores descendidos o patológicos con tendencia a la difusión aleatoria de las moléculas de agua sin vector predominante a los menores de 0,5. En nuestro estudio, se tomaron como valores en rango habitual a las fibras de los nervios con 0,49+– 0,10 de valor de FA, a la vez que se definieron como patológicas a todas aquellas con valores inferiores y coincidentes con la alteración clínica (tabla 2).
Hallazgos clínicos y valores de FA obtenidos
| Paciente | Edad | Sexo | Rama del V par comprometida | Lado afectado (derecho/izquierdo) | Compresión neurovascular | FA del lado clínicamente comprometido | FA del lado contralateral asintomático |
|---|---|---|---|---|---|---|---|
| 1 | 35 | F | V2 | Derecho | No | 0,218 | 0,390 |
| 2 | 46 | F | V1 | Derecho | No | 0,234 | 0,456 |
| 3 | 55 | F | V2 | Izquierdo | Sí (bilateral) | 0,198 | 0,495 |
| 4 | 50 | F | V2 | Izquierdo | Sí (bilateral) | 0,220 | 0,534 |
| 5 | 42 | F | V2 | Izquierdo | Sí (izquierdo) | 0,267 | 0,392 |
| 6 | 30 | F | V3 | Izquierdo | Sí (izquierdo) | 0,226 | 0,547 |
| 7 | 52 | F | V2 | Izquierdo | Sí (izquierdo) | 0,302 | 0,498 |
| 8 | 50 | M | V2 | Izquierdo | Sí (izquierdo) | 0,278 | 0,589 |
| 9 | 35 | M | V3 | Izquierdo | Sí (izquierdo) | 0,342 | 0,561 |
| 10 | 43 | M | V2 | Izquierdo | Sí (izquierdo) | 0,199 | 0,391 |
F: femenino; M: masculino; FA: factor de anisotropía.
De los 10 pacientes, 6 presentaron compresión neurovascular del lado con manifestación clínica y valor de FA descendido con respecto al contralateral en rango normal, mientras que 2 mostraron compresión neurovascular bilateral pero solo descenso del valor de FA del lado afectado clínicamente (interpretándose a estos hallazgos como variantes vasculares). En los otros 2 pacientes no se encontró compresión neurovascular con técnicas de alta resolución, aunque del lado con manifestación clínica neurálgica la FA se encontraba descendida.
DiscusiónLa NET es un complejo sintomático compuesto por paroxismos de dolor facial intenso y agudo, confinado a alguna de las ramas sensoriales del V par craneano. Frecuentemente se debe a una compresión vascular de la REZ (root entry zone) o de la pars triangularis, a nivel cisternal, por un loop de la arteria cerebelosa superior (ACS) u otras arterias, como la arteria cerebelosa antero-inferior (ACAI), la basilar o la vertebral3.
Si bien históricamente se ha creído que solo la compresión vascular por componente arterial era la causante, en la actualidad, por la mayor sensibilidad de los métodos diagnósticos, se sabe que existen dentro del complejo “compresión vascular” otras causas que podrían desencadenar la neuralgia, como por ejemplo el contacto vascular venoso con la pars tringularis, los aneurismas y las malformaciones arteriovenosas, entre otras menos habituales4,5.
En la literatura, se ha descrito que el contacto de estas estructuras vasculares con los diferentes nervios craneales podría ser responsable de patologías como la NET u otras entidades como la paroxismia vestibular6.
Esta compresión provoca daño en los nervios (p. ej. desmielinización y axonopatía), reduciendo su umbral de excitación de tal manera que, ante estímulos de menor importancia, se produce una serie de descargas paroxísticas espontáneas (percibidas como un dolor intenso que puede durar segundos o minutos). A pesar de que no todos los casos se presentan con compresión vascular, hay pacientes con sintomatología clara.
Al respecto, todavía no se cuenta con una explicación certera de por qué la NET se desarrolla en ausencia de esta compresión o de patologías previas diagnosticadas (como la esclerosis múltiple)6,7. Según la hipótesis de Ishikawa et al.8, el engrosamiento aracnoideo y las adherencias granulomatosas entre la raíz del nervio y las estructuras circundantes causarían angulación radicular y torsión, generando una fuerza de estiramiento anormal de la raíz, que podría promover la hiperexcitabilidad del nervio.
Así, se considera que la desmielinización a nivel de la REZ es el denominador común asociado con el dolor. En cuanto a sus eventos desencadenantes, estos han sido bien descritos, pero dado que hasta fines del siglo XX no se pudieron establecer tratamientos eficaces con niveles aceptables de efectos secundarios, hoy existen muchas teorías sobre los orígenes de la NET, y junto con ellas, numerosas modalidades terapéuticas.
En este sentido, el objetivo de la terapia debe ser el alivio completo del dolor, manteniendo un nivel aceptable de efectos secundarios. La opción inicial es el tratamiento médico, aunque si este falla o presenta efectos secundarios significativos, la cirugía -y en particular la descompresión microvascular (propuesta por Janneta et al.3)- es la alternativa de elección. Las técnicas de tratamiento médico y quirúrgico utilizadas actualmente ofrecen medios eficaces para aliviar esta entidad tan dolorosa en la mayoría de los casos9.
La importancia de utilizar la DTI y medir la FA en pacientes con clínica manifiesta radica en la posibilidad de confirmar fehacientemente, en caso de compresión neurovascular, si esta es la causa real de la desmielinización del nervio que ocasiona las descargas y el consecuente dolor. Al igual que Lutz et al.10, hemos encontrado en pacientes con compresión neurovascular del lado coincidente con la clínica valores de FA descendidos, por debajo de los hallados del lado contralateral asintomático considerado en rango habitual.
En 8 de los 10 pacientes se visualizó compresión neurovascular; sin embargo, en 2 casos con sintomatología clara y valores alterados de FA, no se logró evidenciar contacto vascular directo por técnicas convencionales de resonancia magnética. Las imágenes obtenidas con tensor de difusión de alta densidad permitieron la medición de la FA, remarcando la capacidad del método de visualizar in vivo el daño intrínseco microestructural de las fibras del V par craneano (por la compresión neurovascular en pacientes con NET).
Delimitar las fibras con afección resulta de gran importancia para decidir la conducta terapéutica11 y, si bien los métodos convencionales (del tipo FIESTA, CISS, B_FFE T2 o la angiografía por resonancia magnética) son buenos para la detección del contacto vascular en la porción cisternal del V par craneano, no queda plenamente demostrado que estos pequeños vasos generen compresión y que sean la causa de la neuralgia, debido a que también se han observado en pacientes totalmente asintomáticos7,12–14. Por ello, la medida de la FA, junto con los datos anatómicos, permitiría un diagnóstico etiológico y anatómico más exacto.
Tal como han planteado Lutz et al.10 y Herweh et al.15, creemos que las imágenes de DTI son una herramienta valiosa para delinear las compresiones sintomáticas en pacientes con síndromes de dolor facial y hallazgos clínicos y/o imágenes no concluyentes. La FA descendida es el indicador de la desmielinización clínicamente evidente que origina las descargas anómalas en los nervios afectados.
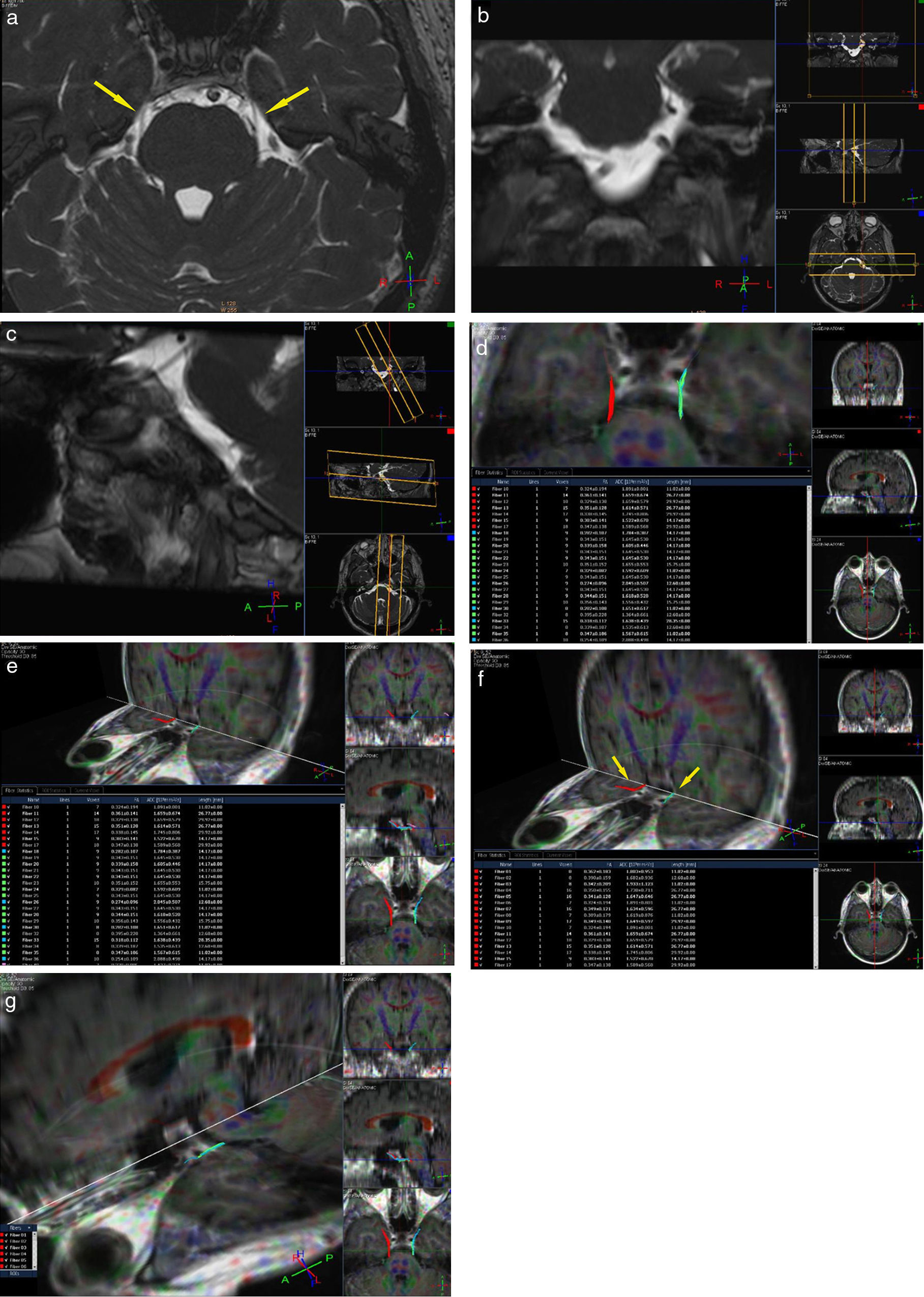
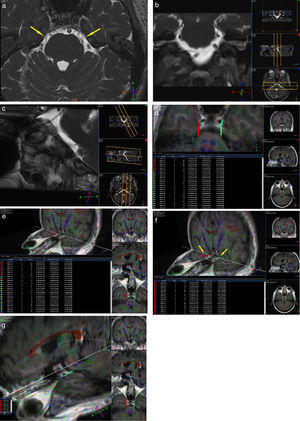
En cuanto a las limitaciones de nuestro estudio, se destacan los largos tiempos de escaneo y la gran susceptibilidad de los resonadores de alto campo a los movimientos involuntarios de los pacientes, ya que esto provocó necesariamente la repetición de adquisiciones por los artificios cinéticos. Si bien se han comparado los valores de FA de los nervios craneanos afectados con los de los contralaterales asintomáticos, mencionamos como otra limitación la falta de un grupo control sano para cotejar los valores normales de la FA estándar con los valores alterados de los pacientes sintomáticos (fig. 2).
Paciente de sexo femenino de 42 años de edad con una neuralgia esencial del trigémino izquierda, de 1 año de evolución. Se encuentra afectada la rama V2 y en la porción cisternal a izquierda (pars triangularis) se observa un vacío de flujo que contacta con la misma, probablemente correspondiendo a un loop de la arteria cerebelosa antero-inferior (a, b y c). En la tractografía se visualiza la continuidad de las fibras, pero llamativamente en algunas de ellas la FA del lado afectado se encuentra disminuida con respecto a su contralateral asintomático (valores disminuidos: fibras celestes en d y e). También se evidencia un compromiso neurovascular similar al del lado contralateral, con una FA en rango normal, interpretado como variante anatómica (flechas en a). Véase en las imágenes f y g las fibras rojas correspondientes al nervio sano y las fibras celestes correspondientes al lado afectado.
La realización de la difusión anisotrópica de alta densidad y la medición de la FA pueden ser una herramienta de gran utilidad en la evaluación de la neuralgia esencial del trigémino.
Este método, reproducible y seguro, mejora la detección del daño microestructural de las fibras del V par craneano en pacientes con o sin compresión neurovascular.
Además, colabora en la decisión de la conducta terapéutica, seleccionando a los pacientes candidatos a la cirugía descompresiva microvascular. Es decir, determina si realmente presentan contacto vascular significativo asociado a desmielinización (comprobada por el descenso de la FA).
Futuros estudios permitirán distinguir a los pacientes que tienen indicación quirúrgica si se demuestra una alteración de la FA correlacionable con la clínica y los hallazgos neuroquirúrgicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.