El linfoma primario del sistema nervioso central (LPSNC) es una entidad rara con un pronóstico fatal. Dado el aumento en el número de casos con inmunosupresión adquirida, nuestros objetivos son estudiar las características epidemiológicas y neurorradiológicas de aquellos pacientes inmunodeprimidos con diagnóstico de LPSNC con afectación cerebral e investigar si existen diferencias entre los pacientes con el virus de la inmunodeficiencia humana (VIH) positivo y negativo.
Materiales y métodosSe realizó un estudio descriptivo y retrospectivo de los pacientes inmunodeprimidos con afectación cerebral por LPSNC, diagnosticados durante los últimos 13 años en 2 hospitales de referencia. Se evaluaron múltiples variables. El nivel de significación estadística utilizado fue p<0,05.
ResultadosEl grupo VIH-positivo tenía una media de edad de 36,82±5,4 años, frente a los 55,60 ± 21,43 años de los pacientes VIH-negativo (p<0,022). Los pacientes VIH-positivo tuvieron una media de 1,27 ± 0,65 lesiones por paciente, mientras que en el grupo VIH-negativo fue de 2,60 ± 1,78 (p<0,039). El 18,2% (n=2) del grupo VIH-positivo y el 80% (n=8) del grupo VIH-negativo presentaron lesiones homogéneas (p<0,005). Ningún paciente VIH-positivo tuvo afectación del cuerpo calloso, pero el grupo VIH-negativo presentó un 50% (n=5) de afectación (p<0,012).
ConclusionesEl LPSNC en pacientes inmunodeprimidos puede presentar múltiples características en las imágenes. Existen diferencias entre los pacientes VIH positivo y negativo, por lo que es importante reconocerlas para establecer un manejo y tratamiento diferente entre ambos grupos.
Primary central nervous system lymphoma (PCNSL) is a rare tumour with poor prognosis. Due to the increased number of patients with acquired immunodeficiency, our purposes are to describe epidemiological and imaging findings in immunodeficient patients with PCNSL of the brain and to study the differences between HIV-positive and HIV-negative patients with PCNSL.
Materials and methodsA retrospective, descriptive study was performed with immunodeficient patients diagnosed of PCNSL of the brain during the last 13 years in two reference hospitals. Twenty-one patients fulfilled the inclusion criteria. Multiple variables were evaluated. Significance was defined as p<0.05.
ResultsHIV-positive group was a mean age of 36,82±5,4 years and the mean age in HIV-negative group was 55,60±21,43 years (p<0,022). The mean number of lesions was 1,27±0,65 in HIV-positive group and 2,60±1,78 in HIV-negative group (p<0,039). The lesions were homogeneous in 18,2% (n=2) HIV-positive group and 80% (n=8) in HIV-negative group (p<0,005). No HIV-positive patient and 50% (n=5) of HIV-negative patients showed corpus callosum involvement (p<0,012).
ConclusionsPCNSL in immunodeficient patients is associated with a large spectrum of radiological findings. There were differences between HIV-positive and HIV-negative patients, is important recognize these differences as the therapeutic management of these two groups vary.
El linfoma primario del sistema nervioso central (LPSNC) es un linfoma no Hodgkin agresivo, de etiopatogenia desconocida, que se origina con mayor frecuencia en el cerebro, pero puede afectar las leptomeninges (12%), los ojos y la médula espinal (1%)1, sin presentar evidencia de infiltración linfomatosa en otra localización en el momento del diagnóstico2,3. La mayoría de los LPSNC están compuestos por células linfomatosas con fenotipo B.
La enfermedad representa aproximadamente el 5% de las neoplasias primarias intracraneales4. Si bien su incidencia aumentó significativamente en décadas anteriores, en la actualidad parece haberse estabilizado5 o tener solo un aumento discreto6.
Hemos sido testigos de cómo el LPSNC ha modificado su historia natural (y, por ende, su expresión macro/microscópica e imagenológica). En las últimas décadas, su incidencia tuvo un aumento significativo, mientras se incrementaba el número de pacientes inmunodeprimidos, fundamentalmente debido a la infección por el virus de la inmunodeficiencia humana (VIH). En la actualidad, junto a una tendencia a la disminución de la incidencia del síndrome de inmunodeficiencia adquirida, se mantienen e incluso aumentan otros factores de inmunodepresión (como trasplantes o farmacoterapia diversa), por lo que nuevamente se plantean ciertos cambios en el devenir de la enfermedad.
El LPSNC puede afectar tanto a pacientes inmunocompetentes como inmunodeprimidos, pero determinadas condiciones asociadas a la inmunosupresión (ya sea congénita o adquirida) conllevan un mayor riesgo de padecer un LPSNC5. Estas han llegado a ser consideradas complicaciones oportunistas frecuentes en un estado de inmunosupresión7.
El método de referencia para el diagnóstico del LPSNC es la biopsia cerebral guiada por estereotaxia o neuronavegación8,9. La radiología, desde esta perspectiva, representa un papel fundamental, tanto en el diagnóstico como en la valoración de la respuesta al tratamiento y recidiva10,11. De hecho, se ha evaluado la opción de reducir la necesidad de realizar biopsias cerebrales mediante la combinación de diferentes herramientas diagnósticas12.
Ciertamente la prueba imagenólogica idónea es la resonancia magnética (RM) por su gran precisión en la visualización de estructuras anatómicas. Si no es posible hacerla o está contraindicada, hay que realizar una tomografía computada (TC) con contraste.
Dada la rareza de este tipo de tumor, todavía no se ha determinado el mejor tratamiento para los pacientes VIH positivo y negativo13.
Varios estudios señalan las características neuroimagenológicas del LPSNC de los pacientes inmunocompetentes y VIH-positivo, pero no se han encontrado trabajos exhaustivos que describan dichas características en los pacientes con inmunosupresión adquirida VIH-negativo. En el presente, este grupo ha incrementado significativamente su número y, por todo ello, hemos decidido estudiar las características epidemiológicas y neuroimagenológicas en RM y TC de todos los pacientes inmunodeprimidos a los que se les diagnosticó linfoma cerebral primario durante los últimos 13 años en 2 hospitales de referencia neurológica, neuroquirúrgica y oncológica. El objetivo fue establecer ciertas características que sirviesen de guía para un diagnóstico rápido y preciso. A su vez, se estudió si existían diferencias entre los pacientes VIH positivo y negativo, ya que, en ese caso, el tratamiento y manejo de ambos grupos sería diferente.
Materiales y métodosSe realizó un estudio descriptivo y retrospectivo de los pacientes inmunodeprimidos con linfoma no Hodgkin difuso de células grandes B del sistema nervioso central con afectación cerebral, que fueron diagnosticados por el servicio de Anatomía Patológica de 2 hospitales de referencia neurológica, neuroquirúrgica y oncológica, desde enero de 1997 hasta diciembre de 2010, tras la realización de una biopsia cerebral. Solo se incluyó a aquellos que disponían de un estudio de RM en el momento del diagnóstico, obteniendo un total de 21 casos.
Todos los pacientes presentaban una estadificación extraneural negativa, condición necesaria para diferenciar el linfoma primario del secundario.
El estudio de RM se llevó a cabo, en ambos hospitales, con un equipamiento similar de 1,5 T; mientras que la investigación de TC se realizó con varios equipos que se fueron modernizando a medida que el método evolucionaba: de 2 (1997) a 64 detectores (2011). Todos los pacientes tuvieron imágenes en ponderación T2, T1 y T1 poscontraste (tras la administración de 0,1mmol/kg de gadodiamida o ácido gadotérico). Debido a que se trató de un estudio multicéntrico, el tiempo de eco y el tiempo de repetición variaron levemente.
A través de los datos obtenidos de las historias clínicas, se analizaron las siguientes variables:
- •
Edad.
- •
Sexo.
- •
Tiempo transcurrido desde el inicio de los síntomas hasta el diagnóstico.
- •
Tiempo transcurrido desde que el paciente acudió al hospital hasta el diagnóstico.
- •
Localización de las lesiones: lóbulos frontal, temporal, parietal y/o occipital, cerebelo o estructuras profundas (englobando afectación intraventricular, cuerpo calloso y ganglios basales).
- •
Localización de las lesiones, según su ubicación derecha, izquierda y/o central.
- •
Número de lesiones: 1, 2, 3, 4 y≥5.
- •
Características por RM de la lesión principal (entendiéndola como aquella capaz de ser biopsiada):
- º
Patrón general: homogéneo/heterogéneo.
- º
Degeneración necrótica (definiendo necrosis como un área hiperintensa en secuencias ponderadas en T2, que no realza en secuencias en ponderación T1 tras la administración de contraste)/degeneración hemorrágica subaguda (definida como un área hiperintensa en ponderación T1 y T2).
- º
Tamaño (medido en centímetros en la secuencia ponderada en T1 con contraste).
- º
Contorno: bien/mal definido.
- º
Intensidad de señal (respecto a la sustancia gris) en secuencias ponderadas en T1 y T2.
- º
Presencia, intensidad y morfología del patrón de realce: predominantemente homogéneo, heterogéneo o realce en anillo.
- º
Presencia y grado del edema, considerándolo: importante, si excede el tamaño de la lesión en la secuencia ponderada en T1 con contraste; moderado, si es > 25% del tamaño de la lesión; leve, si es ≤ 25%.
- º
Presencia y grado del efecto masa: ausente, leve cuando no hay repercusión sobre estructuras adyacentes, e importante cuando sí hay repercusión significativa (como desplazamiento de estructuras de la línea media, hidrocefalia secundaria o herniación cerebral).
- º
Presencia de afectación dural y ósea.
- º
- •
Características por TC:
- º
Patrón general: homogéneo/heterogéneo.
- º
Densidad de las lesiones (respecto a la sustancia gris).
- º
Presencia, intensidad y morfología del realce: predominantemente homogéneo, heterogéneo o realce en anillo.
- º
Los estudios fueron valorados por 2 radiólogos de forma independiente e intervino un tercer radiólogo en casos de discordancia. Se realizó un análisis descriptivo de todas las variables recogidas en el estudio, teniendo en cuenta sus características.
Para valorar la asociación de las variables cualitativas, se emplearon los análisis estadísticos Chi-cuadrado y de Fisher, según correspondiese, y para determinar la asociación entre variables cuantitativas y cualitativas se utilizaron los exámenes t de Student o ANOVA, según se analizase 1 variable de 2 o más categorías, cuando la variable cuantitativa era normal. En los casos de variables no normales, se usó la estadística no paramétrica (Mann-Whitney o Kruskal-Wallis). El nivel de significación estadística utilizado fue p<0,05, y el análisis de los datos se llevó a cabo con el programa informático SPSS-17.
El proyecto fue aprobado por el Comité de Ética de Investigación Clínica de Galicia.
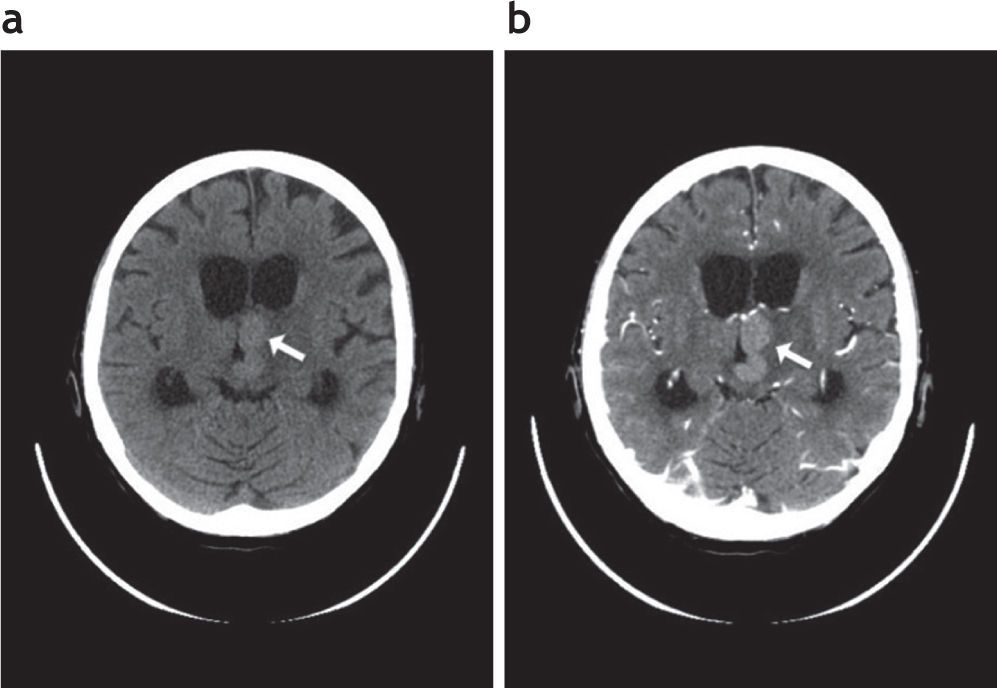
ResultadosResultados del grupo general de pacientes inmunodeprimidosObtuvimos un total de 21 pacientes inmunodeprimidos (figs. 1 y 2) (13 de sexo masculino –61,9%– y 8 de sexo femenino –38,1%–). La media de edad fue de 45,76 años ± 17,71 (rango: 7–78).
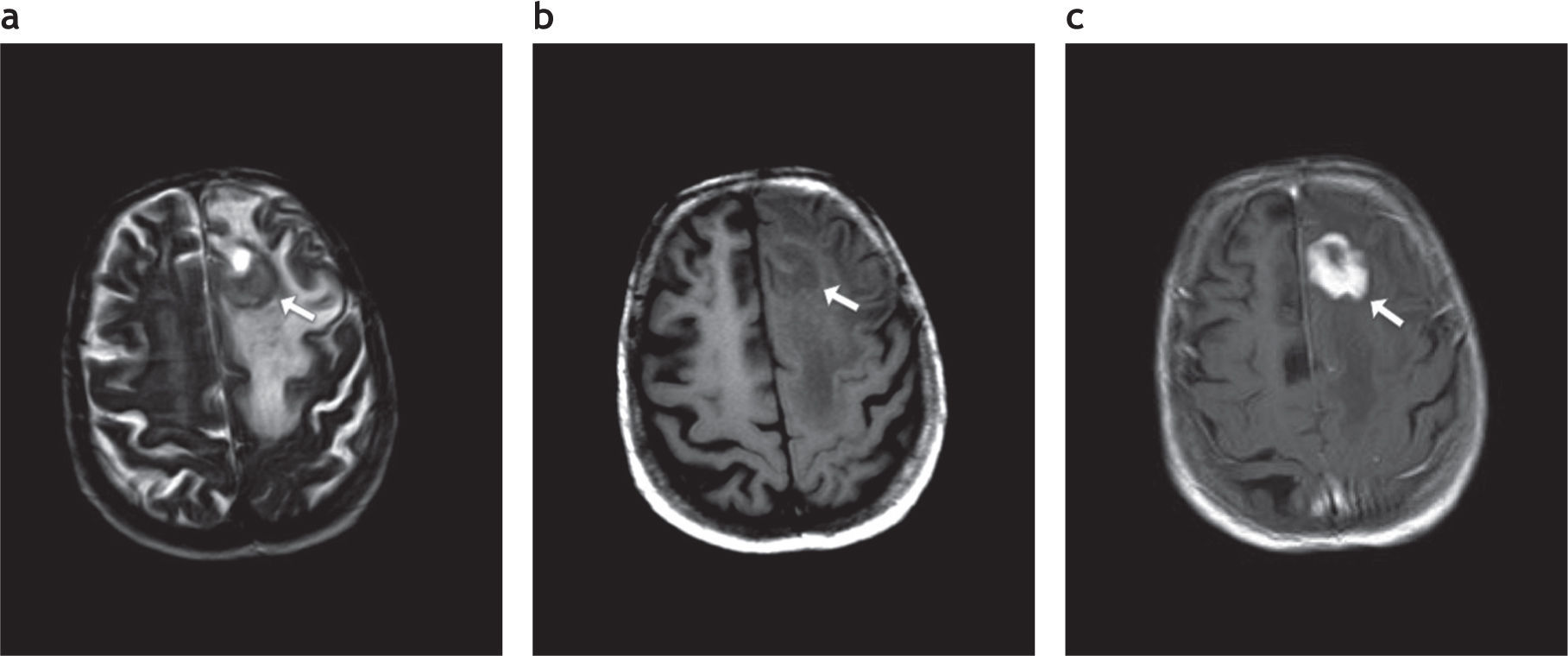
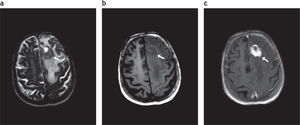
Afectación del lóbulo frontal izquierdo por linfoma primario del sistema nervioso central en un paciente inmunodeprimido. Se visualiza una lesión (fl echa blanca). (a) Hipointensa en ponderación T2. (b) Isointensa en secuencia ponderada en T1, que (c) realza intensamente tras la administración de contraste.
Respecto al tiempo transcurrido desde el inicio de los síntomas hasta la confirmación del diagnóstico histológico, la media fue de 29,29 ± 14,39 días (rango: 8–60), y entre que el paciente acudió al hospital y hubo un diagnóstico histológico, la media fue de 26,67 ± 13,82 días (rango 8–60).
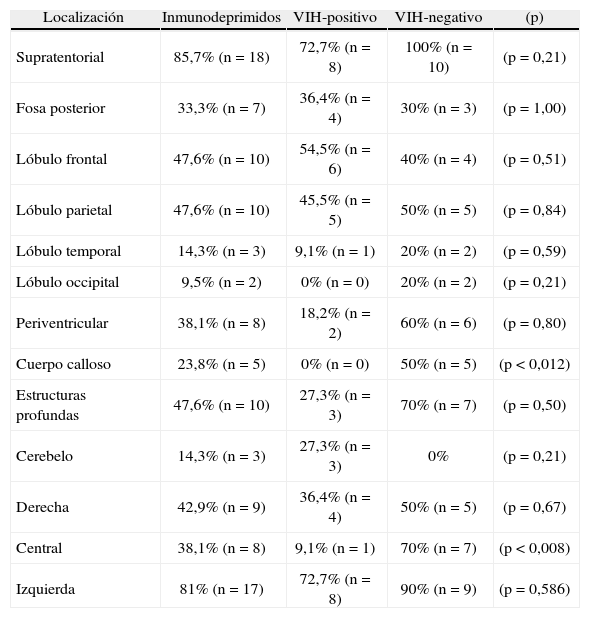
El 38,1% (n=8) presentó una forma multifocal, mientras que el 61,9% (n=13) tuvo una única lesión, con una media de 1,90 ± 1,45 lesiones por paciente. La localización de las lesiones se muestra en la tabla 1.
Localización de las lesions.
| Localización | Inmunodeprimidos | VIH-positivo | VIH-negativo | (p) |
| Supratentorial | 85,7% (n=18) | 72,7% (n=8) | 100% (n=10) | (p=0,21) |
| Fosa posterior | 33,3% (n=7) | 36,4% (n=4) | 30% (n=3) | (p=1,00) |
| Lóbulo frontal | 47,6% (n=10) | 54,5% (n=6) | 40% (n=4) | (p=0,51) |
| Lóbulo parietal | 47,6% (n=10) | 45,5% (n=5) | 50% (n=5) | (p=0,84) |
| Lóbulo temporal | 14,3% (n=3) | 9,1% (n=1) | 20% (n=2) | (p=0,59) |
| Lóbulo occipital | 9,5% (n=2) | 0% (n=0) | 20% (n=2) | (p=0,21) |
| Periventricular | 38,1% (n=8) | 18,2% (n=2) | 60% (n=6) | (p=0,80) |
| Cuerpo calloso | 23,8% (n=5) | 0% (n=0) | 50% (n=5) | (p<0,012) |
| Estructuras profundas | 47,6% (n=10) | 27,3% (n=3) | 70% (n=7) | (p=0,50) |
| Cerebelo | 14,3% (n=3) | 27,3% (n=3) | 0% | (p=0,21) |
| Derecha | 42,9% (n=9) | 36,4% (n=4) | 50% (n=5) | (p=0,67) |
| Central | 38,1% (n=8) | 9,1% (n=1) | 70% (n=7) | (p<0,008) |
| Izquierda | 81% (n=17) | 72,7% (n=8) | 90% (n=9) | (p=0,586) |
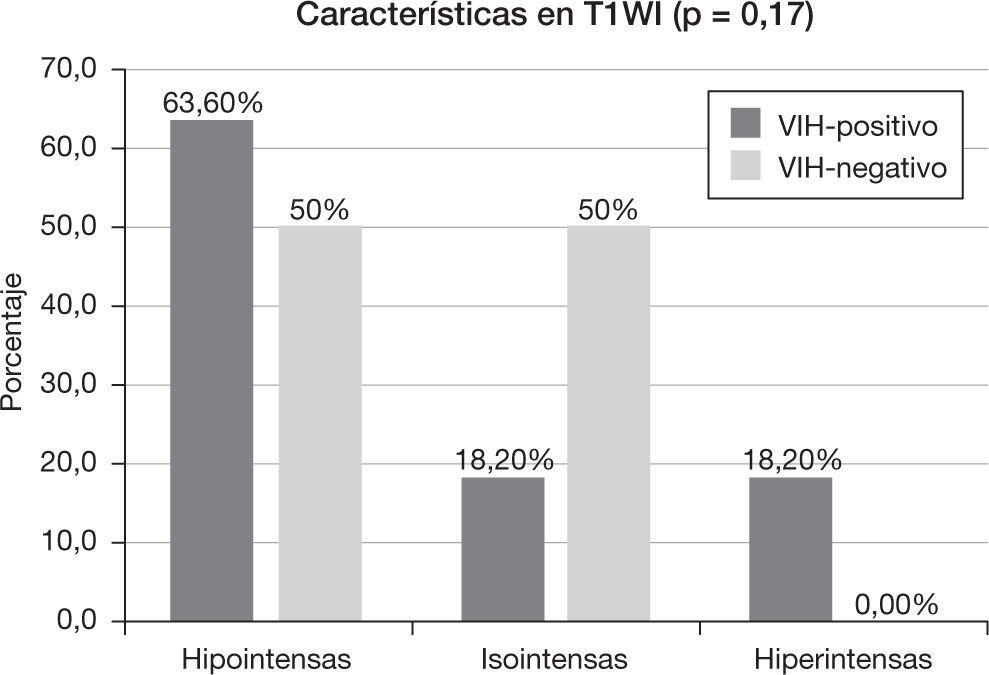
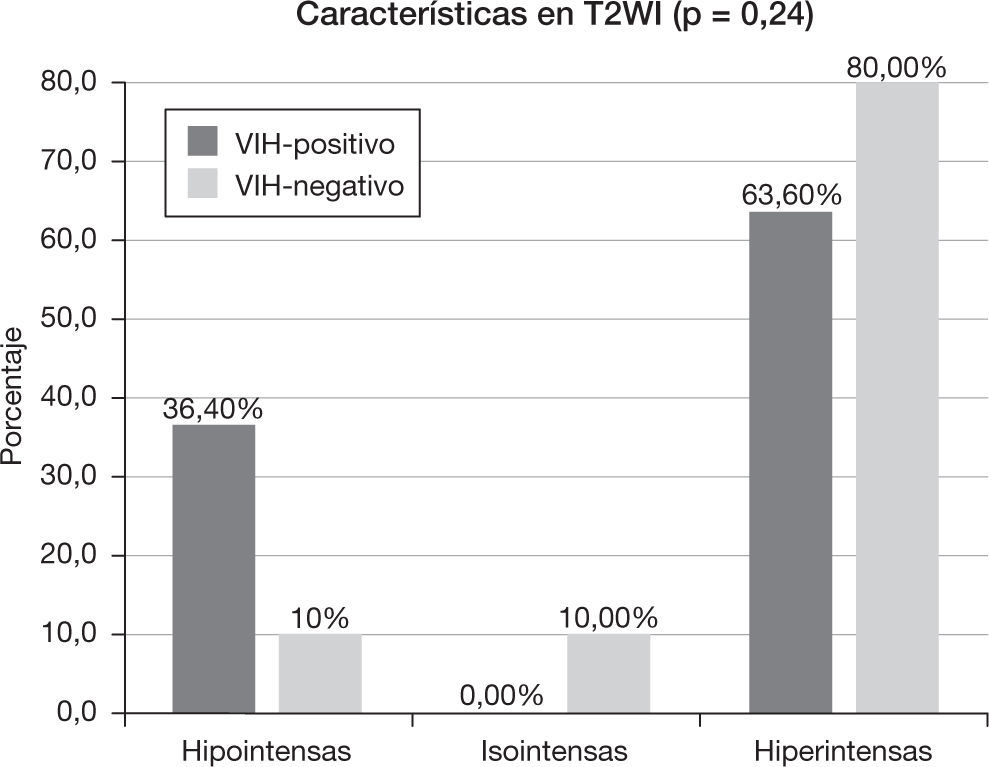
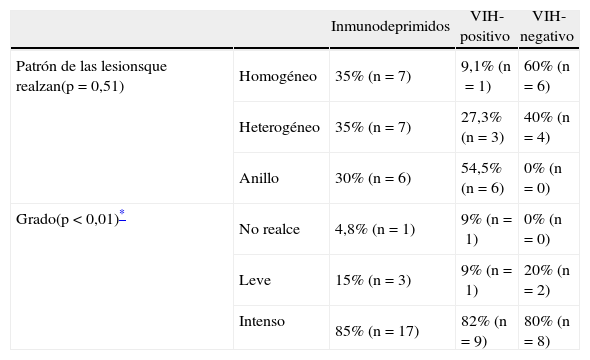
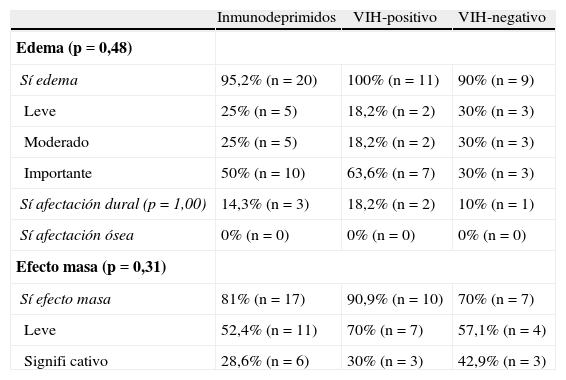
Las lesiones fueron heterogéneas en el 52,4% (n=11) de los pacientes. En un 23,8% (n=5) de los casos hubo degeneración necrótica y en un 23,8% (n=5), degeneración hemorrágica. Las lesiones tuvieron un tamaño medio de 3,18 ± 1,29cm (rango: 1,6-6) y, mientras el 57,1% (n=12) evidenció un contorno bien definido, el 42,9% (n=9) mostró límites imprecisos. Se comportaron como lesiones hipointensas en secuencias ponderadas en T1 en el 57,1% (n=12) de los pacientes, isointensas en el 28,6% (n=6) e hiperintensas en el 14,3% (n=3). En las secuencias en ponderación T2, fueron hipointensas en el 19% (n=4), isointensas en el 4,8% (n=1) e hiperintensas en el 76,2% (n=16). Las características del patrón y grado del realce se muestran en la tabla 2, y las características del edema, efecto masa y afectación dural y ósea se muestran en la tabla 3.
Características del patrón y grado de realce en resonancia magnética.
| Inmunodeprimidos | VIH-positivo | VIH-negativo | ||
| Patrón de las lesionsque realzan(p=0,51) | Homogéneo | 35% (n=7) | 9,1% (n=1) | 60% (n=6) |
| Heterogéneo | 35% (n=7) | 27,3% (n=3) | 40% (n=4) | |
| Anillo | 30% (n=6) | 54,5% (n=6) | 0% (n=0) | |
| Grado(p<0,01)* | No realce | 4,8% (n=1) | 9% (n=1) | 0% (n=0) |
| Leve | 15% (n=3) | 9% (n=1) | 20% (n=2) | |
| Intenso | 85% (n=17) | 82% (n=9) | 80% (n=8) |
Características en resonancia magnética del edema, afectación dural y ósea, y efecto masa.
| Inmunodeprimidos | VIH-positivo | VIH-negativo | |
| Edema (p=0,48) | |||
| Sí edema | 95,2% (n=20) | 100% (n=11) | 90% (n=9) |
| Leve | 25% (n=5) | 18,2% (n=2) | 30% (n=3) |
| Moderado | 25% (n=5) | 18,2% (n=2) | 30% (n=3) |
| Importante | 50% (n=10) | 63,6% (n=7) | 30% (n=3) |
| Sí afectación dural (p=1,00) | 14,3% (n=3) | 18,2% (n=2) | 10% (n=1) |
| Sí afectación ósea | 0% (n=0) | 0% (n=0) | 0% (n=0) |
| Efecto masa (p=0,31) | |||
| Sí efecto masa | 81% (n=17) | 90,9% (n=10) | 70% (n=7) |
| Leve | 52,4% (n=11) | 70% (n=7) | 57,1% (n=4) |
| Signifi cativo | 28,6% (n=6) | 30% (n=3) | 42,9% (n=3) |
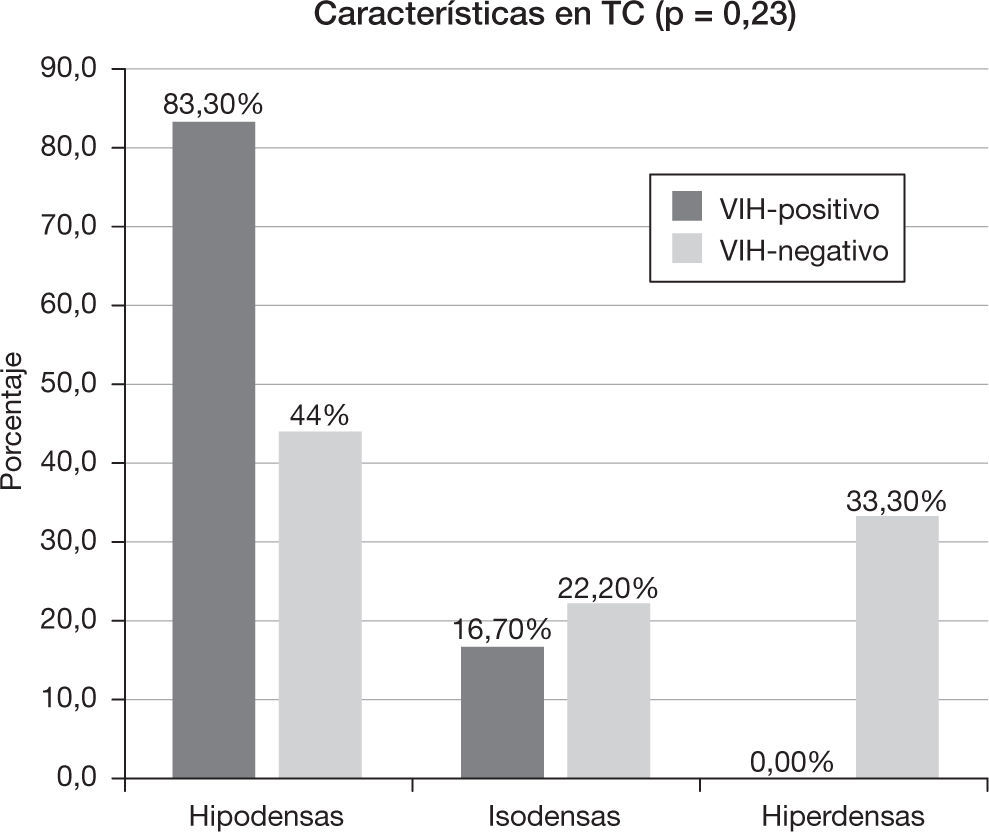
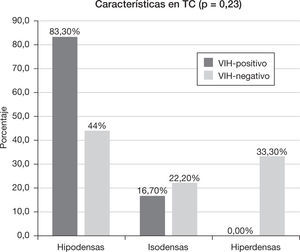
Un 81,58% de los pacientes (n=15) disponía de un estudio de TC. De ellos, en el 60% (n=9) las lesiones se comportaron hipodensas, en el 20% (n=3) isodensas y en el 20% (n=3) hiperdensas. De los pacientes que contaban con un estudio de TC, a 12 (80%) se les realizó un estudio poscontraste, en el cual se observaba, en un 91,66% (n=11), realce de la lesión. De las lesiones que realzaron, el 90,90% (n=10) evidenció un realce intenso, mientras que en el 9,09% (n=1) fue leve. Este realce en el 63,63% (n=7) se mostró homogéneo, en el 9,09% (n=1) heterogéneo y en el 27,27% (n=3) hubo realce en anillo.
Pacientes con virus de la inmunodeficiencia humana positivo vs. virus de la inmunodeficiencia humana negativoDe los 21 pacientes de nuestra muestra, un 52,4% (n=11) era portador del VIH y un 47,6% (n=10) presentaba otros tipos de inmunodeficiencia: 4 pacientes por tratamiento inmunosupresor postrasplante, 4 pacientes oncológicos por otro tumor primario y 2 pacientes sometidos a tratamiento inmunosupresor por diversas causas (tratamiento crónico por el virus de la hepatitis B o artritis reumatoide).
El 81,8% (n=9) de los pacientes VIH-positivo y el 40% (n=4) VIH-negativo eran de sexo masculino (p=0,08). La media de edad del grupo VIH-positivo fue de 36,82 ± 5,4 años (rango: 30–46), mientras que la de los pacientes VIH-negativo fue de 55,60 ± 21,43 años (rango: 7–78; p<0,022).
Con respecto al tiempo transcurrido desde el inicio de los síntomas hasta la confirmación del diagnóstico histológico, la media fue de 31,73 ± 15,05 días (rango: 9–60) para el grupo VIH-positivo, y de 26,60 ± 13,89 (rango: 8-53) para el grupo VIH-negativo (p=0,43).
Desde que el paciente acudió al hospital hasta la confirmación del diagnóstico histológico, la media del tiempo transcurrido fue de 31,73 ± 15,05 días (rango: 9-60) para el grupo VIH-positivo y de 21,10 ± 10,35 días (rango: 8-35) para los pacientes VIH-negativo (p=0,08).
El 18,2% (n=2) de los pacientes VIH-positivo y el 60% (n=6) de los VIH-negativo presentaron lesiones multifocales (p=0,08). La media de lesiones por paciente fue de 1,27 ± 0,65 para los VIH-positivo, mientras que en el grupo VIH-negativo fue de 2,60 ± 1,78 (p<0,039). La localización de las lesiones se muestra en la tabla 1.
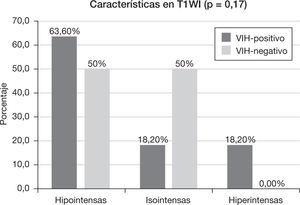
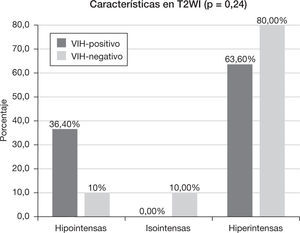
Características en resonancia magnéticaEl 18,2% (n=2) del grupo VIH-positivo y el 80% (n=8) del grupo VIH-negativo presentaron lesiones homogéneas (p<0,005). En el caso de las lesiones heterogéneas, hubo necrosis (p=0,15) en un 45,5% (n=5) y hemorragia (p=0,31) en un 36,4% (n=4) de los pacientes VIH-positivo, frente al 10% (n=1) de necrosis y 10% (n=1) de hemorragia del grupo VIH-negativo. El tamaño medio de la lesión en el grupo VIH-positivo fue de 3,54 ± 0,86cm (rango: 2,3-5 cm), mientras que en el VIH-negativo fue de 2,82 ± 1,58cm (rango: 1,6–6cm) (p=0,08). El 63,6% (n=7) de los pacientes VIH-positivo y el 50% de los pacientes VIH-negativo tuvieron un contorno de la lesión bien delimitado (p=0,67).
Las características de intensidad de señal de las lesiones en secuencias ponderadas en T1 y T2 se muestran en las figuras 3 y 4, respectivamente. El 90,9% (n=10) de los pacientes con VIH-positivo y el 100% (n=10) de los VIH-negativo presentaron realce de sus lesiones (p=1,00). Sus características se muestran en la tabla 2 y las características del edema, efecto masa y afectación dural y ósea se muestran en la tabla 3.
Las características de atenuación de las lesiones en la TC se muestran en la figura 5. De los 15 pacientes que disponían de una TC, a 12 se les realizó una adquisición con contraste: el grupo VIH-positivo tuvo un 100% (n=5) de realce y el VIH-negativo un 85,7% (n=6). Todos los pacientes VIH-positivo realzaron de forma intensa (n=5), mientras que dentro del grupo VIH-negativo, el 71,4% (n=5) realzó de forma intensa, el 14,3% (n=1) de forma leve y el 14,3% (n=1) no realzó (p=0,42). En el grupo VIH-positivo, el 40% (n=2) mostró un realce homogéneo y el 60% un realce en anillo, frente al grupo VIH-negativo que tuvo un realce homogéneo en el 71,4% (n=5) y heterogéneo en el 14,3% (n=1), sin evidenciar realce en anillo (p=0,11).
DiscusiónDe acuerdo con otras series que hacen la comparación con la población inmunocompetente13, hemos encontrado que los pacientes VIH-positivo son significativamente más jóvenes (casi 2 décadas menos). Esto podría estar justificado por la probable mayor agresividad del VIH que ocasiona un desarrollo más rápido de la inmunosupresión.
En nuestra serie, el tiempo transcurrido entre el comienzo de los síntomas y el diagnóstico fue menor que el descrito en otras series publicadas (incluso llegó a ser menos de la mitad en algunos casos). Este dato quizá se deba a la mayor accesibilidad al sistema sanitario que hay en nuestro país, si la comparamos con otros países europeos o asiáticos14.
En lo que respecta a nuestra población inmunodeprimida, hasta el diagnóstico transcurrió una cantidad de tiempo similar entre el comienzo de los síntomas y la primera consulta. Es posible que, debido a la probable agudeza e intensidad de la sintomatología, los pacientes hayan acudido rápidamente al centro hospitalario.
En general, el linfoma afecta preferentemente al parénquima profundo y, en particular, a los ganglios de la base15. De hecho, en nuestro estudio prácticamente la mitad de las lesiones fueron localizadas en las estructuras profundas, a excepción del grupo de pacientes VIH-positivo que tuvo una afectación significativamente menor (dato ya registrado en la bibliografía sobre el tema)16.
Según la literatura, la localización en la fosa posterior es rara17. Sin embargo, en nuestra serie encontramos hasta un tercio de afectación. Dado que en nuestro caso todos los pacientes fueron estudiados por RM, esta diferencia puede deberse a la dificultad de visualizar adecuadamente la fosa posterior en los estudios de TC (único método de imagen usado en algunas de las series revisadas).
Las lesiones se localizaron preferentemente en el lado izquierdo, quizá porque este es el hemisferio más activo y, por tanto, puede favorecer la potenciación de posibles factores etiológicos (alteraciones en genes supresores tumorales, actividad viral, etc.). Los pacientes VIH-positivo también presentaron significativamente poca afectación en el ámbito central, sin que hayamos encontrado estudios que detallasen exhaustivamente distinciones entre la localización derecha, izquierda o central.
Si bien la literatura generalmente cita un índice alto de lesiones múltiples en pacientes inmunodeprimidos3,18–21, existe algún estudio en concordancia con nuestra serie22,23 en el que también hubo un predominio de la forma unifocal. Si tomamos en cuenta la menor cantidad de tiempo transcurrido entre el comienzo de los síntomas y el diagnóstico en nuestros pacientes, el hallazgo probablemente se explique por una clínica más aguda y/o un control clínico rutinario exhaustivo. Los pacientes inmunodeprimidos, al estar sometidos a tratamientos antirretrovirales e inmunosupresores (pacientes oncológicos, trasplantados, etc.), requieren de una actuación más rápida.
Características en resonancia magnéticaLa mayoría de los pacientes VIH-positivo presentaron una lesión heterogénea. Si bien para la literatura la hemorragia y la degeneración necrótico-quística son poco frecuentes en lesiones que no han recibido tratamiento14,23, en nuestra serie obtuvimos numerosos casos. Este hallazgo podría estar asociado al mayor tamaño de las lesiones, ya que el aumento de la dimensión traduce una escasa irrigación de la lesión tumoral. Esta, al alcanzar un tamaño determinado, ve reducida su irrigación en la porción central, necrosándose y aumentando su volumen. Dado que estos hallazgos no se consideran los más característicos, cuando aparecen, en el diagnóstico diferencial deben incluirse el glioblastoma y las metástasis que frecuentemente sangran o presentan necrosis.
El tamaño medio de las lesiones fue aproximadamente de 3cm (mayor que el de otras series revisadas)14, probablemente porque, en el caso de la enfermedad multifocal, tomamos la lesión susceptible de ser biopsiada y esta, en alguna ocasión, también era la de mayor tamaño.
Los pacientes VIH-positivo presentaron una media de lesiones de mayor tamaño (al contrario de lo reportado por otras series13). Este hallazgo, una vez más, podría relacionarse con la agresividad tumoral en este grupo de pacientes: lesiones de mayor tamaño con degeneración necrótica.
Respecto a las secuencias ponderadas en T2, en general las lesiones fueron hiperintensas. Nuestros resultados mantienen su concordancia con algunos estudios17,24–26, pero otros autores han observado lesiones mayoritariamente isohipointensas9. Analizando este hecho, es posible que nuestra serie haya estado influida por el alto porcentaje de necrosis que observamos.
A su vez, tras la administración de gadolinio, en nuestro caso se evidenció un realce intenso en la gran mayoría de pacientes. Este dato (también presente en la literatura) expresa la rotura de la barrera hematoencefálica como reflejo de la agresividad de este tipo de tumor15.
Respecto al patrón de realce, tanto en nuestro estudio como en otros anteriores4,13,17,18,27, observamos un predominio del realce heterogéneo. Si bien este hallazgo resulta llamativo en los pacientes VIH-positivo, está justificado por el alto porcentaje de degeneración en este grupo (relacionando la degeneración necrótica con la presencia de un realce en anillo).
A pesar de que en algunas series el efecto masa y el edema se han registrado como hallazgos no demasiado frecuentes19, en publicaciones más recientes el edema se reporta como un signo común, generalmente leve28 o moderado26. La presencia de un edema importante es raro debido a la naturaleza infiltrativa del tumor (hecho que justificaría también un efecto masa leve). Sin embargo, en los pacientes VIH-positivo, el edema sí es de grado importante (otro hallazgo indicativo más de la agresividad tumoral en este grupo).
Si bien el LPSNC tiende a infiltrar los tejidos subependimarios, diseminándose a las meninges a través del líquido cefalorraquídeo9, solo un pequeño porcentaje de nuestros pacientes presentó afectación de la duramadre (hallazgos consecuentes con la literatura)15,17. No obstante, hay que tener en cuenta que existe una clara discordancia entre los resultados radiológicos y la confirmación por punción lumbar, ya que solo se visualiza un pequeño porcentaje de la afectación meníngea que se demuestra en la punción27. Esta última es considerada un indicador fiable de afectación leptomeníngea29.
Características en tomografía computadaDe acuerdo con otras series5, en el grupo VIH-positivo se observó un predominio de lesiones hipodensas y realce en anillo, vinculado a la presencia de degeneración necrótica en estos pacientes.
Limitaciones del estudioNuestros condicionamientos están relacionados con los límites propios de un diseño observacional y retrospectivo. Además de los posibles sesgos en la información, podemos mencionar la selección y el tamaño de la muestra (enfermedad rara), así como también la recolección de datos a partir de historias clínicas. Creemos que el empleo de diferentes equipos de RM no ha tenido repercusión sobre los resultados, ya que ambas técnicas son similares. A su vez, tampoco consideramos que los diferentes detectores de los equipos de TC hayan tenido alguna influencia significativa sobre las características del realce de las lesiones o la densidad (ya que la comparación fue con la sustancia gris).
Tanto la RM como la TC son capaces de determinar las características del LPSNC. Sin embargo, hay que tener presente que en pacientes inmunodeprimidos existe una dificultad añadida: la distinción entre las lesiones por LPSNC y toxoplasmosis, dado que ambas pueden ser múltiples y tener realce en anillo30.
Actualmente, las técnicas de avanzada por RM (como la perfusión, espectroscopia o difusión) permiten establecer un diagnóstico más preciso, acortando el diagnóstico diferencial, sobre todo en lesiones con comportamiento atípico.
Respecto a las imágenes de RM por difusión, el grado de restricción a la difusión es directamente proporcional a la celularidad tisular (en la imagen potenciada por difusión, el LPSNC presenta una difusión restringida con un mapa de coeficiente de difusión aparente disminuido, más bajo que los valores de los gliomas de alto grado y las metástasis)31.
Por su parte, la perfusión por RM refleja la existencia de angiogénesis. El LPSNC, en el mapa del volumen sanguíneo cerebral relativo, presenta un valor de perfusión reducido en comparación con las neoplasias de alto grado o metástasis, pero es más elevado que el de los procesos infecciosos (por ejemplo, el de la toxoplasmosis)31.
La espectroscopia con RM es un método no invasivo que ofrece información metabólica sobre el cerebro. La mayoría de los LPNSC presentan un incremento en los picos de lípidos y lactato con una relación colina/creatina elevada (hallazgo que comparte con el glioblastoma multiforme y las metástasis, pero que ayuda a diferenciarlo de otras entidades)31.
Como hemos visto, el LPSNC en pacientes inmunodeprimidos puede presentar múltiples características por imágenes que sirven para establecer un rápido diagnóstico. Si bien hay que tener en cuenta que los pacientes VIH-positivo son significativamente más jóvenes, tienen un predominio importante de lesiones heterogéneas, menor número de lesiones, menor afectación del cuerpo calloso y menor afectación central que los pacientes inmunodeprimidos VIH-negativo. Es importante reconocer estas diferencias, ya que el manejo y tratamiento entre ambos grupos de pacientes es diferente.
ConclusionesPara el diagnóstico, la semiología radiológica más habitual en RM y TC de las lesiones en los pacientes inmunodeprimidos con afectación cerebral del LPSNC fue la forma unifocal, hipoisointensa en secuencias ponderadas en T1, hiperintensa en secuencias ponderadas en T2 e hipodensa en la TC, con realce intenso y heterogéneo tras la administración de contraste en ambas técnicas de imagen.
Existen diferencias significativas entre los pacientes VIH negativo y positivo. Dado que este último grupo es significativamente más joven, tiene menor afectación central y de las estructuras profundas.
Los autores declaran no tener ningún conflicto de intereses.