Objectives of training: The aim of this study is to propose an algorithm for the evaluation of adrenal lesions in order to arrive at the correct diagnosis in the shortest possible time.
This method would favor the most appropriate therapeutic procedures for each pathology and may substantially modified a given treatment. In spite of the fact that the structural features of lesions are generally non-specific, it is possible with imaging techniques, to establish compatible features which could help us differentiate benign from malignant lesions and with the contribution of the endocrinologist and the laboratory, to distinguish functional from non-functional ones.
Topic revision: A retrospective evaluation was carried out from May 2009 to December 2011 on 157 patients with adrenal diseases, including 95 females and 61 males, from 33 to 78 years of age (mean age 55). The study protocol consisted of non-contrasted intravenous computed tomography, with lesion density measurement, followed by contrasted intravenous computed tomography and wash out time with lesion density determination in portal time and later at 15' during wash out.
Measurements and calculations were: adrenal lesion size, medium density and absolute and relative washing percentiles. Magnetic resonance and 18F-fluorodesoxyglucose positron emission tomography was only performed on those patients who required these techniques. A comparison of the present results with those in the literature is included.
Imaging findings: Fifty-nine patients with non-functional adenoma were identified (49 unilateral and 10 bilateral), 29 functional adenomas, 9 with bilateral hyperplasia, 4 myelolipomas (2 in a female patient with simple virilizing congenital adrenal hyperplasia), 2 cysts, 2 hematomas, 3 lymphomas (2 secondary and 1 primary bilateral), 30 metastases, 5 adrenocortical carcinomas, 12 pheochromocytomas,1 malignant pheochromocytoma, and 1 ganglioneuroma.
Conclusion: The use of an appropriate study algorithm, with proper diagnostic tools, allows the correct characterization of adrenal lesions. Moreover, this approach prevents loss of time, a wrong diagnosis, excessive irradiation of the patient, and incorrect use of resources.
Objetivos de aprendizaje: El objetivo de este trabajo es proponer un algoritmo de estudio por imágenes de las lesiones suprarrenales que permita arribar a un diagnóstico correcto en el menor tiempo posible. Esto favorece la adopción de la conducta terapéutica más apropiada para cada patología y puede modificar en forma sustancial un tratamiento.
Aunque las características estructurales de las lesiones generalmente son inespecíficas, es posible, a través de las técnicas de imágenes actuales, diferenciar las lesiones compatibles con procesos benignos de las compatibles con procesos malignos y, con la colaboración del endocrinólogo y el laboratorio, también se pueden distinguir las lesiones funcionantes de las no funcionantes.
Revisión de tema: Se evaluaron en forma retrospectiva, entre mayo del 2009 y diciembre del 2011, 157 pacientes con patología suprarrenal. En total, eran 95 mujeres y 61 hombres, de 33 a 78 años (media: 55 años). El protocolo de estudio consistió en una tomografía computada (TC) sin contraste intravenoso (IV), con toma de la densidad de la lesión, seguida de una tomografía computada con contraste intravenoso y tiempo de lavado con toma de densidad de la lesión en tiempo portal y tardío a los 15 minutos (tiempo de lavado o wash-out).
Las mediciones y cálculos realizados fueron: tamaño de la lesión suprarrenal, densidad media de la misma durante las tres fases estudiadas y porcentajes de lavado relativo y absoluto. Se realizó resonancia magnética (RM) y tomografía computada por emisión de positrones con 18F-fluorodesoxiglucosa (FDG-PET/TC) sólo en aquellos pacientes que así lo requirieron. Además, se compararon los resultados con los de la literatura actualizada sobre el tema.
Hallazgos en imágenes: La conjunción de los datos clínicos, de laboratorio y las imágenes con el algoritmo propuesto permitió identificar 59 adenomas no funcionantes (49 unilaterales y 10 bilaterales), 29 adenomas funcionantes, 9 hiperplasias bilaterales, 4 mielolipomas (2 de ellos en una paciente con hiperplasia suprarrenal congénita virilizante simple), 2 quistes, 2 hematomas, 3 linfomas (2 secundarios y 1 primario bilateral), 30 metástasis, 5 carcinomas adrenocorticales, 12 feocromocitomas, 1 feocromocitoma maligno y 1 ganglioneuroma.
Conclusión: La utilización de un algoritmo de estudio adecuado, con las herramientas diagnósticas más apropiadas y accesibles, permite la correcta caracterización de las lesiones suprarrenales. A su vez, evita la pérdida de tiempo, el diagnóstico incorrecto, la irradiación excesiva del paciente y la mala utilización de los recursos.
Introducción
La identificación de una masa suprarrenal en las imágenes obtenidas mediante tomografía computada (TC) o ecografía es del 4-6% en la mayoría de las publicaciones sobre el tema. Luego de su reconocimiento, es necesario establecer los diagnósticos diferenciales y realizar la caracterización precisa de la masa, sin necesidad de recurrir a métodos cruentos1.
Las técnicas de imágenes que están a nuestro alcance en la actualidad nos permiten diferenciar una lesión compatible con benignidad de otra compatible con malignidad y, junto con el aporte del endocrinólogo y el laboratorio, es posible distinguir una lesión funcionante de una no funcionante.
Algunas lesiones pueden ser evidenciadas de inmediato por ciertas características. Por ejemplo, los mielolipomas por su baja densidad en la TC (en tanto presentan generalmente grasa macroscópica), los hematomas adrenales por la alta densidad en el estadio agudo e involución de su tamaño en los controles, o las lesiones quísticas porque en ellas se asocian características propias de su morfología, ausencia de incremento en los estudios con contraste intravenoso (IV), antecedentes clínicos, tipo de evolución y crecimiento de la lesión2.
Las dificultades diagnósticas se plantean con las lesiones más frecuentes. Es decir, con los incidentalomas, los adenomas no funcionantes, las metástasis y el no tan frecuente cáncer adrenocortical (CAC). En estos procesos, la utilización de un algoritmo de estudio permitiría orientar hacia una correcta identificación. Lograr diferenciar estas lesiones tiene profundas implicancias para el paciente en cuanto a su evolución y tratamiento2.
Objetivo
El objetivo de este trabajo es establecer un algoritmo de estudio por imágenes de las lesiones suprarrenales que permita arribar a un diagnóstico correcto (tomando como punto de partida las características imagenológicas asociadas al cuadro clínico y al laboratorio) y que posibilite la caracterización de la mayoría de las lesiones.
A través de su aplicación, se podría lograr un diagnóstico correcto en el menor tiempo posible, disminuir la irradiación del paciente, planificar el tratamiento y mejorar la utilización de los recursos.
Detalles del procedimiento
Se evaluaron en forma retrospectiva 157 pacientes con patología suprarrenal, estudiados entre mayo del 2009 y diciembre del 2011. El consentimiento informado fue firmado por todos los pacientes: 95 mujeres y 61 hombres, de 33 a 78 años (media: 55 años).
El principal método de examen fue la TC, utilizando en la mayoría un equipo marca Siemens Emotion de 16 canales, y en unos pocos casos se usó un tomógrafo espiralado. Se siguió un protocolo de estudio de glándulas suprarrenales (GS), que consistía en la realización de cortes sin contraste IV, con determinación de densidad y tamaño de la lesión.
Si la densidad de la lesión era mayor de 10 Unidades Hounsfield (UH), se continuaba con una serie dinámica luego de la administración de 100 ml de contraste yodado no iónico, a un flujo de 3 ml/s. La colimación utilizada fue de 1,5 a 2,5 mm3.
Se obtuvieron imágenes en tiempo portal (60 segundos) y tardío (15 minutos). Además, se midió la densidad de la lesión en tiempo portal y tardío (tiempo de lavado o wash-out) y se calculó el porcentaje de lavado relativo (PLR) y lavado absoluto (PLA), según las siguientes fórmulas:
— Porcentaje de lavado absoluto: ([atenuación en tiempo portal - atenuación en tiempo tardío] / [atenuación en tiempo portal - atenuación sin contraste]) × 1003
— Porcentaje de lavado relativo: ([atenuación en tiempo portal - atenuación en tiempo tardío] / atenuación en tiempo portal) × 100 3
La densidad de la lesión fue tomada con una región de interés circular (ROI), evitando colocar el ROI en zonas con calcificaciones, sangrado o necrosis. En unos pocos casos nos encontramos ante la dificultad de que las características de la lesión suprarrenal no coincidían con los parámetros descritos en la literatura, por lo que, para arribar al diagnóstico, se recurrió a la resonancia magnética (RM) o a la tomografía computada por emisión de positrones usando el análogo de la glucosa 18F-fluordesoxiglucosa (FDG-PET/ TC). Ésta constituye una importante herramienta tanto en el diagnóstico y diferenciación de la patología benigna y maligna de origen suprarrenal, como en la estadificación de las enfermedades neoplásicas suprarrenales pre y postratamiento.
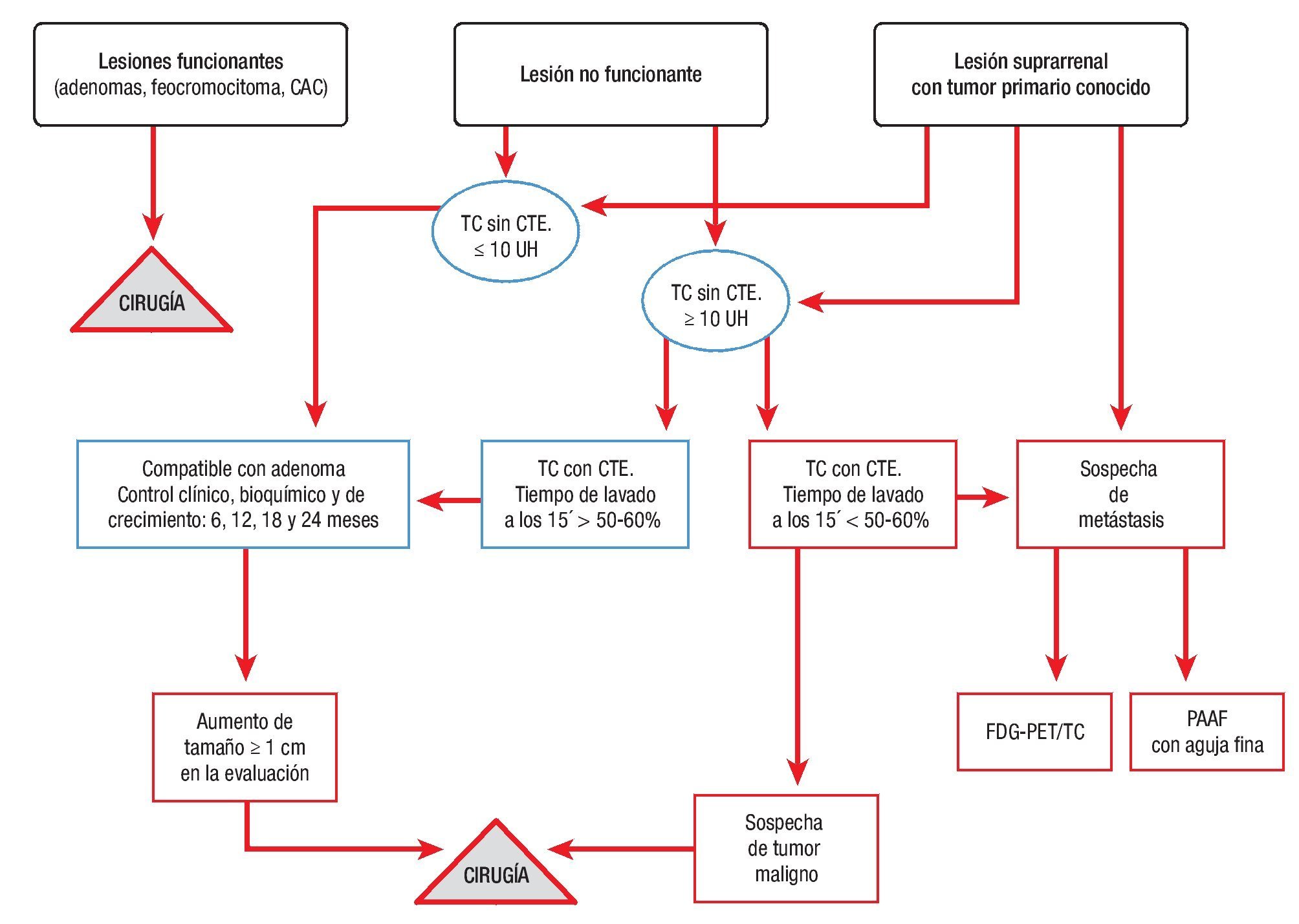
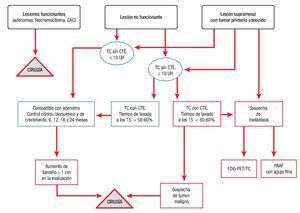
Cuando el algoritmo establecido lo indicó, se decidió la punción biopsia percutánea con aguja fina (PAAF) o la cirugía (fig. 1).
Figura 1. Algoritmo diagnóstico propuesto por los autores. CTE: contraste.
Resultados
En los 157 pacientes estudiados se identificaron: 59 adenomas no funcionantes (49 unilaterales y 10 bilaterales) y 29 funcionantes, 9 hiperplasias bilaterales, 4 mielolipomas (2 en una paciente con hiperplasia congénita virilizante simple), 2 quistes, 2 hematomas, 3 linfomas (2 secundarios y 1 primario bilateral), 30 metástasis, 5 carcinomas adrenocorticales, 12 feocromocitomas, 1 feocromocitoma maligno y 1 ganglioneuroma. El 54% correspondió a incidentalomas.
Todas las lesiones adenomatosas funcionantes, independientemente de su tamaño, fueron extirpadas quirúrgicamente, mientras que las hiperplasias suprarrenales recibieron tratamiento médico. En el caso de las lesiones no funcionantes con una densidad menor de 10 UH, se interpretaron como adenomas y su crecimiento fue evaluado a los 6, 12, 18 y 24 meses, sin requerir estudios contrastados.
En las lesiones con o sin calcificación periférica, que por su densidad y morfología podían corresponder a lesiones quísticas (densidad menor de 10 UH y mayor de -30 UH en la TC sin contraste), se realizó una RM (dado que son habitualmente hiperintensas en secuencias ponderadas en T2) o se completaron con una TC con tiempo de lavado (wash-out). La ausencia de impregnación en tiempo portal y tardío confirmó el diagnóstico.
En las formaciones no funcionantes con una densidad mayor de 10 UH en la TC no contrastada y un tamaño menor de 5 cm, se llevó a cabo el tiempo de lavado. Cuando el PLA resultó superior al 60% y el PLR excedió el 40%, se interpretaron como adenomas de bajo contenido graso y se llevó a cabo un control tomográfico sin contraste a los 6, 12, 18 y 24 meses para observar su crecimiento. En todos los pacientes se analizó el PLA y el PLR, sin encontrar diferencias significativas o contradictorias entre ambos.
Todas las lesiones con una densidad superior a las 10 UH en los cortes sin contraste, que en el tiempo de lavado presentaron un PLA inferior al 60% y un PLR menor del 40%, o que presentaron un tamaño mayor de 5 cm, fueron evaluadas como probables tumores primarios de la glándula suprarrenal o metástasis. La existencia de un tumor primario previo, presente en otra localización, determinó la utilización de la punción biopsia percutánea a fin de confirmar una metástasis, realizándose primero un examen clínico y de laboratorio para descartar un feocromocitoma. En un paciente se arribó, por este método, al diagnóstico de linfoma primario a células B bilateral.
Los feocromocitomas con laboratorio y clínica positivos tuvieron una resolución quirúrgica en todos los casos. En 4 carcinomas adrenocorticales, el diagnóstico fue tardío, ya que los pacientes presentaron metástasis a distancia en el momento del diagnóstico y no se realizó cirugía. En un solo caso el diagnóstico fue quirúrgico.
En una lesión con un tamaño de 6 cm × 3,6 cm se arribó al diagnóstico anatomopatológico con la resección quirúrgica de la lesión (ganglioneuroma).
Tanto en las lesiones probablemente secundarias como en las formaciones primarias se realizó, cuando lo requirieron, el estudio FDG-PET/TC.
A continuación describimos las características de la patología adrenal más frecuente.
Incidentalomas
El término incidentaloma adrenal (IA) se utiliza para definir a una masa clínicamente silente, que se descubre en forma casual en el transcurso de un examen por imágenes (por lo general, una ecografía o una TC), solicitado por un motivo ajeno a la patología adrenal, en ausencia de una neoplasia previa o una enfermedad adrenal conocida. Según Aron4, la definición excluye a los pacientes sometidos a pruebas de imágenes como parte de la estadificación o seguimiento de un cáncer. El 80% de los IA son lesiones benignas en pacientes que no tienen una historia conocida de cáncer2,5,6.
Con el creciente uso de las imágenes, su hallazgo ha aumentado, observándose en el 4-6% de la población estudiada2,6. Su prevalencia se incrementa con la edad y es aproximadamente de un 8% en las series de autopsias y de un 4% en las series radiológicas1,2.
Al evaluar un IA, nuestra meta debe ser diferenciar una lesión benigna de una maligna. Esto permite determinar el tratamiento, dado que éste será quirúrgico, por ejemplo, en el cáncer adrenal.
Existe un consenso dentro de la literatura que determina que todo IA requiere una exhaustiva evaluación clínica, hormonal y radiológica para descartar una lesión funcionante5. El examen físico y el análisis bioquímico deben realizarse para buscar un feocromocitoma, un Cushing subclínico y un aldosteronismo primario, así como también sirven para indagar casos menos frecuentes, como tumores productores de andrógenos y estrógenos.
Los IA catalogados como adenomas no funcionantes tendrán un seguimiento clínico y de imágenes para evaluar su crecimiento. En estos casos debe descartarse la existencia de una lesión primaria extraadrenal, ya que su hallazgo aumenta en forma sustancial las posibilidades de causa secundaria1,5.
Un 27% de pacientes oncológicos con lesión primaria extraadrenal tendrán metástasis adrenales microscópicas, mientras que en el 50% de los pacientes con cáncer la presencia de masas adrenales corresponderá a metástasis5.
Metodología diagnóstica en el incidentaloma adrenal
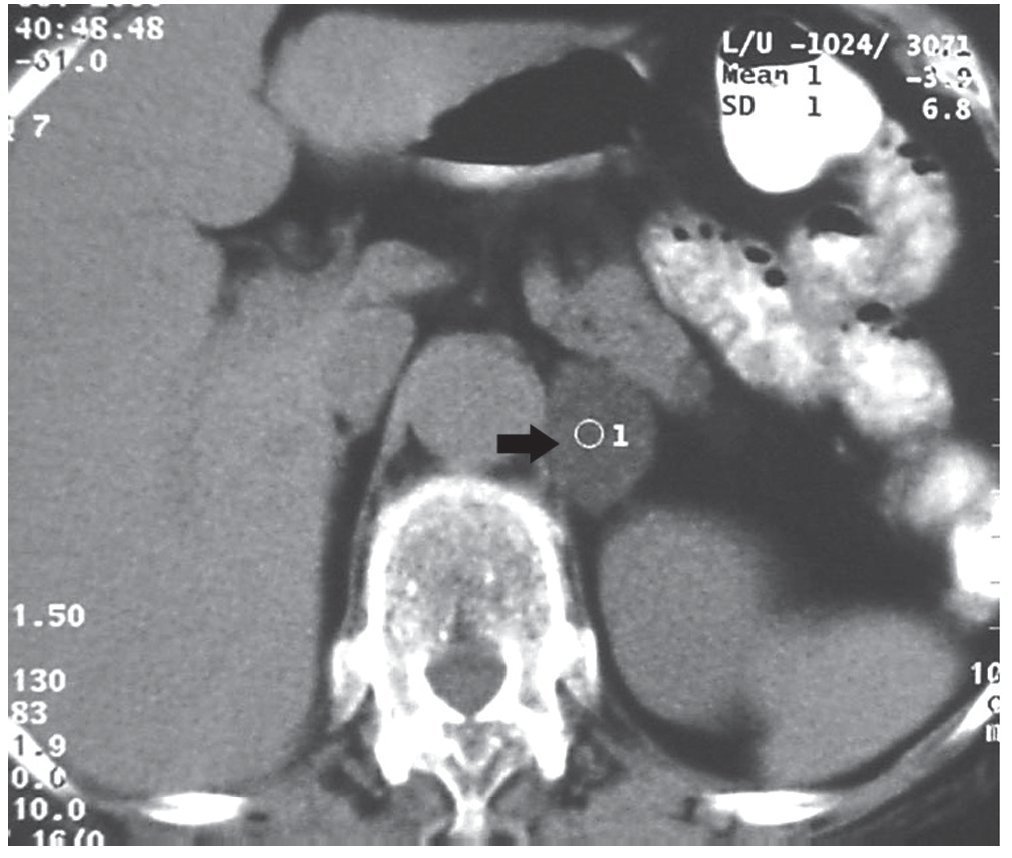
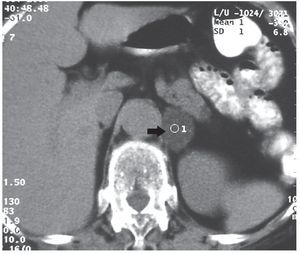
En todos los casos de IA, se realizó una TC siguiendo el protocolo de GS (es decir, la obtención de cortes sin contraste IV, con determinación de densidad y tamaño de la lesión). Las lesiones que presentaron un coeficiente de atenuación inferior o igual a 10 UH y mayor de -30 UH en los cortes sin contraste yodado fueron consideradas adenomas y tuvieron un seguimiento a los 6, 12, 18 y 24 meses para evaluar su crecimiento. No hubo necesidad de efectuar otros estudios (fig. 2).
Figura 2. Paciente de sexo femenino de 56 años con incidentaloma suprarrenal izquierdo. Su densidad en la TC sin contraste tuvo un valor de -3 UH y el diagnóstico fue una lesión compatible con un adenoma no funcionante. Esta se confirmó en el seguimiento de 24 meses.
Cuando la densidad de la lesión fue superior a 10 UH, se proseguió con una serie dinámica con la administración de 100 ml de contraste yodado3. En las imágenes obtenidas se midió la densidad de la lesión en tiempo portal (60 s) y tardío (15 min), y se calculó el PLA y el PLR3.
Las lesiones con densidad entre 10 y 20 UH fueron clasificadas como indeterminadas y se completaron con contraste, tomando el tiempo de lavado (wash-out), el PLA y el PLR (con las fórmulas establecidas). En todos los casos, se calcularon ambos porcentajes3,7,8.
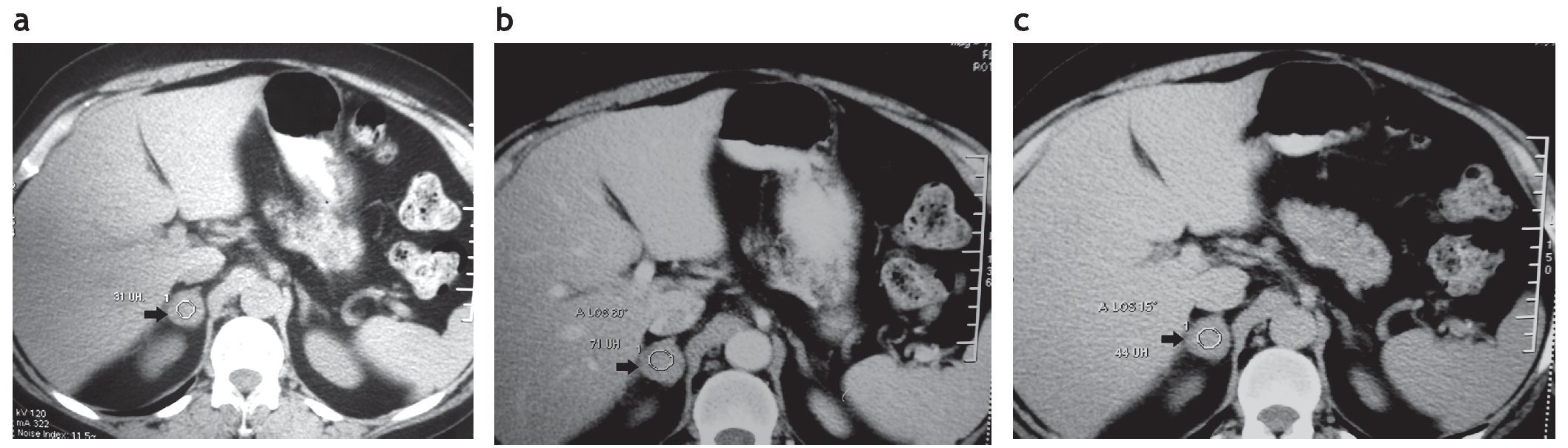
La lesión se diagnosticó como compatible con adenoma cuando el PLA era superior al 60% y el PLR mayor del 40% a los 15 minutos1,3,9,10. Las que lavaron un porcentaje inferior al 60% en el PLA y menor del 40% en el PLR fueron consideradas lesiones no adenomatosas (fig. 3).
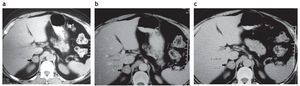
Figura 3. (a) Paciente de sexo femenino de 55 años. Hallazgo incidental de una lesión suprarrenal derecha de 31 UH en los cortes sin contraste IV. Ante la sospecha de una metástasis o lesión maligna se indicó tiempo de lavado. (b) En los cortes en tiempo portal la densidad de la lesión fue de 71 UH. (c) En el tiempo tardío (a los 15 minutos), la densidad fue de 44 UH, indicando un lavado inferior al 50%. Esto corroboró la impresión diagnóstica. Una TC de tórax indicada posteriormente evidenció una lesión pulmonar primaria, confirmada por PAAF como adenocarcinoma de pulmón. En su estatificación la FDG-PET/TC reveló una lesión hipermetabólica en la glándula suprarrenal derecha.
Las lesiones con densidad inferior a -30 UH se diagnosticaron como mielolipomas y su estudio se completó, cuando fue necesario, con una ecografía o una RM.
Un análisis de los resultados de los reportes publicados indican que el valor de 10 UH representa una óptima combinación de alta especificidad (96-98%) y moderada a alta sensibilidad (71-73%) en el diagnóstico del adenoma7.
Para determinar el tamaño de la lesión, se midió su diámetro mayor en los cortes axiales. Los pacientes que presentaban formaciones menores de 4 cm, no funcionantes, sin lesión neoplásica concomitante y que eran consideradas no adenomatosas en la TC sin contraste IV, tuvieron un seguimiento mediante TC sin contraste IV a los 6, 12, 18 y 24 meses para evaluar el crecimiento. Si no se observaba aumento de tamaño, las lesiones eran consideradas benignas, en coincidencia con otros autores1,11,12.
Adenomas
El adenoma es la lesión adrenal más frecuente. Se detecta en el 0,14 al 2% de las TC de abdomen de pacientes entre los 20 y 29 años, y en el 7 al 10% de las TC de pacientes mayores de 70 años13,14. De estas lesiones, el 94% son no funcionantes15.
No hay características morfológicas que permitan la categorización de los adenomas cuando son descubiertos, pero en su mayoría son pequeños, de bordes bien definidos y atenuación homogénea en las imágenes precontraste y en el 58% de las poscontraste.
A pesar de que el tamaño no es un signo definitorio de benignidad, la mayoría de las publicaciones ubican a los adenomas entre los 2-2,5 cm. Otras reportan algunos de hasta 6 cm16,17.
Los adenomas son de crecimiento lento, pero no debe olvidarse que en casos excepcionales pueden sufrir un aumento abrupto de tamaño por el estímulo de niveles elevados de hormona adrenocorticotrófica (ACTH) o a causa de una hemorragia. En pacientes con adenomas y terapia anti-coagulante concomitante, se ha observado una hemorragia que produce heterogeneidad y aumento del tamaño del adenoma y que se correlaciona con los hallazgos patológicos16.
El 70% de los adenomas suprarrenales contiene grasa intracelular (colesterol, ácidos grasos y grasa neutra) en contraste con las lesiones malignas, lo cual determina que en la TC no contrastada su densidad sea menor que la de los tumores primarios y metástasis8,13.
Lee et al.8 fueron los primeros en diferenciar imágenes compatibles con adenomas de lesiones no adenomatosas en la TC sin contraste: mientras en las primeras la atenuación media era de -2,2 UH, en las lesiones no adenomatosas alcanzaba las 28,9 UH18.
Un metaanálisis publicado a posteriori demostró que, si el umbral de atenuación era de 10 UH, la sensibilidad aumentaba al 71% y la especificidad se conservaba en un 98%13.
Las lesiones con una atenuación mayor de 10 UH en la TC no contrastada (indeterminadas) requieren que se realice una TC con contraste y tiempo de lavado (wash-out)1,3,5,8.
Caoili et al.3 demostraron que, independientemente de su contenido graso, los adenomas mostraban un tiempo de lavado rápido, un PLA de más del 60% y un PLR en cortes tardíos superior al 40%, a diferencia de los tumores y metástasis6,10,18,19.
Utilidad de la resonancia magnética y tomografía computada por emisión de positrones con 18F-fluorodesoxiglucosa en el diagnóstico diferencial
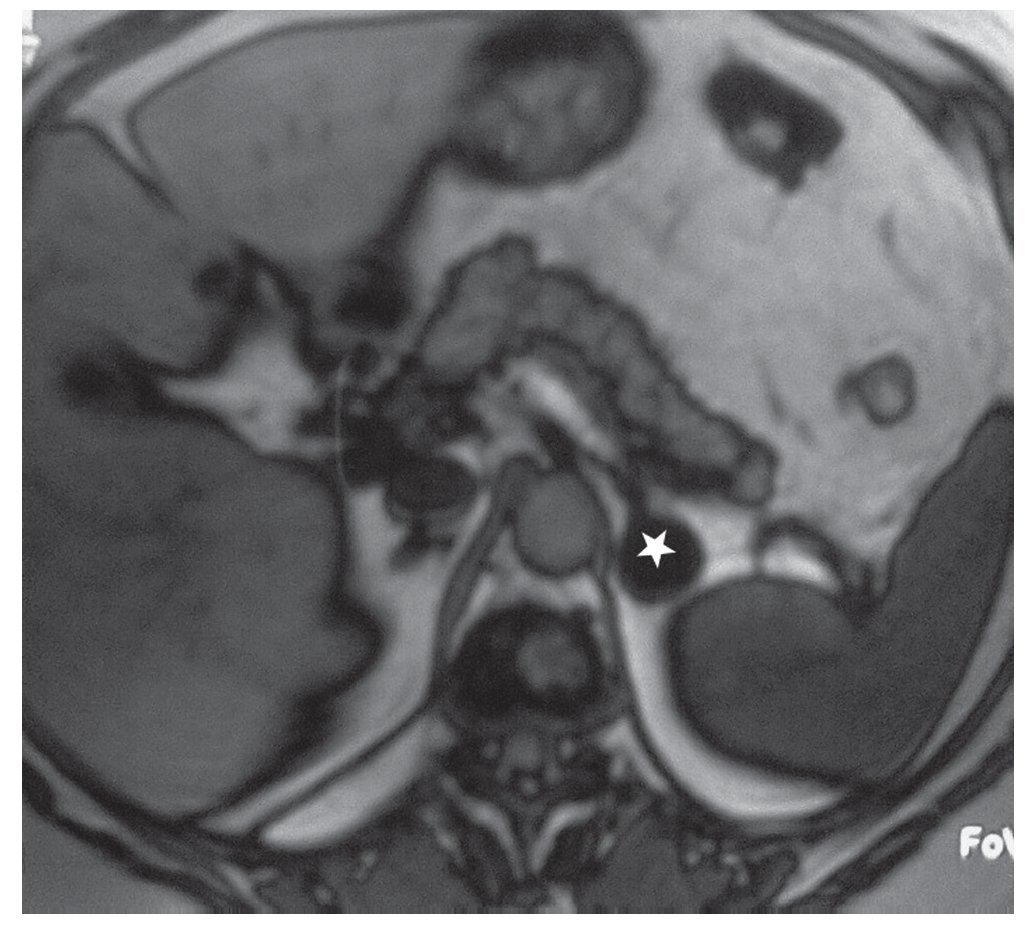
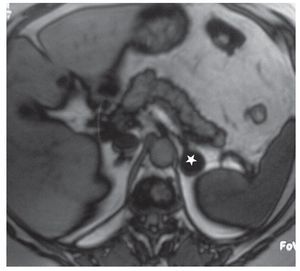
Los adenomas con grasa intracitoplasmática muestran una pérdida de intensidad de señal en la RM en secuencia de desplazamiento químico (chemical shift) fuera de fase, en comparación con las imágenes en fase. Una pérdida de señal mayor del 20% es considerada diagnóstica de adenoma (fig. 4)15,20,21.
Figura 4. Paciente de sexo masculino de 60 años con una lesión en la glándula suprarrenal izquierda, hipointensa con respecto al bazo en la RM, secuencia de desplazamiento químico, fuera de fase. Resultó compatible con adenoma de alto contenido graso.
Los adenomas pobres en grasa intracitoplasmática representan entre el 10 y el 40%. Esto implica que un importante número de incidentalomas no puede ser diferenciado de las metástasis, tumores primarios u otras patologías carentes de grasa intracitoplasmática con la técnica de desplazamiento químico fuera de fase15.
Cuando la lesión no puede ser caracterizada con la TC con tiempo de lavado o la RM, la conducta a seguir depende del tamaño de la lesión: en nuestro estudio, se consideraron quirúrgicas aquellas lesiones mayores de 4 ó 5 cm, con características no adenomatosas en la TC y RM.
El examen FDG-PET/TC permite detectar un incremento en la actividad metabólica de una lesión suprarrenal, la cual muchas veces aparece indeterminada en la TC y RM1,2,15.
En los equipos híbridos, la TC provee una mayor resolución espacial y de contraste, permitiendo una mejor localización anatómica del tumor y medición de su densidad. De esta manera, la utilización del estudio FDG-PET/TC combina las posibilidades diagnósticas de ambos métodos3,7,15.
Si la clínica indica la posibilidad de un feocromocitoma y el laboratorio no es contundente, se puede completar el estudio con una centellografía y el FDG-PET/TC, ya que estos tumores son altamente hipermetabólicos15,22.
En los adenomas puede encontrarse una actividad metabólica mínima, similar a la del hígado. Cuando la avidez por la FDG supera la hepática y la lesión es indeterminada en la TC, o bien el paciente presenta un tumor primario conocido, se descarta el diagnóstico de adenoma. Se han reportado falsos positivos moderados y algunos investigadores sugieren que esto depende del estado funcional del adenoma o de su bajo contenido en grasa.
Otras lesiones en las que se indica el estudio FDG-PET/TC son las que se comportan como no adenomatosas en la TC y RM, y se acompañan con un cuadro clínico y de laboratorio de enfermedad linfoproliferativa. Este examen puede ser diagnóstico en casos de linfoma secundario y se utiliza para su evaluación postratamiento.
La presencia de una lesión primaria en otro órgano y una lesión no adenomatosa en la o las glándulas suprarrenales también es indicación de FDG-PET/TC para corroborar o descartar el diagnóstico de metástasis y realizar la estadificación de la lesión primaria18,23,24.
Un tumor de colisión (coexistencia de mielolipoma con metástasis o metástasis y adenoma) es difícil de diagnosticar sólo por TC. En pacientes con antecedentes de neoplasia maligna, la utilización del estudio FDG-PET/TC ayuda al reconocimiento de la lesión metastásica adrenal en tanto presenta marcada avidez por la FDG12,24.
Lesiones benignas asociadas a hiperfunción o insuficiencia suprarrenal
Síndrome de Cushing
El síndrome de Cushing de origen adrenal es causado en la mayoría de los casos por adenomas que miden de 2 a 4 cm. Una lesión mayor de 4 cm y con necrosis central es sugestiva de adenocarcinoma.
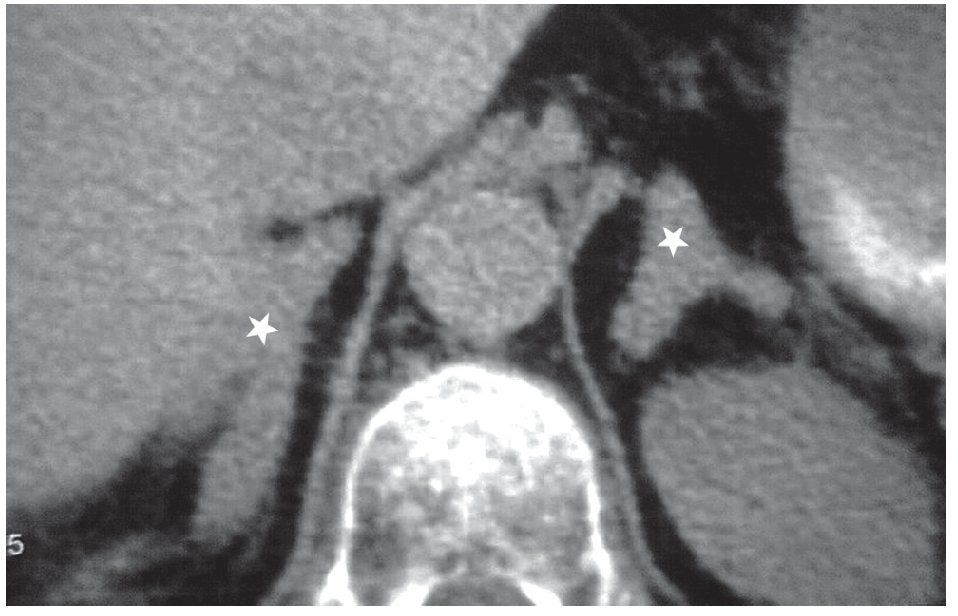
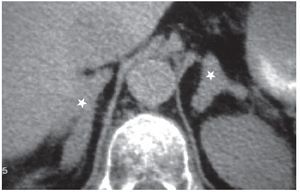
En la enfermedad de Cushing la causa más común del síndrome de Cushing endógeno es la producida por el exceso de ACTH de origen hipofisario. Dado que existe hiperplasia suprarrenal bilateral, ambas glándulas se encuentran aumentadas de tamaño en forma difusa y uniforme (fig. 5). En algunas ocasiones se observa agrandamiento macronodular bilateral.
Figura 5. Hiperplasia suprarrenal bilateral en una enfermedad de Cushing.
En las enfermedades crónicas la glándula puede tomar aspecto nodular, lo cual se conoce como hiperplasia multinodular. A pesar de que estas lesiones son ACTH dependientes, a veces pueden llegar a adquirir autonomía. En este caso, la entidad se denomina hiperplasia macronodular masiva.
Además, otra causa del síndrome de Cushing ACTH-dependiente son las neoplasias productoras de ACTH ectópicas, que por lo general provienen del pulmón o mediastino, incluyendo el carcinoma de células pequeñas (oat cell) y el carcinoide bronquial o tímico, entre otros. La TC de tórax es una herramienta muy útil para la localización de estas lesiones, junto con la confirmación previa de los productos de cosecreción correspondientes22,25,26.
Síndrome de Conn
El síndrome de Conn (o hiperaldosteronismo primario) es el resultado de un exceso en la producción de aldosterona. Clásicamente es causado por adenomas en el 80% de los casos o por una hiperplasia suprarrenal bilateral en el 20%. Esta última, sin embargo, ha incrementado su frecuencia en los últimos años. Ello ocurre especialmente si se considera que, aunque el cuadro originalmente descrito presentaba hipertensión e hipokalemia, también puede tener normokalemia27.
Los adenomas pueden ser vistos en la TC en un 70% de los casos. En revisiones recientes los aldosteronomas detectados por TC presentaron un diámetro promedio menor de 2 cm, por lo que, cuando se sospecha este síndrome, la tomografía debe ser realizada con reconstrucciones de menos de 5 mm.
En la TC sin contraste el adenoma se identifica como una lesión nodular hipodensa, mientras que en la serie con contraste no presenta ninguna diferencia con el adenoma no funcionante23.
La hiperplasia de las glándulas adrenales puede tener un aspecto normal, nodular y a veces multinodular. Una o ambas glándulas pueden estar agrandadas y, en estos casos, está indicado el tratamiento médico.
Cuando la TC revela ambas glándulas normales, nódulos bilaterales o unilaterales, con evidencia de hiperplasia asociada, debe correlacionarse con estudios funcionales de laboratorio para caracterizar la enfermedad23,27.
Virilización y feminización de causa adrenal
Los tumores adrenales corticales benignos o malignos causan en ocasiones virilización y, más raramente, feminización. Los benignos miden entre 2 y 6 cm de diámetro y presentan una apariencia homogénea, mientras que los carcinomas tienden a ser más grandes y heterogéneos26.
Enfermedad de Addison o insuficiencia suprarrenal primaria
La enfermedad de Addison es una insuficiencia suprarrenal primaria que puede manifestarse en forma aguda o crónica.
La enfermedad aguda es rara y puede ser el resultado de una hemorragia adrenal bilateral (apoplejía), debida por lo general a un shock severo y sepsis, y a veces a diátesis hemorrágica28,29.
Los hematomas traumáticos bilaterales en ocasiones causan una insuficiencia suprarrenal que se manifiesta semanas después del trauma. La demostración de hematomas adrenales bilaterales en la TC puede ser el primer indicio para el diagnóstico, ya que las manifestaciones clínicas no son específicas. En este sentido, el rol de la TC es crítico pues revela un aumento de tamaño de ambas glándulas suprarrenales, con centro necrótico y realce en anillo con contraste.
En el caso de las masas adrenales bilaterales, si los estudios complementarios descartan otra patología, se puede llevar a cabo la punción biopsia guiada con TC para establecer la causa del proceso, el cual podría corresponder a una adrenalitis secundaria a tuberculosis (TBC), histoplasmosis, otra infección fúngica o linfoma adrenal bilateral primario. Desde esta perspectiva, es importante destacar que, antes de realizar el procedimiento, siempre debe descartarse la presencia de un feocromocitoma.
Si bien la TC aporta poca información en el caso de pacientes con enfermedad de Addison crónica en relación con las formas agudas, en ciertos casos puede sugerir la causa de la enfermedad.
La atrofia idiopática glandular por probable desorden autoinmune es la causa más frecuente de la enfermedad de Addison, seguida en la literatura internacional por la infección granulomatosa tuberculosa y la histoplasmosis. En nuestro medio, sin embargo, la TBC es la causa prevalente.
Los hallazgos tomográficos en el Addison idiopático incluyen afección bilateral con glándulas pequeñas, atróficas y sin calcificaciones.
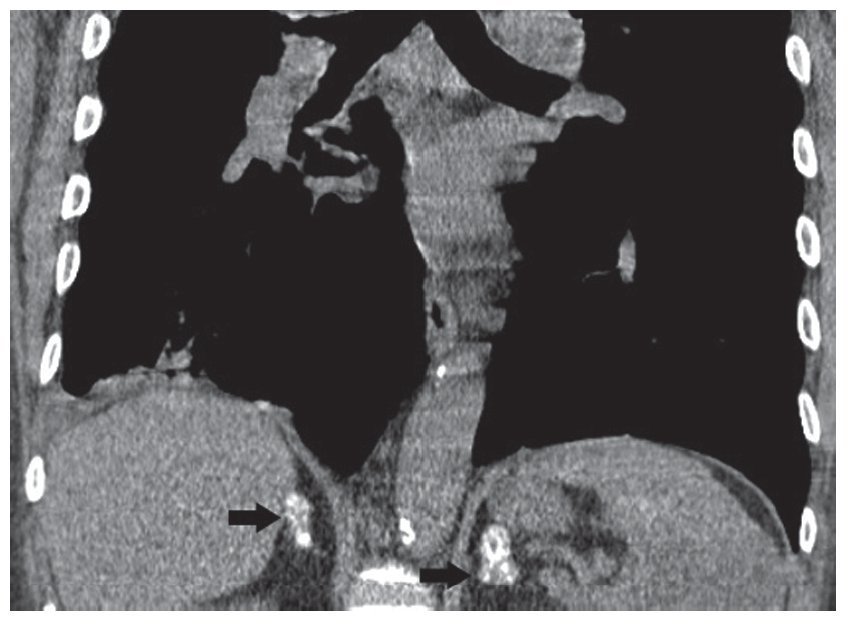
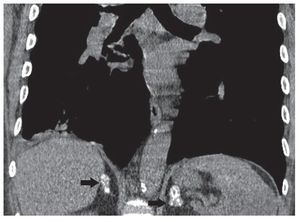
Las calcificaciones están presentes en un 50% de los pacientes con Addison secundario a TBC. No obstante, las calcificaciones adrenales bilaterales no son patognomónicas de la infección granulomatosa previa y resultan indistinguibles de las calcificaciones idiopáticas y de las causadas por hemorragia adrenal previa (fig. 6)7.
Figura 6. Calcificaciones suprarrenales bilaterales en un paciente asintomático.
La correlación clínica y hormonal es esencial debido a que hay glándulas suprarrenales con calcificaciones irregulares que pueden tener la función conservada. La presencia de calcificaciones por sí sola no implica compromiso de la función adrenal2,18,19.
Continúa en: Rev. Argent. Radiol. 2013;77(4).
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Recibido octubre de 2012;
aceptado julio de 2013
* Autor para correspondencia.
Correo electrónico:bindadavila@hotmail.com (M.C. Binda).