Considerar el diagnóstico de sarcoidosis y reacción sarcoid-like en pacientes oncológicos controlados por tomografía computada por emisión de positrones (PET/TC), que presentan adenopatías hiliomediastinales hipercaptantes, para evitar errores diagnósticos.
Materiales y métodosSe analizaron retrospectivamente 18 estudios PET/TC realizados durante 3 años a pacientes con tumores sólidos y linfoma, que presentaron adenopatías hiliomediastinales hipermetabólicas. El patrón morfológico, la distribución y, en algunos casos, la asociación con nódulos pulmonares permitieron plantear como diagnóstico diferencial la sarcoidosis.
ResultadosLas enfermedades oncológicas correspondieron a mama (n=4), próstata (n=3), ovario (n=2) y otros (n=9). En 9 pacientes se obtuvo la confirmación histopatológica. En 7 de los 18 pacientes, las adenopatías fueron catalogadas como benignas por confirmación histológica de sarcoidosis, antracosis o reacción sarcoid-like. En 5 el comportamiento evolutivo fue compatible con benignidad, en 2 la biopsia mostró secundarismo y en los 4 restantes la evolución demostró malignidad. El total de lesiones benignas fue de 12 (66%).
DiscusiónEl hallazgo de adenopatías hiliomediastinales hipermetabólicas con patrón morfológico y de distribución que orientan a sarcoidosis lleva a plantear esta entidad. En pacientes oncológicos, se requiere biopsia para descartar recaída. El uso de nuevos marcadores PET/TC para un diagnóstico diferencial representa un desafío. Los trazadores de síntesis de aminoácidos, como la 18F-fluorotimidina (FLT) y 18F-fluorometiltirosina (FMT), han demostrado ser útiles en la diferenciación entre malignidad y enfermedades granulomatosas.
ConclusiónEn estudios PET/TC de pacientes oncológicos, la presencia de adenopatías hiliomediastinales bilaterales y simétricas debe plantear sarcoidosis como diagnóstico diferencial.
To describe the radiological findings of sarcoidosis or sarcoid-like reactions in cancer patients being monitored by positron emission computed tomography (PET/CT).
Materials and methodsA retrospective analysis was performed on 18 PET/CT studies performed over 3 years in patients with lymphomas and solid tumours who presented with hypermetabolic hiliar-mediastinal adenopathies. The morphological pattern of these adenopathies, the distribution, and in some cases the association with pulmonary nodules, might suggest sarcoidosis as a differential diagnosis.
ResultsOncological diseases corresponded to breast (4), prostate (3), ovary (2), and others (9). The adenopathies were classified in 7 of the 18 patients as benign after histological confirmation of sarcoidosis, anthracosis or sarcoid-like reaction. The evolutionary behaviour in 5 patients was compatible with benign lesions. The biopsy of 2 patients indicated secondary lesions and malignancy was confirmed by the evolution of the 4 remaining cases. There was a total of 12 (66%) benign lesions.
DiscussionSarcoidosis must be suspected in the presence of hypermetabolic hiliar-mediastinal adenopathies with a characteristic morphological pattern and pulmonary changes. However, biopsy is required to rule out oncological recurrence. The use of new PET/CT markers for differential diagnosis represents a challenge. Aminoacid synthesis tracers such as 18F-fluorothymidine (FLT) and 18F-fluoromethyltyrosine (FMT) are useful in the differentiation between malignancy and granulomatous diseases in oncologic patients.
ConclusionThe differential diagnosis of sarcoidosis should be considered in the presence of bilateral symmetric mediastinal hilum lymphadenopathies.
La asociación entre cáncer y sarcoidosis es conocida. Implica la presencia simultánea o diferida de ambas entidades y está descrita fundamentalmente en pacientes con linfoma, melanoma y tumores en mama, pulmón o testículo. Ambas patologías requieren un manejo terapéutico diferente, por lo que es necesario un diagnóstico preciso1–3.
Además, se ha descrito después de la quimioterapia (QT) una reacción sarcoid-like de histología similar a la sarcoidosis, presente en los ganglios linfáticos de drenaje y/o a distancia4,5.
El objetivo del presente trabajo es considerar el diagnóstico de sarcoidosis y la reacción sarcoid-like en pacientes oncológicos, controlados con tomografía computada por emisión de positrones (PET/TC), que presentan adenopatías hiliomediastinales hipercaptantes para evitar errores diagnósticos.
Materiales y métodosTodos los pacientes autorizaron el estudio y la utilización de las imágenes mediante un consentimiento informado.
Selección de estudiosSe analizaron retrospectivamente 15 estudios PET/TC con 18-fluorodesoxiglucosa (18F-FDG) y 3 estudios PET/TC con 11C-colina, realizados durante tres años a pacientes con tumores sólidos y linfoma que presentaban adenopatías hiliomediastinales hipermetabólicas con un patrón morfológico y de distribución que permitió establecer como primer diagnóstico la sarcoidosis (no planteada hasta ese momento).
La búsqueda se realizó a través de la base de datos de nuestra institución y se acotó al período de tiempo mencionado con las palabras clave “sarcoidosis” y “granulomatosis”.
Se descartaron los estudios de pacientes con sarcoidosis ya diagnosticada.
Adquisición de las imágenesSe utilizaron dos equipos híbridos PET/TC GE (STE Discovery y 690 Discovery de 16 y 64 cortes, respectivamente). Todos los pacientes cumplieron al menos 6 horas de ayuno antes del estudio y, tras la determinación de la glicemia capilar, se les inyectó 4 mBq/kg de fluorodesoxiglucosa intravenosa.
Se obtuvieron imágenes de PET 60 minutos después de la inyección, en combinación con una tomografía computada (TC), según el protocolo whole body (base de cráneo/tercio medio diáfisis femoral). No se administró contraste oral ni intravenoso.
En los pacientes en los que había duda de afectación del parénquima pulmonar, se realizó, además, una TC de tórax en inspiración.
Análisis de las imágenesLas imágenes fueron evaluadas en monitores GE Advantage 4.5 y 4.6. La revisión de los estudios mediante análisis cualitativo y semicuantitativo (Standard Uptake Value [SUV máx]) fue realizada por dos médicos (especialistas en Medicina nuclear y en Radiología).
Se constataron las adenopatías y su topografía, el valor de SUV máx y los hallazgos en el parénquima pulmonar y los extratorácicos, correlacionándolos con la histología. En los casos en los que no se realizó biopsia se correlacionó con la evolución clínica (ausencia de progresión oncológica) y control imagenológico por un período de 3 años (TC y PET/TC). Los datos fueron ingresados en una planilla Excel®, en la que se consignó edad, sexo, motivo de realización del PET, radiotrazador, topografía de las adenopatías, SUV máx, alteraciones pulmonares y extratorácicas, tiempo desde el inicio de la QT hasta la realización del examen PET, resultado de biopsia y seguimiento.
ResultadosDe los 18 pacientes, 11 eran mujeres y 7 eran hombres, con edades entre los 32 y los 80 años (promedio: 54,1). Las patologías oncológicas se encontraban en la mama (n=4), la próstata (n=3), el ovario (n=2) y otros lugares (n=9; linfoma no Hodgkin, seminoma y cáncer broncopulmonar, gástrico y en cérvix, recto, amígdala, tiroides y riñón).
Del total, 10 pacientes estaban en tratamiento quimiotérapico. Las adenopatías hiliomediastinales eran bilaterales y simétricas en 15 casos, asimétricas en un caso y solo hiliares bilaterales en otro caso. El SUV máx de las adenopatías varió entre 2,6 y 23,5 (mediana de 6,7).
En cuanto a los hallazgos pulmonares, en 5 pacientes se encontraron micronódulos y en 4 nódulos mayores de 7mm (3 hipercaptantes). En los tres pacientes en los que se planteó una probable sarcoidosis pulmonar, se determinó un secundarismo confirmado por biopsia o evolución. En un paciente se identificaron elementos compatibles con fibrosis pulmonar y en los 8 restantes no se detectaron alteraciones pulmonares.
En nuestra serie, se realizó biopsia ganglionar en 9 casos. En 7 pacientes de la muestra las adenopatías fueron catalogadas como benignas por el estudio PET/TC con confirmación histológica de sarcoidosis, antracosis o reacción sarcoid-like. En 5 de los 18, el comportamiento evolutivo fue compatible con benignidad. En 2 casos en los que se había planteado probable sarcoidosis la biopsia mostró secundarismo y en los 4 restantes la evolución reveló malignidad. El 66% de los casos (12 pacientes) correspondió a lesiones benignas.
Como hallazgos extratorácicos vinculados a la enfermedad oncológica se observaron recaída local (n=3), adenopatías regionales (n=2) e implante peritoneal (n=1).
Todos los resultados se resumen en la tabla 1 e ilustramos los hallazgos en tres pacientes de la serie donde el PET/TC orientó al diagnóstico de sarcoidosis (figs. 1-3).
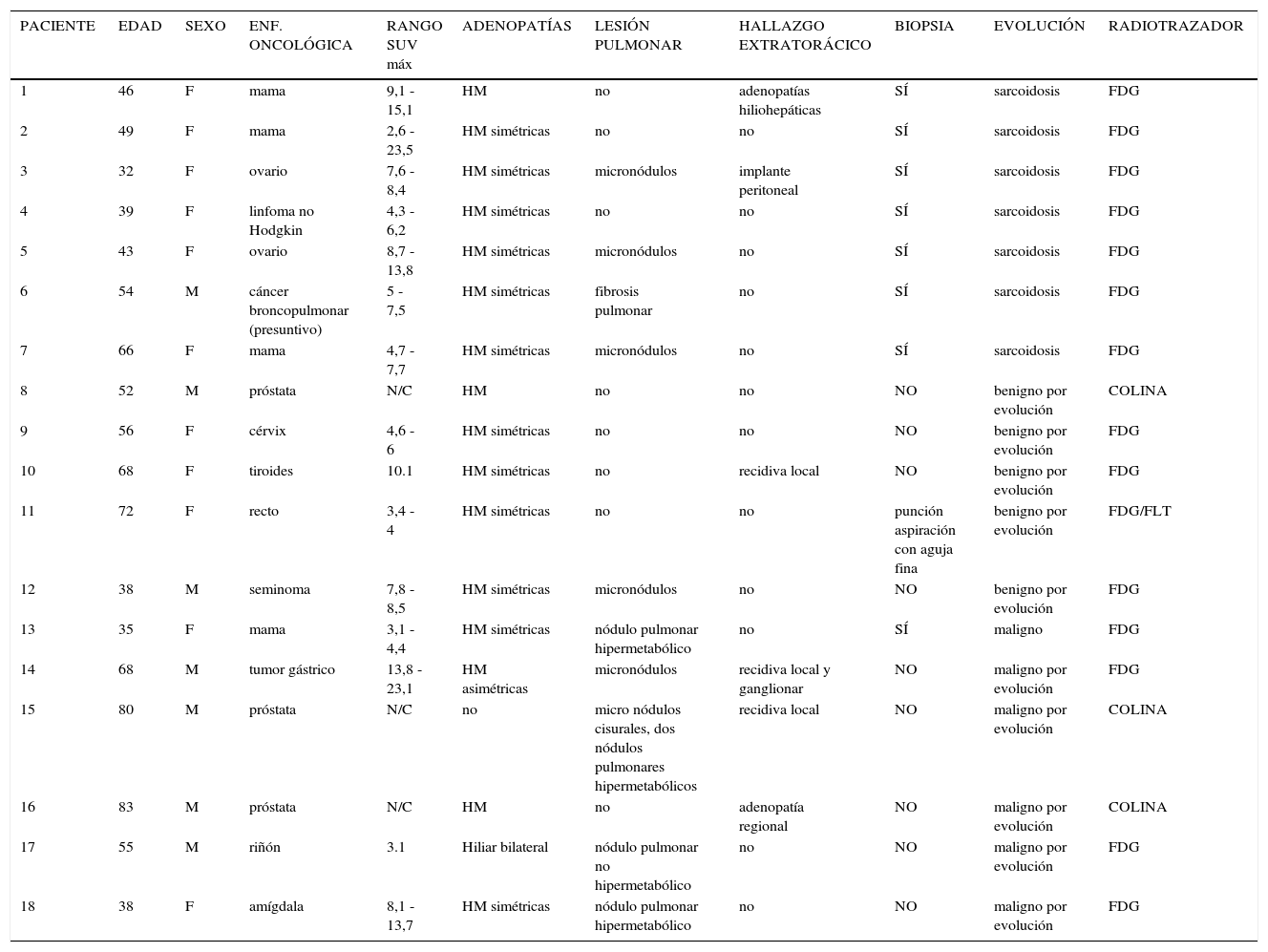
Características, diagnósticos y hallazgos de los pacientes
| PACIENTE | EDAD | SEXO | ENF. ONCOLÓGICA | RANGO SUV máx | ADENOPATÍAS | LESIÓN PULMONAR | HALLAZGO EXTRATORÁCICO | BIOPSIA | EVOLUCIÓN | RADIOTRAZADOR |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 46 | F | mama | 9,1 - 15,1 | HM | no | adenopatías hiliohepáticas | SÍ | sarcoidosis | FDG |
| 2 | 49 | F | mama | 2,6 -23,5 | HM simétricas | no | no | SÍ | sarcoidosis | FDG |
| 3 | 32 | F | ovario | 7,6 - 8,4 | HM simétricas | micronódulos | implante peritoneal | SÍ | sarcoidosis | FDG |
| 4 | 39 | F | linfoma no Hodgkin | 4,3 - 6,2 | HM simétricas | no | no | SÍ | sarcoidosis | FDG |
| 5 | 43 | F | ovario | 8,7 - 13,8 | HM simétricas | micronódulos | no | SÍ | sarcoidosis | FDG |
| 6 | 54 | M | cáncer broncopulmonar (presuntivo) | 5 - 7,5 | HM simétricas | fibrosis pulmonar | no | SÍ | sarcoidosis | FDG |
| 7 | 66 | F | mama | 4,7 - 7,7 | HM simétricas | micronódulos | no | SÍ | sarcoidosis | FDG |
| 8 | 52 | M | próstata | N/C | HM | no | no | NO | benigno por evolución | COLINA |
| 9 | 56 | F | cérvix | 4,6 - 6 | HM simétricas | no | no | NO | benigno por evolución | FDG |
| 10 | 68 | F | tiroides | 10.1 | HM simétricas | no | recidiva local | NO | benigno por evolución | FDG |
| 11 | 72 | F | recto | 3,4 - 4 | HM simétricas | no | no | punción aspiración con aguja fina | benigno por evolución | FDG/FLT |
| 12 | 38 | M | seminoma | 7,8 - 8,5 | HM simétricas | micronódulos | no | NO | benigno por evolución | FDG |
| 13 | 35 | F | mama | 3,1 - 4,4 | HM simétricas | nódulo pulmonar hipermetabólico | no | SÍ | maligno | FDG |
| 14 | 68 | M | tumor gástrico | 13,8 - 23,1 | HM asimétricas | micronódulos | recidiva local y ganglionar | NO | maligno por evolución | FDG |
| 15 | 80 | M | próstata | N/C | no | micro nódulos cisurales, dos nódulos pulmonares hipermetabólicos | recidiva local | NO | maligno por evolución | COLINA |
| 16 | 83 | M | próstata | N/C | HM | no | adenopatía regional | NO | maligno por evolución | COLINA |
| 17 | 55 | M | riñón | 3.1 | Hiliar bilateral | nódulo pulmonar no hipermetabólico | no | NO | maligno por evolución | FDG |
| 18 | 38 | F | amígdala | 8,1 - 13,7 | HM simétricas | nódulo pulmonar hipermetabólico | no | NO | maligno por evolución | FDG |
M: masculino; F: femenino; HM: hiliomediastinal; FDG: fluorodesoxiglucosa; FLT: fluorotimidina.
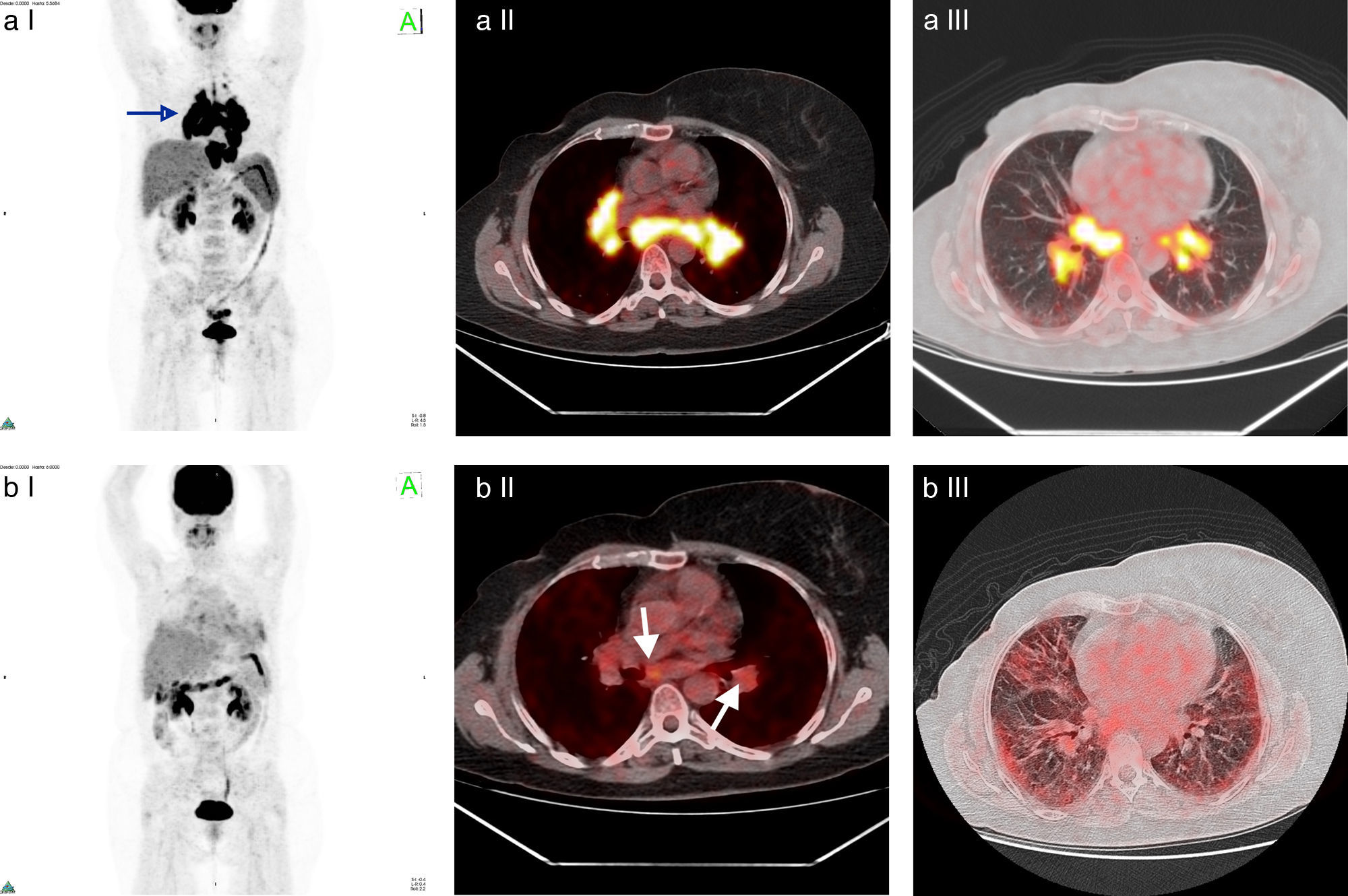
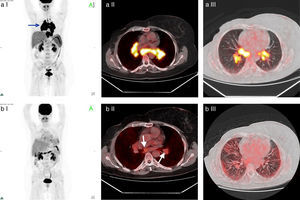
Paciente número 2: mujer de 49 años con diagnóstico de cáncer de mama derecha Her 2+, que recibió QT (trastuzumab) y radioterapia (RT) adyuvante. En la TC de control se encontraron adenomegalias hiliomediastinales, por lo que se solicitó su estudio por PET/TC. El examen mostró hipermetabolismo con SUV máx entre 2,6 y 23,5. Se sugirió diagnóstico diferencial de sarcoidosis, la cual fue confirmada por biopsia a través de mediastinoscopia. Se realizó tratamiento con corticoides, con disminución de las adenomegalias. En un nuevo control por TC se constató aumento de las adenomegalias y la repetición del examen PET/TC reveló una disminución de la captación en las adenopatías, pero identificó la aparición de compromiso pulmonar de tipo intersticial hipermetabólico. Se estableció compromiso inflamatorio pulmonar y se instauró un nuevo tratamiento con corticoides. (a) I: Imagen en proyección de máxima intensidad con aumento de captación hiliomediastinal bilateral y simétrico; II: fusión ventana de mediastino; III: fusión ventana de pulmón. (b) I: Imagen en proyección de máxima intensidad postratamiento; II: fusión ventana de mediastino; III: fusión ventana de pulmón, lesiones hipermetabólicas pulmonares.
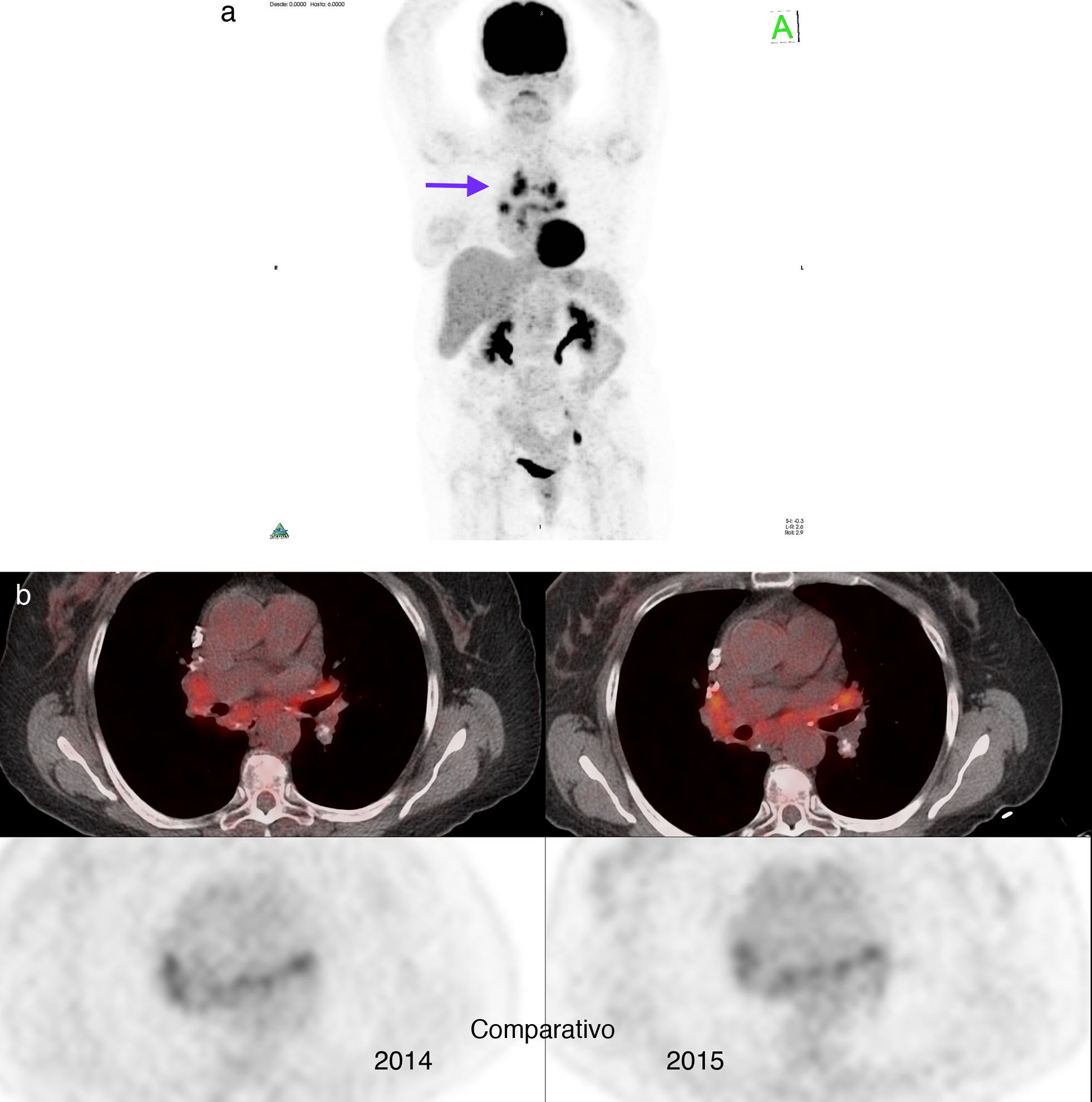
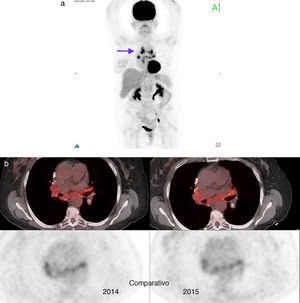
Paciente número 7: mujer de 66 años con cáncer mucinoso de mama derecha con cirugía conservadora, ganglio centinela negativo y adyuvancia con RT y QT en base a vinorelbina y trastuzumab. En la TC de control se evidenciaron adenomegalias hiliomediastinales, por lo que se solicitó el estudio PET/TC, que demostró hipermetabolismo (SUV máx entre 4,7 y 7,7) (flecha). Se planteó diagnóstico diferencial con sarcoidosis, la cual fue confirmada por biopsia a través de mediastinoscopia. (a) Imagen en proyección de máxima intensidad inicial y (b) estabilidad pre y posquimioterapia (imágenes de fusión–comparativo).
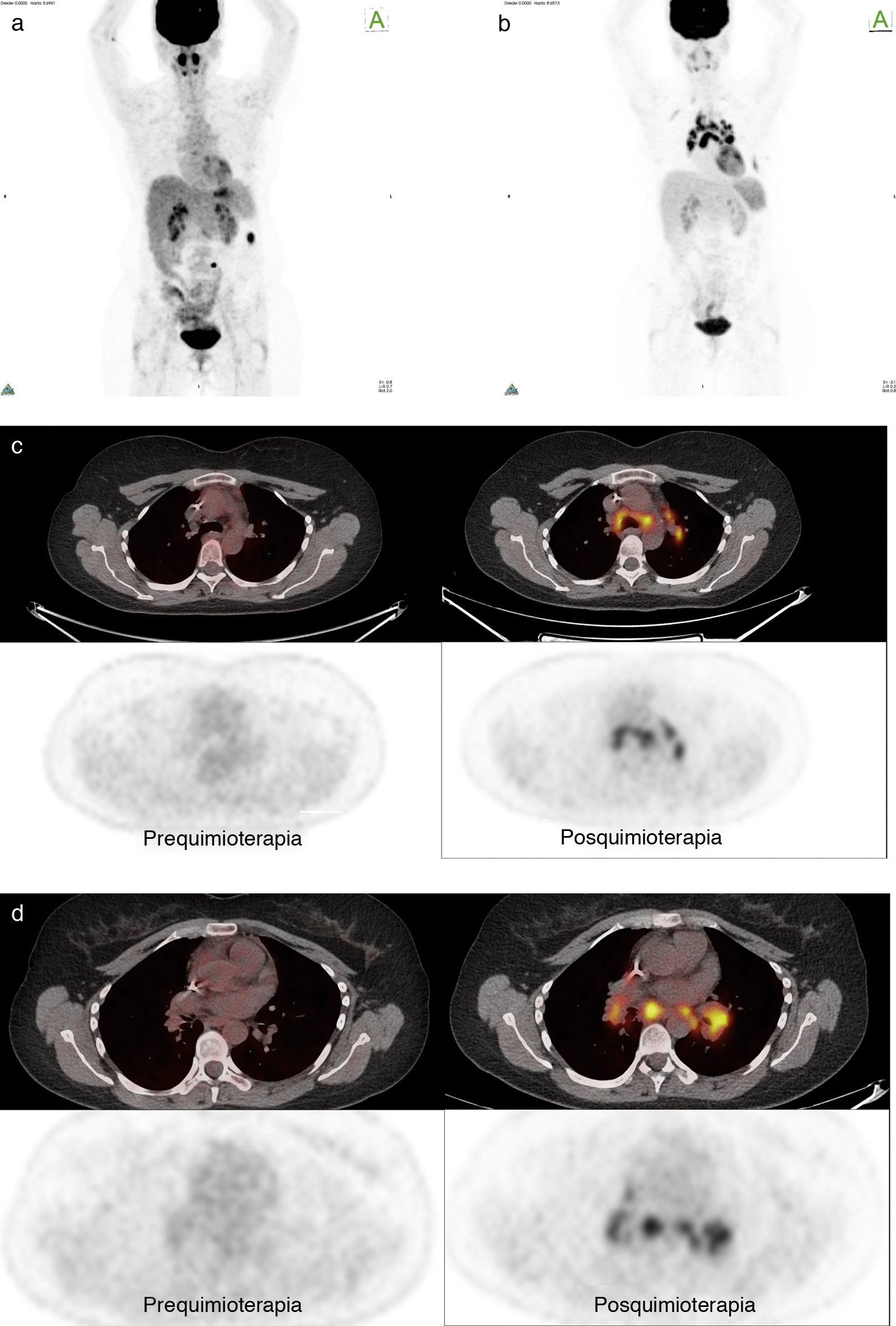
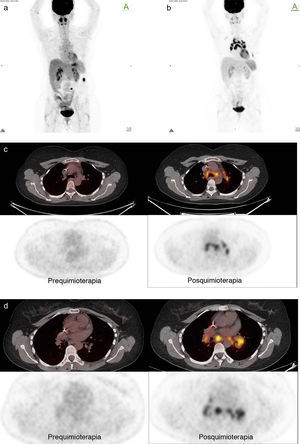
Paciente número 5: mujer de 43 años con cáncer de ovario estadio IV, tratado con cirugía y QT. El control con PET/TC evidenció dos nódulos peritoneales con leve aumento del metabolismo. Se realizó cirugía y nueva QT. El control con PET/TC postratamiento mostró adenopatías hiliomediastinales hipermetabólicas (no presentes en estudio anterior), algunas con calcificaciones. El SUV máx estuvo entre 8,7 y 13,8. Se planteó como diagnóstico diferencial sarcoidosis. La mediastinoscopía con biopsia confirmó el diagnóstico. La evolución fue compatible con una reacción sarcoid-like. (a) Imagen en proyección de máxima intensidad pre-QT; (b) imagen en proyección de máxima intensidad pos-QT; (c) fusión pre y pos-QT (comparativo); y (d) fusión pre y pos-QT (comparativo en un nivel inferior).
La asociación frecuente (10-14%) entre cáncer y sarcoidosis ha sido motivo de debate en las últimas décadas. Como hipótesis, se establece que se debería a un fallo en la regulación del sistema inmune (que promueve la aparición de enfermedades malignas) o a la inflamación crónica (que se cree es una de las causas del desarrollo de cáncer). Un metaanálisis del año 2014 ha demostrado que no hay evidencia de que los pacientes con sarcoidosis tengan mayor probabilidad de desarrollar cáncer1.
Asimismo, se plantea que el desarrollo de la sarcoidosis se ve favorecido durante o inmediatamente después de la quimioterapia. En la literatura, se ha reportado fundamentalmente asociado a casos de linfoma, osteosarcoma y tumores sólidos2.
La sarcoidosis es una enfermedad multisistémica, de causa desconocida, que afecta a adultos jóvenes. Se presenta con adenopatías hiliares bilaterales, compromiso pulmonar, y lesiones cutáneas y oculares. Puede haber también afectación extratorácica: hepatoesplenomegalia o nodal, y en las glándulas salivales, el corazón, el sistema nervioso y los huesos.
Histológicamente se caracteriza por la presencia de granulomas no caseificantes de células gigantes multinucleadas. Su curso y pronóstico dependen de la forma de inicio y extensión de la enfermedad. En un 60% de los pacientes, los granulomas resuelven espontáneamente y en el resto se vuelven crónicos, siendo causa de muerte solo en el 5% de los casos y en vinculación fundamentalmente con un compromiso cardíaco6.
El 90% de los pacientes tiene afectación torácica, siendo lo más frecuente el patrón ganglionar (85%). De este, el más común es el hiliar bilateral con adenopatía laterotraqueal derecha, posiblemente con calcificación amorfa, punteada o en “cáscara de huevo”.
La afectación pulmonar se ve como un engrosamiento intersticial multinodular, peribroncovascular y de septos interlobulillares, a predominio de los lóbulos superiores. Otro patrón es el multinodular bilateral que, a diferencia de las metástasis, afecta mayormente a los lóbulos superiores, evidencia contornos irregulares y puede tener broncograma aéreo. Incluso, es posible que se formen masas pulmonares con retracción del parénquima y bronquiectasias, también a predominio de lóbulos superiores7,8.
La reacción sarcoid-like se define por la existencia de granulomas de células epitelioides y gigantes, similares a los de la sarcoidosis, en pacientes que no cumplen los criterios para su diagnóstico. La entidad fue descrita por primera vez por Wolbach en 1911 y, desde entonces, se ha comunicado en asociación a todo tipo de tumor sólido y neoplasias hematológicas.
Histológicamente, estos granulomas suelen ser heterogéneos en su tamaño y pueden mostrar una mayor proliferación de células epitelioides, necrosis, exudados e infiltrados de células mononucleares. Como desencadenante, se plantean factores antigénicos tumorales, liberados en el proceso de necrosis, que generan una respuesta del huésped mediada por células T, similar a la reacción de hipersensibilidad que sucede en la sarcoidosis. Se ha sugerido un mejor pronóstico en la enfermedad de Hodgkin y en el cáncer gástrico, cuando existe este tipo de reacción, pero sigue siendo todavía controvertido en los carcinomas pulmonares4,9.
Dado que la quimioterapia de alta dosis inhibe la respuesta inmunológica (base posible de la formación de los granulomas), se cree que la sarcoidosis es producida por un microorganismo debido a la inmunosupresión provocada por la QT. De todos modos, hacen falta más estudios para relacionar el factor productor de sarcoidosis asociada a la QT4.
En el análisis de las imágenes PET/TC el elemento orientador para el planteo de sarcoidosis fue la distribución bilateral y simétrica de las adenopatías mediastinales e hiliares y su eventual asociación con enfermedad intersticial pulmonar. En algún tipo de cáncer, como en el de ovario, esta afectación ganglionar bilateral y simétrica no es esperable, ya que no suele ser un territorio normalmente afectado. En otras neoplasias, como la de mama, cuando existe afectación hiliomediastinal, están comprometidas otras localizaciones también, como la axila y la región supraclavicular, o hay metástasis pleurales y/o linfangitis carcinomatosa pulmonar.
En el componente TC del PET/TC, pueden detectarse calcificaciones ganglionares o micronódulos pulmonares. La distribución de los nódulos pulmonares en la sarcoidosis es, en general, pericisural y peribronquial, con un tamaño variable y a veces captan el radiotrazador.
El radiotrazador más utilizado es el 18F-FDG, en tanto marca el aumento de la actividad metabólica en las lesiones, hallazgo compartido por enfermedades inflamatorias y neoplásicas benignas y malignas. Su grado de captación en los pacientes con cáncer o sarcoidosis es variable y depende de la actividad metabólica, por lo que no es posible establecer un punto de corte para poder diferenciar una patología de la otra10,11. La acumulación del 18F-FDG en los tejidos inflamatorios está relacionada con un metabolismo incrementado de glucosa en un proceso probablemente más complicado que en las células tumorales.
Numerosas citoquinas y factores de crecimiento actúan sobre las células inflamatorias (macrófagos y leucocitos, principalmente) y las transforman en células activadas. Esto provoca un aumento de la expresión y afinidad de los transportadores de glucosa (principalmente GLUT-1 y GLUT-3) y una mayor producción de enzimas glucolíticas, como la hexoquinasa. Todo ello hace que se incremente la captación de 18F-FDG, ya que es dependiente del grado de activación celular, siendo mayor en los neutrófilos y macrófagos. Por este motivo, los procesos en los que predominan estas células serán más probablemente visualizados con este radiotrazador. El 18F-FDG ha mostrado en la sarcoidosis una sensibilidad para la afectación extrapulmonar del 100% y en la afectación pulmonar del 90%11.
Otros radiotrazadores que marcan síntesis proteica, como la 11C-metionina (MET), la 18F-fluorotimidina (FLT) y la 18F-flurometiltirosina (FMT), han sido evaluados para el estudio de la sarcoidosis con el objetivo de mejorar el diagnóstico diferencial entre tumores malignos y granulomas. Hay análisis que comparan la 18F-FDG con la 11C-MET y la 18F-FLT, e informaron que, aunque no hubo diferencias para la FDG y la FLT, la captación de MET fue inferior en las lesiones granulomatosas que en los tumores y que sería útil en su diagnóstico diferencial12.
En un estudio prospectivo reciente, que compara el PET/TC utilizando 18F-FLT y FDG en pacientes con adenopatías hiliomediastinales, no fue posible caracterizar los hallazgos como benignos o malignos mediante la medida del SUV, a pesar de que ambos trazadores marcan procesos biológicos diferentes (metabolismo y proliferación). En países con alta prevalencia de tuberculosis o sarcoidosis, ni siquiera valores altos de SUV máx implican siempre malignidad13.
Otro estudio con 24 pacientes que comparó el examen PET/TC utilizando FDG y FMT demostró que en la sarcoidosis la captación de FMT era menor14.
Como limitación de nuestro trabajo se destaca que no contamos con la confirmación histológica de todos los casos. Se necesitan estudios con mayor número de pacientes para poder establecer evidencias científicas que permitan la diferenciación entre una patología y otra.
ConclusiónLa asociación entre cáncer y sarcoidosis o reacción sarcoid like es frecuente. Ante la presencia de adenopatías hiliomediastinales bilaterales y simétricas, deben plantearse estas últimas entidades como diagnóstico diferencial.
En pacientes en seguimiento por cáncer después de la QT, la aparición de ganglios mediastinales y micronódulos pulmonares debe sugerir al clínico la posibilidad de una sarcoidosis.
Un radiotrazador que marca actividad metabólica, como la 18 F-FDG, puede no ser útil para la diferenciación entre uno y otro. En estos casos se puede plantear el uso de diferentes radiotrazadores, como la metionina, la fluorometiltirosina, la fluorotimidina y, eventualmente, una combinación de ellos.
Se necesitan estudios con mayor número de pacientes para poder establecer evidencias científicas que permitan la diferenciación entre ambas patologías.
En casos de persistir la duda se sugiere plantear el estudio histopatológico, de modo de no someter al paciente a tratamientos innecesarios.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.