O implante percutâneo de bioprótese aórtica é a terapia estabelecida em pacientes com estenose aórtica grave. Houve um progressivo aperfeiçoamento na tecnologia dos dispositivos que, associada a maior experiência dos operadores, resultou em procedimentos mais seguros e com melhores resultados. O primeiro dispositivo de segunda geração aprovado no Brasil, o sistema de válvula Lotus™ (Boston Scientific Corporation, Natick, EUA), incorpora várias dessas novas características. Descrevemos aqui os dois primeiros casos realizados no país, conduzidos sob anestesia local e sedação consciente, ambos com sucesso.
Transcatheter aortic valve implantation is a well‐established therapy in patients with severe aortic stenosis. There has been a progressive improvement in device technology associated with increased experience of the interventionists, resulting in safer procedures with better outcomes. The first second‐generation device approved in Brazil, Lotus™ Valve System (Boston Scientific Corporation, Natick, USA), incorporates several of these new characteristics. This report describes the first two cases, both successfully performed in the country, carried out under local anesthesia and conscious sedation.
O implante percutâneo de bioprótese aórtica (TAVI) é, atualmente, uma opção viável de tratamento para os pacientes com estenose aórtica (EAo) grave sintomática, considerados inoperáveis ou de alto risco para complicações relacionadas à troca valvar cirúrgica convencional. Essa técnica tem demonstrado resultados robustos, com significativa diminuição de mortalidade, quando comparada ao tratamento medicamentoso em pacientes inoperáveis1 e com mortalidade similar à da cirurgia convencional nos pacientes de alto risco.2 No entanto, complicações inerentes aos procedimentos podem comprometer os resultados de curto e médio prazos, limitando o uso dessa técnica.
O posicionamento correto ao nível do anel valvar aórtico dos dispositivos de primeira geração disponíveis no Brasil pode ser bastante desafiador, sendo uma das principais limitações da técnica, e o deslocamento da válvula pode levar a complicações graves, incluindo a oclusão coronária.3 A aposição incompleta da prótese pode ocorrer na presença de quantidades significativas de cálcio, em anatomias muito elípticas ou com o implante subótimo, resultando em regurgitação paravalvar (RPV),4,5 e está associada ao aumento da mortalidade em vários registos longitudinais.
Com a evolução tecnológica, diversas melhorias foram obtidas nos dispositivos, assim como no manuseio anestésico. Descrevemos aqui os dois primeiros procedimentos executados no Brasil, utilizando‐se um dispositivo de segunda geração, o sistema de válvula Lotus™ (Boston Scientific Corporation, Natick, EUA), para tratamento percutâneo da EAo valvar, realizados sob anestesia local e sedação consciente.
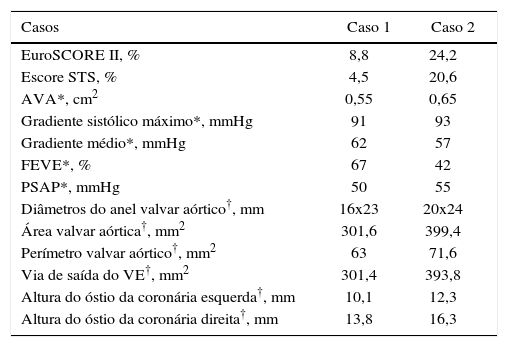
Relatos de casoCaso 1Paciente do sexo feminino, 88 anos, admitida no Hospital Brasil (Santo André, SP), por quadro de insuficiência cardíaca congestiva, em classe funcional New York Heart Association (NYHA) IV. Antecedentes pessoais de hipertensão arterial sistêmica, diabetes melito, doença arterial coronária com angioplastia e implante de stent farmacológico para lesão em artéria descendente anterior em 2014, e EAo moderada. O ecocardiograma transtorácico (ETT) da internação demonstrou EAo grave e, devido a idade avançada e comorbidades, indicou‐se tratamento percutâneo. Tomografia com contraste foi realizada para avaliar a raiz da aorta, o anel valvar e o acesso vascular (tabela 1).
Características pré‐procedimento
| Casos | Caso 1 | Caso 2 |
|---|---|---|
| EuroSCORE II, % | 8,8 | 24,2 |
| Escore STS, % | 4,5 | 20,6 |
| AVA*, cm2 | 0,55 | 0,65 |
| Gradiente sistólico máximo*, mmHg | 91 | 93 |
| Gradiente médio*, mmHg | 62 | 57 |
| FEVE*, % | 67 | 42 |
| PSAP*, mmHg | 50 | 55 |
| Diâmetros do anel valvar aórtico†, mm | 16x23 | 20x24 |
| Área valvar aórtica†, mm2 | 301,6 | 399,4 |
| Perímetro valvar aórtico†, mm2 | 63 | 71,6 |
| Via de saída do VE†, mm2 | 301,4 | 393,8 |
| Altura do óstio da coronária esquerda†, mm | 10,1 | 12,3 |
| Altura do óstio da coronária direita†, mm | 13,8 | 16,3 |
STS: Society of Thoracic Surgeons; AVA: área valvar aórtica; FEVE: fração de ejeção do ventrículo esquerdo; PSAP: pressão sistólica da artéria pulmonar; VE: ventrículo esquerdo.
* Ecocardiograma transtorácico.
† Tomografia cardíaca.
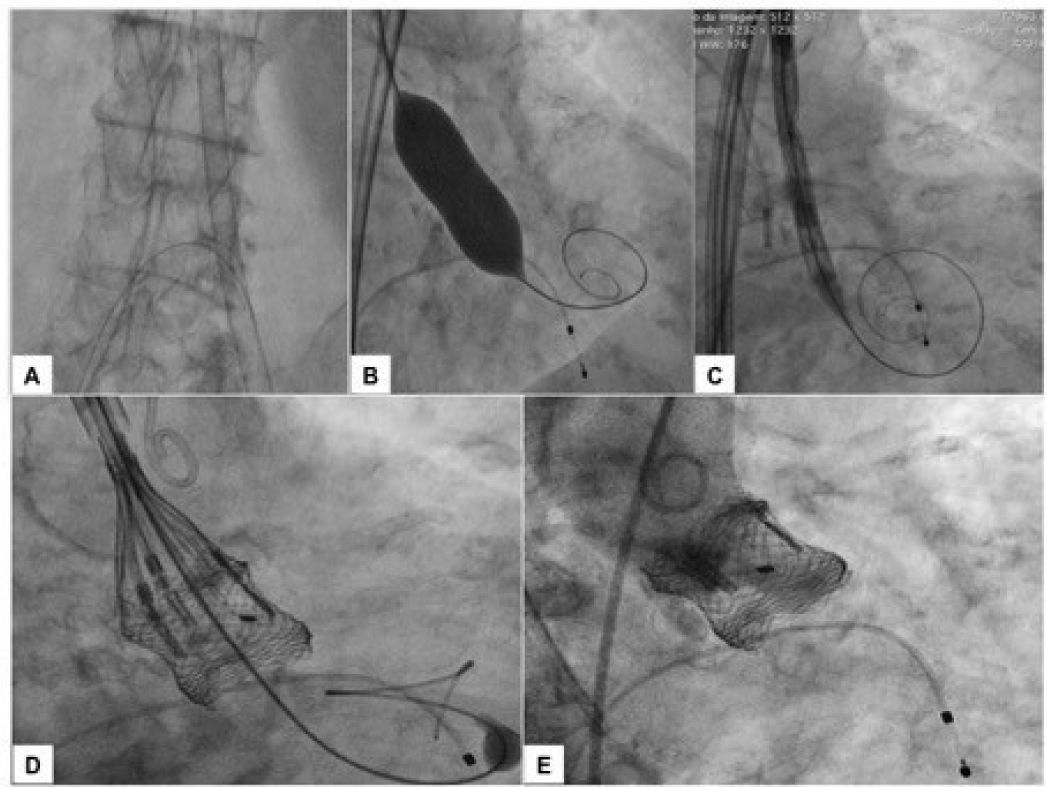
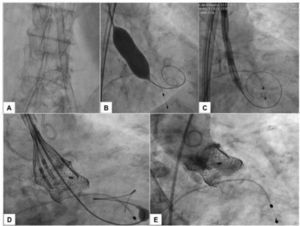
O procedimento foi realizado sob anestesia local, sedação consciente e sem a necessidade de ecocardiografia transesofágica. Administrou‐se heparina na dose de 150 UI/kg, com o objetivo de atingir tempo de coagulação ativado entre 300 e 350 segundos. Inicialmente, o acesso arterial femoral direito foi estabelecido com introdutor 7 F para proteção contralateral com fio‐guia 0,018 × 300cm. O acesso arterial principal foi obtido da artéria femoral esquerda por via percutânea com colocação de dois dispositivos Perclose Proglide® (Abbott Vascular, Redwood City, EUA), seguido de introdutor 18 F. Acesso venoso femoral direito foi obtido por via percutânea para colocação de marca‐passo temporário no ventrículo direito. Em seguida, foi realizada aortografia para identificação da projeção com alinhamento das três cúspides no mesmo plano, a qual foi utilizada para a liberação da prótese. O gradiente transvalvar aórtico pico‐pico basal foi de 83mmHg. Um fio‐guia rígido 0,035” Safari® Pre‐Shaped TAVI Guidewire (Boston Scientific Corporation, Natick, EUA) foi mantido no ventrículo esquerdo e, sobre esse fio‐guia, um balão de valvuloplastia Cristal® 18 × 40mm (Balt, Montmorency, França) foi avançado, posicionado na válvula aórtica e insuflado até seu diâmetro nominal, sob taquicardia induzida pelo marca‐passo. A seguir, uma bioprótese aórtica Lotus™ número 23 foi avançada sobre o fio‐guia rígido e posicionada ao nível do anel valvar. Após angiografias para ajuste fino de posicionamento, a prótese foi liberada. Na angiografia de controle, observamos ausência de refluxo, e a manometria não revelou gradiente transvalvar sistólico (fig. 1). O ETT realizado ao final do procedimento não evidenciou refluxo aórtico e mostrou gradiente pico de 18mmHg e médio de 8mmHg. A paciente foi transferida para o quarto no dia seguinte e recebeu alta hospitalar 4 dias após o procedimento.
(A) Introdutor 18 F e proteção contralateral com fio‐guia 0,018 × 300cm. (B) Fio‐guia rígido 0,035” Safari® no ventrículo esquerdo e balão de valvuloplastia 18 × 40mm, sob taquicardia induzida pelo marca‐passo. (C) SV Lotus™ número 23 em posição inicial e expandida. (D) Posição pré‐liberação. (E) Aortografia de controle‐posicionamento ótimo e ausência de regurgitação aórtica.
Paciente do sexo feminino, 87 anos, foi admitida no Hospital São Luiz – Unidade Morumbi (São Paulo, SP), por quadro de insuficiência cardíaca congestiva (ICC), em classe funcional NYHA IV. Tinha diagnóstico de EAo grave de longa data, tendo recusado várias vezes o tratamento cirúrgico. Pelo risco cirúrgico elevado e, de acordo com a preferência da paciente, decidiu‐se pela realização do tratamento percutâneo.
Tomografia com contraste foi realizada para avaliar a via de acesso vascular, bem como a valva aórtica e a geometria da raiz da aorta (tabela 1).
O procedimento foi realizado sob anestesia local, sedação consciente e sem a utilização da ecocardiografia transesofágica. Inicialmente, administrou‐se heparina (150 UI/kg), e o acesso femoral direito foi estabelecido com introdutor 7 F (proteção contralateral). O acesso arterial principal foi obtido pela via femoral esquerda, por via percutânea, com a colocação de dois dispositivos Perclose Proglide® e a utilização de introdutor 18 F. Marca‐passo temporário foi posicionado pela veia femoral direita. Realizada aortografia para identificação da projeção com alinhamento das três cúspides no mesmo plano, a qual foi empregada para a liberação da prótese. O gradiente transvalvar aórtico pico‐pico basal foi de 90mmHg. Valvoplastia com balão Cristal® 18 × 40mm foi realizada antes do implante da bioprótese aórtica Lotus™ número 23, ambos avançados sobre o fio‐guia rígido 0,035” Safari® e posicionados ao nível do anel valvar. Após angiografias para ajuste fino de posicionamento, a prótese foi liberada. Na angiografia de controle não foi observado refluxo aórtico, assim como no ETT final. Os gradientes pico e médio pós‐procedimento foram de 15mmHg e 9mmHg, respectivamente. Recebeu alta da unidade de terapia intensiva após 48 horas e alta hospitalar 5 dias após o procedimento.
DiscussãoO sistema de válvula Lotus™ foi recentemente introduzido no Brasil para o tratamento de EAo grave sintomática. Trata‐se de uma bioprótese de pericárdio bovino com três folhetos fixados a uma estrutura de nitinol trançado, com um marcador radiopaco, em um sistema montado em um cateter, para introdução e liberação retrógrada, por via femoral (fig. 2). A válvula é liberada por expansão mecânica controlada. É pré‐fixada a um sistema de liberação e começa a funcionar precocemente, contribuindo para um posicionamento inicial controlado e preciso, um reposicionamento ou a completa retirada em qualquer momento antes da liberação, mesmo quando 100% expandida, como em caso de mau posicionamento do dispositivo ou uma complicação desfavorável (por exemplo, a oclusão coronária). Exibe uma vedação adaptativa externa única de poliuretano/policarbonato, projetada para se adaptar às superfícies anatômicas irregulares, ocluindo interstícios entre a prótese e o material do folheto degenerado calcificado na interface aorto‐ventricular e, assim, minimizando a RPV. Não há necessidade de taquicardia induzida pelo marca‐passo durante o implante. Encontra‐se disponível nos tamanhos 23mm (introdutor 18 F), 25mm e 27mm (ambas com introdutor 20 F).
A propriedade única de iniciar o funcionamento precoce dos folhetos, mesmo antes de ser liberada completamente, associada à não necessidade de estimulação ventricular rápida pelo marca‐passo, e sua capacidade de ser totalmente recapturada após o implante e antes da liberação são características que priorizam sua escolha em estratégias menos invasivas, que utilizam a anestesia local e a sedação consciente.
O estudo clínico REPRISE II6 (REpositionable Percutaneous Replacement of Stenotic Aortic Valve Through Implantation of Lotus Valve System: Evaluation of Safety and Performance), prospectivo, multicêntrico e de braço único, em pacientes de alto risco cirúrgico com EAo grave, demonstrou a segurança e a eficácia do procedimento com sucesso no implante da válvula em todos os 120 pacientes, atingindo o objetivo primário de desempenho do dispositivo (gradiente médio < 18mmHg em 30 dias), com baixas taxas de mortalidade (4,2%) e acidente vascular cerebral incapacitante (1,7%), além de ausência de embolização, liberação ectópica da válvula ou implante de válvula adicional. Associou‐se aos resultados a melhora acentuada na classe funcional (91% estavam em classe funcional I ou II, em 30 dias), com baixa taxa de RPV significante (RPV moderada ocorreu em 1,0%, e RPV grave em nenhum paciente).
A anestesia geral tem algumas desvantagens, como o efeito cardiodepressor de anestésicos gerais, que podem provocar instabilidade cardiovascular no momento da indução anestésica e durante o procedimento − em particular, hipotensão e bradicardia e, consequentemente, a necessidade de vasoconstritores, podendo ser deletério em pacientes com EAo grave.7 A anestesia local, por sua vez, evita mudanças hemodinâmicas não controladas, é mais tolerada naqueles com doença pulmonar crônica e permite o monitoramento instantâneo de qualquer alteração neurológica. Além da possibilidade de duração mais curta do procedimento, com recuperação rápida e diminuição do tempo de internação, o que poderia diminuir o risco de infecções hospitalares e outras complicações associadas à permanência hospitalar,8 tem como vantagem adicional a redução de custos. No entanto, a possibilidade de mudança para anestesia geral deve ser considerada em qualquer momento do procedimento.
Essa estratégia foi avaliada por registro francês9 (FRANCE 2 Registry Investigators), com 2.326 pacientes submetidos à TAVI por via femoral, com as próteses CoreValve® (Medtronic, Minneapolis, EUA) e Edwards SAPIEN/SAPIEN XT (Edwards Lifesciences, Irvine, EUA), e comparou os resultados clínicos dos que realizaram o procedimento sob anestesia geral (1.377 pacientes) ou local (949 pacientes). Não houve diferenças quanto ao sucesso do implante do dispositivo e taxa de sobrevida em 30 dias (97,6% vs. 97,0%; p = 0,41; e 91,6% vs. 91,3%; p = 0,69, respectivamente), ao passo que a incidência de RPV ≥ leve foi significativamente menor com a anestesia geral (15,0% vs. 19,1%; p = 0,015), achado não confirmado após o pareamento dos grupos (12,7% vs. 16,2%; p = 0,19). Não existem estudos que avaliam essa questão com o dispositivo de segunda geração Lotus™.
Nos dois casos, não houve necessidade de utilização de drogas vasoativas durante todo o procedimento, e os pacientes mantiveram‐se colaborativos, apesar da sedação, levando a uma rápida recuperação e alta hospitalar precoce (quarto e quinto dias). Não foi necessário implante de marca‐passo definitivo em nenhum dos pacientes.
Em conclusão, os casos relatados neste artigo demonstraram o desempenho de uma prótese que permite maior estabilidade durante o procedimento, posicionamento exato (com correção em qualquer etapa prévia à liberação) e vedação adaptativa com potencial de minimizar a RPV (e diminuir também a necessidade do ETT), além de facilitar a utilização de técnicas menos invasivas, como o emprego de anestesia local e sedação consciente.
Fonte de financiamentoNão há.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A revisão por pares é de responsabilidade da Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.