Estudos recentes têm demonstrado a eficácia do implante transcateter valve‐in‐valve para o tratamento de disfunção de biopróteses em pacientes de alto risco cirúrgico. Apresentamos nossa experiência inicial com o implante valve‐in‐valve.
MétodosCaracterizamos o perfil clínico, ecocardiográfico e do procedimento, e reportamos os resultados de médio prazo de pacientes com disfunção de bioprótese submetidos a implante valve‐in‐valve em posição aórtica.
ResultadosIncluímos sete pacientes do sexo masculino, com idade de 72,6 ± 10,0 anos. O escore STS foi 9,6 ± 10,5%, e o EuroSCORE logístico foi 22,7 ± 14,7%. Três pacientes apresentavam dupla disfunção; dois tinham insuficiência; e dois exibiam estenose isolada. A via transfemoral foi utilizada em seis casos, e a transapical, em um caso. Os dispositivos implantados incluíram as próteses Sapien XT (n = 5) e CoreValve (n = 2). O sucesso do procedimento foi obtido em seis (85,7%) casos. Após o procedimento, o gradiente médio reduziu‐se de 38,2 ± 9,6mmHg para 20,9 ± 5,9mmHg, e a área valvar elevou‐se de 1,2 ± 0,4cm2 para 1,5 ± 0,5cm2. Ao final de 1 ano, não ocorreram óbitos e nem outros desfechos adversos significativos; 80% dos pacientes encontravam‐se em classe funcional NYHA I/II. Os gradientes transvalvares e a área valvar permaneceram inalterados nesse período.
ConclusõesO procedimento valve‐in‐valve foi eficaz na maioria dos pacientes de alto risco cirúrgico com disfunção de bioprótese. Quando realizado em pacientes bem selecionados, resulta em desfechos clínicos e hemodinâmicos satisfatórios.
Recent studies have demonstrated the efficacy of the transcatheter valve‐in‐valve implantation for the treatment of bioprosthesis dysfunction in high‐risk surgical patients. This study presents the initial experience with valve‐in‐valve implantation.
MethodsClinical, echocardiographic, and procedural profiles were characterized, and the mid‐term results of patients with surgical bioprosthesis dysfunction submitted to valve‐in‐valve implantation in the aortic position were reported.
ResultsSeven male patients were included, aged 72.6 ± 10.0 years. The STS score was 9,6 ± 10,5%, and the logistic EuroSCORE was 22.7 ± 14.7%. Three patients had combined aortic bioprosthesis failure; two had isolated regurgitation; and two had isolated stenosis. The transfemoral access was used in six cases, and the transapical access in one case. Implanted devices included Sapien XT (n = 5) and CoreValve (n = 2) prostheses. Procedural success was achieved in six (85.7%) cases. After the procedure, the mean gradient decreased from 38.2 ± 9.6mmHg to 20.9 ± 5.9mmHg, and the valve area increased from 1.2 ± 0.4cm2 to 1.5 ± 0.5cm2. After 1 year, there were no deaths and no other significant adverse outcomes; 80% of patients were in NYHA functional class I/II. The transvalvular gradients and valve area remained unchanged in this period.
ConclusionsThe valve‐in‐valve procedure was effective in most high‐risk surgical patients with bioprosthesis dysfunction. When performed in well‐selected patients, it results in satisfactory clinical and hemodynamic outcomes.
Pacientes com disfunção de bioprótese valvar cirúrgica representam um desafio clínico, pois, apesar de uma nova troca cirúrgica ser considerada o tratamento padrão, a reoperação associa‐se à elevada morbimortalidade.1,2 Tais pacientes são caracterizados como de alto risco cirúrgico ou inoperáveis, devido a múltiplas comorbidades, idade avançada, fragilidade clínica ou redução da fração de ejeção ventricular.3
Originalmente desenvolvido para a abordagem da estenose de valva nativa, o implante de prótese aórtica por cateter constitui o tratamento padrão para pacientes sintomáticos e considerados inoperáveis, além de representar uma estratégia terapêutica alternativa à cirurgia de troca valvar em indivíduos de alto risco cirúrgico.4–8 Estudos recentes demonstram a eficácia clínica do implante de prótese transcateter valve‐in‐valve (VIV) para o tratamento das biopróteses cirúrgicas aórticas com disfunção. Essa modalidade representa uma opção de tratamento menos invasiva, principalmente por não expor o paciente à circulação cardiopulmonar extracorpórea e nem aos riscos inerentes à reoperação. Apesar de as próteses não terem sido desenhadas para essa finalidade, os resultados publicados têm sido encorajadores.9–14
Este estudo teve como objetivo caracterizar a experiência inicial de equipe cardiovascular multidisciplinar no emprego de procedimentos VIV para pacientes com disfunção de biopróteses cirúrgicas em posição aórtica. São descritos os perfis clínico e ecocardiográfico, e os aspectos relacionados ao procedimento, bem como os resultados clínicos do seguimento de médio prazo.
MétodosSeleção de pacientes e indicação do procedimento valve‐in‐valveForam incluídos nesta análise pacientes maiores de 18 anos com disfunção de bioprótese aórtica sintomática, submetidos consecutivamente ao procedimento VIV em dois centros cardiológicos terciários no Estado de São Paulo entre janeiro de 2009 e junho de 2015. Pacientes com prótese valvar transcateter prévia ou com endocardite infecciosa ativa foram excluídos da amostra. O projeto foi aprovado pelo Comitê de Ética institucional, e os pacientes assinaram o Termo de Consentimento Livre e Esclarecido. As informações foram registradas prospectivamente em formulários apropriados desenvolvidos para o estudo, armazenadas em planilhas eletrônicas e coletadas do banco de dados de cada instituição.
Avaliação clínica pré‐procedimentoEm geral, a avaliação do paciente para o procedimento VIV foi similar àquela realizada em indívíduos portadores de estenose aórtica e candidatos ao implante de prótese por cateter em posição nativa. A indicação desse tratamento foi baseada no risco cirúrgico, determinado por características clínicas ou por razões técnicas. Para a estimativa de risco, foram utilizados os escores Society of Thoracic Surgeons (STS, disponível em http://riskcalc.sts.org/de.aspx) e European System for Cardiac Operative Risk Evaluation (EuroSCORE logístico, conforme http://www.euroscore.org/calcold.html). Fatores de risco não contemplados nesses escores, como a presença de “aorta em porcelana”, fragilidade, tórax hostil consequente à irradiação torácica prévia, hepatopatias e distúrbios da coagulação, também foram considerados nessa decisão. Todos os casos foram analisados e discutidos por grupo multidisciplinar (Heart Team), composto por cardiologistas clínicos e intervencionistas, cirurgiões cardiovasculares e cardiologistas especialistas em imagens.
Características específicas a respeito da prótese cirúrgica previamente utilizada foram pesquisadas para embasar a indicação do procedimento VIV. Foram identificados tipo, modelo, tamanho e posição (intra‐ ou supra‐anular) da prótese valvar cirúrgica. O diâmetro interno de cada bioprótese foi obtido conforme informações do fabricante. Aspectos técnicos da cirurgia empregada, como a necessidade de reconstrução da raiz de aorta e a presença de enxertos venosos ou arteriais, também foram elucidados.
Exames complementares pré‐procedimentoForam realizados exames laboratoriais, eletrocardiograma de repouso, radiografia de tórax, ecocardiograma transesofágico, angiotomografia (angio‐TC) do coração e aorta total, e coronariografia.
O principal parâmetro considerado para a escolha da prótese aórtica transcateter a ser implantada foi o diâmetro interno da bioprótese cirúrgica prévia, obtido junto ao fabricante ou conforme informado pelo aplicativo VIV Aortic, desenvolvido por Bapat e pela empresa UBQO Ltda. (Londres, Reino Unido).15 O ecocardiograma foi utilizado para avaliação do mecanismo e das consequências da disfunção protética, definindo‐se a integridade e mobilidade dos folhetos, a função ventricular esquerda, e a presença de hipertensão pulmonar e de valvopatias associadas. Nos casos de disfunção por insuficiência da prótese, o ecocardiograma transesofágico excluiu a presença de refluxo paravalvar. A angio‐TC da aorta foi o método utilizado para determinação da melhor via de acesso. Em caso de não disponibilidade dos dados da cirurgia prévia, a angio‐TC auxiliou na análise dos diâmetros da prótese cirúrgica e na escolha da prótese transcateter mais adequada para o procedimento VIV. A cinecoronariografia foi empregada para a avaliação de doença arterial coronária associada e na estimativa do risco de oclusão coronária durante o implante valvar.
Aspectos técnicos do procedimentoDupla antiagregação plaquetária (ácido acetilsalicílico 300mg e clopidogrel 300mg) era iniciada com uma dose de ataque 24 horas antes do procedimento. Os procedimentos foram realizados preferencialmente em sala híbrida. A decisão a respeito do emprego de anestesia geral e do ecocardiograma transesofágico ficou a critério dos operadores.
O acesso vascular femoral foi a primeira escolha para o implante, sendo utilizado dispositivo hemostático específico de reparo arterial mediado por sutura ProGlide® (Abbott Vascular®, Santa Clara, EUA). Em caso da impossibilidade do emprego da via femoral, utilizou‐se o acesso transapical. Após o estabelecimento do acesso vascular, foi utilizada dose em bólus de heparina não fracionada (80 a 100 U/kg).
Considerando o fato de que, na maioria dos casos, o anel da bioprótese cirúrgica é radiopaco, a identificação da melhor projeção angiográfica para o implante foi obtida por fluoroscopia: a angulação coplanar foi buscada e tomada como referência para o adequado posicionamento da prótese transcateter. Aortografia com visualização dos óstios coronários foi obtida com o intuito de se avaliar a ocorrência de obstrução coronária no procedimento.
Foram utilizados o sistema autoexpansível CoreValve (Medtronic, Minneapolis, EUA) e o sistema balão‐expansível Edwards Sapien XT (Edwards Lifesciences, Irvine, EUA). Tanto a escolha de uma ou outra prótese, bem como a necessidade ou não de pré‐dilatação ou pós‐dilatação foram baseadas no julgamento dos operadores.
SeguimentoForam coletados dados clínicos, laboratoriais e ecocardiográficos 30 dias e 6 meses após a alta hospitalar. Dupla antiagregação plaquetária foi recomendada em doses de manutenção (clopidogrel 75mg ao dia por 6 meses e ácido acetilsalicílico 100mg ao dia, continuamente). Nos pacientes com indicação de uso de anticoagulantes orais, o esquema farmacológico consistia na associação de clopidogrel à varfarina, de acordo com o International Normalized Ratio (INR), com alvo entre 2,0 e 3,0.
DefiniçõesOs desfechos foram categorizados de acordo com os critérios Valve Academic Research Consortium (VARC)‐2,16 e os eventos adjudicados por dois cardiologistas experientes. Analisou‐se como desfecho primário o sucesso do dispositivo, definido como o implante de uma única prótese em local planejado, com ausência de desproporção prótese‐paciente (mismatch), gradiente transvalvar aórtico médio < 20mmHg ou velocidade de pico < 3 m/s, e ausência de regurgitação aórtica ≥ moderada, avaliada pela aortografia e ecocardiografia. O desfecho de segurança precoce (até 30 dias pós‐procedimento) foi definido como a combinação de mortalidade por todas as causas; acidente vascular cerebral (AVC); sangramento com risco de vida; insuficiência renal aguda estágios 2 ou 3, conforme o escore Acute Kidney Injury Network (AKIN);17 complicação vascular maior ou disfunção valvar com necessidade de reintervenção. Os critérios de eficácia clínica (30 dias após o procedimento) consistiram no desfecho combinado envolvendo mortalidade por todas as causas, AVC, re‐hospitalização por insuficiência cardíaca, classe funcional New York Heart Association (NYHA) III ou IV, ou disfunção de prótese VIV (estenose ou regurgitação).16
Foram avaliadas também outras complicações, como necessidade de conversão para cirurgia convencional, ocorrência de obstrução coronária, tamponamento cardíaco, comunicação interventricular, mau posicionamento valvar, endocardite, trombose valvar, distúrbios de condução e necessidade de implante de marca‐passo definitivo.16
Análise estatísticaAs variáveis contínuas com distribuição normal foram descritas como média e desvio padrão, ou mediana e intervalo interquartil para as variáveis assimétricas. As variáveis categóricas foram descritas como números absolutos e porcentuais. A comparação entre as variáveis contínuas foi realizada pelo teste t de Student pareado. Valores de p ≤ 0,05 foram considerados estatisticamente significantes. Foi utilizado o programa R, versão 3.1 (The R Foundation for Statistical Computing, Viena, Áustria).
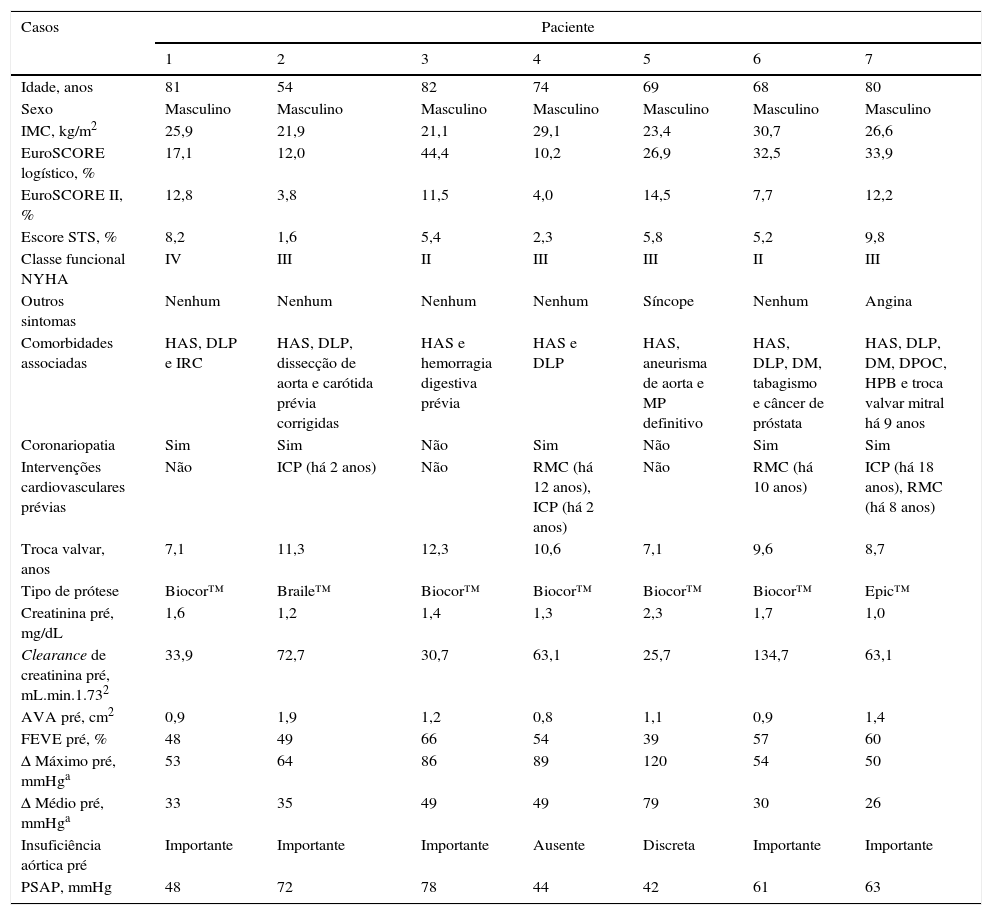
ResultadosCaracterísticas clínicas basaisTodos os pacientes eram do sexo masculino, com média de idade de 72,6 ± 10,0 anos e de alto risco cirúrgico, com escore STS de 9,6 ± 10,5% e EuroSCORE logístico 22,7 ± 14,7% (tabela 1). A maioria dos pacientes (71%) estava em classe funcional NYHA III ou IV. Quatro dos sete pacientes tinham sido submetidos previamente a cirurgia de revascularização do miocárdio. O intervalo decorrido entre o implante cirúrgico da bioprótese e o procedimento VIV foi de 9,5 ± 2,0 anos.
Características demográficas e clínicas
| Casos | Paciente | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| Idade, anos | 81 | 54 | 82 | 74 | 69 | 68 | 80 |
| Sexo | Masculino | Masculino | Masculino | Masculino | Masculino | Masculino | Masculino |
| IMC, kg/m2 | 25,9 | 21,9 | 21,1 | 29,1 | 23,4 | 30,7 | 26,6 |
| EuroSCORE logístico, % | 17,1 | 12,0 | 44,4 | 10,2 | 26,9 | 32,5 | 33,9 |
| EuroSCORE II, % | 12,8 | 3,8 | 11,5 | 4,0 | 14,5 | 7,7 | 12,2 |
| Escore STS, % | 8,2 | 1,6 | 5,4 | 2,3 | 5,8 | 5,2 | 9,8 |
| Classe funcional NYHA | IV | III | II | III | III | II | III |
| Outros sintomas | Nenhum | Nenhum | Nenhum | Nenhum | Síncope | Nenhum | Angina |
| Comorbidades associadas | HAS, DLP e IRC | HAS, DLP, dissecção de aorta e carótida prévia corrigidas | HAS e hemorragia digestiva prévia | HAS e DLP | HAS, aneurisma de aorta e MP definitivo | HAS, DLP, DM, tabagismo e câncer de próstata | HAS, DLP, DM, DPOC, HPB e troca valvar mitral há 9 anos |
| Coronariopatia | Sim | Sim | Não | Sim | Não | Sim | Sim |
| Intervenções cardiovasculares prévias | Não | ICP (há 2 anos) | Não | RMC (há 12 anos), ICP (há 2 anos) | Não | RMC (há 10 anos) | ICP (há 18 anos), RMC (há 8 anos) |
| Troca valvar, anos | 7,1 | 11,3 | 12,3 | 10,6 | 7,1 | 9,6 | 8,7 |
| Tipo de prótese | Biocor™ | Braile™ | Biocor™ | Biocor™ | Biocor™ | Biocor™ | Epic™ |
| Creatinina pré, mg/dL | 1,6 | 1,2 | 1,4 | 1,3 | 2,3 | 1,7 | 1,0 |
| Clearance de creatinina pré, mL.min.1.732 | 33,9 | 72,7 | 30,7 | 63,1 | 25,7 | 134,7 | 63,1 |
| AVA pré, cm2 | 0,9 | 1,9 | 1,2 | 0,8 | 1,1 | 0,9 | 1,4 |
| FEVE pré, % | 48 | 49 | 66 | 54 | 39 | 57 | 60 |
| Δ Máximo pré, mmHga | 53 | 64 | 86 | 89 | 120 | 54 | 50 |
| Δ Médio pré, mmHga | 33 | 35 | 49 | 49 | 79 | 30 | 26 |
| Insuficiência aórtica pré | Importante | Importante | Importante | Ausente | Discreta | Importante | Importante |
| PSAP, mmHg | 48 | 72 | 78 | 44 | 42 | 61 | 63 |
Valores medidos pelo ecocardiograma.
IMC: índice de massa corporal; EuroSCORE: European System for Cardiac Operative Risk Evaluation; Escore STS: Society of Thoracic Surgeons; NYHA: New York Heart Association; HAS: hipertensão arterial sistêmica; DLP: dislipidemia; IRC: insuficiência renal crônica; DM: diabetes melito; DPOC: doença pulmonar obstrutiva crônica; HPB: hiperplasia prostática benigna; ICP: intervenção coronária percutânea; RMC: revascularização miocárdica cirúrgica; AVA: área valvar aórtica; FEVE: fração de ejeção do ventrículo esquerdo; Δ: gradiente; PSAP: pressão sistólica de artéria pulmonar.
Três pacientes apresentavam disfunção da bioprótese cirúrgica do tipo dupla‐lesão; dois tinham insuficiência protética; e dois pacientes apresentaram estenose da prótese. Um paciente já tinha sido submetido à troca valvar mitral previamente. Todas as próteses cirúrgicas eram de pericárdio bovino, sendo SJ Medical Biocor™ (St. Jude Medical Biocor, St. Paul, EUA) em cinco pacientes, SJ Medical Epic™ (St. Jude Medical Biocor, St. Paul, EUA) em um paciente e prótese Braile™ (Braile Biomédica, São José do Rio Preto, SP, Brasil) em outro, cujos diâmetros variaram de 21 a 25mm. A média dos diâmetros internos das biopróteses foi de 24,0 ± 3,9mm, obtida com a angio‐TC. Os gradientes máximo e médio, conforme a ecocardiografia, foram de 73,7 ± 25,9mmHg e 38,2 ± 9,6mmHg, respectivamente. A média das áreas das próteses cirúrgicas foi de 1,2 ± 0,4cm2. A fração de ejeção do ventrículo esquerdo variou de 39 a 66%, com média de 53,3 ± 8,9%. Quatro pacientes apresentavam hipertensão arterial pulmonar importante, com média de pressão sistólica de artéria pulmonar (PSAP) de 58,3 ± 14,0mmHg.
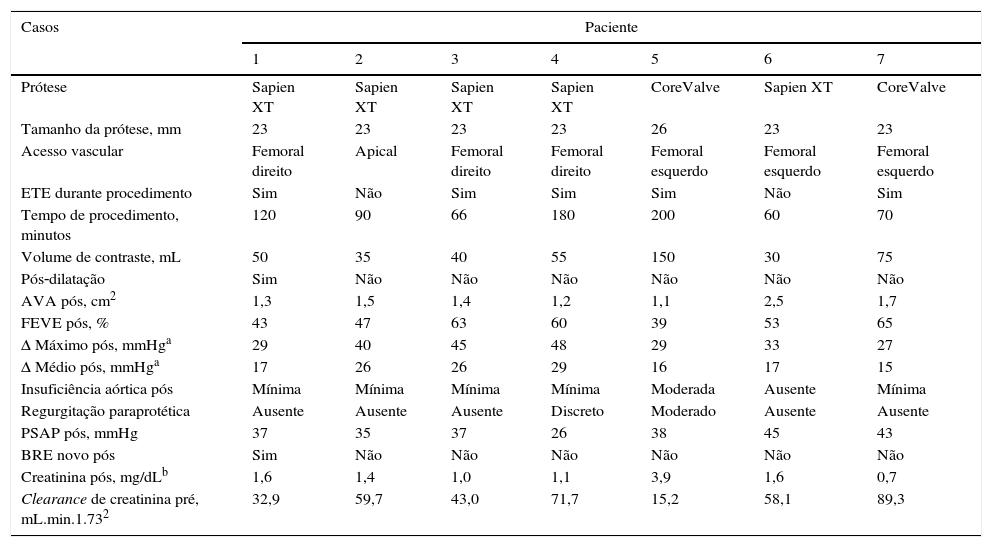
Aspectos técnicos da intervençãoA maioria dos procedimentos (seis pacientes) foi realizada sob anestesia geral e com monitorização por ecocardiograma transesofágico; em um paciente, optou‐se por sedação e anestesia local (tabela 2). A via transfemoral foi utilizada em seis casos; nesses indivíduos, a hemostasia foi obtida sem complicações vasculares, por meio do dispositivo PercloseTM. Devido à presença de endoprótese em aorta descendente, a via transapical foi empregada em um paciente. A pré‐dilatação foi realizada em dois pacientes, e a pós‐dilatação também foi necessária em dois pacientes. O tempo do procedimento foi de 112,3 ± 57,0 minutos, e o volume de contraste foi 63,3 ± 45,4mL.
Características do procedimento
| Casos | Paciente | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| Prótese | Sapien XT | Sapien XT | Sapien XT | Sapien XT | CoreValve | Sapien XT | CoreValve |
| Tamanho da prótese, mm | 23 | 23 | 23 | 23 | 26 | 23 | 23 |
| Acesso vascular | Femoral direito | Apical | Femoral direito | Femoral direito | Femoral esquerdo | Femoral esquerdo | Femoral esquerdo |
| ETE durante procedimento | Sim | Não | Sim | Sim | Sim | Não | Sim |
| Tempo de procedimento, minutos | 120 | 90 | 66 | 180 | 200 | 60 | 70 |
| Volume de contraste, mL | 50 | 35 | 40 | 55 | 150 | 30 | 75 |
| Pós‐dilatação | Sim | Não | Não | Não | Não | Não | Não |
| AVA pós, cm2 | 1,3 | 1,5 | 1,4 | 1,2 | 1,1 | 2,5 | 1,7 |
| FEVE pós, % | 43 | 47 | 63 | 60 | 39 | 53 | 65 |
| Δ Máximo pós, mmHga | 29 | 40 | 45 | 48 | 29 | 33 | 27 |
| Δ Médio pós, mmHga | 17 | 26 | 26 | 29 | 16 | 17 | 15 |
| Insuficiência aórtica pós | Mínima | Mínima | Mínima | Mínima | Moderada | Ausente | Mínima |
| Regurgitação paraprotética | Ausente | Ausente | Ausente | Discreto | Moderado | Ausente | Ausente |
| PSAP pós, mmHg | 37 | 35 | 37 | 26 | 38 | 45 | 43 |
| BRE novo pós | Sim | Não | Não | Não | Não | Não | Não |
| Creatinina pós, mg/dLb | 1,6 | 1,4 | 1,0 | 1,1 | 3,9 | 1,6 | 0,7 |
| Clearance de creatinina pré, mL.min.1.732 | 32,9 | 59,7 | 43,0 | 71,7 | 15,2 | 58,1 | 89,3 |
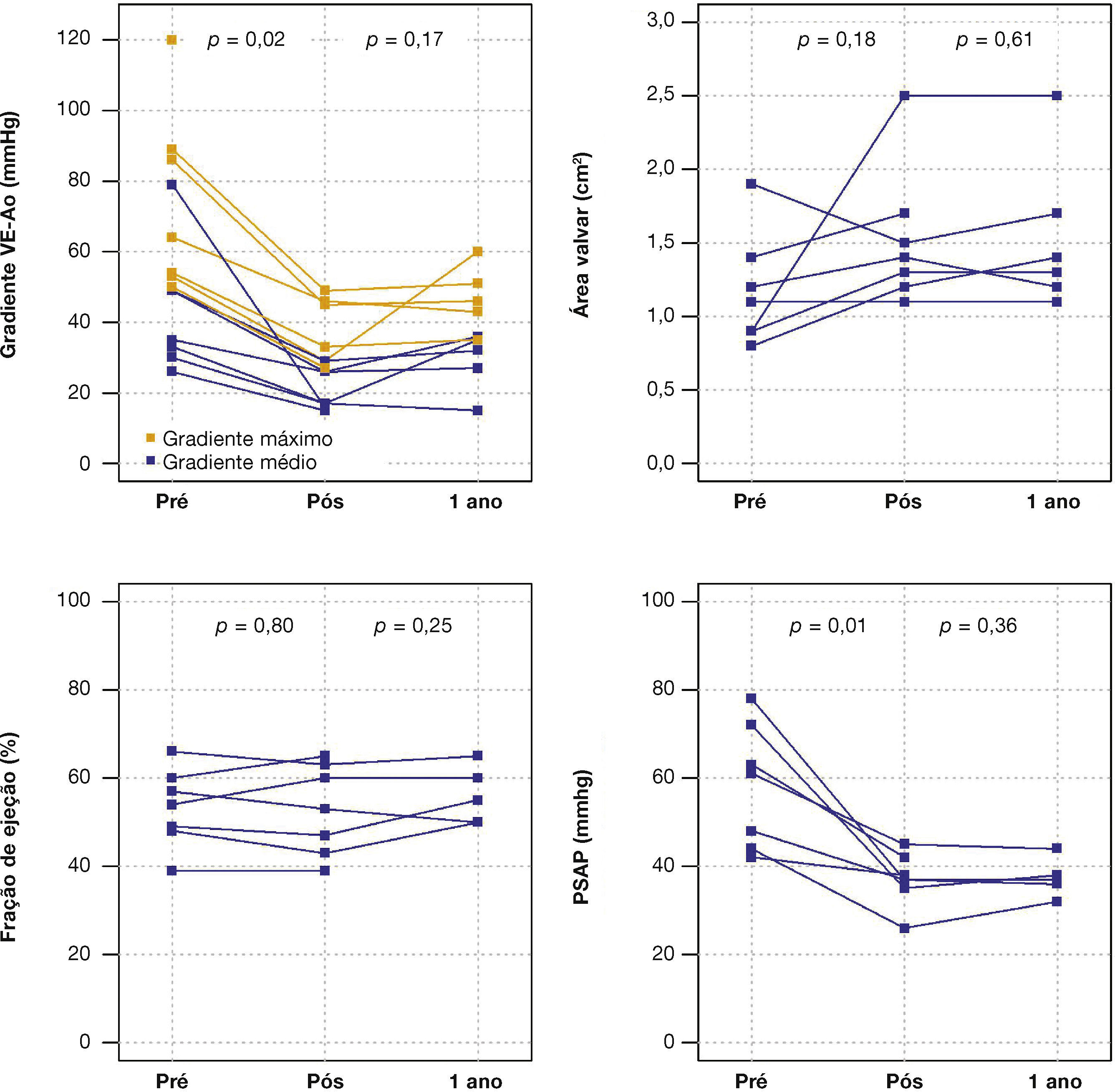
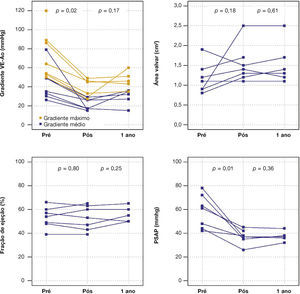
Ao ecocardiograma, o gradiente máximo ventrículo esquerdo/aorta reduziu‐se de 73,7 ± 25,9mmHg para 38,2 ± 9,6mmHg (p = 0,01) e o gradiente médio, de 38,2 ± 9,6mmHg para 20,9 ± 5,9mmHg (p = 0,02). Houve queda significativa da PSAP de 58,3 ± 14,0mmHg para 37,1 ± 6,0mmHg (p = 0,01) e aumento da área valvar de 1,2 ± 0,4cm2 para 1,5 ± 0,5cm2 (p = 0,18) (fig. 1).
O sucesso do dispositivo ocorreu em seis dos sete pacientes (85,7%). O primeiro paciente da série apresentou desproporção paciente‐prótese (mismatch) moderada, com área do orifício efetivo indexado de 0,67cm2/m2, insuficiência aórtica moderada, regurgitação paravalvular moderada e necessidade de uma segunda prótese imediatamente após o procedimento. Durante a internação hospitalar, este paciente evoluiu com choque cardiogênico, insuficiência renal aguda (estágio AKIN 3) com necessidade de hemodiálise, e insuficiência respiratória, vindo a falecer 48 horas após o procedimento.
Dois pacientes apresentaram bloqueio de ramo esquerdo após o procedimento, sem necessidade de implante de marca‐passo definitivo. A recuperação intra‐hospitalar dos seis pacientes ocorreu sem intercorrências, e todos obtiveram alta hospitalar no sétimo dia pós‐procedimento.
Seguimento clínicoAo final de 30 dias, o desfecho de segurança precoce foi atingido em 85,7% dos pacientes.
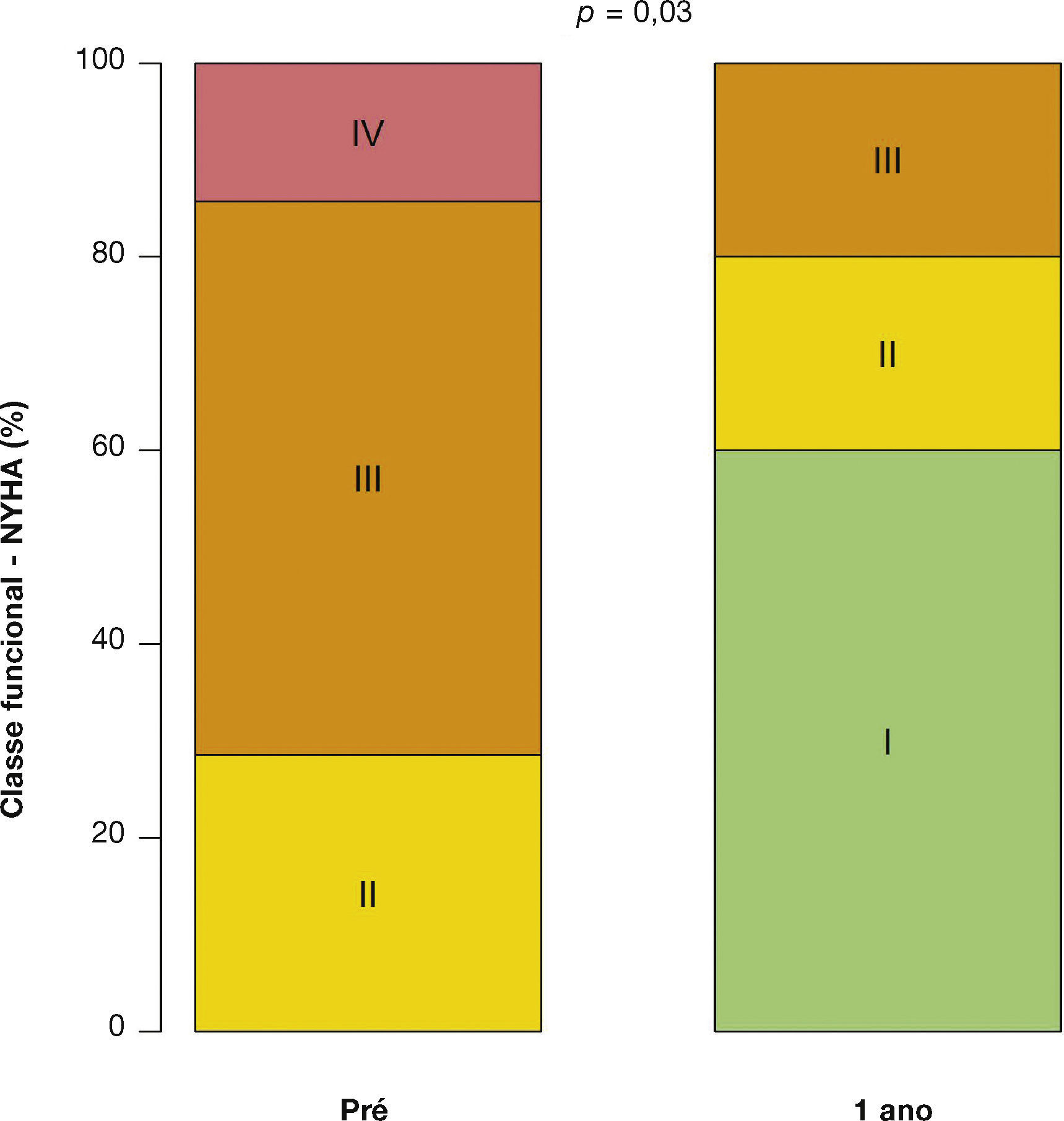
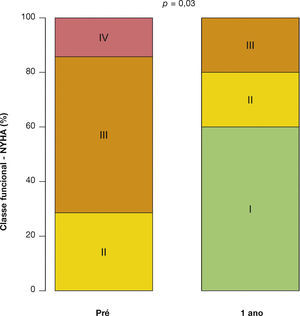
Após média de acompanhamento de 585 dias (288 a 776 dias), somente um dos pacientes ainda não havia atingido 1 ano de evolução pós‐procedimento. Ao final de 12 meses, não houve necessidade de re‐hospitalização, e 80% dos pacientes estavam em classe funcional NYHA I ou II (p = 0,03), tendo sido atingido, dessa forma, o desfecho de eficácia clínica. Neste período, não foram encontradas diferenças significativas nos gradientes transvalvares, na área valvar, na fração de ejeção do ventrículo esquerdo ou na PSAP, quando comparados aos resultados imediatos: o gradiente ventrículo esquerdo‐aorta médio foi de 29,0 ± 8,6mmHg (p = 0,17); a área valvar da prótese aórtica de 1,5 ± 0,5cm2 (p = 0,61); a fração de ejeção de ventrículo esquerdo de 56,0 ± 6,5% (p = 0,25); e a PSAP de 37,4 ± 4,3mmHg (p = 0,36) (fig. 2). Não foram identificados sinais de disfunção estrutural e nem de deteriorização hemodinâmica em nenhum dos casos.
DiscussãoO presente estudo descreveu a experiência inicial de um grupo multidisciplinar com o implante transcateter VIV para tratamento de disfunção de bioprótese cirúrgica em posição aórtica em pacientes de alto risco cirúrgico. Os dados foram obtidos em um ambiente da prática clínica e confirmam sua viabilidade técnica, proporcionando aos indivíduos tratados benefícios clínicos e hemodinâmicos nos primeiros 30 dias, os quais foram sustentados ao final de 1 ano.
Descrito primeiramente por Wenaweser et al.,18 o implante VIV tem sido aplicado a pacientes em todo o mundo, e seus desfechos clínicos foram analisados em diversas séries9,19–22 e por estudos multicêntricos.11,14 Nestes registros, a idade média foi de 78 anos, e as estimativas de risco cirúrgico por EuroSCORE logístico e escore STS foram 31,3% e 11,3%, respectivamente. Tal perfil clínico assemelha‐se ao de nossa coorte, também constituída por pacientes considerados de alto risco cirúrgico (EuroSCORE logístico > 20% e escore STS > 8%).
No maior registro até então publicado, o VIVID (Valve In Valve International Data), com 429 pacientes, o índice de sucesso do procedimento foi de 93,1%, com mortalidade aos 30 dias de 7,6%. Dos sobreviventes, 92,6% evoluíram no período com classe I/II NYHA. A sobrevida foi de 83,2% aos 12 meses.14 Em nossa casuística, o sucesso do procedimento traduziu‐se em significativa melhora clínica, com a maioria dos pacientes (80%) em classe funcional NYHA I/II após o primeiro ano.
Em geral, o sucesso clínico do implante percutâneo de prótese valvar aórtica transcateter (TAVI) está fundamentalmente relacionado às características basais dos pacientes tratados, à técnica empregada e aos dispositivos utilizados. Os conhecimentos acumulados desempenham papel de destaque para melhoria de seus resultados. Nos últimos anos, em particular, importantes conceitos têm sido aplicados nos procedimentos VIV. Em nossa série, o primeiro paciente tratado apresentou mismatch e refluxo paraprotético moderados, potencialmente associados ao tamanho da prótese transcateter utilizada e seu posicionamento. Este paciente apresentou evolução desfavorável, com choque cardiogênico pós‐procedimento. Naquela fase da curva de aprendizado, particularidades hoje reconhecidas como fundamentais dos procedimentos VIV ainda não tinham sido estudadas ou descritas.
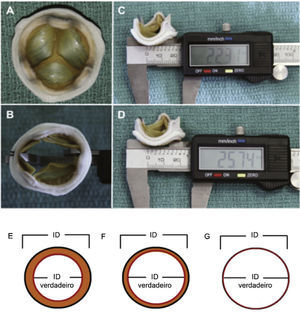
Dessa maneira, importantes aspectos, como modelo, design e tamanho da bioprótese cirúrgica que apresenta disfunção, devem ser valorizados para a escolha do tamanho da prótese transcateter a ser implantada. A determinação do diâmetro interno verdadeiro da prótese cirúrgica é um dos fatores mais importantes nesse cenário entende‐se por diâmetro verdadeiro o diâmetro do anel interno da bioprótese menos o espaço ocupado pelos folhetos (porcinos ou de pericárdio bovino) (fig. 3).
(A) Bioprótese cirúrgica com folhetos porcinos. (B) Aferição do diâmetro interno da bioprótese com auxílio de um paquímetro. (C) Sutil distorção da valva causada pelo paquímetro, podendo levar a medidas incorretas. Primeira medida: 22,31mm. (D) Segunda medida: 25,74mm, evidenciando o efeito causado pela distorção. (E) Próteses de folhetos porcinos: o diâmetro interno (DI) verdadeiro é pelo menos 2mm menor que o DI do stent. (F) Valvas de pericárdio bovino com folhetos suturados internamente ao stent: o DI é pelo menos 1mm menor que o DI intra‐stent. (G) Valvas de pericárdio bovino com folhetos suturados externamente ao stent: DI verdadeiro é o mesmo que o DI intra‐stent.
Adaptado de Bapat et al., 23.
O conhecimento do aspecto fluoroscópico de determinada prótese cirúrgica define a posição ideal para o implante da bioprótese transcateter (em geral, de 15% abaixo do anel de sutura para a prótese Sapien XT e de zero a 4mm para a CoreValve)24 (fig. 4). Atualmente, o aplicativo para smartphones desenvolvido em 2013 por Bapat15 permite acessar as informações estruturais necessárias das diversas biopróteses cirúrgicas, auxiliando na escolha do tamanho e no posicionamento mais adequado da prótese VIV, e reduzindo a possibilidade de mismatch e de refluxo aórtico.
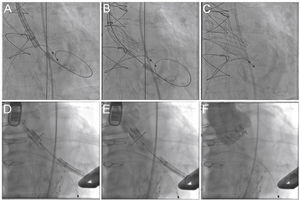
Procedimento valve‐in‐valve com as próteses CoreValve (A‐C) e Sapien XT (D‐F). (A) O anel de sutura radiopaco da bioprótese é visualizado por fluoroscopia, sendo verificadas a angulação adequada antes do procedimento e a landing zone. (B) Liberação da prótese autoexpansível CoreValve, lenta e gradualmente, e controle por fluoroscopia. (C) Posição final da prótese. (D) Posicionamento da prótese balão‐expansível Sapien XT. (E) liberação sob fluoroscopia e resultado após o implante (F).
Nesta série, o gradiente transvalvar médio após o procedimento VIV foi de 20,9 ± 5,9mmHg, e 42% dos pacientes apresentaram gradiente médio ≥ 20mmHg. Tais valores são maiores do que os comumente observados após TAVI em estenose valvar nativa (≤ 10mmHg). Estudos apontam que a ocorrência de mismatch grave (< 0,65cm2/m2) após VIV aórtico é de 32,1%. Gradientes transvalvares mais altos são, portanto, de alguma forma esperados nesses procedimentos: a prótese VIV é implantada dentro de estrutura não distensível (no caso, o anel da prótese cirúrgica), resultando em uma menor área efetiva de fluxo.9,25 Alguns pacientes apresentam, ainda, mismatch e gradiente médio basal elevado após a troca valvar cirúrgica (principalmente com biopróteses < 23mm). Esse fato também contribui para a observação de gradientes mais altos após VIV.14,26 Na série atual, contudo, mesmo pacientes com gradiente médio > 20mmHg após VIV obtiveram melhora significativa dos sintomas de insuficiência cardíaca.
Devido à reduzida casuística, não foi observada diferença estatisticamente significativa entre o gradiente médio obtido após VIV com próteses autoexpansível vs. balão‐expansível. Na série de Dvir et al., tanto o tratamento da disfunção de prótese cirúrgica do tipo estenose como o implante de prótese balão‐expansível estiveram associados a maiores gradientes transvalvares pós‐procedimento.14
Neste estudo, não observamos complicações como AVC ou necessidade de marca‐passo permanente. De fato, evidências apontam que o procedimento VIV não eleva o risco de distúrbios de condução, a necessidade de marca‐passo e nem de AVC, quando comparado ao tratamento de estenose valvar nativa.27 As taxas de regurgitação paravalvar são substancialmente menores quando comparadas ao TAVI.9
Não foram detectados casos de insuficiência aórtica, aumento progressivo de gradiente valvar após o implante ou evidências de degeneração de folhetos nas avaliações ecocardiográficas seriadas.
ConclusõesNesta casuística inicial, o procedimento valve‐in‐valve foi clinicamente eficaz, traduzindo‐se em resultados imediatos favoráveis a pacientes com disfunção de biopróteses aórticas e de alto risco cirúrgico. Os benefícios clínicos e hemodinâmicos auferidos mantiveram‐se sustentados em seguimento de médio prazo. Estudos com maior número de pacientes e seguimento de mais longo prazo ainda são necessários para consolidar sua indicação, principalmente em indivíduos de menor risco cirúrgico.
Fonte de financiamentoNão há.
Conflitos de interesseDr. Dimytri A. Siqueira é proctor das empresas Edwards, Medtronic e Symetis. O Dr. Alexandre Abizaid é proctor das empresas Edwards, Medtronic e Symetis. A Dra. Magaly Arrais é proctor das empresas Edwards e Medtronic. Os demais autores declaram não haver conflito de interesses relacionado a este manuscrito.
À equipe do Centro de Pesquisa Clínica da Seção de Angioplastia Coronária: Renata Viana, Patricia Stein e Mayra Mika. Ao Sr. Reginaldo Barreto, pela disponibilização, organização e auxílio na coleta das informações do banco de dados do Serviço de Cardiologia Invasiva do Instituto Dante Pazzanese de Cardiologia.
A revisão por pares é de responsabilidade da Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.