Primero, valorar la adherencia a las recomendaciones de la guía de práctica clínica de manejo de la infección por Clostridium difficile de las sociedades americanas de enfermedades infecciosas y epidemiología de 2010 y evaluar su influencia en la evolución de los pacientes. Segundo, identificar las recomendaciones no aplicadas en la práctica para su posterior implementación.
Material y métodosEstudio retrospectivo, descriptivo, de pacientes con síntomas clínicos compatibles y positividad para toxinas A y/o B de C. difficile en heces, en un servicio de medicina interna de un hospital de tercer nivel, en un período de 36 meses. Se recogieron datos clínicos, demográficos, evolutivos, factores de riesgo y la adherencia a las recomendaciones de la guía de práctica clínica.
ResultadosSe identificaron 77 pacientes con infección por C. difficile (87 episodios). La estratificación por gravedad mostró un 49,3% de pacientes leves-moderados, 35,1% graves y 15,6% graves-complicados. La adherencia completa a las recomendaciones terapéuticas se observó en 40,2% de pacientes y fue significativamente mejor en los leves-moderados (71,0%), que en los graves (7,4%) o graves complicados (16,6%) (p<0,003). La adherencia se asoció significativamente a una mayor probabilidad de curación (57% vs 42%) y menor de recurrencia (22,2% vs 77,7%) y mortalidad (25% vs 75%) (p<0,01). Las recomendaciones no implementadas fueron la estratificación de la gravedad de los pacientes y la adecuación del tratamiento antibiótico a la categoría de gravedad clínica.
ConclusionesLa adherencia a las recomendaciones terapéuticas de las guías es baja, especialmente en pacientes graves y graves complicados, asociándose a un peor curso evolutivo. Se precisan intervenciones educacionales para mejorar su aplicación.
The first aim was to determine whether patients are being treated in accordance with the Society for Healthcare Epidemiology of America and the Infectious Diseases Society of America (IDSA/SHEA) Clostridium difficile guidelines and whether adherence impacts patient outcomes. The second aim was to identify specific action items in the guidelines that are not being translated into clinical practice, for their subsequent implementation.
Material and methodsA retrospective, descriptive study was conducted over a 36 month period, on patients with compatible clinical symptoms and positive test for C. difficile toxins A and/or B in stool samples, in an internal medicine department of a tertiary medical centre. Patient demographic and clinical data (outcomes, comorbidity, risk factors) and compliance with guidelines, were examined
ResultsA total of 77 patients with C. difficile infection were identified (87 episodes). Stratified by disease severity criteria, 49.3% of patients were mild-moderate, 35.1% severe, and 15.6% severe-complicated. Full adherence with the guidelines was observed in only 40.2% of patients, and was significantly better for mild-moderate (71.0%), than in severe (7.4%) or severe-complicated patients (16.6%) (P<.003). Adherence was significantly associated with clinical cure (57% vs 42%), fewer recurrences (22.2% vs 77.7%), and mortality (25% vs 75%) (P<.01). The stratification of severity of the episode, and the adequacy of antibiotic to clinical severity, need improvement.
ConclusionsOverall adherence with the guidelines for management of Clostridium difficile infection was poor, especially in severe and severe-complicated patients, being associated with worse clinical outcomes. Educational interventions aimed at improving guideline adherence are warranted.
Clostridium difficile fue identificado como causa de colitis pseudomembranosa asociada al uso de clindamicina en 19781. Aunque la infección por C. difficile (ICD) se asocia sobre todo al uso de los antibióticos, su epidemiología ha cambiado en las 3 últimas décadas, debido a la aparición de brotes de ICD grave causados por la cepa BI/NAP1/027, y por afectar a pacientes previamente no considerados en riesgo (embarazadas, niños, pacientes con enfermedad inflamatoria intestinal y personas sin contacto reciente con el sistema sanitario)2–4.
La ICD tiene un impacto importante en los pacientes (12-31% fallecimientos5,6, 20-30% recurrencias7) y en el sistema sanitario (incremento del coste del ingreso en 33-54% y aumento de reingresos2–4). En nuestro país estudios con diferentes metodologías estiman una incidencia creciente de la ICD (de 41,2 casos por 100.000 altas5 a 171 casos por 100.000 ingresos6, en el período 1997 a 2007), relacionada con la prevalencia de los principales factores de riesgo para ICD (uso de antibióticos, envejecimiento y aumento de las comorbilidades)2–4,8, no con la circulación de la cepa BI/NAP1/027 (aunque se han descrito casos aislados9). Estos factores de riesgo son prevalentes en los pacientes ingresados en los servicios de medicina interna, que atienden el 54,6% del total de episodios con diagnóstico principal de ICD de nuestro país10.
La Infectious Diseases Society of America (IDSA) y la Society for Healthcare Epidemiology of America (SHEA) elaboraron guías conjuntas de práctica clínica para la ICD en 199511 y 20103. La guía de 1995 recomendaba metronidazol en la mayoría de los casos, reservando vancomicina en el fracaso a metronidazol11. Los cambios epidemiológicos de la ICD y las evidencias de la superioridad de vancomicina en casos graves de ICD motivaron que la guía IDSA-SHEA de 2010 recomendara estratificar la gravedad de los episodios y tratar con metronidazol oral solo los episodios leves-moderados, con vancomicina oral los graves y con vancomicina enteral (oral, sonda nasogástrica, rectal) y metronidazol intravenoso los graves complicados3.
Dada la relevancia de la ICD, su creciente incidencia e impacto en la actividad de los servicios de medicina interna, y que las recomendaciones incluidas en la guía IDSA-SHEA de 2010 suponen cambios significativos en la práctica clínica, se plantea la realización del presente estudio, que tiene como objetivo principal determinar la adherencia a estas recomendaciones y su impacto en la evolución de los pacientes ingresados en un servicio de medicina interna de un hospital de tercer nivel, y determinar las áreas de mejora para su posterior implementación.
Pacientes y métodosEstudio retrospectivo de los pacientes con ICD atendidos por el servicio de Medicina Interna del Hospital Clínico Universitario de Valladolid, entre enero de 2010 a diciembre de 2012, obtenidos de la base de datos del Servicio de Microbiología. El diagnóstico microbiológico de ICD en nuestro centro en ese período se realizó mediante la detección de la toxina y el antígeno de C. difficile (glutamato deshidrogenasa) por inmunocromatografía en las heces (ALERE Scarborough INC, Maine, EE. UU). El estudio fue autorizado por la comisión de investigación del centro.
Objetivo primarioValorar la adherencia a las recomendaciones de la guía de práctica clínica de ICD de la IDSA-SHEA 20103 y su impacto en la evolución de los pacientes.
Objetivos secundariosDetectar las áreas de mejora en la implementación de la guía. Conocer la incidencia y características de los casos de ICD (origen, factores de riesgo, gravedad, evolución).
Definición de paciente con infección por C. difficilePaciente con diarrea (más de 3 deposiciones de heces no formadas en menos de 24h) y demostración de C. difficile toxigénico o toxinas3.
Procedencia de la ICD: comunitaria (no hospitalización previa, menos de 48h de ingreso; más de 12 semanas tras el alta); indeterminada (4-12 semanas tras el alta) y asociada a cuidados sanitarios (más de 48h del ingreso, menos de 4 semanas tras el alta)3,4.
Estratificación de la gravedad del pacienteSe realiza en el momento del diagnóstico de la ICD según los criterios IDSA-SHEA 20103 como paso previo a la indicación terapéutica: leve-moderado (leucocitos <15.000/ml y creatinina<1,5 veces la basal), grave (leucocitos ≥15.000/ml o creatinina≥1,5 veces la basal) y grave complicado (hipotensión o shock, íleo, colitis fulminante y megacolon)3.
Adherencia a las recomendaciones de la guía de práctica clínica de las sociedades americanas de enfermedades infecciosas y epidemiología de 20103Se considera adherencia parcial cuando el paciente recibe el antibiótico indicado por la guía, y adherencia completa cuando recibe el antibiótico indicado por la vía correcta.
Respuesta al tratamiento12,131) Curación: descenso en la frecuencia y aumento de la consistencia deposicional (3 o menos deposiciones de heces no formadas en 2 días consecutivos) o resolución de la diarrea tras 3 días de tratamiento, sin nuevos signos de colitis grave; 2) fracaso clínico: ausencia de respuesta al tratamiento de la ICD, con persistencia de la diarrea, necesidad de terapia adicional para la ICD o ambos; 3) Recurrencia: reaparición de más de 3 deposiciones diarreicas en 24h durante 2 días o aparición de signos de colitis grave y positividad de C. difficile toxigénico en las heces, sin evidencia de otra causa de diarrea, tras haber respondido al tratamiento inicial para ICD; y 4) éxitus: fallecimiento del paciente durante el episodio atribuible a ICD como causa principal o contribuyente, o a otras causas.
Se valoraron en cada paciente las características epidemiológicas (edad, sexo, institucionalización, hospitalización previa), la comorbilidad (índice de Charlson14), los factores de riesgo para ICD, la situación nutricional (método CONUT15), sintomatología, métodos diagnósticos, el valor de leucocitos totales y creatinina y la evolución del episodio (complicaciones, estancia y mortalidad).
Las variables cuantitativas se presentan con la media y la desviación típica y las cualitativas según su distribución de frecuencias. Mediante el test Chi-cuadrado de Pearson se ha analizado la asociación de las variables cualitativas. En el caso de que el número de celdas con valores esperados menores de 5 fuera mayor de un 20%, se ha utilizado el test exacto de Fisher o el test Razón de verosimilitud para variables con más de 2 categorías. Las comparaciones de los valores cuantitativos se ha realizado mediante la prueba «t» de Student o el ANOVA de un factor para muestras independientes, dependiendo de si el número de grupos a comparar es 2 o mayor. En aquellos casos en los que no se podían utilizar estas pruebas, las alternativas no paramétricas han sido el test de Mann Whitney y el de Kruskall Wallis. Los datos fueron almacenados en el sistema de gestión de datos de investigación del Hospital Clínico Universitario de Valladolid, cumpliendo con la ley de protección de datos, y han sido analizados con el programa estadístico IBM SPSS Statistics versión 20.0 para Windows. Aquellos valores de p<0,05 han sido considerados estadísticamente significativos.
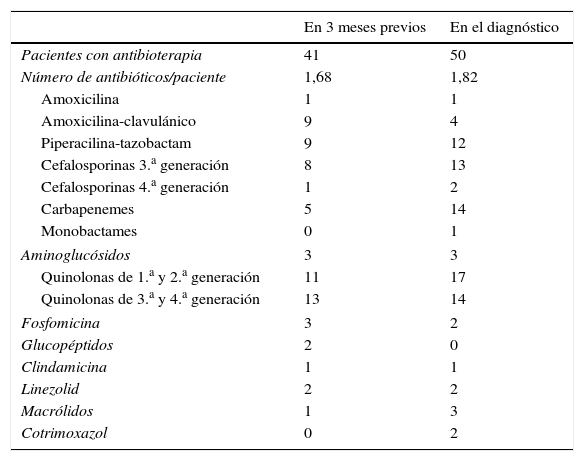
ResultadosEn el período de estudio se identificaron 77 pacientes con ICD, con 87 episodios totales de ICD: 7 pacientes presentaron 10 episodios de recurrencia (una en 5 pacientes, 2 en un paciente y 3 en un paciente). La tasa de infección por ICD fue de 70,8 episodios/10.000 ingresos en el servicio de Medicina Interna; la tasa de recurrencia fue del 11,4%. Entre las características de los pacientes (tablas 1 y 2) destacaron la elevada edad (80,5% mayores de 65 años), comorbilidad (85,7% con Charlson≥3), desnutrición (moderada-grave en 57,1%), su origen en cuidados sanitarios en 76,6% y la presencia de factores de riesgo clásicos en 91%. El 53,2% de los pacientes había recibido antibióticos no dirigidos a la ICD en los 3 meses previos, y 64,9% los estaban recibiendo en el momento del diagnóstico de la ICD. Los antibióticos más frecuentemente implicados fueron betalactámicos (47-51%) y quinolonas (34%) (tabla 3). La estratificación por gravedad mostró un 49,3% de pacientes leves-moderados, 35,1% graves y 15,6% graves-complicados. Fallecieron 29 pacientes (37,6%), siendo la ICD causa principal en 8 y la causa contribuyente en 15.
Características de los pacientes con infección por Clostridium difficile (n=77)
| Características epidemiológicas | |
| Número total de episodios | 87 |
| Número de recurrencias | 10 |
| Edad, años (media±DE) | 78±15 años |
| %>65 años | 62 (80,5%) |
| Sexo (mujer) | 37 (48,05%) |
| Origen de la ICD | |
| Asociada a cuidados sanitarios | 59 (76,6%) |
| Comunitaria | 16 (20,8%) |
| Indeterminada | 2 (2,6%) |
| Factores de riesgo de ICD | |
| Indice de Charlson (media±DE) | 6,1±3,1 |
| Indice Charlson≥3 | 66 (85,7%) |
| Institucionalizado | 21 (27,2%) |
| Hospitalizado en mes previo | 22 (28,5%) |
| Antibiótico no dirigido a C. difficile en los 3 meses previos | 41 (53,2%) |
| Antibiótico no dirigido a C. difficile en diagnóstico (n.°/total, %) | 50 (64,9%) |
| Inhibidores bomba protones | 65 (84,4%) |
| Inmunosupresores | 16 (20,7%) |
| Número de factores de riesgo para C. difficile (media±DE) | 4,4±2,1 |
| CONUT (media±DE) | 5,4±2,8 |
| Desnutrición moderada-grave (CONUT>4) | 44 (57,1%) |
| Gravedad | |
| Leve-moderado | 38/77 (49,3%) |
| Grave | 27/77 (35,1%) |
| Grave-complicado | 12/77 (15,6%) |
| Evolución | |
| Estancia media, días (media±DE) | 23±20 |
| Éxitus | 29 (37,6%) |
| Recurrencias | 10 (12,9%) |
CONUT: método de cribado nutricional basado en parámetros bioquímicos; DE: desviación estándar; ICD: infección por Clostridium difficile.
Incidencia de infección por Clostridium difficile, mortalidad y estancia por grupos de edad
| Edad (años) | <40 | 41-59 | 60-79 | >79 | Total | p |
|---|---|---|---|---|---|---|
| N (%) | 2 (2,5) | 8 (10,3) | 18 (23,3) | 49 (63,6) | 77 (100%) | |
| Mujeres | 1 (50%) | 4 (50%) | 9 (50%) | 23 (46,9%) | 37 (48%) | NS |
| Mortalidad | 1 (50%) | 1 (12,5%) | 7 (38,8%) | 20 (40,8%) | 29 (37,6%) | NS |
| Estancia (días) | 23±20 | 19±15 | 34±26 | 20±15 | 23±20 | NS |
NS: diferencias no significativas.
Antibioterapia no dirigida a C. difficile en los 3 meses previos y en el momento del diagnóstico
| En 3 meses previos | En el diagnóstico | |
|---|---|---|
| Pacientes con antibioterapia | 41 | 50 |
| Número de antibióticos/paciente | 1,68 | 1,82 |
| Amoxicilina | 1 | 1 |
| Amoxicilina-clavulánico | 9 | 4 |
| Piperacilina-tazobactam | 9 | 12 |
| Cefalosporinas 3.a generación | 8 | 13 |
| Cefalosporinas 4.a generación | 1 | 2 |
| Carbapenemes | 5 | 14 |
| Monobactames | 0 | 1 |
| Aminoglucósidos | 3 | 3 |
| Quinolonas de 1.a y 2.a generación | 11 | 17 |
| Quinolonas de 3.a y 4.a generación | 13 | 14 |
| Fosfomicina | 3 | 2 |
| Glucopéptidos | 2 | 0 |
| Clindamicina | 1 | 1 |
| Linezolid | 2 | 2 |
| Macrólidos | 1 | 3 |
| Cotrimoxazol | 0 | 2 |
Respecto al manejo terapéutico, en 35,1% se suspendió el tratamiento antibiótico no dirigido a ICD, se administró metronidazol oral en 85,1%, vancomicina oral en 3,75% y la combinación vancomicina enteral (oral/SNG/rectal) y metronidazol intravenoso en 11,1%. Se emplearon probióticos en 25,9%.
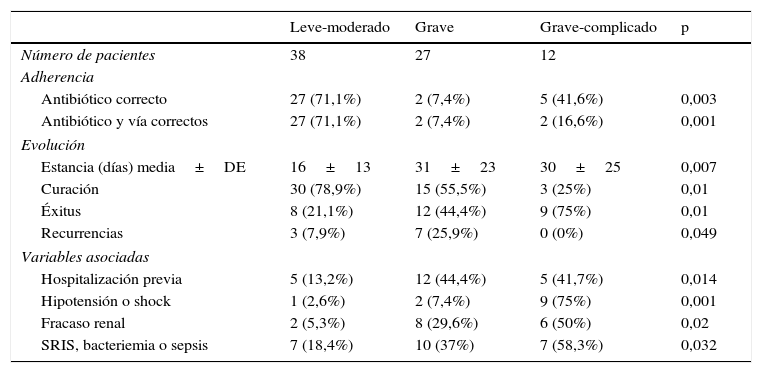
La adherencia a las recomendaciones terapéuticas de la guía IDSA-SHEA 20103 fue parcial en 44,1% y completa en 40,2% de los pacientes (71,05% en leves-moderados, 7,4% en graves y 16,6% en graves complicados). El seguimiento de las recomendaciones difería significativamente según la gravedad de los pacientes. El cumplimiento fue peor en los pacientes graves (p<0,001) (tabla 4), y su menor seguimiento se asoció a un peor pronóstico: menor probabilidad de curación (42% vs 57%), mayor de recurrencia (77,7% vs 22,2%) y de éxitus (75% vs 25%) (p<0,01). La gravedad de los pacientes se asoció con la existencia de una hospitalización reciente, peor evolución (menor curación, mayor estancia y mortalidad) y menor probabilidad de recurrencia en pacientes graves complicados (tabla 4). Las recurrencias también se asociaron a la existencia de antibioterapia no dirigida frente a C. difficile en el momento del diagnóstico (p<0,023).
Adherencia a las recomendaciones de la guía de práctica, evolución y complicaciones de los pacientes, estratificados por nivel de gravedad
| Leve-moderado | Grave | Grave-complicado | p | |
|---|---|---|---|---|
| Número de pacientes | 38 | 27 | 12 | |
| Adherencia | ||||
| Antibiótico correcto | 27 (71,1%) | 2 (7,4%) | 5 (41,6%) | 0,003 |
| Antibiótico y vía correctos | 27 (71,1%) | 2 (7,4%) | 2 (16,6%) | 0,001 |
| Evolución | ||||
| Estancia (días) media±DE | 16±13 | 31±23 | 30±25 | 0,007 |
| Curación | 30 (78,9%) | 15 (55,5%) | 3 (25%) | 0,01 |
| Éxitus | 8 (21,1%) | 12 (44,4%) | 9 (75%) | 0,01 |
| Recurrencias | 3 (7,9%) | 7 (25,9%) | 0 (0%) | 0,049 |
| Variables asociadas | ||||
| Hospitalización previa | 5 (13,2%) | 12 (44,4%) | 5 (41,7%) | 0,014 |
| Hipotensión o shock | 1 (2,6%) | 2 (7,4%) | 9 (75%) | 0,001 |
| Fracaso renal | 2 (5,3%) | 8 (29,6%) | 6 (50%) | 0,02 |
| SRIS, bacteriemia o sepsis | 7 (18,4%) | 10 (37%) | 7 (58,3%) | 0,032 |
DE: desviación estándar; SRIS: síndrome de respuesta inflamatoria sistémica.
No se encontró asociación significativa entre la gravedad de los pacientes con la edad, sexo, origen de la infección, comorbilidad, institucionalización, antibioterapia previa, número de factores de riesgo o desnutrición.
La valoración del objetivo principal de nuestro trabajo permite apreciar una baja adherencia a las recomendaciones IDSA/SHEA 2010 en la ICD (40,2% adherencia completa, 44,1% parcial) y su asociación a una mayor gravedad y peor evolución clínica. Así, se indicó metronidazol en el 85% de pacientes, aunque más del 50% eran graves o graves complicados y hubieran precisado vancomicina oral/enteral. Tampoco se suspendió la antibioterapia no dirigida frente a C. difficile en el 65% de los pacientes, en general por precisarse tratamiento para otra infección simultánea urinaria, respiratoria y/o de partes blandas, lo que constituye un factor de riesgo de recurrencia3,4. La guía IDSA no recomienda la administración de probióticos en la ICD, por la falta de evidencia y riesgo de fungemia; fueron empleados en el 25,9% de los pacientes.
Como en nuestro trabajo, otras series coinciden en mostrar una baja adherencia a las recomendaciones (38,5-43,4%), también significativamente menor en pacientes graves (0-39%) o graves complicados (17,9-35,5%) que en leves-moderados (53,9-85,7%), tratando a más de la mitad de pacientes graves con metronidazol (55-76%)16–18. El análisis de esta pobre adherencia a las recomendaciones muestra varias posibles causas concurrentes. En primer lugar, el desconocimiento o falta de familiaridad con las directrices IDSA-SHEA: el período de estudio se inicia en 2010, año de publicación de la guía, lo que puede haber dificultado su difusión inicial. En segundo lugar, la inercia en la evaluación y manejo terapéutico de los pacientes con ICD: se ha continuado tratando casi todos los episodios iniciales con metronidazol, siguiendo la guía IDSA-SHEA previa de 199511, sin tener en cuenta la estratificación de gravedad y diferente manejo propuesto en la guía de 2010, que hubiera hecho que más de la mitad hubieran recibido vancomicina. Es conocido que es más difícil suspender una práctica habitual que incorporar una recomendación nueva19. Esto también explica la significativa mayor adherencia a las recomendaciones observada en los pacientes con ICD leve-moderada (cuyo tratamiento no se ha modificado en las últimas guías), y significativamente menor en los pacientes graves y graves complicados, con peor evolución clínica (mortalidad y recurrencias). No pensamos que la baja adherencia a las recomendaciones de la guía se haya debido a otros factores, como el mayor coste de la vancomicina oral, el riesgo de aumento de infecciones por microorganismos resistentes a vancomicina, o al desacuerdo con las recomendaciones. Las áreas de mejora evidenciadas son la necesidad de estratificar la gravedad de los pacientes, adecuar la antibioterapia específica de C. difficile a la gravedad y suspender la antibioterapia no dirigida frente a C. difficile cuando sea posible.
La incidencia de ICD obtenida (70,8/10.000 ingresos) es mayor que en otros trabajos de nuestro ámbito (21,6/10.000 altas)20, y puede estar justificada por las diferentes características de los pacientes (mayor edad, comorbilidad, desnutrición y factores de riesgo)20–23 y el diferente método de inclusión empleado (microbiológico). La detección de la toxina de C. difficile tiene un rendimiento 22-29% mayor que el análisis del conjunto mínimo básico de datos, con una concordancia moderada entre ambas metodologías (kappa 0,509)24,25. Un reciente trabajo muestra que solo el 51,5% de las altas con estudio microbiológico positivo para C. difficile incluían este diagnóstico en su informe de alta26. El 20,7% de los episodios de ICD tuvieron origen comunitario, dentro del rango de los valores recogidos en la bibliografía (14-36%)6,9,23. La baja sospecha clínica en pacientes sin los factores de riesgo habituales (jóvenes, embarazadas, o pacientes sin contacto con el sistema sanitario) es la principal causa de infradiagnóstico de la ICD (47%)21. Debido a la relevancia de los casos con origen comunitario y al cambio de perfil de pacientes tributarios de sufrir una ICD, los expertos recomiendan solicitar la toxina de C. difficile también en pacientes previamente no considerados en riesgo de ICD, además de hacerlo en pacientes con los factores de riesgo clásicos27.
La mortalidad obtenida (37,6%) es superior a la de otros trabajos europeos (22%)20 o específicos de medicina interna (12,5%)20,23, y puede explicarse por las características y mayor gravedad de los pacientes de nuestra serie (50% graves vs 24-39%)12,13. La baja tasa de recurrencia (11,4% vs 18-25% en la bibliografía)3,4,12,13,23 puede estar influida por el carácter retrospectivo del estudio (con posible pérdida de información tras el primer episodio de ICD) y la elevada tasa de mortalidad de los episodios iniciales.
Son limitaciones de este trabajo su carácter retrospectivo (con los posibles sesgos por pérdida o ausencia de información en las historias clínicas), el sesgo del investigador (ya que el objetivo principal depende de la valoración de la estratificación de gravedad y de la adecuación del tratamiento), la metodología de detección de la toxina de C. difficile por inmunocromatografía (que tiene un rendimiento del 60%), y su realización en un servicio médico de un único centro hospitalario, lo cual limita su validez externa. La ausencia de análisis de la dosis de antibiótico empleada y la duración del mismo es otra limitación, motivada por la dificultad de su obtención, especialmente en los pacientes con ICD leve-moderada (casi la mitad de la muestra) que finalizaban el tratamiento ambulatoriamente.
Como punto fuerte, este trabajo nos ha permitido conocer la adherencia a las recomendaciones en situación de práctica clínica real y su influencia en la evolución de los pacientes, lo que nos ha hecho replantearnos nuestro manejo de la ICD. Se han realizado reuniones formativas para difundir a los facultativos las nuevas guías de práctica de ICD, aportando los resultados de este estudio y subrayando la importancia de la adherencia a estas directrices (mejor evolución de los pacientes). No solo se ha incidido en el manejo terapéutico de los pacientes (adecuación del tratamiento a la estratificación por gravedad y riesgo de recurrencia, con aumento implícito del uso de vancomicina oral), sino también en el diagnóstico (aumento de sospecha clínica, con incremento de solicitudes de estudio de C. difficile en heces), en las medidas de prevención (uso racional de antibióticos e inhibidores de la bomba de protones) y en la prevención de transmisión (adecuada higiene de manos y aislamiento entérico)3,4. También se ha colaborado en la realización del protocolo de manejo de la ICD institucional de nuestro centro. Estas iniciativas están modificando nuestra práctica en la ICD con un aumento de la sospecha diagnóstica (mayor número de peticiones microbiológicas de C. difficile) y aumento en el uso de vancomicina oral (datos no publicados).
En conclusión, se evidencia una adherencia baja a las recomendaciones de la guía de manejo de ICD de IDSA-SHEA 2010, especialmente en pacientes graves y graves-complicados, asociándose un peor curso evolutivo. Es necesario realizar intervenciones educacionales sostenidas para mejorar su aplicación.
Como acabamos de comprobar, existe un amplio margen de mejora en el manejo terapéutico de los pacientes con ICD en la práctica clínica diaria.
Conflicto de interesesLos autores carecen de conflictos de intereses en este trabajo.
A Marifé Muñoz, de la Unidad de apoyo a la Investigación del Hospital Clínico Universitario de Valladolid, por su inestimable ayuda en la elaboración de la base de datos y en su análisis.