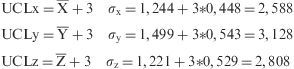El control estadístico de proceso (SPC) fue aplicado para monitorizar la estabilidad del proceso de colocación de pacientes en un tratamiento de radioterapia. Una vez medidos los errores de colocación, si estos indicaban una pérdida de estabilidad se identificaba la causa principal y se procedía a eliminarla para prevenir dichos errores.
Material y métodosSe midieron los errores de colocación en las dimensiones medial-laterales, craneal-caudal y anterior-posterior y se calcularon los límites de control superiores. Una vez conocidos los límites de control y el rango de variabilidad era aceptable, se procedió a observar los errores de colocación utilizando subgrupos de tres pacientes tres veces cada turno y se representaron en una gráfica de control a tiempo real.
ResultadosLos valores de límite de control mostraron que la variabilidad existente era aceptable. Los errores de colocación, medidos y representados en un gráfico de promedio del proceso, ayudaron a controlar la estabilidad del proceso de colocación, ya que si la estabilidad se perdía, el tratamiento se interrumpía, se identificaba la causa específica responsable del patrón no aleatorio y se llevaba a cabo una acción correctora antes de proceder con el tratamiento.
ConclusionesEl protocolo del SPC se centra en el control de la variabilidad debido a una causa asignable en lugar de centrarse en la variabilidad paciente a paciente, la cual no existe normalmente.
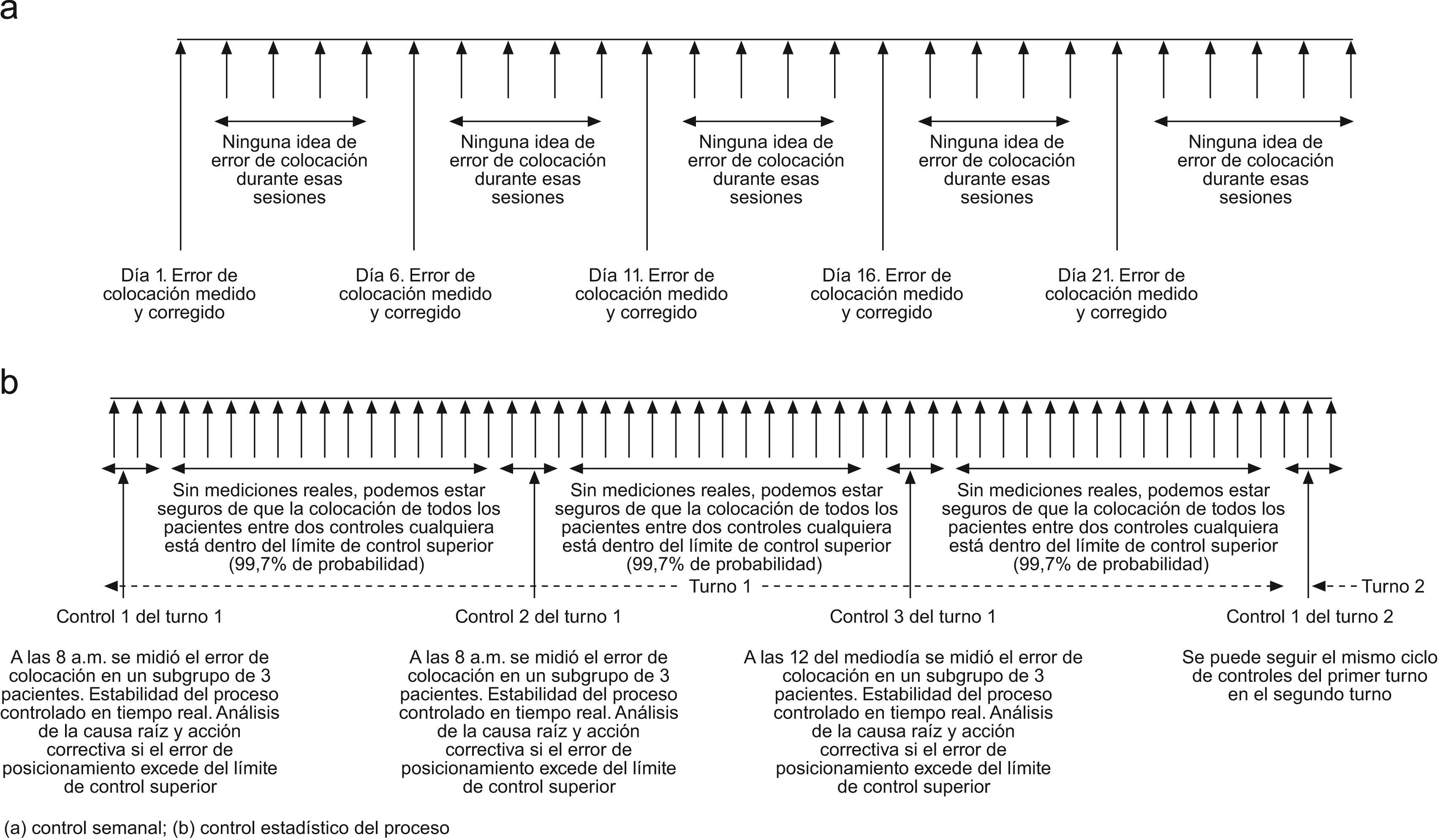
A diferencia del método actual, que consiste en un único control semanal de colocación por paciente y, por tanto, solo asegura la correcta colocación del paciente en dicha sesión, el SPC permite prevenir el error de colocación de todos los pacientes en todas las sesiones al mismo tiempo que se reducen los costes de control.
Statistical Process Control (SPC) was applied to monitor patient set-up in radiotherapy and, when the measured set-up error values indicated a loss of process stability, its root cause was identified and eliminated to prevent set-up errors.
Materials and methodsSet up errors were measured for medial-lateral (ml), cranial-caudal (cc) and anterior-posterior (ap) dimensions and then the upper control limits were calculated.
Once the control limits were known and the range variability was acceptable, treatment set-up errors were monitored using sub-groups of 3 patients, three times each shift. These values were plotted on a control chart in real time.
ResultsControl limit values showed that the existing variation was acceptable. Set-up errors, measured and plotted on a X¯ chart, helped monitor the set-up process stability and, if and when the stability was lost, treatment was interrupted, the particular cause responsible for the non-random pattern was identified and corrective action was taken before proceeding with the treatment.
ConclusionSPC protocol focuses on controlling the variability due to assignable cause instead of focusing on patient-to-patient variability which normally does not exist. Compared to weekly sampling of set-up error in each and every patient, which may only ensure that just those sampled sessions were set-up correctly, the SPC method enables set-up error prevention in all treatment sessions for all patients and, at the same time, reduces the control costs.
Los métodos «lean» en la sanidad tienen como objetivo mejorar la seguridad y la calidad al mismo tiempo que se mejoran los costes1. El control estadístico de proceso (SPC) es una herramienta «lean» y se utiliza en el sector industrial, ya que en dicho sector es necesario asegurar que todos los productos fabricados estén libres de defectos para evitar costes de refabricación y/o desechos, devoluciones de clientes y posibles daños de imagen para la marca del fabricante, pero inspeccionar la totalidad de los productos tendría un coste prohibitivo. Los protocolos del SPC proporcionan bases científicas para definir controles óptimos que sustituyen la necesidad de tener que inspeccionar todos los productos, por lo que se minimizan los costes de control al mismo tiempo que se proporciona la garantía de que cerca del 100% de los productos entregados está libre de defectos2.
El problema del error de colocación en el tratamiento de la radioterapia es comparable al problema en el sector industrial, ya que se debe reproducir la colocación del paciente para proteger los tejidos sanos y asegurar la efectividad del tratamiento, pero la verificación de la colocación en cada sesión de tratamiento no solo tiene un coste prohibitivo, sino que además generaría un período de espera más largo para los nuevos pacientes en el sistema sanitario público de países como España, en el que siempre hay más demanda que oferta.
A raíz de este conflicto entre calidad y productividad, en la mayoría de los centros de radioterapia se efectúa una verificación de colocación semanal. Este tipo de muestreo tiene un beneficio muy limitado, ya que solo se puede corregir el día en que el error es detectado. La figura 1 muestra una comparación entre el control semanal existente y el protocolo propuesto por el SPC. Con el método SPC, si se pudiera demostrar mediante una muestra estadística apropiada que el proceso fue estable durante todo el turno del tratamiento, se podría afirmar con un 99,7% de probabilidad que todos los pacientes tratados fueron colocados correctamente.
En cualquier proceso se produce variabilidad. Los errores debidos a causas comunes siempre se presentan en cualquier proceso. Una «causa común» de variación en la bibliografía industrial se conoce como «error aleatorio» en la bibliografía sobre radioterapia. En primer lugar, se cuantifica la variabilidad existente debido a causas comunes para ver si es aceptable, de no serlo se realiza una mejora del proceso para reducir dicha variabilidad. Una vez encontrada la variabilidad del proceso que genera un rango aceptable, se puede controlar la estabilidad del proceso, con lo que, cuando el proceso es estable, se puede decir que el proceso ha variado solo dentro del rango aceptable.
Con el fin de controlar la estabilidad del proceso se usan los límites de control (promedio del proceso (X¯)±3σ). Si el proceso pierde estabilidad será debido a una excesiva variación producida por una «causa asignable» (una «causa asignable» o una «causa especial» de variación en la bibliografía sobre radioterapia es conocida como un «error sistemático»), por tanto, se debe identificar esa causa asignable, llevar a cabo una acción correctiva y, así, reconducir el proceso hacia su variabilidad original.
Holli et al investigaron la variabilidad entre físicos en planificación de radioterapia empleando gráficas de rango para pacientes de cáncer de mama después de la mastectomía y concluyeron que los procesos planificados requerían una mejora que incluyera formación del médico3. En otro estudio parecido, Pitkanen et al investigaron la variabilidad del volumen blanco de planificación en médicos con pacientes de cáncer de mama tras una cuidadosa cirugía y encontraron que entre los médicos existía una inaceptable variabilidad en la delineación del volumen blanco de planificación4. Pawlickia et al fueron primeros en aplicar el SPC en radioterapia con un haz de fotones de 10MV5. Utilizando las gráficas de control del SPC, descubrieron que los umbrales de acción fijados eran capaces de distinguir el error sistemático de los errores aleatorios, y analizaron los beneficios de cuatro aspectos clave del SPC: 1) la disponibilidad de la información cuantificable del error de colocación; 2) la disponibilidad del error aleatorio (también conocido como «causa común de variación»), información que permite la determinación del límite aceptable del comportamiento del proceso (también conocido como el «límite de control superior [UCL]»); 3) la medición interactiva del error en tiempo real y la interpretación de los usuarios, y 4) la interpretación causa-efecto de la mejora de variabilidad. Otra aplicación más reciente del SPC en radioterapia consiste en evaluar en un cierto plazo de tiempo el funcionamiento dosimétrico del proceso de radioterapia de intensidad modulada para conseguir la estabilidad y encontrar los niveles de tolerancia aceptables6.
Un estudio de la bibliografía muestra que la aplicación del SPC es relativamente un nuevo fenómeno. En nuestro estudio para el tratamiento de pacientes con cáncer de próstata utilizando radioterapia se aplicó una metodología del SPC para definir el protocolo de control de colocación del paciente con los siguientes objetivos:
- 1.
Definir el proceso de variabilidad existente y asegurarse de que la variabilidad sea aceptable.
- 2.
Aplicar un control estadístico del proceso para detectar cualquier pérdida de estabilidad de este, evidenciada por los errores de colocación que exceden la variabilidad normal aceptable.
- 3.
Identificar y eliminar las causas especiales cuando el proceso de colocación pierde estabilidad antes de continuar con el tratamiento.
- 4.
Asegurarse de que todas las sesiones de tratamiento de todos los pacientes se llevan a cabo en condiciones estables, es decir, que los errores de colocación siempre se mantengan en un rango aceptable de variabilidad.
El estudio se realizó en el Servicio de Oncología Radioterapia del Instituto Catalán de Oncología ubicado en el Hospital Germans Trias i Pujol (Badalona), que trata aproximadamente a 1.500 pacientes al año. Dicho Servicio está dotado de tres aceleradores lineales de uso clínico que generan fotones (6 y 18MV) y electrones (4, 6, 9, 12, 16 y 20MeV), un equipo de tomografía computarizada y dos equipos de planificación tridimensional; en él trabajan 8 oncólogos radioterapeutas, 3 radiofísicos, 7 diplomados de enfermería, 11 técnicos especialistas en radioterapia, 4 administrativos y 1 celador.
El estudio se llevó a cabo durante el primer semestre de 2007 y participaron un total de 67 pacientes de cáncer de próstata no obesos (IMC<30 kg/m2) tratados con la técnica radioterapia de intensidad modulada, de los cuales 9 se utilizaron para la fase 1 y los 58 restantes para la fase 2.
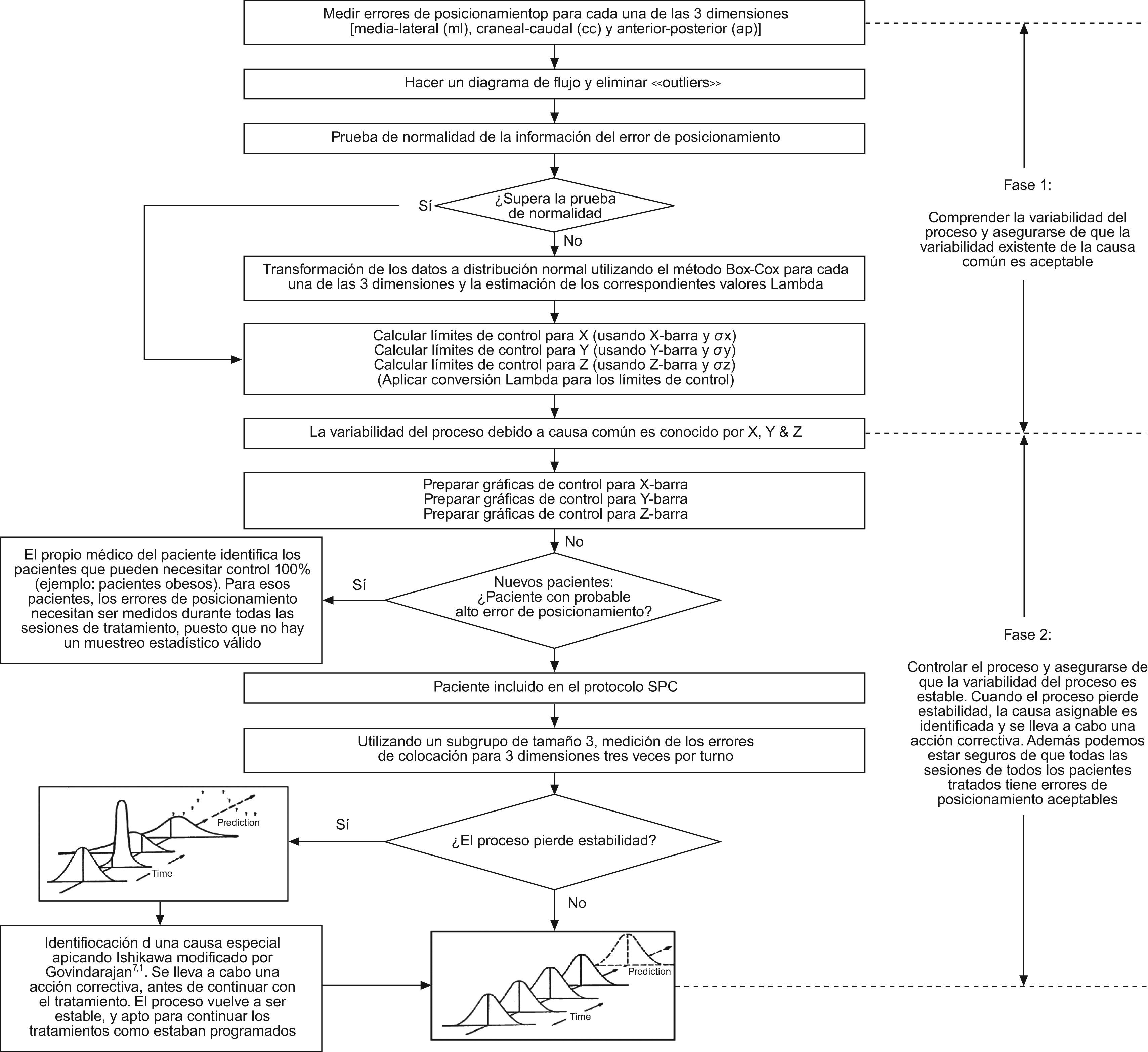
Fase 1: conocimiento de las causas comunes de variabilidad en el error de colocaciónLa información del error de colocación fue recopilada de las dimensiones medial-lateral (ml), craneal-caudal (cc) y anterior-posterior (ap) medidas durante un período de 4 meses en cada sesión de tratamiento. El número total de errores de colocación recopilados fue de 270 (n=270) para cada una de las tres dimensiones con respecto al punto de referencia para cada sesión de tratamiento de cada uno de los pacientes que participaron en el estudio. Los errores de colocación medidos podían ser +ve o –ve dependiendo de en qué lado del valor de referencia cayó el valor medido. Todos los valores medidos eran convertidos a valores absolutos, ya que lo que interesaba era medir y controlar la magnitud del error.
En este protocolo, los pacientes obesos, dado que es más probable que tengan niveles más altos de errores de colocación, fueron excluidos porque requieren una verificación de colocación para el 100% de sus sesiones de tratamiento y su colocación no puede ser controlada estadísticamente. En la primera fase del estudio se midió la variabilidad de los procesos existentes. Diferentes técnicos de tratamiento posicionaron a los pacientes utilizando un procedimiento estandarizado mediante el alineamiento de láseres con tatuajes en la piel en la unidad de tratamiento (antes de aplicar la dosis del tratamiento, el error de colocación se medía comparando las estructuras óseas de la imagen portal [tomada inmediatamente después de la colocación del paciente] con la radiografía digital reconstruida obtenida de la tomografía computarizada el día que se localizó el tumor).
En cualquier proceso, cuando es estable, hay 6 «M» que colectivamente contribuyen a esta variabilidad–causa común de variabilidad. Así, pues, una sola «M» no puede ser asignada específicamente como responsable de la variabilidad. Las 6 «M» son: 1) material; 2) máquina; 3) mano de obra (personal); 4) metodología; 5) medio externo (entorno de trabajo), y 6) medición (dispositivo de medición). Sin embargo, se considera que el proceso tiene una pérdida de estabilidad cuando una de las «M» ha variado en exceso y la causa de dicha variabilidad puede ser identificada y asignada a esa «M» en particular1,7. En el caso de nuestro proceso de colocación, la primera «M» (material) fue representada principalmente por los propios pacientes y los inmovilizadores; la segunda «M» (máquina) fue representada por nuestra unidad de tratamiento; la tercera «M» (mano de obra [personal]) fue representada por nuestros técnicos; la cuarta «M» (metodología) fue representada por nuestro procedimiento de colocación (el cual ha sido estandarizado para minimizar su contribución a la variabilidad total); la quinta «M» (medio externo [entorno de trabajo]) fue representada por el entorno del búnker, y la sexta «M» (medición [dispositivo de medición]) fue representada por el sistema de medición de los errores de colocación.
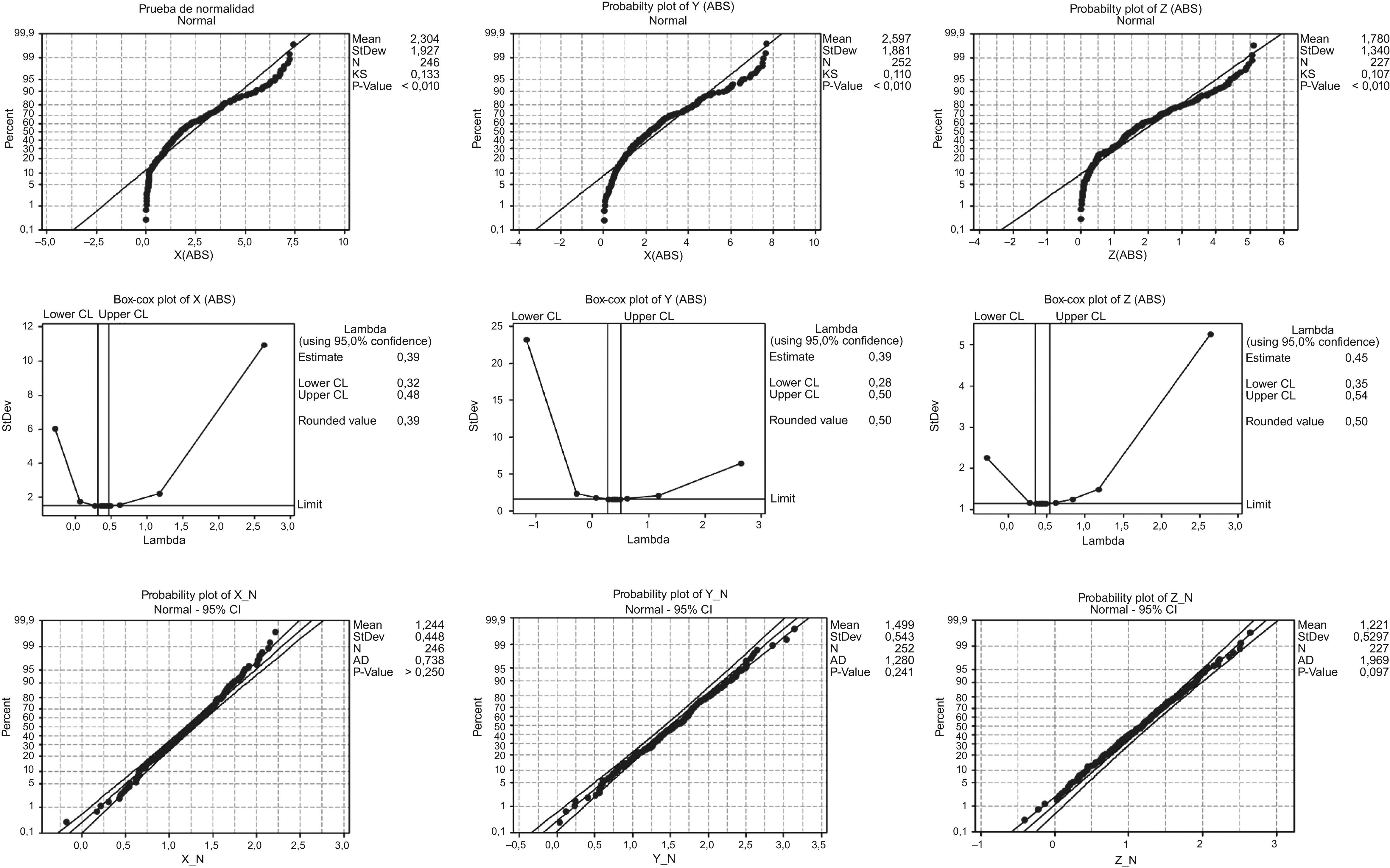
Bajo condiciones estables, el error de colocación medido representó una variabilidad inducida por esas seis causas comunes. Para asegurarse de que esos seis factores de variación por causa común eran mínimos así como que la variabilidad total pudiera ser la mínima posible fueron utilizados a lo largo de todo el estudio los mismos dispositivos de inmovilización, la misma maquinaria, los mismos técnicos, el mismo método estándar, el mismo entorno de trabajo y el mismo sistema de medición del error de colocación. El tratamiento siempre se efectuaba durante la mañana, de 8 de la mañana a 2 de la tarde, para que fuera posible trabajar con los mismos técnicos. El movimiento de los órganos internos no se tenía en cuenta, así que la metodología se centraba en la posición externa del paciente con máxima reproducibilidad. Basándonos en la información inicial obtenida durante la fase 1 del estudio, se hicieron test de normalidad para cada una de las tres dimensiones. Cuando la información no superaba el test de normalidad se realizaba una conversión Box-Cox. Basándonos en los valores λ se construyó una nueva variable y se repitió la prueba de normalidad. Y una vez que la nueva variable pasó la prueba de normalidad se calcularon los límites de control (X¯±3σ) utilizando la información del estudio de la fase 1 con el fin de trazarlos en la gráfica de control. Como el objetivo era minimizar el error de colocación se aplicó solo el UCL (conocido como límite de control unilateral).
Fase 2: control de la estabilidad del proceso y prevención de la causa asignable de variabilidadEn la segunda fase del trabajo se controló la estabilidad del proceso. Se midió el error de colocación tres veces durante cada sesión (a las 8, a las 10 y a las 12h) en tres subgrupos de tres pacientes cada uno. Cada subgrupo se componía de tres pacientes consecutivos. El resultado de los valores X¯ de cada subgrupo se trazaba en la gráfica de control. La gráfica de rango no se trazaba para hacer más simple el control en tiempo real (para causar interrupciones mínimas durante el tratamiento y así evitar demoras o pérdida de productividad), pero los técnicos también fueron instruidos para controlar el rango (sin trazarlo en una gráfica). Se les dijo que no trataran a ningún paciente cuyo error de colocación fuera más allá de 5mm, y se les pidió que en esos casos llamaran al físico que les proporcionaría asistencia. De este modo, los técnicos calcularon el promedio de los subgrupos únicamente cuando los valores individuales no fueron especialmente altos (<5mm). Así, el rango de variabilidad se guardaba bajo control. Los técnicos fueron entrenados para realizar gráficas de control con X¯, y se consideró que el proceso había perdido estabilidad cuando ocurría uno de los siguientes fenómenos:
- 1.
El promedio de algún subgrupo estaba por encima del UCL.
- 2.
Cuando siete puntos seguidos de una línea presentaban una tendencia ascendente (señal de un posible cambio en el promedio del proceso).
- 3.
Aproximadamente dos terceras partes de los puntos trazados no estaban en la tercera región media dentro de los límites superiores e inferiores de control.
El control del punto 1 era responsabilidad de los técnicos. El control de los puntos 2 y 3 era responsabilidad del físico encargado, quien revisaba los datos del gráfico cada día.
Resumen del procedimiento de la gráfica del SPC:
- •
Medir el error de colocación en dimensión X (ml) en tres pacientes consecutivos (nombrados X1, X2 y X3). Convertirlos en valores absolutos.
- •
Calcular (X¯)inicial=(X1+X2+X3)/3.
- •
Computar (X¯)final=(X¯)inicial0,39para convertirlo en un valor normal de distribución antes de trazarlo en la gráfica de control con X¯(λx=0,39). Véase el apartado «Resultados» para entender por qué se lleva a cabo una conversión Box-Cox a distribución normal.
- •
Medir el error de colocación en la dimensión Y (cc) en los tres mismos pacientes consecutivos (nombrados Y1, Y2 y Y3). Convertirlos en valores absolutos.
- •
Calcular (Y¯)inicial=(Y1+Y2+Y3)/3.
- •
Computar (Y¯)final=(Y¯)inicial0,39para convertirlo en un valor normal de distribución antes de trazarlo en la gráfica de control con Y¯(λy=0,39).
- •
Medir el error de colocación en la dimensión Z (ap) en los tres mismos pacientes consecutivos (nombrados Z1, Z2 y Z3). Convertirlos en valores absolutos.
- •
Calcular (Z¯)inicial=(Z1+Z2+Z3)/3.
- •
Computar (Z)¯final=(Z¯)inicial0,45 para convertirlo en un valor normal de distribución antes de trazarlo en la gráfica de control con Z¯ (λz=0,45).
- •
Obtener los puntos de información (X¯)final, (Y¯)finaly (Z¯)finalen sus correspondientes gráficas de control.
- •
Si el proceso pierde estabilidad, se encuentra la causa originaria y se efectúa la acción correctiva antes de continuar con más tratamientos.
- •
Si se quiere saber de nuevo el valor inicial real, todo lo que se tiene que hacer es reconvertir la variable utilizando el correspondiente valor λ. Por ejemplo, (X¯)inicial=(X¯)final(1/λx)=(X¯)final(1/0,39).
Cuando el proceso perdía estabilidad, los técnicos tenían instrucciones de parar el tratamiento temporalmente y contactar con el físico encargado para analizar la causa principal, que consistía en identificar una de las 6 «M» que había causado la variabilidad excesiva en el proceso. La causa asignable tenía que estar entre las seis «M» que contribuyen colectivamente a la variabilidad, como se ha mencionado con anterioridad. Se aplicó el método de análisis de causa Ishikawa modificado por Govindarajan1,7. Una vez identificada la causa asignable (por ejemplo, el paciente no coopera, el tatuaje no es claro, el técnico no sigue el procedimiento, el fallo del dispositivo de inmovilización, el error del láser, la mala interpretación del procedimiento, etc.), se realiza una acción correctiva antes de tratar al paciente y se mide de nuevo el error de colocación para asegurarse de que el nuevo valor vuelve a ser normal. En circunstancias normales, el análisis completo y la acción correctiva no ocupan más de 5min y no causan una interrupción mayor en el tratamiento, pero ayudan a asegurar que la colocación de todos los pacientes entre cualesquiera dos controles está libre de errores. La información fue recopilada durante un mes y el número total de subgrupos fue de 58. La figura 2 describe esquemáticamente la metodología de ambas fases (1 y 2).
ResultadosDe los 270 puntos de información, los «outliers» fueron eliminados y los valores finales «n» utilizados para el análisis estadístico fueron ml=246, cc=252 y ap=227. Cada variable fue sometida al test de distribución normal. Ninguna de las tres dimensiones seguía una distribución normal, por tanto, cada variable fue convertida a una distribución normal utilizando el método Box-Cox (fig. 3). El promedio de los valores de X, Y y Z después de la conversión Box-Cox fue de 1,244; 1,499 y 1,221, respectivamente. Los valores de la desviación estándar para X, Y y Z fueron 0,448; 0,543 y 0,529, respectivamente. Los valores lambda para X, Y y Z fueron 0,39; 0,39 y 0,45, respectivamente. Los UCL fueron calculados utilizando la siguiente fórmula:
Prueba de la distribución normal antes y después de la conversión Box-Cox. Fila superior: prueba inicial de distribución normal; Fila intermedia: conversión Box-Cox; Fila inferior: prueba de distribución normal después de la conversión Box-Cox. Columna izquierda: medial-lateral (ml), con valor lambda 0,39. Columna intermedia: craneal-caudal (cc), con valor lambda 0,39. Columna derecha: anterior-posterior (ap), con valor lambda 0,45.
El equipo debatió sobre el promedio de los valores de error de colocación y los valores de UCL de cada dimensión y los consideró para que fueran buenos y aceptables. La tabla 1 presenta el resumen de esos resultados.
Resumen de los resultados de la fase 1
| Resultados de la fase 1 | ml | cc | ap |
| Imagen portal (Rx) sacada desde arriba | X | Ya | – |
| Imagen portal (Rx) lateral izquierda | – | Yb | Z |
| Fórmula resultante para medir la magnitud del error de colocación | |X| | Y = (|Ya| + |Yb|) / 2 | |Z| |
| Fase 1: tamaño de la muestra excluyendo «outliers» | n=246 | n=252 | n=227 |
| Promedio del proceso antes de la conversión Box-Cox | X=2,300mm | Y=2,597mm | Z=1,78mm |
| Lambda para la conversión Box-Cox | λx=0,39 | λy=0,39 | λz=0,45 |
| Promedio del proceso después de la conversión Box-Cox* | 1,244mm | 1,499mm | 1,221mm |
| Desviación estándar tras la conversión Box-Cox* | σx=0,448mm | σy=0,543mm | σz=0,529mm |
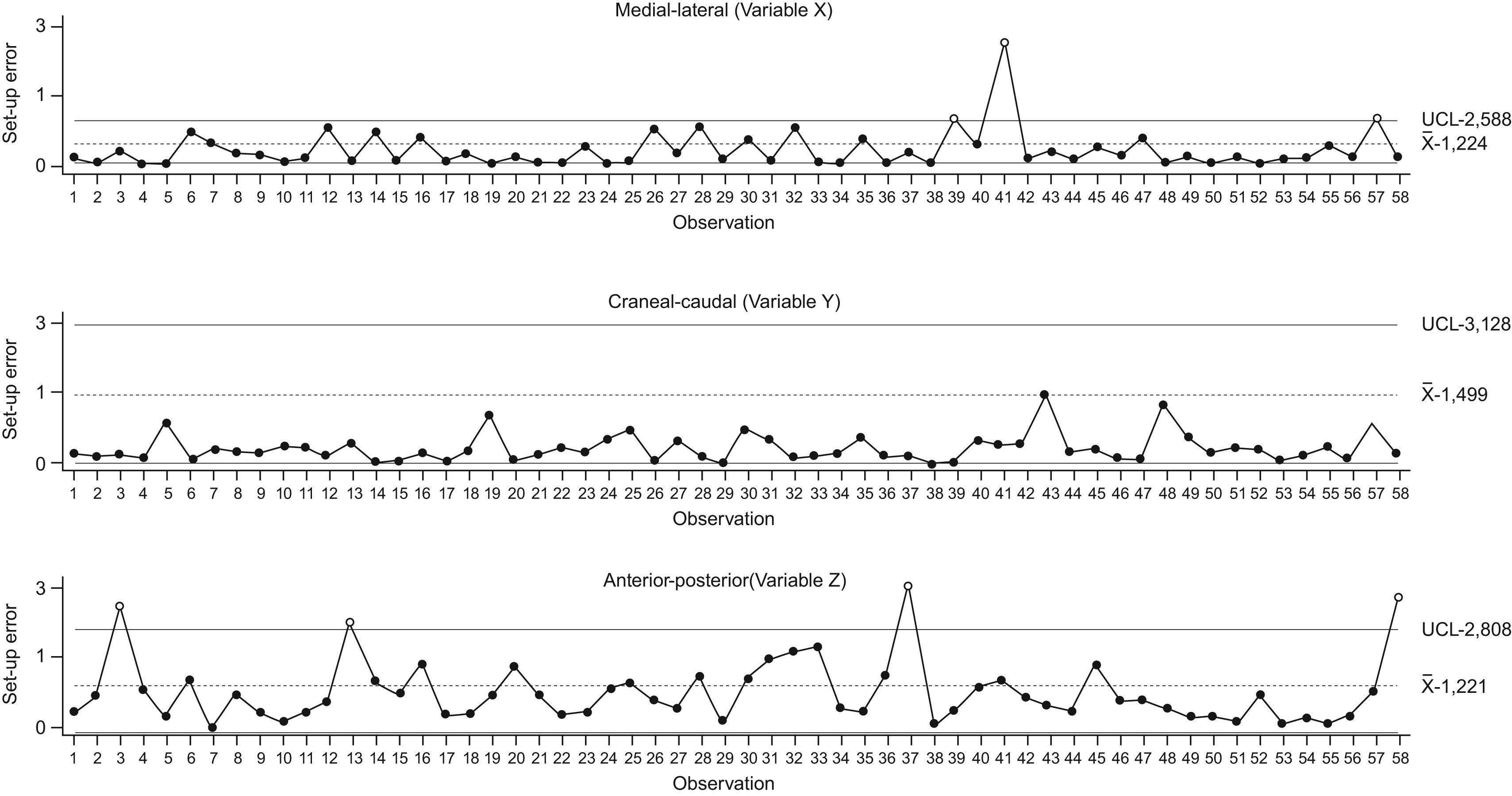
| Límite de control superior* | X¯+3σx=2,588mm | Y¯+3σy=3,128mm | Z¯+3σz=2,808mm |
ap: anterior-posterior; cc: craneal-caudal; ml: medial-lateral; Rx: radiografía.
Para la fase 2 del estudio, una vez computado el UCL y dibujado en las gráficas de control, se inició el SPC. Los valores del promedio de cada subgrupo fueron representados para cada una de las tres dimensiones en sus respectivas gráficas de control. La figura 4 muestra el promedio del proceso de variabilidad para las coordenadas controladas en tiempo real. Como se puede ver en la figura, la variable ml (X) perdió estabilidad tres veces y el análisis de la causa originaria mostró que la primera y la tercera vez fueron debidas a movimientos del paciente y la segunda a un problema con el alineamiento del láser que fue corregido antes de continuar con el tratamiento. Durante el estudio, el proceso se mantuvo estable en la dirección cc. En el caso de los errores de colocación ap, los valores excedieron el UCL cuatro veces durante el estudio, y en todos los casos era debido a que el paciente no mantenía el cuerpo correctamente colocado. Al llevar a cabo el estudio con pacientes de próstata colocados en posición supina, existía una variabilidad ap asignable al hecho de que dichos pacientes no siempre apoyaban su pelvis de manera relajada en la camilla. Como acción correctiva se le pidió a cada paciente que se colocara correctamente (de modo similar a cómo lo había hecho el día que se le hizo la marca de tatuaje en la máquina de simulación), y este hecho corrigió los valores.
Como acción preventiva se les pidió a los técnicos que justo antes de cada tratamiento solicitaran de manera sistemática a todos los pacientes que se colocaran correctamente.
DiscusiónEl control semanal existente está basado en la filosofía reactiva, mientras que el SPC está basado en la comprensión de la variabilidad existente, en asegurar que la variabilidad existente es aceptable (si no es así, se debe reducir la variabilidad mediante acciones de mejora) y, finalmente, en controlar la estabilidad del proceso, siempre dentro de un rango aceptable. Esta es una estrategia proactiva y preventiva de control de calidad. Los autores desconocen la existencia de estudios similares en la sanidad española.
El método actual existente está basado en el control de muestreo semanal sin bases estadísticas con la intención de asegurarse de que la colocación durante las sesiones no controladas es correcta. Si se considera un control semanal en un paciente con 26 sesiones de tratamiento, solo se puede asegurar que en 4 de las 26 sesiones la colocación ha sido correcta. En otras palabras, solo se puede asegurar que el 15% de las sesiones de cada uno de los pacientes está libre de errores de colocación. No se tiene idea alguna de cuántos errores de colocación ocurrieron durante las 22 sesiones restantes. De hecho, en la mayoría de los casos se sabe que hay probabilidad de error en las sesiones no controladas, pero no se pueden afrontar más controles. Por ejemplo, digamos que 1 de cada 4 controles semanales muestra grandes errores de colocación, eso significa que hay un 25% de probabilidad de errores en las sesiones no controladas. En otras palabras, si se controla solo 4 de las 26 sesiones, en el 25% de las 22 sesiones restantes (0,25×22=5,5 sesiones) probablemente hay errores de colocación sin ser corregidos. ¿Esto no significa riesgo de más morbilidad y menos posibilidad de sobrevivir al cáncer? Éticamente es complicado permitir esto para continuar, pero como no se puede hacer controles en el 100% de las sesiones se está permitiendo.
Otro problema que actualmente hay en muchos centros de radioterapia es no conocer con exactitud cuál es el nivel de error de colocación (debido a causa común de variabilidad). Cada radioterapeuta utiliza su propio juicio para decidir qué nivel de error de colocación detectado es aceptable o necesita corrección. Keall et al argumentaban que una definición más precisa de la distribución de la dosis del paciente que la que se practica actualmente mejoraría el nivel de supervivencia al cáncer y haría decrecer la morbilidad8. Thwaites sugería que el rol del físico era entender el funcionamiento del proceso y minimizar la variación en lugar de únicamente asegurar que las dosis suministradas a los pacientes estaban en concordancia con las especificaciones clínicas9. El SPC es una buena herramienta estadística que puede ayudar a entender y a controlar el proceso de variabilidad y evitar que este varíe más allá del rango aceptable. Se debe corregir únicamente cuando el error exceda de la causa común de variación, de lo contrario provocaría el fenómeno del «sobre-ajuste». El «sobre-ajuste» incrementa más aún la variabilidad (véase el manual AIAG de SPC2). Es decir, es necesario conocer nuestra causa común de variabilidad y, si es aceptable, lo mejor que se puede hacer es asegurarse de que el proceso continúa estando dentro de la variabilidad permisible.
El reto consiste en buscar bases estadísticas para prevenir errores sin incrementar los costes de control. El SPC ofrece ese método alternativo que se busca para lograr la correcta colocación sin incrementar el número de controles. De hecho, en el ejemplo mostrado hay posibilidad de ahorrar en los costes de control. La tabla 2 muestra una comparación entre el control semanal existente de paciente por paciente y el método del SPC. Con el método existente, si se hacen 4 controles por paciente, suponiendo que se proporciona tratamiento a 100 pacientes por mes, se tiene un total de 400 controles. Con la propuesta del SPC, si se realizan 3 subgrupos de control por turno de trabajo, con cada subgrupo compuesto por 3 pacientes consecutivos, se realizan 396 controles al mes (tabla 2). Así, con el mismo número de controles, el método SPC da la garantía de que todos los pacientes durante todas las sesiones están libres de error de colocación. De hecho, hay incluso más posibilidades de reducir el número de controles con la misma calidad garantizada. Un mayor ahorro es posible una vez que se comprenda mejor cómo varía el proceso y qué factores son la causa de que el proceso pierda estabilidad, por tanto, el proceso podría ser comprendido y controlado tan bien que se podría llegar a considerar la posibilidad de reducir el número de subgrupos de control de 3 por turno a 2, pudiendo disminuir los controles totales de 396 a 264. Todavía hay más potencial de reducir el número de controles por turno de 396 a 176 si se reduce el tamaño de subgrupo de 3 a 2 (mínimo permitido) y así ahorrar más aún en controles, sin sacrificar la probabilidad del 99,7% de que todos los pacientes colocados en un proceso estable esté dentro de los errores aceptables. De todos modos, hay que decir que en el estudio se limita a subgrupos de 3 miembros con 3 controles por turno.
Análisis comparativo entre el control semanal y el control estadístico de proceso
| Características | Protocolo de control existente | SPC |
| Sesión inicial | Control de posicionamiento del paciente | Control de posicionamiento de los pacientes |
| Pacientes que requieren control especial (p. ej., obesos) | El 100% de las sesiones necesita ser controlada | El 100% de las sesiones necesita ser controlada |
| Método de control | Orientación del paciente | Orientación al proceso y centrada en el turno de trabajo |
| Filosofía del control de calidad | Reactiva. Basada en la detección y la corrección de errores | Proactiva. Basada en el control de la estabilidad del proceso y la prevención de errores |
| Frecuencia de control | Control semanal | Tres controles por turno x 3 pacientes consecutivos (al inicio y dos veces más durante el turno) |
| Número total de controles por paciente | Aproximadamente 4 controles por paciente a lo largo de su tratamiento | Nueve mediciones por turno x 2 turnos al día = 18 mediciones diarias |
| Número total de controles al mes* | Si son tratados alrededor de 100 pacientes cada mes y hay 4 controles por paciente: 100×4=400 controles por mes | Dieciocho mediciones al día x 22 días laborables al mes = 396 controles por mes |
| Base científica | Control aleatorio sin base estadística (no puede asegurarse de que el posicionamiento es correcto durante las sesiones no controladas). Se asegura que 4 de las 26 sesiones se han posicionado correctamente. En otras palabras, solo se puede asegurar que el 15% de las sesiones por paciente estén libres de error de posicionamiento. No hay conocimientos de los errores reales de posicionamiento que pudiera haber durante las restantes 22 sesiones de los pacientes | Como se ha demostrado la estabilidad del proceso mediante la muestra de subgrupos, todos los pacientes de todas las sesiones seguramente están libres de error (con una certeza del 99,7%). Si se pierde estabilidad, dicha pérdida es detectada y corregida antes de continuar con el tratamiento |
| Posible ahorro en el tiempo/costes de control | Ninguna posibilidad de bajar de 400 controles por mes. Todo lo contrario. Hay que aumentar las garantías aumentando los controles | Una vez que el SPC está bien implementado, y si el proceso de variabilidad está bajo control, existe la posibilidad de reducir el número de controles de 3 a 2 por turno y, así, es posible reducir el total de controles mensuales de 396 a 264 y, por tanto, se producirá un ahorro en los costes de control. También se puede reducir el tamaño del subgrupo a 2 (el mínimo permitido) si se tiene dominio sobre la variación de la causa asignable de nuestro proceso y así poder reducir los controles mensuales de 396 a 176, manteniendo probabilidad (99,7%) de que el 100% de las sesiones de tratamiento de todos las pacientes fueron correctas |
SPC: control estadístico de proceso.
En el tratamiento de radioterapia, la diferencia entre seguridad y mortalidad y entre morbilidad y supervivencia al cáncer está en la exactitud del volumen tratado. Debido a que el tratamiento se distribuye en docenas de sesiones, la colocación correcta del paciente en toda y cada una de las sesiones (conocido como repetibilidad y reproducibilidad del tratamiento) es clave para la seguridad y el tratamiento eficaz del paciente, pero la detección y la corrección de los errores de colocación durante toda y cada una de las sesiones no solo son muy costosas, sino que también aumentarían la lista de espera y causarían un retraso en el inicio del tratamiento para los nuevos pacientes. El SPC ofrece una solución a este problema. Partiendo de la base de que la seguridad del paciente es primordial, se tiene la obligación de hacer una transición desde el método «detección y corrección» basado en controles aleatorios hasta la «prevención» sin aumentar los costes de control. En cualquier proceso, el primer paso es entender los factores que causan la variabilidad1, medir y cuantificar los niveles existentes de errores debidos a causa común de variación. El segundo paso es la reducción de la variabilidad a niveles aceptables y el tercer paso es la creación de un plan de control para controlar la estabilidad del proceso e interferir con una acción correctiva solo cuando el proceso pierde estabilidad. Al fin y al cabo este es el mejor control de calidad posible que uno puede hacer dada la variación por causa común naturalmente existente en el proceso. Afortunadamente, el plan de muestreo que requiere el SPC es comparable con el plan semanal existente en número de controles y, además, no requiere más inversión. Por otra parte, las bases científicas para asegurar que el proceso siempre varía dentro del límite 3σ de su valor de promedio dan un 99,7% de garantías de que todo paciente tratado bajo condiciones estables tenga una colocación correcta.
El protocolo del SPC se centra en el control de la variabilidad debido a una causa asignable en lugar de focalizar en la variabilidad paciente por paciente, que se sabe que no existe, excepto en pacientes obesos. Si un paciente es una causa asignable de variabilidad para sí mismo, el protocolo estadístico no es suficiente y son recomendables las mediciones de colocación al 100% y sus correcciones correspondientes. Este nuevo protocolo del SPC mejora la prevención de error de colocación en términos estadísticos, no hace incrementar los costes de control e incluso tiene potencial para bajarlos y al mismo tiempo no hace aumentar el tiempo de espera para nuevos pacientes.