Describir el estudio de la intercambiabilidad de los resultados de las magnitudes de bioquímica que se procesan indistintamente en los 4 laboratorios de Catlab.
Material y métodosSe establecieron requisitos de calidad de coeficiente de variación y error total (CV% y ET%). Se verificó, con materiales de control comercial, el cumplimiento del CV% en cada magnitud y para cada analizador de cada laboratorio y se estudió la intercambiabilidad con muestras recientes de suero. Se analizaron las diferencias con una aplicación en Microsoft Access® que genera gráficos de Bland-Altman modificados.
ResultadosLa intercomparación de las 32 magnitudes que se realizan en más de un laboratorio o analizador generó 306 gráficas de Bland-Altman: 101 (33,1%) cumplían directamente el requisito de ET% establecido a partir de la variabilidad biológica y 205 (66,9%) requirieron revisión. Se reprocesaron los datos según los requisitos mínimos de consenso de la Asociación Española de Farmacéuticos Analistas (AEFA), la Sociedad Española de Bioquímica Clínica y Enfermedad Molecular (SEQC), la Asociación Española de Biopatología Médica (AEBM) y de la Sociedad Española de Hematología y Hemoterapia (SEHH) de octubre del 2013. Aplicándolos, 170 comparaciones (56%) cumplían directamente los requisitos y 136 (44%) requerían revisión. Al valorar el número de puntos que excedían el requisito, los errores aleatorios, el intervalo de resultados en el que se detectaban discrepancias y el intervalo de decisión clínica se consideró que todos los resultados se podían aceptar y que las 32 magnitudes eran intercambiables en todos los centros y analizadores.
ConclusionesA partir del requisito de consenso de las 4 sociedades, los resultados de todas las magnitudes comparadas eran intercambiables. No obstante, cada uno de los laboratorios debe cumplir con criterios más estrictos de error total.
To describe the study of the comparability of the measurements levels of biological tests processed in biochemistry in Catlab's 4 laboratories.
Material and methodsQuality requirements, coefficients of variation and total error (CV% and TE %) were established. Controls were verified with the precision requirements (CV%) in each test and each individual laboratory analyser. Fresh serum samples were used for the comparability study. The differences were analysed using a Microsoft Access® application that produces modified Bland-Altman plots.
ResultsThe comparison of 32 biological parameters that are performed in more than one laboratory and/or analyser generated 306 Bland-Altman graphs. Of these, 101 (33.1%) fell within the accepted range of values based on biological variability, and 205 (66.9%) required revision. Data were re-analysed based on consensus minimum specifications for analytical quality (consensus of the Asociación Española de Farmacéuticos Analistas (AEFA), the Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC), the Asociación Española de Biopatología Médica (AEBM) and the Sociedad Española de Hematología y Hemoterapia (SEHH), October 2013). With the new specifications, 170 comparisons (56%) fitted the requirements and 136 (44%) required additional review. Taking into account the number of points that exceeded the requirement, random errors, range of results in which discrepancies were detected, and range of clinical decision, it was shown that the 44% that required review were acceptable, and the 32 tests were comparable in all laboratories and analysers.
ConclusionsThe analysis of the results showed that the consensus requirements of the 4 scientific societies were met. However, each laboratory should aim to meet stricter criteria for total error.
Los datos proporcionados por el laboratorio clínico tienen un fuerte impacto en la atención sanitaria, por lo que se debe asegurar la trazabilidad y equivalencia de los resultados, ya que un resultado erróneo o una interpretación incorrecta de los resultados por parte del clínico tendría una repercusión directa e inmediata sobre la seguridad del paciente1.
Si bien los sistemas suministrados íntegramente por la industria están sometidos a la directiva 98/79 de la Comisión Europea sobre los productos sanitarios para el diagnóstico in vitro2, que establece que los fabricantes deben validar los sistemas de medida que fabrican y suministran con la marca CE, el laboratorio debe comprobar que en el proceso de transporte o de instalación no se han producido desviaciones respecto a las condiciones en que el fabricante hizo la validación del sistema de medida3.
Una situación frecuente que se presenta en los laboratorios clínicos es la existencia de diferentes analizadores que se usan indistintamente para la determinación de las mismas pruebas. Por ello, además de la verificación inicial del analizador por parte del laboratorio, también se debe asegurar que el grado de concordancia entre los resultados obtenidos sea independiente de los sistemas o plataformas analíticas y que, por tanto, las mediciones sean comparables1. Para facilitar la intercambiabilidad de los resultados, se deben cumplir una serie de requisitos que afectan a todos los procesos del laboratorio (preanalítico, analítico y postanalítico)4.
Catlab inició su actividad el 1 de junio del 2008 como resultado de la integración de Egarlab, laboratorio del Hospital Universitario Mútua de Terrassa (HUMT) y del laboratorio del Consorci Sanitari de Terrassa (CST). En junio del 2012 se incorporó el laboratorio de la Fundació Hospital Sant Joan de Déu de Martorell (FHSJDM). Catlab dispone de un laboratorio central, con las siguientes áreas analíticas: bioquímica, hematología y hemostasia, immunología, citometría, citogenética, biología molecular, microbiología y 3 laboratorios hospitalarios, con las áreas analíticas de urgencias y microbiología hospitalaria. Da cobertura a una población de referencia de 1.020.000 habitantes con 98 centros de primaria y 3 hospitales. Tiene una actividad de 3.500 peticiones al día y 7.800.000 determinaciones año. Obtuvo la certificación según la norma UNE-EN ISO 9001:20085 en el año 2010 para el laboratorio central y los laboratorios hospitalarios del HUMT y del CST. El laboratorio de la FHSJDM obtuvo la certificación en junio del 2013.
Mediante la certificación, un organismo externo da garantía de que el sistema de gestión de la calidad del laboratorio es conforme a unos requisitos establecidos previamente. La acreditación, en cambio, es el reconocimiento formal por parte de un organismo externo (ENAC) de la competencia técnica de un laboratorio para realizar una técnica analítica o un conjunto de técnicas analíticas6,7.
Se estableció como objetivo estratégico a medio plazo obtener la acreditación8 según la norma UNE-EN ISO 15189:2007. Se planificó por etapas y en la primera, en mayo de 2012, se acreditaron la toma de muestras (sangre), la manipulación y gestión de muestras (sangre y orina) del área de preanalítica y las magnitudes de bioquímica de solicitud más frecuente procesadas en el laboratorio central (119 magnitudes, que representan el 62% de la actividad del laboratorio central). En una segunda etapa, a finales del 2013, se acreditaron magnitudes del laboratorio central de hematología y hemostasia, inmunología, citometría, citogenética, biología molecular, así como la mayoría de magnitudes de hematología, hemostasia y bioquímica de los laboratorios hospitalarios de HUMT y CST. También se amplió la acreditación a la manipulación y gestión de muestras de líquido amniótico, vellosidades coriales, médula ósea y líquidos biológicos. Con más de 400 magnitudes acreditadas, Catlab consiguió tener un 88% de su actividad acreditada, superando el objetivo del 70% que se había fijado para el año 2013. En el año 2014, se incorporaron a la ampliación de la acreditación otras magnitudes realizadas en los laboratorios hospitalarios (gases en sangre, líquidos biológicos y sedimento de orina) y una parte importante de las magnitudes de microbiología, así como la mayoría de magnitudes de hematología, hemostasia y bioquímica del laboratorio hospitalario de FHSJDM, con lo que se consiguió ampliar la acreditación hasta el 92,5% de la actividad de Catlab, además de la adecuación a la nueva versión de la norma UNE-EN ISO 15189:20139, que añade nuevos requisitos a la versión anterior.
El objetivo de este trabajo es describir la experiencia en el estudio de la intercambiabilidad de los resultados de las magnitudes de bioquímica que se procesan indistintamente en los 4 laboratorios que constituyen Catlab, en cumplimiento del punto 5.6.4 de la norma UNE-EN ISO 15189:20139, en el que se establece como requisito «comparar los procedimientos, equipos y métodos utilizados y establecer la comparabilidad de los resultados de las muestras de pacientes en los intervalos clínicos apropiados».
Material y métodosDocumentación: Catlab había establecido la sistemática para todos los procedimientos del laboratorio, tanto en la fase preanalítica como en la analítica y en la postanalítica, plasmándolo en una serie de procedimientos normalizados e instrucciones de trabajo. Con motivo de la acreditación, se revisó y actualizó toda la documentación vigente en el laboratorio. Se establecieron, entre otros, los requisitos que debían cumplir las muestras que llegaban al laboratorio, así como el protocolo para la validación o verificación de analizadores y métodos.
Previamente, se habían unificado todos los procedimientos de la fase extraanalítica (preparación del paciente, sistema de extracción, conservación y transporte de las muestras, terminología y unidades utilizadas en el informe, valores de referencia y valores críticos).
El método analítico para cada una de las magnitudes involucradas fue el mismo en los 4 laboratorios, así como los requisitos de imprecisión (CV%) y de exactitud (ET%) detallados en el documento de especificaciones de calidad del laboratorio (ver ET% en tabla 1).
Especificaciones de calidad de error total (%) establecidas en Catlab el año 2014 y origen de los datos
| Magnitud | Especificación de calidad (versión 8; 01/04/2014) | Especificación de calidad (versión 9; 01/09/2014) | ||
|---|---|---|---|---|
| ET% | Origen | ET% | Origen | |
| Albúmina | 6,1 | (1) | 14,0 | (5) |
| Fosfatasa alcalina | 12,0 | (1) | 31,0 | (5) |
| Alanina-aminotransferasa (ALT) | 13,7 | (1) | 41,2 | (6) |
| Amilasa pancreática | 17,7 | (3) | 17,7 | (3) |
| Aspartato-aminotransferasa (AST) | 8,3 | (1) | 21,0 | (5) |
| Bilirrubina esterificada | 22,3 | (2) | 22,3 | (2) |
| Bilirrubina total | 13,5 | (1) | 24,0 | (5) |
| Calcio (II) | 3,8 | (1) | 11,0 | (5) |
| Colesterol | 4,5 | (1) | 11,0 | (5) |
| Creatina-cinasa (CK) | 15,2 | (1) | 24,0 | (5) |
| Creatinina | 8,9 | (1) | 20,0 | (5) |
| Proteína C reactiva (PCR) | 28,3 | (1) | 28,3 | (1) |
| Gama-glutamiltransferasa (GGT) | 11,1 | (1) | 22,0 | (5) |
| Glucosa | 7,0 | (1) | 11,0 | (5) |
| HDL-Colesterol | 11,6 | (1) | 33,0 | (5) |
| Hierro | 15,3 | (1) | 24,0 | (5) |
| Magnesio | 4,8 | (1) | 7,2 | (4) |
| Fosfato | 5,1 | (1) | 17,0 | (5) |
| Proteínas totales | 5,4 | (1) | 12,0 | (5) |
| Triglicéridos | 13,0 | (1) | 18,0 | (5) |
| Urato | 6,0 | (1) | 17,0 | (5) |
| Urea | 7,8 | (1) | 19,0 | (5) |
| Lactato deshidrogenasa (LDH) | 5,7 | (1) | 26,0 | (5) |
| Ion-sodio | 5,0 | (5) | 5,0 | (5) |
| Ion-potasio | 5,6 | (1) | 8,0 | (5) |
| Cloruro | 9,0 | (5) | 9,0 | (5) |
| Litio | 10,5 | (1) | 10,5 | (1) |
| Coriogonadotropina beta (bHCG) | 12,6 | (1) | 12,6 | (1) |
| Paratirina (PTH) | 15,1 | (1) | 15,1 | (1) |
| Tiroxina libre (FT4) | 8,0 | (1) | 16,0 | (5) |
| Tirotropina (TSH) | 11,9 | (1) | 15,2 | (5) |
| Troponina | 24,5 | (1) | 24,5 | (1) |
| Digoxina | 14,3 | (1) | 20,0 | (5) |
Origen de los datos:
(1) Especificaciones FPQLC 2014.
(2) SEQC (óptimo): base de datos variación biológica SEQC (actualización año 2014).
(3) SEQC (deseable): base de datos variación biológica SEQC (actualización año 2014).
(4) SEQC (mínimo): base de datos variación biológica SEQC (actualización año 2014).
(5) Consenso de sociedades (AEFA, SEQC, AEBM, SEHH) octubre 2013.
(6) Especificación mínima calculada a partir de CVbi y CVbg.
Analizadores: Los analizadores utilizados eran de Roche® Diagnostics: Cobas 8000, Cobas 6000, Cobas Integra 400 plus, Modular Analytic E-170, Cobas e-411.
Calibradores y controles de calidad: Se utilizaron los calibradores específicos suministrados por Roche.
Los controles internos utilizados fueron el Lyphocheck Assayed Chemistry Control nivel 1 y 2 (BIO-RAD) y Lyphocheck Immunoassay Plus Control nivel 1 y 2 (BIO-RAD).
Los 4 laboratorios participaban en los programas de intercomparación de calidad de la Fundación para el Control de Calidad de los Laboratorios Clínicos (FPCQLC).
Sistemática para la comprobación de la intercambiabilidad de resultados: Previamente al estudio de intercambiabilidad de resultados, se verificó el cumplimiento de los requisitos establecidos para el CV% (control de calidad interno) y el ET% (programa de intercomparación) para cada magnitud y analizador, en cada uno de los laboratorios.
Se utilizaron muestras de suero procedentes de pacientes en tubos de Becton Dickinson, BD Vacutainer ® SST™ II Advance.
Se seleccionaron 40 muestras de suero recién obtenidas y sin hemólisis visible, y con resultados que estuvieran comprendidos en el intervalo de medición de los diferentes métodos utilizados, principalmente en el intervalo de concentraciones de decisión clínica. De cada muestra de suero se prepararon 4 alícuotas, una para cada laboratorio. Se guardaron a una temperatura de −20°C, y el día acordado se procesaron simultáneamente en los diferentes analizadores y laboratorios. Las muestras se analizaron en las condiciones habituales de cada laboratorio con la finalidad de evitar introducir variables ajenas a la medición.
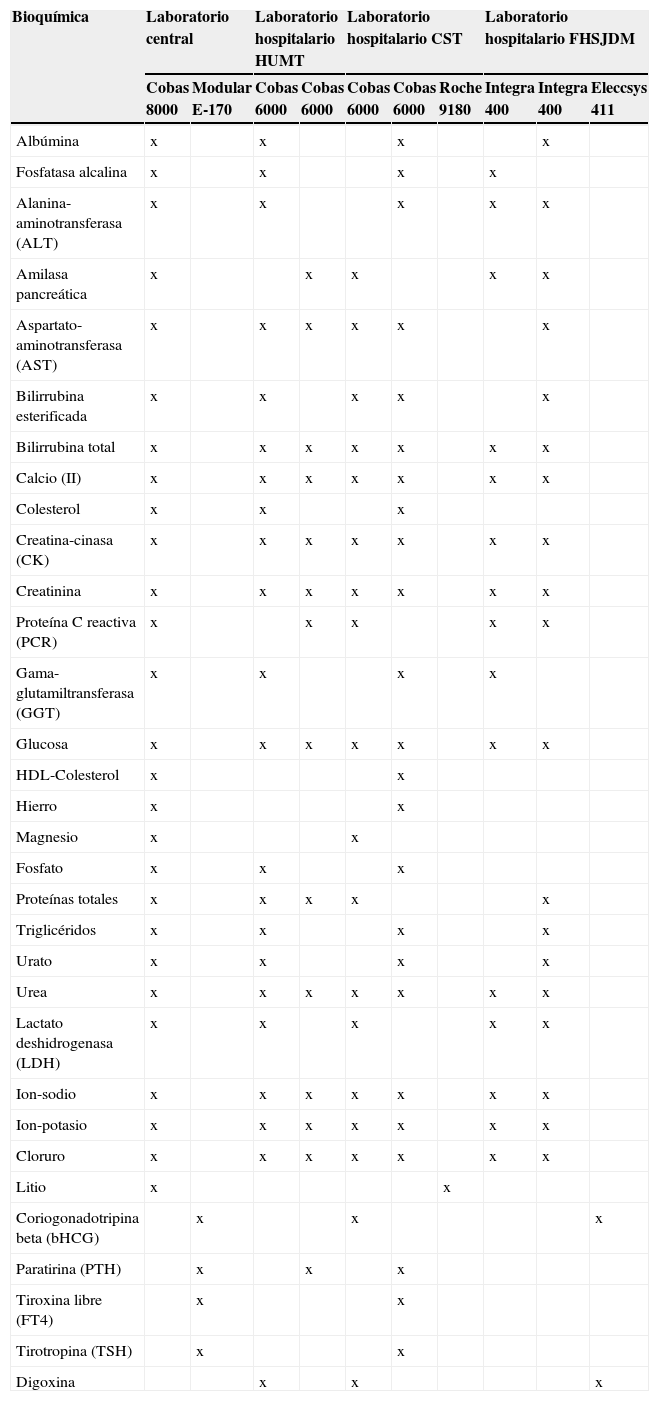
En la tabla 2 se detallan los analizadores utilizados y las magnitudes comparadas en cada laboratorio y con cada analizador.
Magnitudes analizadas en el estudio de intercambiabilidad de resultados, detallando los analizadores utilizados en cada laboratorio
| Bioquímica | Laboratorio central | Laboratorio hospitalario HUMT | Laboratorio hospitalario CST | Laboratorio hospitalario FHSJDM | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Cobas 8000 | Modular E-170 | Cobas 6000 | Cobas 6000 | Cobas 6000 | Cobas 6000 | Roche 9180 | Integra 400 | Integra 400 | Eleccsys 411 | |
| Albúmina | x | x | x | x | ||||||
| Fosfatasa alcalina | x | x | x | x | ||||||
| Alanina-aminotransferasa (ALT) | x | x | x | x | x | |||||
| Amilasa pancreática | x | x | x | x | x | |||||
| Aspartato-aminotransferasa (AST) | x | x | x | x | x | x | ||||
| Bilirrubina esterificada | x | x | x | x | x | |||||
| Bilirrubina total | x | x | x | x | x | x | x | |||
| Calcio (II) | x | x | x | x | x | x | x | |||
| Colesterol | x | x | x | |||||||
| Creatina-cinasa (CK) | x | x | x | x | x | x | x | |||
| Creatinina | x | x | x | x | x | x | x | |||
| Proteína C reactiva (PCR) | x | x | x | x | x | |||||
| Gama-glutamiltransferasa (GGT) | x | x | x | x | ||||||
| Glucosa | x | x | x | x | x | x | x | |||
| HDL-Colesterol | x | x | ||||||||
| Hierro | x | x | ||||||||
| Magnesio | x | x | ||||||||
| Fosfato | x | x | x | |||||||
| Proteínas totales | x | x | x | x | x | |||||
| Triglicéridos | x | x | x | x | ||||||
| Urato | x | x | x | x | ||||||
| Urea | x | x | x | x | x | x | x | |||
| Lactato deshidrogenasa (LDH) | x | x | x | x | x | |||||
| Ion-sodio | x | x | x | x | x | x | x | |||
| Ion-potasio | x | x | x | x | x | x | x | |||
| Cloruro | x | x | x | x | x | x | x | |||
| Litio | x | x | ||||||||
| Coriogonadotripina beta (bHCG) | x | x | x | |||||||
| Paratirina (PTH) | x | x | x | |||||||
| Tiroxina libre (FT4) | x | x | ||||||||
| Tirotropina (TSH) | x | x | ||||||||
| Digoxina | x | x | x | |||||||
El requisito establecido para que los resultados fueran intercambiables fue que la diferencia porcentual entre 2 resultados obtenidos para cada magnitud en una misma muestra y entre 2 analizadores diferentes fuera inferior o igual al requisito de error total establecido (ET%), en el intervalo de decisión clínica. En la tabla 1 se detallan las especificaciones de calidad de error total (%) establecidas en Catlab el año 2014 y el origen de los datos.
Los requisitos de ET% vigentes en el laboratorio en el inicio del estudio eran: para la bilirrubina esterificada y la amilasa pancreática, el óptimo y el deseable de la base de datos de Variación Biológica del 2014 de la SEQC; para el ion sodio y cloruro, los de consenso de las sociedades científicas Asociación Española de Farmacéuticos Analistas (AEFA), Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC), Asociación Española de Biopatología Médica (AEBM) y Sociedad Española de Hematología y Hemoterapia (SEHH)10 y para el resto de las magnitudes incluidas en el programa de intercomparación de la FPQCL, los del programa del año 2014, basados mayoritariamente en criterios de variabilidad biológica11.
Métodos estadísticos: Se utilizó el método de Bland-Altman, que permite detectar tanto errores sistemáticos como proporcionales y aleatorios, en todo el intervalo de medida12,13.
No obstante, siempre hay que valorar las diferencias observadas teniendo en cuenta no solo los criterios estadísticos, sino también los límites de decisión clínica y el error máximo admisible, de acuerdo con los requisitos de error total especificados. Por este motivo, en Catlab hemos desarrollado una aplicación en Microsoft Access® que permite obtener de manera automática gráficos de Bland-Altman modificados en los que, además de los elementos habituales, también quedan representados el intervalo de decisión clínica, el error total máximo establecido y otros indicadores basados en criterios estadísticos y de variabilidad biológica, que facilitan la comprobación de la intercambiabilidad de los resultados. En el proceso automático de la generación de las gráficas, el programa las clasifica y genera para cada una de ellas un comentario en función de los criterios establecidos.
ResultadosLos 4 laboratorios cumplían, a nivel individual, los requisitos de calidad de imprecisión y exactitud establecidos.
La intercomparación de las 32 magnitudes que se realizan en más de un laboratorio o analizador generó 306 gráficas de Bland-Altman. Cada una de ellas representaba la comparación de los resultados para una magnitud entre 2 analizadores diferentes. De ellas, 101 (33,1%) cumplían directamente el requisito de error total establecido y 205 (66,9%) requerían revisión.
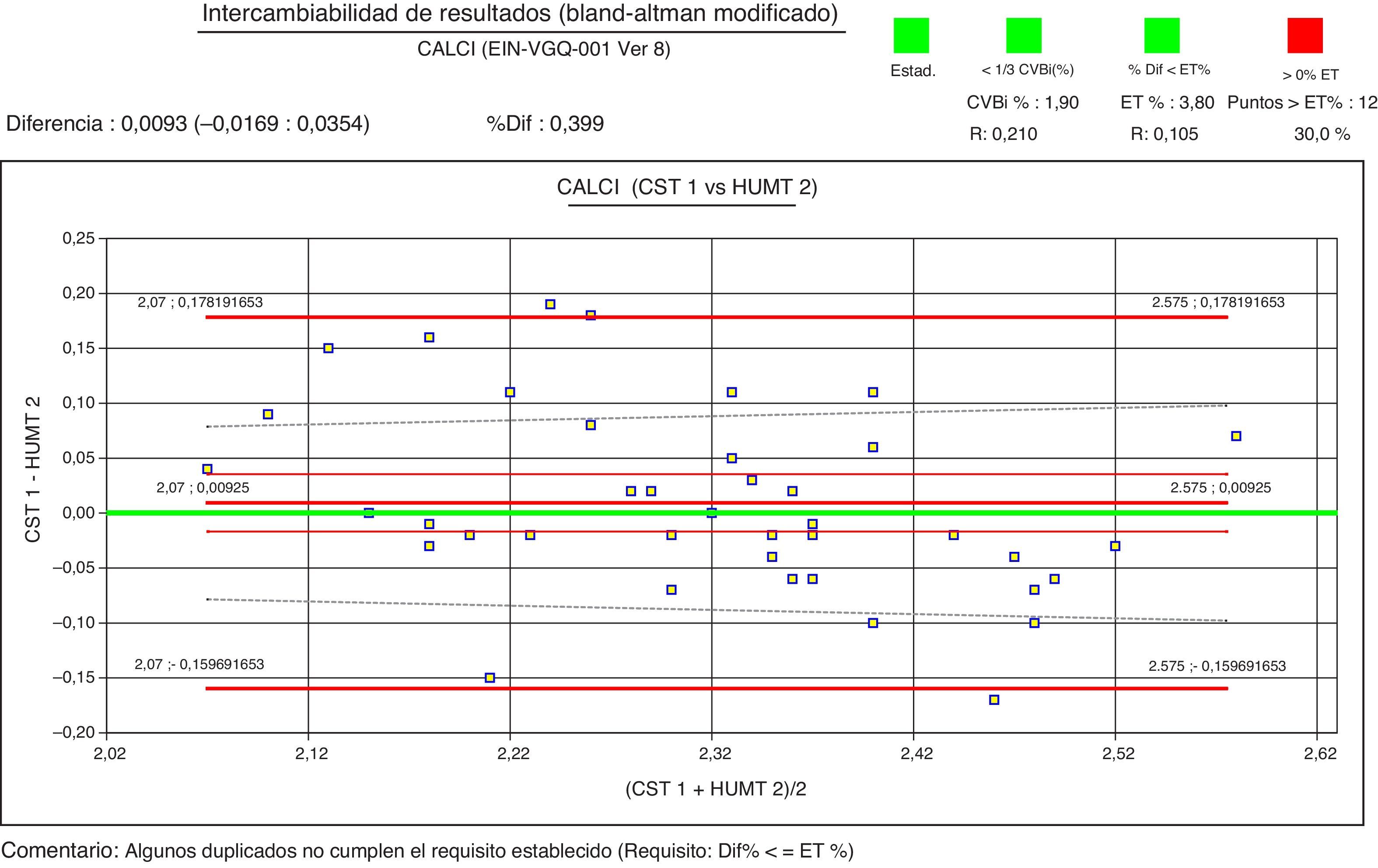
En la revisión de las gráficas se evidenció que 16 de las 32 magnitudes (50%) eran intercambiables en todos los laboratorios y analizadores.
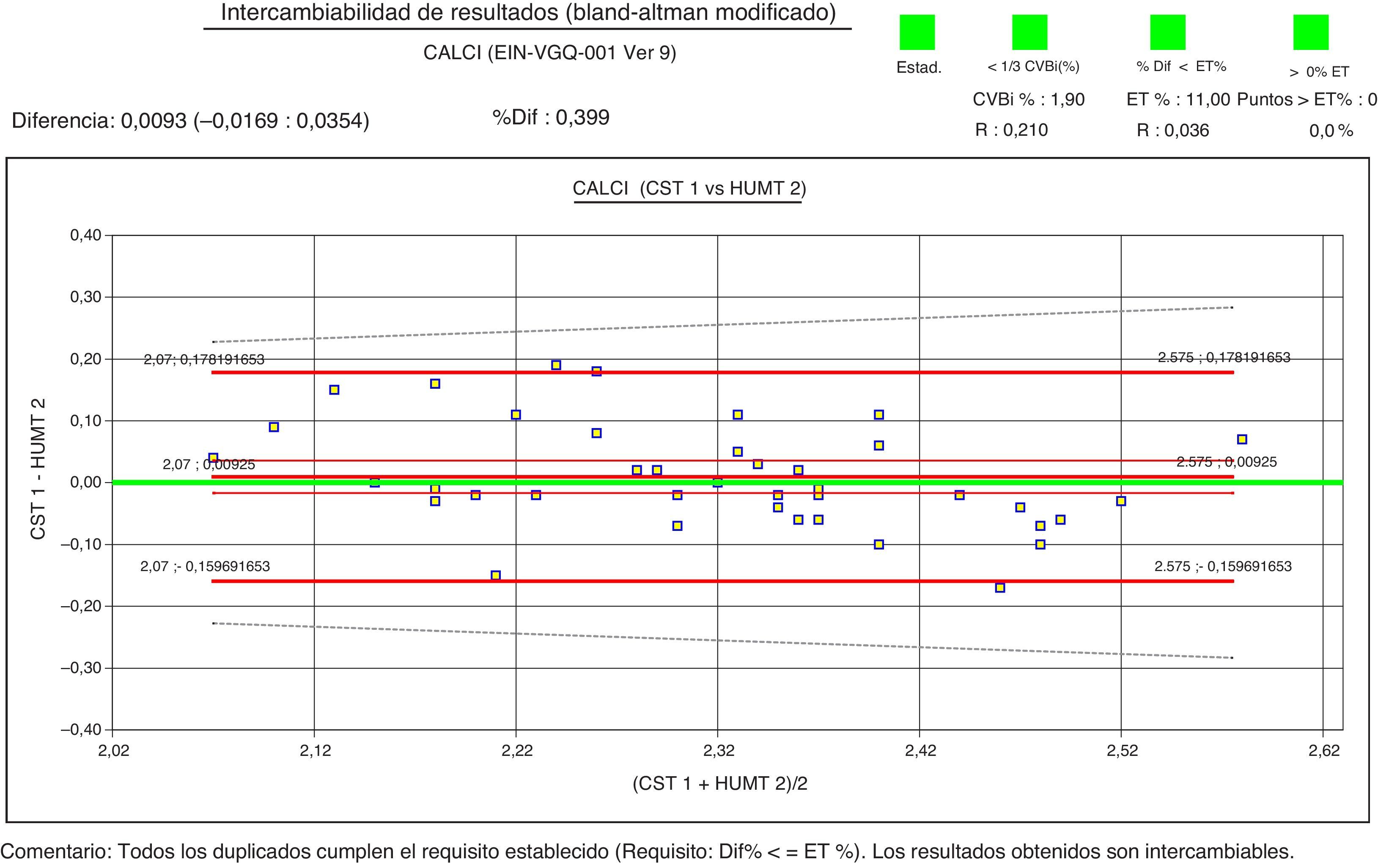
Teniendo en cuenta que a nivel individual cada uno de los laboratorios cumplía los requisitos vigentes de imprecisión y error total y que no se evidenció ningún motivo que justificase el elevado grado de desacuerdo, se decidió reprocesar los datos de la intercomparación según las especificaciones mínimas de consenso de calidad analítica (consenso de las sociedades AEFA, SEQC, AEBM y SEHH de octubre del 2013)12, con excepción del magnesio y la alanina-aminotransferasa, para las que se utilizó el ET% mínimo basado en variabilidad biológica. Aplicando los nuevos requisitos, 170 comparaciones (56%) los cumplían estrictamente, es decir, no había ninguna diferencia entre los resultados que excediera el error total máximo establecido, y 136 (44%) requerían revisión.
En la revisión de estas 136 gráficas, se observó que algunas diferencias que superaban la máxima permitida eran atribuibles a errores aleatorios y el resto de las diferencias correspondían a concentraciones fuera del rango de decisión clínica, por lo que no tenían ninguna trascendencia clínica. Con estos resultados, y teniendo en cuenta que la metodología, los valores de referencia y las especificaciones de calidad eran los mismos para todos los analizadores14, se consideró que los resultados de las 32 magnitudes eran intercambiables entre todos los centros y analizadores.
Como ejemplo de las gráficas revisadas, se han escogido 2 de las 15 comparaciones que se generaron para el estudio de la intercomparación del calcio. En ambos casos los resultados son intercambiables desde el punto de vista estadístico, pero al tener en cuenta el requisito de error total (línea discontinua en la gráfica), se observa que el 30% de los puntos exceden el error máximo permitido si se emplea el requisito basado en variabilidad biológica (fig. 1). En cambio, todos los puntos cumplen al utilizar el requisito de error total de consenso de las 4 sociedades (fig. 2).
La finalidad del laboratorio de análisis clínicos es proporcionar resultados correctos y útiles para el diagnóstico, seguimiento y tratamiento del paciente. Para ello es imprescindible que los resultados obtenidos en nuestros laboratorios sean intercambiables.
Disponer, en la fase preanalítica, de protocolos unificados de preparación del paciente, obtención y preparación de muestras, condiciones de transporte y conservación de las mismas, informes analíticos unificados (terminología, unidades, intervalos de referencia) y utilizar, en la fase analítica, métodos analíticos que cumplen los requisitos establecidos ha facilitado el estudio.
Para obtener resultados analíticos comparables entre laboratorios y a lo largo del tiempo, es esencial establecer requisitos de calidad comunes. En un inicio se escogieron las especificaciones recomendadas por la FPCQLC y basadas en la variabilidad biológica13, pero, con los resultados obtenidos en la intercomparación inicial, hubo que modificar y tomar, para la mayoría de las magnitudes, las especificaciones mínimas de consenso de las sociedades (ver tabla 1).
Debe tenerse en cuenta que un mismo principio de medida utilizado en distintos instrumentos produce resultados diferentes, y así lo demuestran, por ejemplo, los datos obtenidos en la evaluación de programas de intercomparación, como comenta Doménech14. Por ello, es imprescindible que cada analizador cumpla los requisitos de imprecisión e inexactitud, pero esto no es suficiente para asegurar la intercambiabilidad de los resultados de todos los equipos que analizan la misma magnitud.
La documentación del laboratorio incluye las especificaciones mínimas de calidad analítica (coeficiente de variación y error total), que son las que se deben cumplir cuando se comparan resultados de analizadores, siempre teniendo en cuenta que son especificaciones lo suficientemente estrictas como para que no se vea afectada la interpretación clínica, ni mermada la calidad analítica. Esta intercomparación se planifica regularmente. Al mismo tiempo, se han establecido objetivos de calidad (coeficiente de variación y error total) más estrictos para el control y el seguimiento de cada analizador. De esta manera el proceso analítico estará bien controlado y nos aseguramos de cumplir las especificaciones establecidas para la comparación entre analizadores o laboratorios.
Debido a las características de nuestro laboratorio, el número de intercomparaciones necesario para verificar la intercambiabilidad de los resultados fue muy elevado. Disponer de una aplicación en Microsoft Access® que permite obtener gráficos de Bland-Altman modificados facilitó mucho su análisis.
Podemos concluir diciendo que, a pesar de que inicialmente en cada uno de los laboratorios la mayoría de los requisitos de error total se habían establecido a partir del valor óptimo o el deseable recomendados por las sociedades científicas de acuerdo con la variabilidad biológica, al poner en común los resultados de los 4 laboratorios, fue necesario ampliar el requisito de error total de algunas magnitudes, eligiendo en algunos casos el valor de consenso de las sociedades científicas. No obstante, de acuerdo con el principio de mejora continua, se planteó que cada uno de los laboratorios debe tener como objetivo cumplir criterios más estrictos de error total, y utilizar solamente el criterio más amplio a efectos de intercomparación entre diferentes analizadores o laboratorios, comprobando que no haya diferencias que afecten al diagnóstico o seguimiento de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.