La eficacia y la seguridad del tratamiento de reperfusión en el ictus isquémico agudo es tiempo-dependiente y presenta una ventana terapéutica limitada que constituye el principal criterio de exclusión. Iniciativas que monitoricen la calidad asistencial resultan imprescindibles para diseñar intervenciones de mejora dirigidas a garantizar mejores tiempos de atención y de aplicación de dichos tratamientos.
ObjetivosIdentificar y clasificar las causas potenciales de retraso en la administración del tratamiento de reperfusión del ictus en un hospital de referencia para el tratamiento integral del ictus agudo.
Material y métodosEl proyecto se desarrolló en el Hospital Clínico Universitario Virgen de la Arrixaca. Se evaluó a 337 pacientes con ictus isquémico agudo tratados con terapias de reperfusión. Para el análisis cualitativo se constituyeron 2 grupos de trabajo e investigación: uno promotor, que diseñó y dirigió todo el proyecto, y otro multidisciplinar, que sirvió como fuente de información y como mecanismo de implicación activa de todos los profesionales de la cadena asistencial del ictus. Con la información recogida en 3 reuniones se elaboraron los flujogramas y un diagrama causa-efecto.
ResultadosCon base en las herramientas anteriores, se identificaron las causas potenciales de demora, que fueron clasificadas de acuerdo con un criterio operativo en estructurales inmodificables, modificables con evidencia conocida y de repercusión hipotética. Destacaron, por su importancia en el diseño de futuras intervenciones de mejora, las causas modificables como la variabilidad en el seguimiento de protocolos establecidos, la ausencia de procedimientos en algunos puntos del circuito, etc.
ConclusionesEl conocimiento de las causas de demora en la aplicación del tratamiento de reperfusión ha sido solo el punto de partida, pero se ha tratado de un paso indispensable para el diseño y la puesta en marcha de intervenciones de mejora de los tiempos de atención al paciente con «código ictus».
Efficacy and safety of reperfusion therapy in acute ischaemic stroke is time-dependent and has a limited therapeutic window, which is, in fact, the main exclusion criterion. Initiatives to evaluate the quality of care are essential to design future interventions and ensure the shortest management times and application of such treatments.
ObjectiveThe aim of the study is to identify and classify potential causes of delay in the administration of reperfusion therapy in a tertiary hospital, a reference for the comprehensive treatment of acute ischaemic stroke.
Material and methodsThe project was developed in Hospital Universitario Virgen de la Arrixaca, Murcia, Spain. A total of 337 patients with acute ischaemic stroke treated with reperfusion therapies were evaluated. For qualitative analysis, 2 working groups were formed: an advocacy group that designed and directed the entire project, and a multidisciplinary one, which served as a source of information and a mechanism for active involvement of all professionals in the stroke-care chain. Information was collected in 3 meetings and then, both the flowcharts and the cause-effect diagram were prepared.
ResultsBased on the above tools, potential causes of delay were identified and classified according to an operational criterion into unmodified structures, and modifiable ones with known evidence and hypothetical repercussions. Modifiable ones are noted for their importance in the design of future improvement interventions in stroke care. Some of them are: Variability in following established protocols, lack of procedures in some parts of the stroke-care chain, etc.
ConclusionKnowledge of the current situation has just been the starting point, but it has been an essential requisite for the design and implementation of a quality improvement program to shorten in-hospital stroke code times.
La enfermedad cerebrovascular es la segunda causa de mortalidad global, la primera causa médica de discapacidad permanente en el adulto y la segunda causa de demencia1. Además, se estima que consume un 3-4% del gasto sanitario2. Se ha demostrado que la eficacia y la seguridad del tratamiento de reperfusión en el ictus isquémico agudo dependen de la precocidad con que se administre el fibrinolítico o la trombectomía y que disminuyen progresivamente con el tiempo de evolución3–8. De hecho, la estrecha ventana terapéutica constituye uno de los principales criterios de exclusión para la aplicación de dichos tratamientos9.
El «código ictus» (CI) es un sistema que permite la rápida identificación, notificación y traslado de los pacientes con ictus agudo al centro de referencia. Su implantación ha reducido los tiempos de atención y ha aumentado el número de pacientes tratados5,10,11. En 2008, la Estrategia en Ictus del Sistema Nacional de Salud marcó como objetivo para 2010 la necesidad disponer de sistemas de CI organizados y acceso a unidades de ictus en todo el territorio12.
Por todo ello, en los últimos años se han desarrollado sistemas y herramientas para monitorizar la calidad y las diferencias y variaciones en los estándares de cuidados entre hospitales, regiones y países13. Además, se han definido diferentes indicadores de calidad (como el porcentaje de pacientes tratados en los primeros 60 min desde su llegada al hospital, o el de pacientes a los que se realiza la neuroimagen en los primeros 25 minutos desde la llegada a urgencias)14, y son varios los centros internacionales que han implementado programas de mejora con buenos resultados15–18.
Sin embargo, estas iniciativas de mejora se han centrado casi de forma exclusiva en el proceso extrahospitalario, sin establecer actuaciones claras una vez que el paciente llega al hospital19–21. Por eso, todavía existe alta variabilidad en los procedimientos hospitalarios y en la aplicación efectiva de las recomendaciones, de tal forma que muchos pacientes no reciben las intervenciones de manera oportuna22. Las causas de este retraso son multifactoriales: intervienen factores relacionados con la estructura, la organización, el paciente y los profesionales implicados17,23–25. En este contexto un detallado análisis de situación y rendimiento a nivel local es esencial tanto para valorar la puesta en marcha de iniciativas de mejora como para comprobar si estas producen los cambios que se persiguen23,26. En nuestro hospital (referencia regional para el tratamiento integral del ictus) este análisis apuntó a que los tiempos intrahospitalarios excedían las recomendaciones establecidas e identificó una importante oportunidad de mejora. Por ello, y para maximizar los beneficios clínicos y los resultados de salud en estos pacientes, se creó un grupo de mejora con el que se pretendía reducir dichos tiempos.
El objetivo de este estudio fue identificar y clasificar las causas potenciales de retraso en la aplicación del tratamiento de reperfusión a los pacientes que llegaban al hospital, como requisito previo al diseño e implementación de intervenciones para mejorar.
Material y métodoEl proyecto completo se diseñó como un ciclo de evaluación y mejora de la calidad (estudio cuasiexperimental sin grupo control) y se ha desarrollado en el Hospital Clínico Universitario Virgen de la Arrixaca (HCUVA), hospital de referencia para el tratamiento integral del ictus en la Región de Murcia.
La población en estudio para la evaluación inicial englobó a un total de 337 pacientes: todos aquellos que presentaron ictus isquémico agudo fueron atendidos en nuestro centro y tratados mediante terapias de reperfusión (trombólisis intravenosa [TLIV] o trombectomía intraarterial mecánica [TIAM]) desde febrero de 2009 hasta febrero de 2014.
Para el análisis cualitativo de las causas de retraso en el tratamiento del paciente con ictus agudo se constituyeron 2 grupos de trabajo e investigación:
- •
Un grupo promotor, que ha diseñado y dirigido todo el proyecto, formado por el coordinador y un médico de la Unidad de Calidad, la coordinadora de la Unidad de Ictus y una neuróloga.
- •
Un grupo multidisciplinar, que estaba integrado por 20 representantes de todas las categorías de profesionales, sanitarios y no sanitarios, y de todos los servicios que formaban parte de la cadena asistencial al ictus en nuestro hospital, esto es: urgencias, neurología, análisis clínicos, radiología y neurorradiología intervencionista. Su función principal fue la de servir de fuente de información y de ayuda en su análisis, para aprovechar así el conocimiento y enfoque de cada uno de sus miembros. Para el proyecto global de evaluación y mejora actuó, además, como mecanismo de implicación activa de todos los profesionales que asistían al paciente con ictus agudo desde que este llegaba al hospital.
Se programaron 3 reuniones presenciales del grupo multidisciplinar durante el primer trimestre de 2015, y se mantuvo, además, comunicación permanente mediante correo electrónico entre ellas. En la primera reunión se explicó el proyecto de mejora y se recogió un amplio abanico de causas potenciales de retraso mediante lluvia de ideas y debate, que el grupo promotor vertebró como un diagrama de causa y efecto. Este borrador fue debatido, modificado y finalmente consensuado por todo el grupo en el transcurso de las reuniones restantes.
De forma paralela, el grupo promotor utilizó entrevistas estructuradas con cada profesional implicado en la cadena de atención al paciente con CI en nuestro hospital, a fin de conocer los diferentes puntos y etapas de que constaba el proceso de atención, sus procedimientos habituales y sus desviaciones. Con esta información se elaboraron flujogramas y diagramas de vías paralelas27, fundamentales para decidir intervenciones en el seno del proyecto global de mejora.
Como resultado del empleo de las herramientas anteriores, fue posible identificar las causas potenciales de demora en la aplicación del tratamiento de reperfusión. Estas se clasificaron de forma matricial según 2 criterios:
- •
Operativo. Tres grupos de causas: estructurales inmodificables, modificables con evidencia conocida (existía evidencia de un nexo causal con el problema de calidad) y causas de repercusión hipotética (se intuía una relación con el problema de calidad, pero no existía evidencia previa), siguiendo el esquema propuesto por Saturno28.
- •
Dominios usualmente utilizados en el contexto de los análisis de causa-raíz29. Distinguimos 5: paciente y su entorno (familiares, situación clínica), estructura, formación, organización y personal.
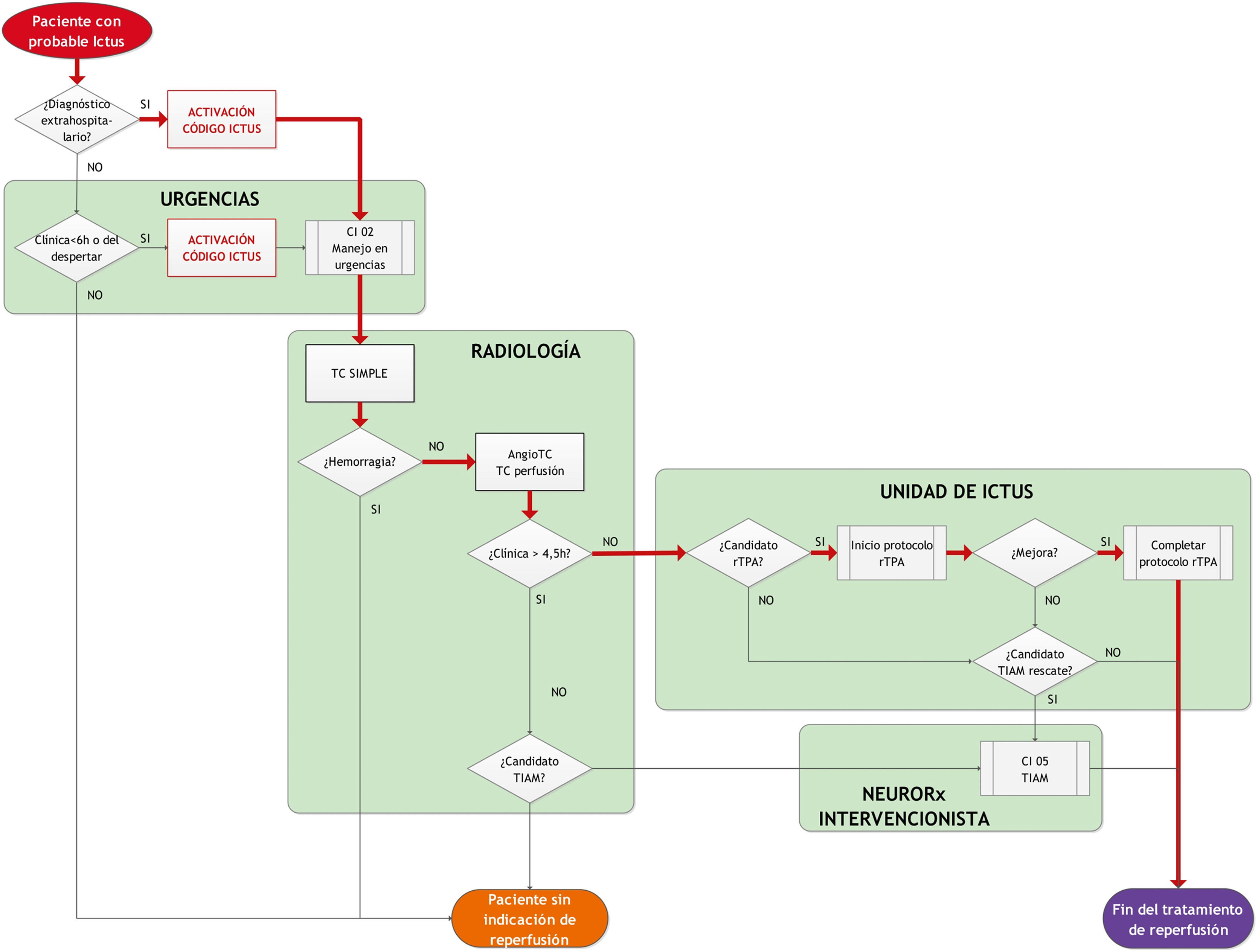
En cuanto a la elaboración de los flujogramas y diagramas de líneas paralelas, el resultado fue un set de 6 procedimientos secuenciales que incluían todo el proceso de atención intrahospitalaria al paciente con CI tal y como se venía realizando en nuestro hospital y susceptible de ser optimizado por los grupos de trabajo, y cuyas interrelaciones principales se resumen en la figura 1. Estos fueron:
- •
Acceso del paciente con CI.
- •
Manejo del paciente en camas de urgencias.
- •
Sala de radiología y obtención de neuroimagen.
- •
Unidad de ictus y trombólisis intravenosa.
- •
Planteamiento de trombectomía intraarterial mecánica de rescate.
- •
Sala de neurorradiología y trombectomía intraarterial mecánica.
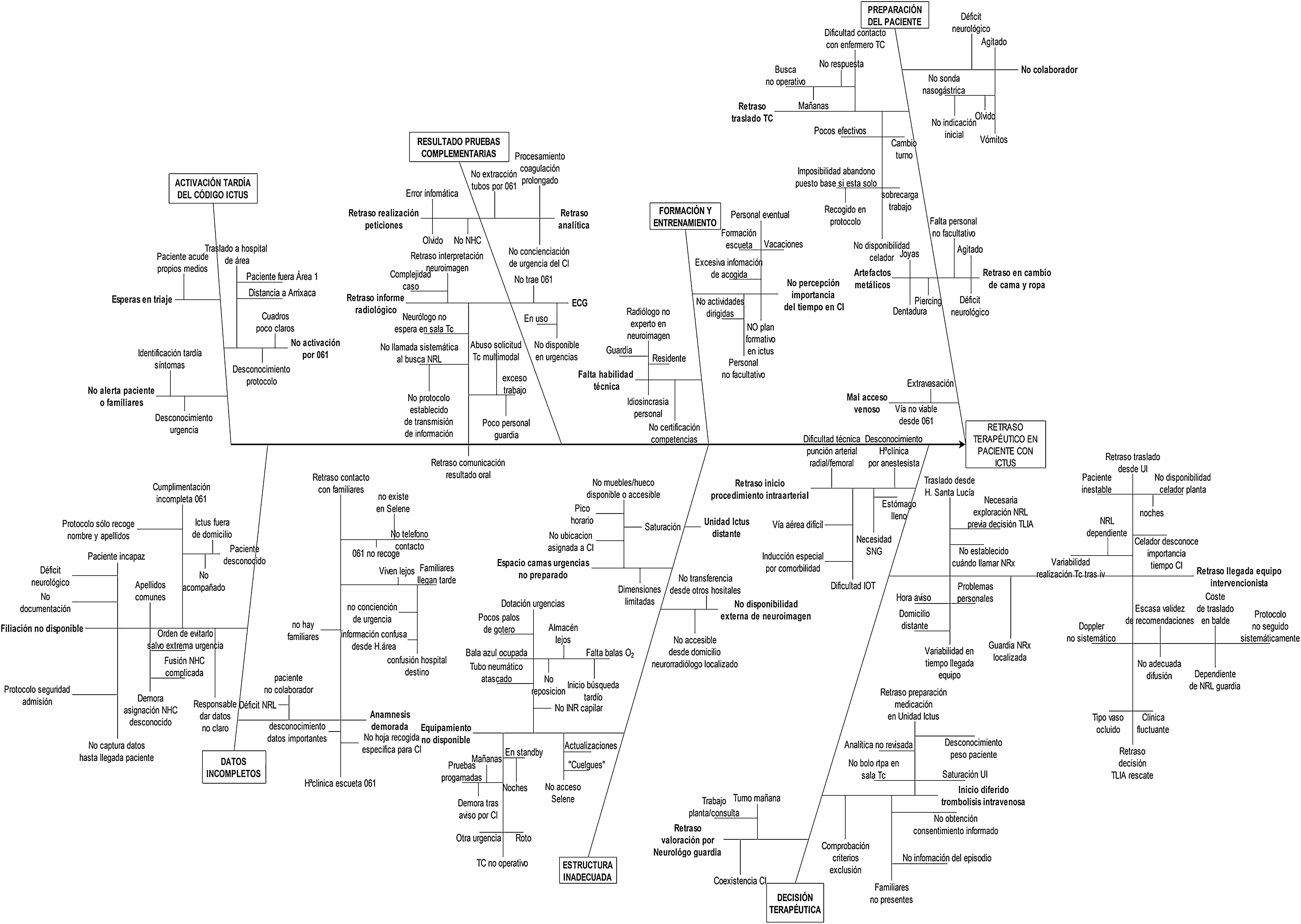
El grupo de trabajo estructuró los resultados del análisis de causa-efecto con base en 7 grupos de causas de primer orden. El diagrama de Ishikawa resultante se recoge en la figura 2.
- •
Activación tardía del CI.
- •
Datos de filiación y clínicos incompletos.
- •
Retraso en el resultado de pruebas complementarias.
- •
Estructura.
- •
Formación y entrenamiento del personal.
- •
Preparación del paciente.
- •
Decisión terapéutica.
Las causas identificadas se clasificaron en una matriz de doble entrada (tabla 1), en función de su carácter modificable o no modificable y en función del ámbito en el que acontecían. Es decir: relacionadas con el paciente, los familiares o el propio evento vascular (comorbilidades, agitación o vómitos, déficit neurológico que impidiera colaborar en la anamnesis o el consentimiento, la ausencia de testigos o familiares a los que realizar la anamnesis, su indecisión con respecto a la administración del tratamiento, el déficit neurológico fluctuante o la inestabilidad clínica), relacionadas con la estructura (dimensiones limitadas en el área de camas de urgencias, no tener acceso a la neuroimagen realizada en otro hospital, ocupación de la bala de envío de muestras biológicas, neurorradiólogo de guardia localizada, etc.), relacionadas con la formación, relacionadas con la organización (pico horario en puerta de urgencias, demora en la obtención de resultados de coagulación, no captura de datos hasta la llegada del paciente, etc.) y relacionadas con el propio personal (idiosincrasia, inexistencia de certificación de competencias, variabilidad en el seguimiento de procedimientos y protocolos).
Matriz de clasificación de causas
| Causas inmodificables | Causas modificables con evidencia conocida | Causas hipotéticas | |
|---|---|---|---|
| Paciente | • Edad • Cuadro clínico poco claro • Comorbilidad • Situación clínica inestable • Ictus producido lejos del hospital • Paciente no asignado al área de influencia del hospital • Sin familiares • No colaborador por déficit neurológico • Déficit neurológico fluctuante • Acceso venoso complejo | • Portador de artefactos metálicos a la llegada a sala de radiología • Paciente agitado en sala de radiología • Vómitos en sala de radiología | • No reconocimiento del cuadro por el paciente o sus familiares • Familiares se demoran en acudir al hospital • Caso complejo con difícil interpretación de neuroimagen |
| Estructura | • Área de camas de urgencias de dimensiones limitadas • Almacenamiento de balsa de oxígenos lejano al área de urgencias • Unidad de Ictus lejana al área del urgencias | • Inexistencia de ubicación asignada en urgencias para pacientes con código ictus • Deficiencias en el sistema de historia clínica electrónica • Disponibilidad insuficiente de palos de gotero • Tomógrafo averiado • No acceso a neuroimágenes realizadas desde otro hospital • Bala de envío de muestras biológicas ocupada • No disponibilidad de medidor de INR capilar • Neurorradiólogo de guardia localizada • Pocos celadores en turno de noche | • Dimensionamiento de plantilla inadecuado • Fallo del tubo neumático de transporte de muestras • Aparatos de EKG ocupados • Sala de radiología ocupada |
| Formación | - | • Personal de urgencias 061 no activa el código ictus • Personal de urgencias 061 no conoce datos necesarios en caso de código ictus • Inexistencia de plan formativo en código ictus para personal no facultativo • Personal eventual • No manejo de doppler en unidad de ictus | • Personal de urgencias 061 no conoce protocolo de código ictus • Personal sanitario eventual no concienciado con la situación de urgencia • Celador de planta no consciente de la importancia del tiempo en código ictus • Falta de habilidad en interpretación de neuroimágenes por personal de guardia |
| Organización | • Pico horario en puerta de urgencias | • Esperas en triaje de urgencias • Traslado desde domicilio hasta hospital de área en vez de al HCUVA. • Personal de urgencias 061 no extrae la analítica necesaria • No recogida del número de teléfono de contacto con familiares • Admisión no captura datos hasta la llegada efectiva del paciente • Protocolo de asignación de número de historia clínica de desconocido • Protocolo de priorización de actividades en celador • Sala de camas de urgencias saturada • Demora en la obtención de resultados de coagulación • Celador no disponible para traslados entre salas o unidades cuando se necesita • Balas de oxígeno agotadas en sala de camas de urgencias • No protocolo para la indicación de sondaje nasogástrico en urgencias • Enfermero de radiología no tiene busca asignado en turno de mañana • Tomógrafo en situación de espera • Aviso a radiólogo de guardia tras la llegada efectiva del paciente • No protocolo sobre actuación en casos de alergia a contraste • No inicio de fibrinólisis intravenosa en sala de radiología • No aviso a unidad de ictus desde radiología, para comenzar a preparar fibrinólisis • Petición no sistemática de trombectomía mecánica • No protocolo escrito para el procedimiento intraarterial | • Balas de oxígeno no repuestas con rapidez por celador • Radiólogo o neurólogo de guardia ausentes a la llegada del paciente a radiología • Abuso de la imagen multimodal • Resultados analíticos no revisados a la llegada a la unidad de ictus • Indefinición y variabilidad en la necesidad de firma de consentimiento informado • Historia clínica no disponible para anestesista • Variabilidad en el momento de aviso a neurorradiólogo intervencionista |
| Profesionales | • Idiosincrasia | • No existe certificación de competencias • Variabilidad en el seguimiento de procedimientos y protocolos | • Comprobación exhaustiva de criterios de inclusión/exclusión • Olvidos en tramitación electrónica de peticiones analíticas • Errores en la indicación de sondaje nasogástrico |
HCUVA: Hospital Clínico Universitario Virgen de la Arrixaca.
El estudio ha identificado y clasificado un amplio abanico de causas de retraso en la atención al paciente con CI en nuestro hospital. La matriz resultante ha permitido diferenciar y priorizar todas ellas y ha proporcionado un conocimiento profundo del fenómeno, que ha hecho posible el diseño e implementación de intervenciones dirigidas a mejorar. Aquellas causas clasificadas como modificables fueron las que ofrecieron la posibilidad de generar intervenciones de mejora, algunas de ellas inmediatas, entre las que podríamos destacar la revisión de los procedimientos. El desarrollo de procedimientos escritos que apoyaran la toma de decisiones médicas ha sido considerado uno de los elementos esenciales en la organización y aplicación de los cuidados urgentes al ictus, que debían estar disponibles y actualizados en todos servicios implicados30,31.
En nuestro caso, a pesar de existir un manual de protocolos interno en torno a la atención al ictus revisado recientemente32, la ausencia de procedimientos en algunos puntos del circuito, en especial cuando exigían coordinación entre servicios y unidades, fue una causa importante de demora. Algunos ejemplos fueron: la recogida de datos específicos de CI por los profesionales que actuaban a nivel extrahospitalario, la asignación ágil de un número de historia clínica de desconocido cuando faltaban datos del paciente, el momento del aviso al radiólogo de guardia o de la colocación de sonda nasogástrica, sonda urinaria, etc., entre otros.
Pero además, se detectó la existencia de variabilidad en el seguimiento de los protocolos previamente establecidos y consensuados, como, por ejemplo, en la exigencia de la firma de consentimiento informado previa a la administración del tratamiento de reperfusión o en el momento de aviso al neurorradiólogo intervencionista localizado en casos en los que estaba indicada la TIAM de rescate. Hasta la fecha no se habían establecido unas referencias temporales para ello en las guías de práctica clínica, lo que podría explicar este último punto. Sin embargo, recientemente se introdujo la recomendación de que la TLIV no debía suponer un retraso en el inicio de la TIAM y que un intervalo de observación previo a la TIAM de rescate no estaba indicado33, lo que pudo aportar algo de luz a la hora de establecer y consensuar nuevas actuaciones. También la existencia de un número no desdeñable de residentes rotantes que hacían guardias de neurología se identificó como fuente de variabilidad, ya que esta situación podía contribuir a una menor difusión de la responsabilidad para el rendimiento global del tiempo puerta-aguja, definido como el periodo transcurrido desde la llegada del paciente a la puerta de urgencias hasta la administración del bolo de activador recombinante del plasminógeno tisular intravenoso, y a una menor memoria institucional para buenas prácticas23.
La adecuada selección de las exploraciones complementarias y la disponibilidad de sus resultados previamente al inicio del tratamiento de reperfusión habían sido también identificadas como causas de demora en varios estudios. Así, se sabía que solicitar un electrocardiograma o una radiografía de tórax previos a la neuroimagen originaba retrasos de hasta 6 y 13 min, respectivamente24, o que la realización de una angio-TC antes de la TLIV aumentaba el tiempo puerta-aguja en 10 min, probablemente más por el tiempo de interpretación de la imagen y de disponibilidad de esta información radiológica que por la adquisición de imágenes en sí misma34,35. En nuestro centro se identificaron retrasos en la obtención de resultados de coagulación y de neuroimagen. El primero, fundamentalmente, por no contar con medidores de international normalized ratio (INR) capilar en el área de urgencias; el segundo, por múltiples causas entre las que figuraban la ocupación de la sala de la TC por otro paciente, la calibración del aparato en el turno de noche y, especialmente, por el tiempo necesario para la correcta interpretación de la neuroimagen. Este último estaba ligado a la habilidad y pericia del radiólogo de guardia, bien porque no estuviera especializado en neuroimagen o TC multimodal o bien porque la sobrecarga de trabajo pudiera hacer del residente de radiología el primer encargado de dicha interpretación.
El tiempo puerta-aguja se ha considerado una responsabilidad directa de todos los profesionales que atendieran al paciente3, lo que explicaría la influencia de factores humanos y personales en la generación de retrasos, como el desconocimiento del CI o la falta de concienciación de los profesionales implicados17. En nuestro centro, se ha visto que tanto la idiosincrasia personal de algunos profesionales como la falta de concienciación de la urgencia y de la importancia de los tiempos provocaban demoras, posiblemente debidas a déficits formativos (por ejemplo en personal eventual durante periodos vacacionales) o a la no exigencia de certificación periódica de habilidades técnicas.
El listado de causas inmodificables englobó factores implicados en el aplazamiento de toma de decisiones médicas (un condicionante de primer orden en el retraso en los tiempos intrahospitalarios)25, como la comorbilidad del paciente, la ausencia de testigos o familiares a los que realizar la anamnesis, la indecisión de los mismos con respecto a la administración del tratamiento, el déficit neurológico que impidiera al paciente colaborar en la anamnesis o en el consentimiento, el déficit neurológico fluctuante o la inestabilidad clínica que limitaba y retrasaba el traslado del paciente o el inicio del tratamiento específico de reperfusión. Estas situaciones complicarían la decisión médica que, aunque basada en protocolos estandarizados, siempre debería asegurar un abordaje individualizado. En este sentido, algunos autores han propuesto que, en casos concretos de inestabilidad hemodinámica, compromiso respiratorio o déficit neurológico fluctuante, el empeño por lograr un tiempo puerta-aguja inferior a 60 min podría no ser apropiado31. La agitación del paciente, los vómitos o las cifras de tensión arterial excesivamente elevadas17 serían otros factores que podrían conllevar demoras y que se deberían controlar antes del tratamiento fibrinolítico.
La presión asistencial en el pico horario en la puerta de urgencias, las dimensiones limitadas de su área de camas y su plantilla o la localización alejada de la unidad de ictus se identificaron como causas inmodificables de alargamiento de los tiempos intrahospitalarios, y, por el momento, no ha resultado posible solventarlas. Igualmente, la guardia localizada del equipo de neurorradiología intervencionista fue otro factor limitante de los tiempos de TIAM fuera del horario laboral.
Como se ha señalado anteriormente, este estudio está englobado en un proyecto más amplio que se complementa con un análisis cuantitativo de los pacientes tratados. Los resultados de ambos forman la base para la priorización y puesta en marcha de intervenciones que persiguen minimizar los tiempos asistenciales del ictus a fin de mejorar los resultados clínicos y la calidad de vida de los pacientes con ictus agudo que acudan a nuestro hospital. A día de hoy ya se han puesto en marcha intervenciones de mejora cuyos resultados evaluaremos en un futuro no muy lejano.
La principal limitación del estudio fue su validez externa y su utilidad práctica, pues estas deberían circunscribirse al hospital donde se han investigado. Si bien las causas identificadas en este estudio fueron en gran parte coincidentes con las de la literatura revisada, en un sentido estricto su importancia relativa y las iniciativas a implementar como consecuencia podrían diferir en otros entornos, por lo que un análisis como este debería llevarse a cabo en todos los casos.
En definitiva, conocer el porqué de las demoras en la aplicación del tratamiento de reperfusión en nuestro entorno de trabajo ha sido solo el punto de partida en el camino hacia la mejora de los tiempos de atención al paciente con ictus isquémico agudo. Sin embargo, se ha tratado de un paso indispensable para el diseño y la puesta en marcha de intervenciones de mejora exitosas. Complementar estos resultados con un análisis cuantitativo de las demoras nos ha permitido, además, situar al hospital con relación a los indicadores de calidad consensuados, monitorizar resultados y conocer en el futuro el impacto de las medidas que se hayan llevado a cabo.
Conflicto de interesesNo existe.
A todos los profesionales del grupo de mejora de la atención al paciente con ictus de HCUVA.