El presente trabajo tiene como objetivo abordar el impacto que tiene sobre la sociedad el adecuado desempeño de las autoridades reguladoras de medicamentos a partir de la implementación de un sistema de gestión de calidad (SGC) en estas agencias. Para esto, previamente se muestra un análisis del entorno actual en la regulación de medicamentos y de la influencia de la calidad en los sistemas de salud, que han propiciado un incremento en los controles en este sentido.
Se exponen los beneficios tanto para el desarrollo de la industria farmacéutica y biotecnológica como para la población, que recibe los productos de éstas, a través de un modelo que relaciona el desempeño de las autoridades reguladoras y el ciclo de mejora que se ilustra en un SGC. Finalmente, se presenta el caso de la autoridad reguladora cubana, que actualmente dispone de un SGC avalado por agencias certificadoras.
The aim of this paper is to illustrate the social impact of drugs regulatory authorities’ procedures, viewed from the perspective of the implementation of a quality management system. A review of drug regulations and their influence on quality and health systems is described.
La salud, definida por la Organización Mundial de la Salud (OMS), es un estado de completo bienestar físico, mental y social y no solamente la ausencia de las afecciones o enfermedades1. Se caracteriza por ser un valor fundamental de la humanidad y debe entenderse como “la calidad de la existencia del hombre determinada por su relación armónica con el medio natural-social que le corresponde”2.
Entre otros factores, la salud puede verse afectada por el inadecuado consumo de medicamentos, que paradójicamente están destinados a conservarla, y es que los problemas relacionados con la seguridad y calidad de los medicamentos existen en muchos países del mundo actualmente, ya sean desarrollados o en vías de desarrollo. Esto ocurre en muchas ocasiones por la escasa o inadecuada regulación de medicamentos que puede conllevar a la presencia en el mercado nacional e internacional de productos falsificados, dañinos e inefectivos, lo que se traduce en serios perjuicios a la salud del consumidor3.
En la búsqueda de estrategias que eviten este panorama, se ha impuesto como necesaria la regulación efectiva de medicamentos para garantizar la seguridad, la eficacia y la calidad de éstos, así como la disponibilidad de información precisa y apropiada para la población.
Paralelo a lo anteriormente expuesto, se encuentra la actual y creciente necesidad de eficacia y eficiencia en la prestación de servicios, que ha dado lugar a que la calidad evolucione y se aspire a un nivel superior constantemente. Esto ha conllevado a la implementación de sistemas de gestión de calidad (SGC) para la mejora continua, incluso en el campo de la salud, uno de los sectores más sensibles, ya que un incremento en la calidad de estos servicios incide directamente sobre la calidad de vida de la población, dada por la introducción de mejoras organizativas en los servicios tanto asistenciales como no asistenciales4.
Este movimiento por la calidad en los sistemas de salud es una muestra de su repercusión sobre el desarrollo y bienestar de la humanidad, y es precisamente lo que se expone en este trabajo, que tiene como objetivo abordar el impacto que tiene sobre la sociedad el adecuado desempeño de las autoridades reguladoras de medicamentos (ARM) a partir de la implementación de un SGC en estas agencias.
Entorno regulador de medicamentosComo estrategia fundamental, la OMS se ha encargado de apoyar a los países en su esfuerzo por implementar programas y políticas nacionales para asegurar la equidad al acceso de medicamentos esenciales, seguros y de calidad, así como el apropiado uso de éstos a través de eficientes mecanismos reguladores nacionales. Actualmente son varios los aspectos que conforman la estructura de regulación de medicamentos: leyes, agencias reguladoras, esquemas de evaluación, laboratorios de control de calidad y centros de información, que evolucionan constantemente y permiten que se detecten los problemas y las necesidades de la sociedad.
Específicamente las agencias reguladoras, también ARM, incluyen una variedad de funciones —y tienen toda la autoridad y la responsabilidad para ejercerlas—, como son el otorgamiento de licencias, la inspección de fabricación y distribución, la evaluación de productos y registro sanitario, el monitoreo de reacciones adversas, el control de calidad, el control de promoción y alerta de medicamentos, y el control de ensayos clínicos3,5–13.
En la figura 1 se muestran algunos de los países que cuentan con una ARM.
La población resulta ser la principal afectada por una decisión errónea al registrar productos que no son confiables, liberar lotes de vacunas que no cumplan las especificaciones requeridas, no accionar a tiempo con el retiro de productos con defectos del mercado, incluso por falta de monitoreo de las condiciones en centros productores y distribuidores. De ahí la importancia de la veracidad de las decisiones tomadas por las ARM, que implican la disponibilidad de medicamentos confiables y seguros en el mercado.
Calidad en el entorno regulador de medicamentosLa OMS evalúa periódicamente a las ARM, con el apoyo de un número de herramientas predefinidas que brindan información del estado en que se encuentran e identifican sus debilidades y fortalezas en el control adecuado de medicamentos en cada país.
Recientemente se consideró incluir como parte de esta herramienta un módulo de indicadores referente a la presencia de un SGC que abarque todas sus funciones reguladoras, lo que está en correspondencia con la actual tendencia de elevar la calidad en los servicios de salud.
Estos indicadores son:
- 1.
Compromiso de la dirección para implementar un SGC pertinente para todas las funciones reguladoras.
- •
Declaración de política y plan de desarrollo.
- •
Identificación y designación del soporte financiero y los recursos humanos necesarios.
- •
- 2.
Presencia de un SGC.
- •
Definición del diagrama organizacional y las responsabilidades.
- •
Documentación escrita para llevar a cabo todas las funciones.
- •
Sistema de auditoría documentado e implementado.
- •
Sistema de gestión para asegurar la trazabilidad de las acciones.
- •
Para dar cumplimiento a estos nuevos indicadores podría adoptarse la norma ISO 9001, guía recomendada y generalizada internacionalmente para la implementación de un SGC, que plantea la aplicación de un conjunto de requisitos organizativos y técnicos que podrían usarse con el fin de alcanzar una mayor credibilidad en las decisiones de estas agencias, una mayor fortaleza y estabilidad de sus funciones y una sistematización en la planificación, el control y la mejora de la calidad de sus procesos, así como la elevación de los niveles de eficacia y eficiencia. Todo esto basado en los principios de enfoque al cliente y a los procesos, en la búsqueda de la mejora continua.
Esto les permite a las ARM identificar constantemente el funcionamiento de sus procesos y las metas que deben lograr para encaminarse cada vez más a hacia estadios superiores que garanticen el incremento en la satisfacción de sus clientes y el ahorro de recursos necesarios, todo lo cual permitirá una más rápida disponibilidad del medicamento confiable en el mercado14.
Lo anterior se traduce en la identificación constante de acciones de mejora a partir de los resultados obtenidos luego de cada actuación, sobre la base de corregir los problemas que se han presentado y prevenir aquellos que puedan ocurrir dadas las circunstancias actuales.
El control sanitario en materia de medicamentos, paralelo a un SGC, potencia la acción reguladora de las ARM. En el esquema de la figura 2 se representa la secuencia de operaciones básicas de una ARM para la ejecución de sus funciones y se inserta el ciclo de la mejora continua. Aquí se muestran los beneficios sociales que brinda esta coalición, donde a partir de la toma de decisiones sustentada en una planificación adecuada, con políticas y objetivos definidos, la apropiada gestión de los recursos humanos y materiales dada por la formación y la competencia del personal involucrado con los procesos, así como la adquisición de los recursos necesarios para su realización, se logra la constante identificación de las debilidades en sus procesos, las oportunidades de mejora y las acciones que requieren emprenderse en caso de detectarse fuentes de error de las operaciones básicas, lo que garantiza la calidad, la seguridad y la eficacia de los medicamentos destinados a la población.
Algunos de los indicadores para evaluar el cumplimiento de los requisitos, previamente establecidos en cada una de las funciones, así como determinadas acciones de mejora que pudieran identificarse en los diferentes procesos para el logro de estos beneficios, se expresan en la tabla 1. Este proceder debe ser sistemático y monitorizado para verificar la efectividad de las acciones emprendidas.
Ejemplos de indicadores de eficacia y de acciones de mejora emprendidas para el cumplimiento de requisitos
| Funciones | Indicadores |
| Actividades de licenciamiento y de autorización de comercialización | Porcentaje de solicitudes de trámites de registro sanitario evaluadas en tiempo |
| Porcentaje de respuesta a trámites de licencia sanitaria de operaciones farmacéuticas | |
| Inspecciones reguladoras | Porcentaje de cumplimiento de inspecciones planificadas |
| Porcentaje de informes de inspecciones farmacéuticas estatales entregados en tiempo | |
| Liberación de lotes | Porcentaje de lotes liberados por documentación y ensayo |
| Supervisión reguladora de ensayos clínicos | Número de inspecciones a ensayos clínicos autorizados realizados |
| Actividades de postcomercialización (seguimiento de acontecimientos adversos) | Porcentaje de investigaciones ante acontecimientos adversos realizadas en tiempo |
| Porcentaje de medidas sanitarias emitidas monitoreadas | |
| Acceso a laboratorios | Porcentaje de capacidad analítica del laboratorio nacional de control |
| Sistema nacional regulador | Porcentaje de regulaciones aprobadas diseminadas en tiempo |
| Porcentaje de cumplimiento del plan de calibración/verificación | |
| Algunas acciones de mejora emprendidas | |
| |
ARM: autoridad reguladora de medicamentos.
Dentro de la sociedad, tanto la población como la industria farmacéutico-biotecnológica se favorecen con este proceder por la disponibilidad de medicamentos seguros en el mercado, la respuesta rápida y efectiva ante acontecimientos adversos de medicamentos en el mercado, el incremento en la cultura poblacional del consumo y el efecto de los medicamentos, el desarrollo de la industria por el mayor alcance regulador, las mejoras en el servicio, la comunicación y el tiempo de respuesta de las solicitudes presentadas.
Escenario cubano en la regulación de medicamentosEl Centro para el Control Estatal de la Calidad de los Medicamentos, ARM de Cuba, ha implementado un SGC con resultados favorables en su desempeño como agencia sanitaria. De ello dan fe la reciente certificación ISO 9001 otorgada por los órganos certificadores (la Oficina Nacional de Normalización y la Agencia Española de Normalización) y los resultados favorables en este sentido declarados por la OMS en los últimos años.
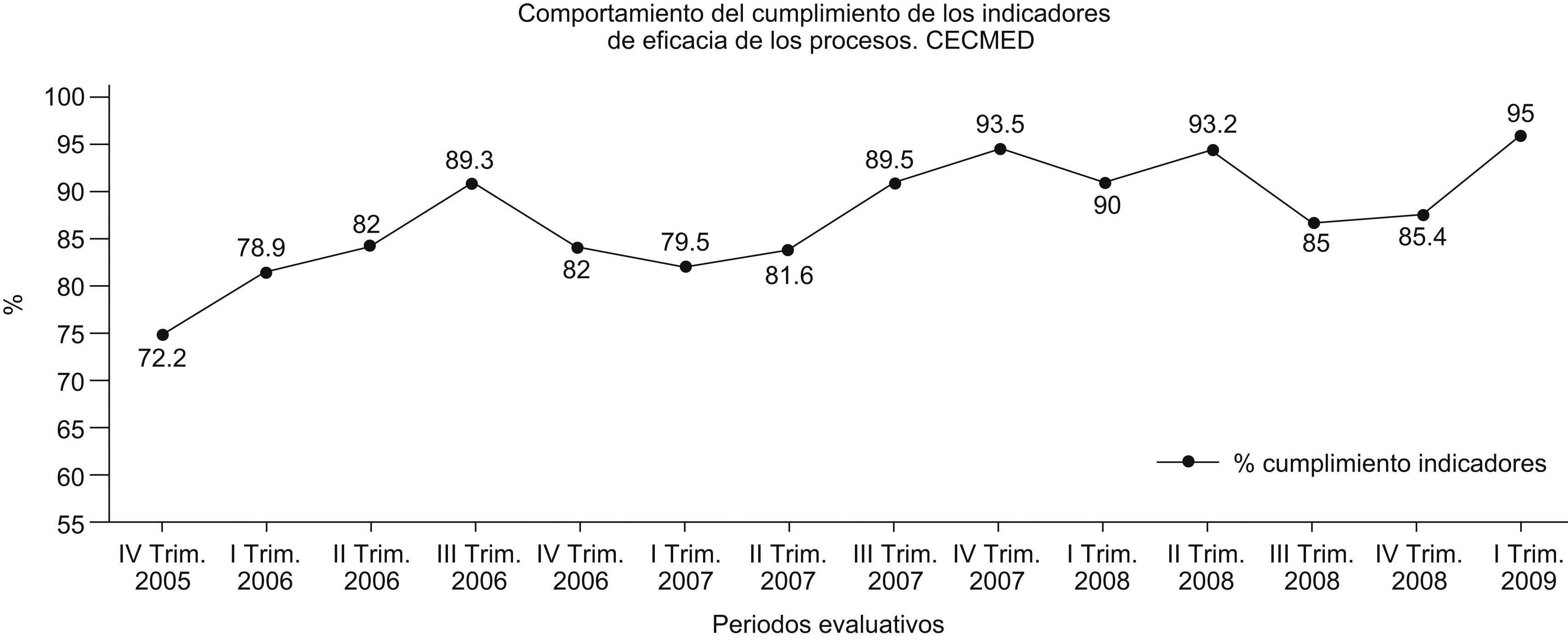
La implementación de este SGC ha contribuido a elevar el nivel de eficacia de los procesos de la autoridad, lo que se muestra en la figura 3, donde se representa el comportamiento del cumplimiento de estos indicadores.
Estos avales son evidencias de un compromiso y una actuación adecuados en el control de medicamentos y la protección del consumidor (población).
La experiencia del Centro para el Control Estatal de la Calidad de los Medicamentos se trasmitirá a las ARM interesadas, en especial de la región de las Américas por la similitud en condiciones, para lograr un servicio conforme que propicie la seguridad, la calidad y la eficacia de los medicamentos que se comercialicen en su país.