Introducción
Las vías clínicas (VC) o mapas de asistencia son instrumentos para planificar y coordinar la secuencia de procedimientos médicos, de enfermería y administrativos (determinaciones diagnósticas, medicación, consultas, educación, planificación del alta, etc.) necesarios para conseguir la máxima eficiencia en el proceso asistencial1. Su carácter de instrumento organizativo y multidisciplinario permite la estandarización de los cuidados para un grupo de pacientes con una misma patología y un curso clínico previsible2. Su formato habitual es el de una matriz de tareas-tiempo, tipo diagrama de Gantt3, cuyas columnas contienen las decisiones por días u horas y cuyas filas identifican los principales componentes de los cuidados4,5.
Su origen se remonta a los años cincuenta, cuando la industria norteamericana las desarrolló como herramienta para coordinar a todos los participantes en proyectos complejos, identificando la secuencia de acciones clave o vías críticas (critical path) para llevarlos a cabo en el tiempo y con los resultados requeridos6. En las 2 décadas siguientes se utilizaron en proyectos tan diversos como la construcción naval o la ingeniería civil.
Las VC se emplearon por primera vez en sanidad durante los años ochenta, cuando en Estados Unidos se generalizaron los métodos de pago prospectivo que obligaban a mejorar la eficiencia y reducir los costes de la asistencia sanitaria4. Las VC primitivas fueron desarrolladas por enfermeros como planes de cuidados para mejorar los cuidados de enfermería7, pero su evolución posterior las ha convertido en instrumentos multidisciplinarios que integran el conjunto de actividades de todos los profesionales que intervienen en la asistencia sanitaria8.
La rápida diseminación de las VC en Estados Unidos se debió a las características intrínsecas del sector en ese país, a la alta competitividad de su mercado sanitario y a la creciente variabilidad no deseable en la práctica clínica. Estos factores justificaron que, desde los años noventa, más del 60% de los hospitales use VC para sus procesos más frecuentes9.
La principal dificultad para desarrollar VC es la ausencia de una metodología rigurosa y reproducible. La bibliografía en castellano referente a este tema es casi inexistente, mientras que en la anglosajona la mayoría de los artículos aportan más consideraciones teóricas que fundamentos prácticos para el diseño e implantación de estos instrumentos. Los escasos trabajos sobre metodología presentan un grado de detalle insuficiente para ser reproducibles y grandes variaciones entre autores respecto a los criterios de elección de temas, la formación de equipos multidisciplinarios, la propia elaboración de las VC o su implantación y evaluación2,10. La disparidad afecta incluso a la terminología que se ha utilizado para denominar a estas herramientas. Se han llamado de formas distintas (mapas de cuidados, guías prácticas, protocolos de atención, atención coordinada, vías de atención integrada, etc.), aunque finalmente se ha impuesto la denominación de VC, que es la aceptada preferentemente en los buscadores de las bases de datos internacionales. Es paradójico que los métodos para diseñar instrumentos que reduzcan la variabilidad clínica estén sujetos también a gran variabilidad11.
Las enfermedades del corazón son la primera causa de muerte en nuestro país y en nuestra provincia, y entre éstas, el infarto agudo de miocardio (IAM) es la enfermedad que causa más fallecimientos y uno de los principales motivos de ingreso. Nuestro equipo ha venido trabajando en el mejoramiento continuo de la calidad de la asistencia del IAM, y ha desarrollado guías de buenas prácticas clínicas12, evaluando la adaptación a éstas13,14 y realizando intervenciones que también se han evaluado15. Con este estudio pretendemos diseñar, realizar un ensayo piloto y una propuesta definitiva de una VC para el IAM no complicado.
Material y método
Lugar
El estudio se realizó en la Unidad de Cuidados Integrales al Corazón, que cuenta con 3 secciones (intensivos, subintensivos y de hospitalización convencional), en las que se admite a todos los pacientes con IAM no complicado.
Diseño del estudio
Se desarrolló por etapas (tabla 1). De las 10 etapas propuestas en total, sólo 8 formaron parte del estudio (de la etapa I a la VIII) concluyendo con el ajuste, la revisión y la propuesta definitiva de la VC.
Elección del procedimiento para el desarrollar la VC (etapa I)
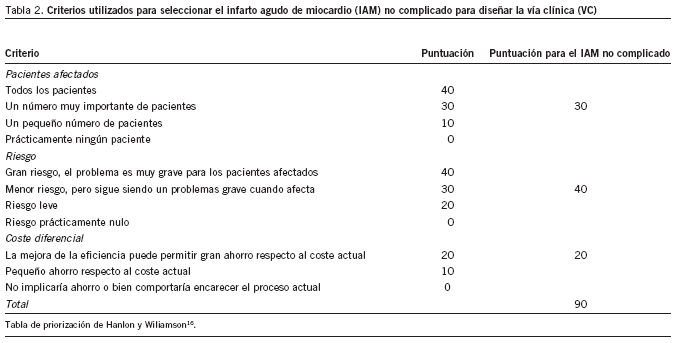
Se seleccionó el IAM no complicado, ya que se trata de una enfermedad que comporta un elevado riesgo y coste, y afecta a muchos pacientes; por otro lado, seleccionar el IAM no complicado permite tener una mayor estandarización en los procesos o, lo que es lo mismo, menor variabilidad del manejo entre pacientes. Por esto se utilizó la escala de selección de Hanlon y Wiliamson, para dar mayor objetividad a esta prioridad16 (tabla 2).
Revisión bibliográfica (etapa II)
Se realizó una búsqueda de trabajos en Medline en los últimos 15 años utilizando las palabras clave "clinical pathways and myocardial infarction" y "critical pathways and myocardial infarction", y se seleccionaron los estudios de relevancia relacionados con nuestro diseño.
Reclutamiento del equipo multidisciplinario (etapa III)
Se reunió a representantes de los profesionales implicados en el proceso asistencial con amplia experiencia en el tema y, además, se contó con la colaboración de un representante de la dirección. Finalmente, el equipo estuvo integrado por 10 profesionales (9 médicos [8 especialistas y 1 residente] y una enfermera).
Diseño escrito de la VC (etapa IV)
Al equipo se le presentó una propuesta de VC que fue elaborada por algunos de sus integrantes y que sirvió de base para la discusión y el consenso.
Técnica de método formal de consenso y evidencia científica (etapa V)
Esta técnica combina la experiencia de los profesionales con la revisión crítica de la experiencia externa. Se inició con la revisión del estado previo del proceso que se quería mejorar, y se identificaron los pasos intermedios más importantes durante la asistencia de los pacientes con IAM, así como las variaciones que se producían y sus causas. Una vez identificados los elementos mejorables, se analizó la experiencia interna convenientemente consensuada, y se combinó con la revisión crítica de la experiencia externa. La experiencia externa provino, fundamentalmente, de las recientes Guidelines for the management of patients with ST-elevation myocardial infarction: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1999 Guidelines for the management of patients with acute myocardial infarction)17, basadas en la evidencia y que categorizan la información disponible en clasificación de las recomendaciones (clases I, II y III) y nivel de evidencia (A, B y C). También se revisaron las guías de otras sociedades18 y las nuestras12. Se tuvieron en cuenta las VC diseñadas en otras instituciones, propiciando el consenso y el respaldo de los profesionales4,19-27.
Ensayo piloto (etapa VI)
Una vez modificada la VC propuesta en la etapa IV, y cuando se hubo llegado a consenso, fue aplicada por los mismos integrantes del equipo. Los resultados se evaluaron en la siguiente etapa.
Discusión preliminar de los resultados e indicadores para su evaluación (etapa VII)
Los resultados de la aplicación de la VC provisional se evaluaron mediante el indicador de satisfacción de los profesionales, por lo cual se confeccionó un cuestionario que exploraba la aceptación y el beneficio de utilizar la VC medida con una escala de 0 a 10. Se elaboraron otros indicadores, pero no todos se evaluaron en esta etapa; los que no se evaluaron formaron parte de la etapa de reevaluación y medición del impacto (tabla 3).
Ajuste y revisión de la VC (etapa VII)
Las dudas o problemas no previstos antes de la aplicación de la VC provisional se corrigieron y se aprobaron de nuevo por parte del equipo, de modo que la VC quedó construida definitivamente.
Datos/variables
Para tener una referencia previa a la etapa X (reevaluación y medición del impacto) se recogieron variables demográficas, clínicas y de resultados; demográficas: edad y sexo; clínicas: prioridad (tabla 4)28, localización del infarto, intervalos de tiempo en minutos (comienzo-puerta, puerta-electrocardiograma [ECG], ECG-decisión, decisión-fármaco, puerta-fármaco, comienzo-fármaco), utilización de medicamentos recomendados (estreptocinasa, aspirina, heparina, bloqueador ß oral, inhibidor de la enzima de conversión de la angiotensina (IECA), anticálcico); y de resultado: estancia hospitalaria.
Resultados
Propuesta de VC definitiva para el IAM no complicado
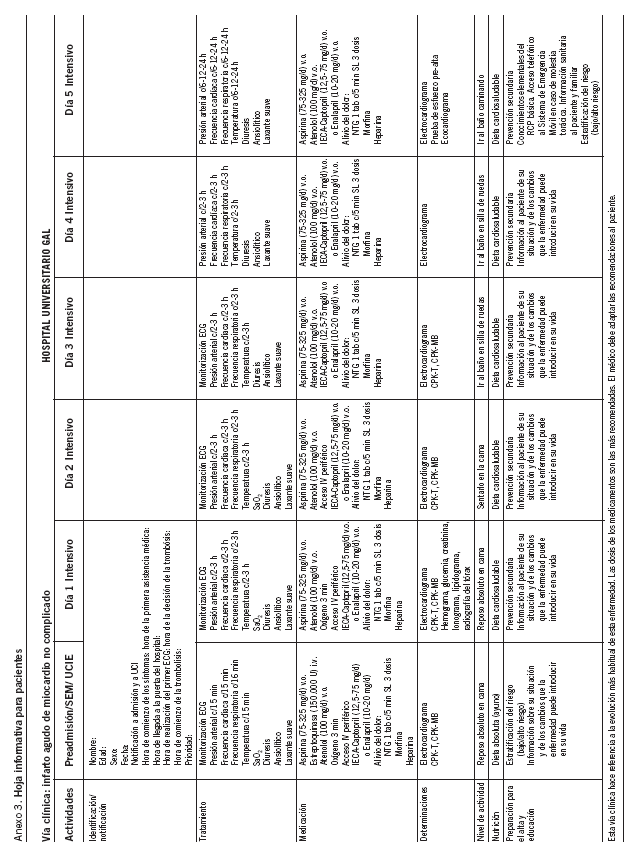
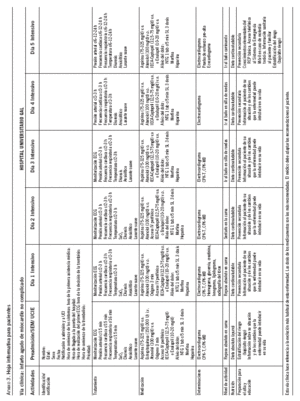
La propuesta final de VC quedó culminada después de 4 encuentros formales y modificada según las opiniones del grupo multidisciplinario. De esta forma, se estructuró en una matriz de tareas-tiempo. Las actividades quedaron divididas en identificación/notificación, tratamiento (aparecen las medidas generales), medicación (medicamentos específicos para el IAM), determinaciones, nivel de actividad, nutrición, preparación para el alta y educación. Estas actividades se distribuyeron según los días de hospitalización hasta el alta. La propuesta inicial se desechó por su marcada síntesis. En una sola hoja aparecían todas las actividades distribuidas en el tiempo de hospitalización y no se podía tomar como sustituta de la indicación tradicional. A sugerencia de los participantes se realizó una segunda propuesta: en una hoja aparecían las actividades de un solo día, estructuradas de manera que permitía conocer su cumplimiento (anexo 1), el dorso de la hoja se podía utilizar para agregar actividades adicionales para cada paciente particular y había espacio para comentar el motivo del incumplimiento de lo sugerido (hoja de variaciones [anexo 2]). También se diseñó la hoja informativa para pacientes, con la misma estructura de la matriz pero simplificada en una sola hoja (anexo 3).
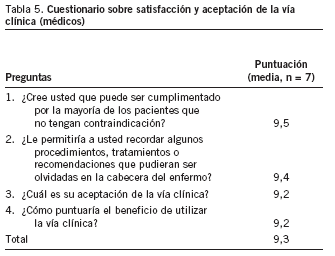
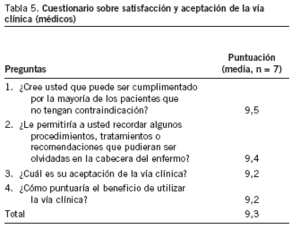
Cuestionario sobre la satisfacción y aceptación de la VC por los médicos (tabla 5)
De 8 los médicos que trabajan en la VC, 7 respondieron el cuestionario. Las puntuaciones medias de cada una de las 4 preguntas sobrepasaron los 9 puntos, y las más bajas fueron de 9,2 puntos, que eran las que hacían referencia a la aceptación y al beneficio de utilizarlas. El 85,7% de los médicos (6) obtuvo puntuaciones por encima de 9 a estas 2 últimas preguntas. La única insatisfacción expresada estuvo relacionada con la complejidad del modelo utilizado en el ensayo piloto.
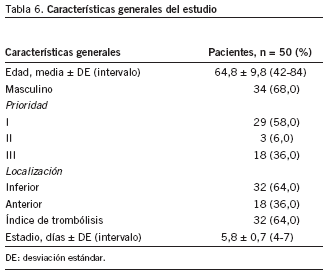
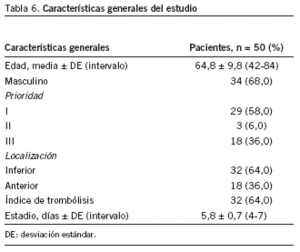
Características generales del estudio (tabla 6)
Un total de 50 pacientes siguió la VC con una edad media de 64,8 ± 9,8 años. El 68,0% eran hombres. El 58,0% se clasificó en prioridad I y el 6,0% en prioridad II, mientras que según la localización, el 64,0% fue inferior. La estancia hospitalaria media fue de 5,8 ± 0,7 días.
Dentro de los elementos identificados en el proceso de atención a pacientes con IAM que se podrían mejorar se encontraban: el tiempo para la administración de trombolíticos, el uso no óptimo de medicamentos de probada eficacia, como la aspirina, los bloqueadores ß, las heparinas, los IECA, la escasa realización de la prueba de esfuerzo y ecocardiografía, así como la posible prolongación innecesaria de la estancia hospitalaria. Con la excepción de las pruebas (de esfuerzo y ecocardiografía), todos fueron evaluados en el ensayo piloto.
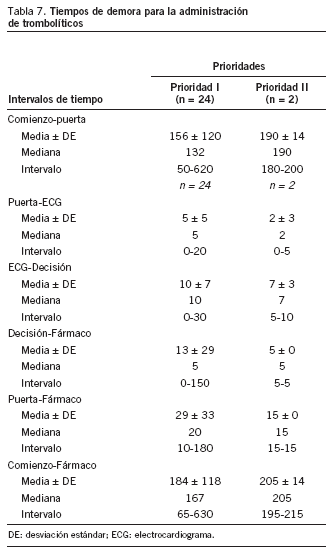
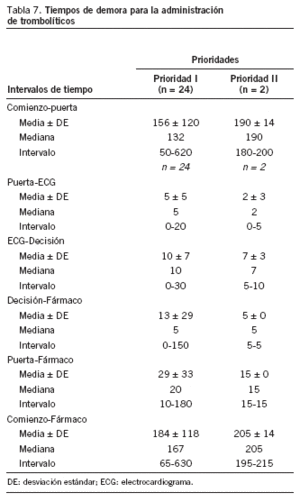
Tiempos de demora para la administración de trombolíticos (tabla 7)
De los 29 pacientes clasificados en prioridad I, sólo en 24 se pudo recoger el tiempo comienzo-fármaco y en 25 en el tiempo puerta-fármaco; por otro lado, en sólo 2 de los clasificados en prioridad II se pudo obtener estos tiempos. Para los pacientes en prioridad I, el intervalo de tiempo puerta-fármaco fue de 20 minutos (mediana), mientras que para los pacientes en prioridad II fue de 15 minutos (mediana).
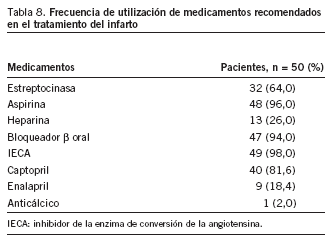
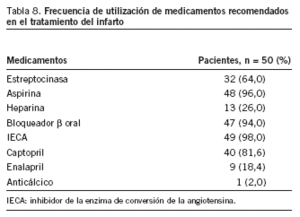
Frecuencia de utilización de medicamentos recomendados en el tratamiento del IAM (tabla 8)
La frecuencia de utilización de medicamentos recomendados en el tratamiento del IAM fue del 64,0% para la estreptocinasa, del 96,0% para la aspirina, del 26,0% para la heparina, del 94,0% para el bloqueador ß oral, del 98,0% para los IECA y del 2% para los anticálcicos.
Discusión
En los sistemas de salud donde la competitividad se incrementa, las VC se han utilizado como el método para reducir la variabilidad clínica, disminuir la utilización de los recursos y potenciar el mejoramiento de la calidad de los cuidados de salud. La medicina cardiovascular, en particular, es el área en la que las VC se han desarrollado más. Esto es, en parte, por el gran volumen y el elevado coste asociado de las enfermedades y procederes cardiovasculares22. Si bien en nuestro país no es aplicable la primera justificación, la competencia, sí lo es lo relacionado con la mejora de la calidad. Las metas de las VC y, en particular, las de esta VC para el IAM pueden resumirse como sigue.
Metas de las VC2,3,21,22
Incrementar el uso de medicamentos recomendados (p. ej., aspirina, bloqueadores ß).
Reducir el tiempo para la terapia de reperfusión.
Proveer de una guía en el tiempo para los procederes cardíacos.
Disminuir el uso innecesario de determinaciones y procedimientos.
Reducir el tiempo en el departamento de emergencias y en la unidad de cuidados intensivos (UCI), al igual que la estancia hospitalaria global.
Incrementar la participación en estudios clínicos.
Proporcionar un sistema de colección de datos para la mejora continua de la calidad.
Mejorar los cuidados del paciente y disminuir los costes.
Facilitar la introducción de guías y la sistematicidad y continuidad de las auditorías en la práctica clínica.
Mejorar la comunicación multidisciplinaria y los planes de cuidados, incluyendo los cuidados primarios.
Alcanzar o superar los estándares de calidad existentes.
Disminuir las variaciones que se producen en la práctica.
Mejorar la comunicación médico-paciente y la satisfacción del paciente.
Identificar investigaciones y su desarrollo.
El primer principio del proceso de confección de una VC es que debe ser dirigida al paciente "ideal"13. La identificación de los pacientes apropiados para seguir la VC es uno de los pasos más importantes en la implementación. En general, las VC son más aplicables a pacientes sin complicaciones que son sometidos a procederes o cirugía. Para tratar a pacientes con condiciones médicas como el síndrome coronario agudo es dificultoso definir el tratamiento "apropiado" para la mayoría de los pacientes14,22,23. Sin embargo, en nuestro estudio se discutió y consensuó el manejo, incluido el tratamiento "base", de los pacientes con IAM, y se escogió a los no complicados, ya que era un conjunto más homogéneo en cuanto al manejo. En primer lugar, posiblemente este grupo de pacientes aporte poco a la mortalidad, aunque se desconoce en nuestro contexto (mortalidad a los 28 días, al año y a los 5 años), y quizás a la morbilidad temprana o en fase de hospitalización pero con alguna influencia en la morbilidad después del alta (reinfarto, insuficiencia cardíaca). En segundo lugar, constituye el grupo mayoritario de pacientes o, lo que es lo mismo, el porcentaje de pacientes con IAM que no se complica supera a los complicados de manera manifiesta y, así, el beneficio de la VC sería para la mayoría de los pacientes con IAM. Estos argumentos sustentan el desarrollo de la VC para pacientes con IAM no complicado.
Satisfacción
Si bien los profesionales dieron puntuaciones elevadas en sus respuestas, no se alcanzó el indicador propuesto (> 90%) en las preguntas relacionadas con la aceptación y el benefi-
cio esperado de la VC. Sólo uno dio puntuaciones por debajo de 9, de manera que el número de profesionales incluidos influyó en el resultado. El equipo de la unidad está constituido por 8 médicos pero sólo 7 contestaron el cuestionario; otros 3, a los que no se les aplicó el cuestionario, trabajan parcialmente en la unidad. Por tanto, hemos decidido mantener el estándar y hacer la reevaluación una vez implantada la VC definitiva, en esa ocasión aplicándolo a todos los médicos que participan en el proceso asistencial. Posiblemente la VC definitiva, ahora menos compleja ("más amigable"), pueda influir al menos en la aceptación. En esta ocasión no se evaluó la satisfacción de los pacientes, pero sí se diseñó la hoja informativa y su evaluación formará parte de la medición del impacto.
Otros indicadores
El intervalo de tiempo puerta-fármaco puede reducirse con la implantación de la VC hasta alcanzar el estándar de 30 minutos29. Un estudio observacional sobre implementación de una VC en pacientes con infarto y elevación del segmento ST trombolizados encontró una reducción del tiempo puerta-fármaco de 73 minutos antes a 37 minutos después30. Nuestros resultados preliminares alcanzan el estándar; sin embargo, en ello puede influir la no entrada al estudio de los pacientes complicados, los que posiblemente tuvieron un mayor tiempo puerta-fármaco.
Los medicamentos recomendados en el IAM mejoran la frecuencia de utilización en relación con un estudio previo
realizado en nuestro hospital. En este estudio de casos antes y después de una intervención informativa/educativa realizada en médicos de la UCI, en relación con el uso de medicamentos de probada eficacia en pacientes con IAM se encontró un porcentaje de utilización como sigue: estreptocinasa, 67,5%; aspirina, 90,8%; bloqueador ß oral, 76,6%, y anticálcicos, 2,5% (resultados después de la intervención)13. Los resultados obtenidos ahora mejoraron, pero en el estudio anterior entraron todos los pacientes independientemente de la presencia de complicaciones. Por otro lado, la organización de la asistencia de los pacientes con IAM cambió: en el primer estudio la asistencia era fraccionada y, posiblemente, algunos pacientes no llegaran a la UCI convencional (p. ej., infarto sin elevación del segmento ST), y ahora la asistencia es continuada en una misma unidad y el paciente pasa por cuidados intensivos, subintensivos y de hospitalización convencional asistidos por el mismo equipo médico y de enfermería31. Estos resultados también superan los de otros32, pero no alcanzan los sugeridos por Mant33 y que nosotros tomamos en nuestros estándares.
Con este estudio se logró proponer una VC definitiva para el manejo de los pacientes con IAM no complicado basada en el análisis previo del proceso y la identificación de
áreas de mejora estructuradas en una matriz de tareas-tiempo, quedando divididas las actividades en identificación/notificación, tratamiento (medidas generales), medicación (medicamentos específicos para el infarto), determinaciones, nivel de actividad, nutrición, preparación para el alta y educación, que quedaron distribuidas según los días de hospitalización hasta el alta, y listas para su implementación comprobándose mejoría en el ensayo piloto de algunos de los indicadores propuestos.