La resección quirúrgica ha demostrado ser la única opción curativa para el cáncer gástrico, al incluir linfadenectomía D2 como estándar de seguridad.
Sin embargo, el beneficio de extender la resección a la bursa omentalis sigue siendo controvertido. La investigación publicada no ha arrojado evidencia categórica definiendo la eficacia.
Realizamos una revisión sistemática de ensayos clínicos aleatorizados publicados (ECA), para evaluar el beneficio de la bursectomía en la sobrevida global (OS) y la sobrevida libre de enfermedad (SLE) de los pacientes. Como resultado secundario se consideró la seguridad del procedimiento.
MétodosSe realizó una búsqueda bibliográfica en las bases de datos de Pubmed, Cochrane, Scielo, Metabuscador PUC, Epistemonikos, Tripdatabase, Sciencedirect y Lilacs para ECA que compararan la bursectomía con la no bursectomía, publicados antes de marzo de 2016. Se establecieron y aplicaron criterios de inclusión y exclusión.
ResultadosSe encontraron 3 ECA correspondientes a diferentes informes de la misma cohorte de pacientes. Se incluyeron 210 pacientes (104 en el grupo de bursectomía y 106 en el grupo de no bursectomía). La bursectomía no tuvo un efecto significativo ni en la OS a 5 años (HR: 1,4; IC del 95%: 0,87-2,25) ni en la SLE (HR: 1,25; IC del 95% 0,80-1,97).
No se observó diferencia estadísticamente significativa en la tasa de complicaciones al comparar el grupo de bursectomía y el grupo de no bursectomía.
ConclusiónLa gastrectomía con bursectomía no es superior a la no bursectomía, ya sea en términos de OS a 5 años o de SLE.
The surgical resection has proved to be the only curative option for Gastric Cancer, when including D2 linfadenectomy as security standard.
The benefit of extending the resection to the bursa omentalis, however, is still controversial. The published research has not yielded categorical evidence on defining the efficacy of bursectomy.
We conducted a systematic review of published randomized controlled trials (RCT), to evaluate the benefit of bursectomy in the overall survival (OS) and disease-free survival (DFS) of patients. As secondary outcome, was considered the safety of the procedure.
MethodsA literature search was conducted in Pubmed, Cochrane library databases, Scielo, Metabuscador PUC, Epistemonikos, Tripdatabase, Sciencedirect, and Lilacs for randomized clinical trials comparing bursectomy with non-bursectomy, published before March 2016. Inclusion and exclusion criteria were established and applied.
ResultsWe found three RCT corresponding to different reports of the same cohort of randomized patients. They included 210 patients (104 in the bursectomy group, and 106 in the non-bursectomy group). The bursectomy did not have a significant effect either on 5-years OS (HR: 1.4; 95%CI: 0,87-2,25), or on DFS (HR: 1.25; 95% CI: 0,80-1,97).
No statistically significant difference was observed in the rate of complications, when comparing the bursectomy group and the non-bursectomy group.
ConclusionGastrectomy with bursectomy is not superior to non-bursectomy either in terms of 5 years OS or on DFS.
El cáncer gástrico es la quinta neoplasia en incidencia a nivel mundial y la tercera en mortalidad, con una tasa de 10,2/100.000habitantes1. La tasa de sobrevida a 5 años en pacientes con cáncer gástrico avanzado es del 45% en Japón, del 40% en China y cerca del 20% en países de Occidente, pudiendo llegar a niveles tan bajos como de un 6% en algunos países de África2.
La resección quirúrgica ha demostrado ser la única alternativa de opción curativa, la cual ha incluido la linfadenectomía como elemento esencial en su desarrollo y, desde Japón a partir de 1960, establecido la disección D2, el estándar de seguridad3,4.
En la búsqueda de obtener los mejores resultados quirúrgicos, aún existe la discusión respecto al beneficio de ampliar esta indicación resectiva hacia la resección de la bursa omentalis, procedimiento conocido como bursectomía.
Hoy en día, el asociar o no este procedimiento se restringe a las conductas adquiridas por uno u otro grupo quirúrgico, sin necesariamente tener un fundamento claro que sostenga su accionar.
La literatura tampoco ha sido categórica en definir el mejor actuar, con artículos que orientan la conducta tanto hacia un lado como hacia el otro.
Con la discusión instalada, la presente revisión, amparada en una búsqueda metódica y el posterior análisis de la mejor evidencia disponible, pretende determinar el beneficio de la bursectomía para el manejo del cáncer gástrico, analizando tanto la sobrevida global (OS) y la libre de enfermedad (SLE) como la morbimortalidad asociadas al procedimiento.
MétodoEsta revisión sistemática fue conducida siguiendo los principios establecidos en las guías Cochrane5 y Agency for Healthcare Research and Quality Methods Guide6. Se realizó una búsqueda amplia en los distintos servidores de Pubmed, Cochrane database, Scielo, Metabuscador PUC, Epistemonikos, Tripdatabase, Sciencedirect y Lilacs para la identificación de estudios que evaluaran la bursectomía en pacientes con adenocarcinoma gástrico. Se utilizó la combinación de las siguientes palabras clave y términos MeSH: bursectomy, gastric cancer, stomach neoplasms y gastrectomy. La búsqueda no tuvo restricciones de lenguaje, año ni tipo de publicación y se realizó sobre publicaciones históricas, efectuada a fecha del 23 de marzo de 2016. Finalmente, se llevó a cabo una búsqueda manual sobre la bibliografía de todos los artículos incluidos y revisiones relevantes.
Criterios de selecciónSe evaluaron los ensayos clínicos aleatorizados (ECA) existentes que realizaran una evaluación comparativa entre pacientes intervenidos o no con bursectomía en el contexto del tratamiento quirúrgico resectivo de un adenocarcinoma gástrico avanzado. Se incluyeron trabajos publicados hasta la fecha del estudio, en idioma inglés o español. Se excluyeron del análisis final todos los estudios no aleatorizados, retrospectivos, reporte de casos o presentaciones parciales, ya fuera en formato póster o reunión de abstracts. De igual forma, constituyeron criterios de exclusión estudios desarrollados con pacientes con adenocarcinoma avanzado cuyo objetivo quirúrgico hubiese sido paliativo o reductivo de carga tumoral y aquellos realizados sobre pacientes con otro tipo de tumor distinto al adenocarcinoma, como linfoma, GIST o tumor neuroendocrino, por ejemplo.
Resultados buscadosEl principal resultado de interés fue el beneficio de la bursectomía en OS y SLE en pacientes con adenocarcinoma gástrico. Como resultado secundario a evaluar se consideró la morbilidad asociada al procedimiento.
Revisión de artículos y extracción de datosLa revisión de los resultados fue realizada mediante una aproximación sistemática desarrollada por 2 autores diferentes. Estos 2 revisores analizaron los títulos, luego abstracts y, finalmente, el texto completo de forma independiente. Con el análisis inicial del título se excluyeron todos aquellos trabajos que no se relacionaban con el tema buscado. Durante la revisión de abstracts, fueron excluidos todos aquellos trabajos que no cumplían criterios de inclusión o en los cuales se realizaron intervenciones sin fines curativos. Se accedió a todos los artículos completos de aquellos trabajos que a nivel de abstract cumplieran criterios, los cuales fueron sometidos a un análisis final para evaluar su inclusión. Los conflictos en cuanto a la selección de estudios fueron resueltos bajo común acuerdo y, en caso de no lograrlo, sometidos a la revisión y criterio de un tercer autor.
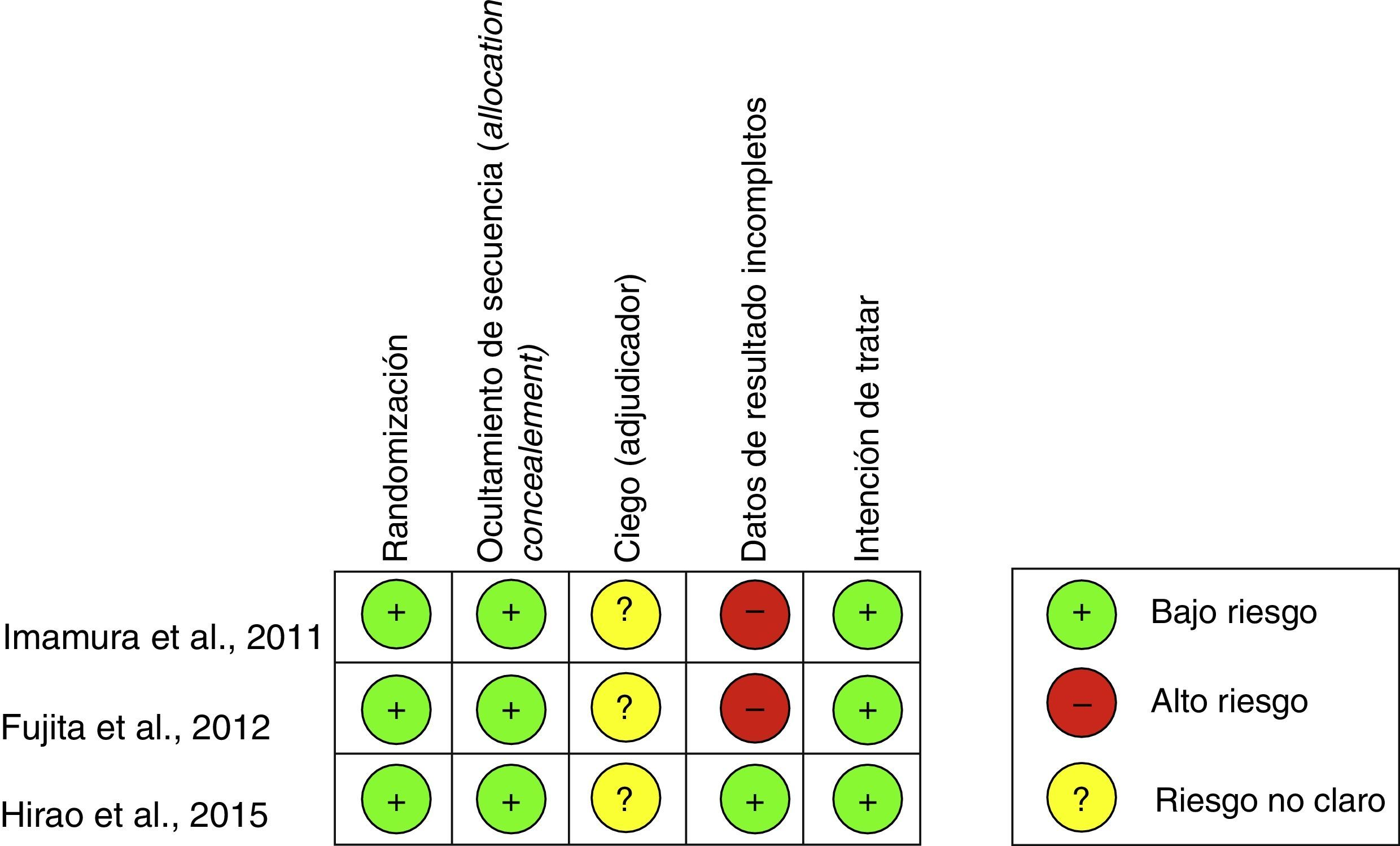
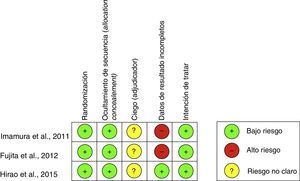
Ambos autores extrajeron los datos de los ensayos que cumplían los criterios de selección, y fueron revisados y confirmados en conjunto de común acuerdo. Si bien solo se consideraron estudios publicados en inglés o español y la búsqueda bibliográfica se realizó sin restricción de lenguaje, ningún estudio de aquellos que cumplió los requisitos previos fue necesario excluirlo por el idioma. Todos los estudios incluidos fueron valorados en su calidad siguiendo un chequeo de riesgo (herramienta de la Colaboración Cochrane para evaluar el riego de sesgo5).
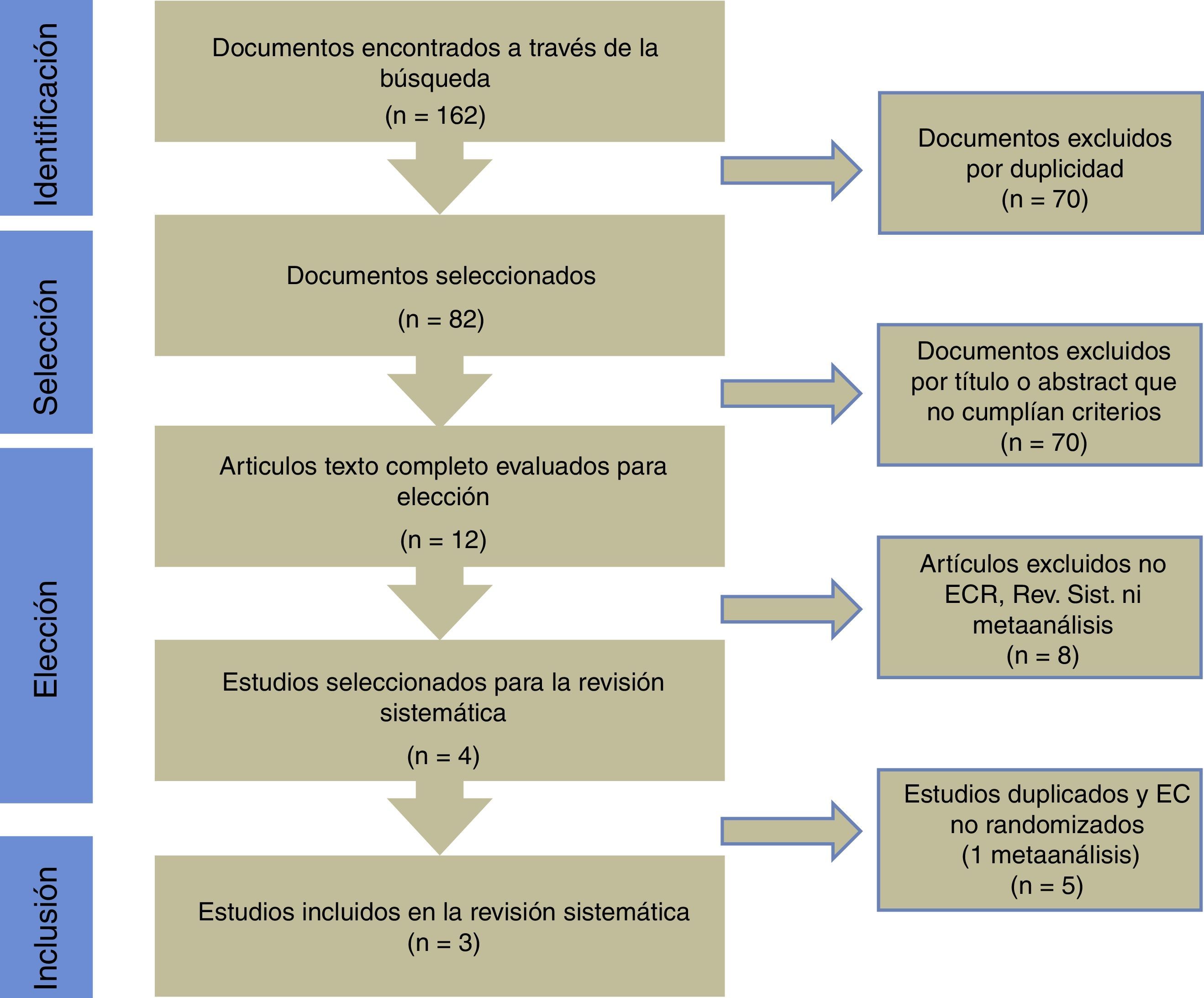
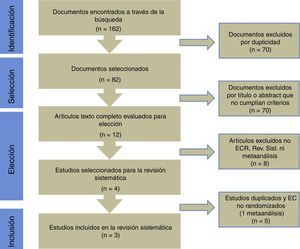
ResultadosLas búsquedas electrónica y manual arrojaron 162artículos, de los cuales 82 correspondían a artículos originales no repetidos. Doce artículos fueron seleccionados en relación con el título y abstract como posibles artículos relevantes para el estudio y futura lectura a texto completo. De un total de 4 artículos, 3 correspondieron a ECA y uno a metaanálisis (fig. 1).
Con la intención de recoger nuevos ECA, se evaluaron los estudios incluidos en el metaanálisis seleccionado. Dicho artículo incluyó 5 estudios; solo 2 de estos fueron ECA, uno de Fujita y el otro de Imamura, ambos ya recogidos mediante la búsqueda previa en esta revisión.
De esta forma esta revisión se estableció sobre una base final de 3 artículos correspondientes a ECA. Todos ellos evaluados en su calidad mediante el chequeo señalado (fig. 2).
Durante la revisión de cada uno de los estudios, se evidenció que tanto la publicación de Imamura et al., 20117, la de Fujita et al., 20128 como la de Hirao et al., 20159 fueron publicaciones correspondientes al mismo instituto, por lo cual se realizó un análisis único analizando sus datos de forma complementaria.
Un total de 210 pacientes fueron aleatorizados: 104 al grupo de bursectomía y 106 al de no bursectomía. Sobre 7 pacientes se realizó una resección ganglionar R1 (4 correspondieron al grupo control).
Respecto al análisis primario de OS, con una media de seguimiento de 80 meses, hubo 30 muertes en el grupo de bursectomía y 40 en el de no bursectomía (21 y 30 muertes por cáncer gástrico, respectivamente). La OS a 5 años fue del 77,5% para el grupo de bursectomía y del 71,3% para el de no bursectomía (p=0,99 para no inferioridad), con HR de 1,4 (IC 95%: 0,87-2,25) de mortalidad en el grupo de no bursectomía. Sin embargo, la bursectomía pareció ser un buen factor pronóstico de OS cuando se realizó el análisis multivariado de Cox (p=0,034), con HR de 1,71 (IC 95%: 1,04-2,82). De igual forma se extrajo, en este subanálisis, que el sexo masculino, el carácter histológico indiferenciado y la invasión sobre la serosa serían factores de riesgo estadísticamente significativos para la OS.
La SLE fue del 73,7 y 66,6% para los grupos bursectomía y no bursectomía, respectivamente (p=0,99 no inferioridad), con un HR de mortalidad en no bursectomía de 1,25 (IC 95%: 0,80-1,97), y siendo la recurrencia peritoneal la más frecuente: 8,7% en el grupo bursectomía y 14,3% en el de no bursectomía (tabla 1).
Sin ser el objetivo primario del estudio, el análisis por subgrupo mostró datos interesantes: uno fue el del beneficio estadísticamente significativo a favor del procedimiento en tumores ubicados en el tercio medio o inferior del estómago en un total de 179 pacientes (HR=1,69; IC 95%: 1,00-2,86; p=0,048), y el otro, con una «n» menor (48 pacientes), fue que solo marcó una tendencia sobre tumores >pT3, 55,5% vs. 34,8% de OS para la realización o no del procedimiento (p=0,096).
Respecto a la cosecha ganglionar no se describe mayor diferencia ni análisis, reportando promedios de 38 vs. 37 ganglios para bursectomía y no bursectomía, respectivamente.
Como resultados secundarios, las complicaciones no mostraron diferencias, con el 14,3% para ambas ramas (tabla 2). Cabe destacar que en 103 pacientes se realizó una resección combinada con otro órgano, 98 colecistectomías, 26 esplenectomías (considerada como parte de la resección en gastrectomías totales), una pancreatectomía parcial, una colectomía parcial, una adrenalectomía izquierda y una resección diafragmática.
Morbilidad postoperatoria
| Morbilidad | Bursectomía (n=104) | No Bursectomía (n=106) |
|---|---|---|
| Cualquier complicación | 15 | 15 |
| Fístula pancreática | 3 | 7 |
| Absceso abdominal | 3 | 8 |
| Filtración anastomótica | 4 | 3 |
| Obstrucción intestinal | 2 | 1 |
| Neumonía | 1 | 1 |
| Hemorragia | 1 | 0 |
Fuente: Imamura et al.7.
Se describe que otras complicaciones como 2 linforreas quilosas, 2 retrasos al vaciamiento gástrico sin obstrucción, un síndrome de asa aferente, colecistitis aguda, arterioesclerosis obliterante de la pierna, hepatitis por droga y estenosis anastomótica tendieron a ser más frecuentes en el grupo intervenido (7,7% vs. 1,9%; p=0,057).
La bursectomía se asoció con un mayor sangrado (475cc vs. 350cc; p=0,047) y con un mayor tiempo operatorio (27min extra en promedio), sin reflejarse en la mortalidad (0,95% para ambas ramas) ni en los días de hospitalización (16 días para bursectomía vs. 15 en el grupo control).
DiscusiónLa bursectomía muchas veces es mal entendida como un procedimiento similar a la omentectomía. Esta última consiste en la simple resección del omento mayor y, así, en un procedimiento carente de mayor complejidad que no alteraría los tiempos quirúrgicos ni la morbilidad de la cirugía7. Sin embargo, la bursectomía consiste en un procedimiento aún más complejo.
Éste procedimiento consiste en la disección de aquel plano que se encuentra entre el aspecto posterior del omento mayor y su fusión a la capa anterior del peritoneo del mesocolon10, representando un plano seguro, avascular, que permite una disección libre de sangrado (holy plane).
Mantener este plano de disección se asociaría a beneficios como a) eliminación de depósito microscópico de tumor en omento mayor y saco menor; b) resección completa de enfermedad de la cabeza del páncreas; c) limpieza del grupo ganglionar subpilórico de alto riesgo (grupos 6 y 14v11), y d) disección celíaca estética y limpia12. Otorgaría un mayor beneficio en tumores avanzados de cara posterior del tercio inferior del estómago, amparado en cierta recomendación de la guía japonesa respecto a los tumores que invaden la serosa de la pared posterior13.
Algunos estudios plantearían una tendencia biológicamente razonable, pero no estadísticamente significativa de mejor OS a 5 años, 53% para bursectomía vs. 40% para no bursectomía en estadios avanzados en el estudio de Shchepotin et al. 2013, y 69,8% vs. 50,3% respectivamente, con un HR de 2,16, en el artículo de Hundahl 201212,14. Visión que, desde otro lado, parece alterada ante la existencia de estudios que plantean la imposibilidad de evitar la migración de células tumorales a la cavidad peritoneal. Se considera que las células metastásicas serían capaces de migrar perfectamente a través del foramen de Winslow y, por lo tanto, encontrarlas solo libres en la bursa sería infrecuente15,16. En esta línea, Kayaalp et al. plantean que no solo resulta infrecuente demostrar células cancerígenas luego de una bursectomía profiláctica (10%), sino también siempre que se evidencia que existe ya manifestación macroscópica de implantes en otros órganos17,18.
Igualmente, Yamamura et al. plantean la inexistencia de beneficio en la OS con la bursectomía16, y Kochi et al., en su ECA, es de los pocos estudios que ha demostrado, al menos para estadios en los que no se evidencia invasión serosa, que no existiría diferencia en la OS, en la SLE a 5 años, ni en la cosecha ganglionar, con una recurrencia del 6,6% vs. 5,3% para bursectomía y no bursectomía, respectivamente4.
Considerando estos puntos, el valor terapéutico y el beneficio estadístico en sobrevida, ya sea OS o SLE, se hace difícil de demostrar19, quedando en una recomendación ambigua sin un soporte tan claro.
La aparición del metaanálisis de Shen et al. 20142 parecía solucionar la discusión. Sin embargo, ante la falta de evidencia disponible, reunieron en su análisis fundamentalmente estudios no aleatorizados y tan solo 2 estudios aleatorizados que, al igual que en nuestra revisión, correspondieron al mismo estudio en etapas diferentes de ejecución y sin los resultados definitivos obtenidos el 2015. Con esto sobre la mesa, este metaanálisis no demostró beneficio en OS ni en SLE (HR=1,14; IC 95%: 0,88-1,4 y HR=1,06, IC 95%: 0,82-1,37, respectivamente). Y aunque en un subanálisis de tumores serosa (+) podría mostrar mejor OS y SLE, tampoco demostró beneficio significativo.
Estos últimos resultados resultan similares a los encontrados en nuestra revisión sistemática que, de mayor peso aún, utiliza los resultados definitivos del estudio que en estadios iniciales se incluyó en el metaanálisis señalado.
Nuestra revisión arroja otros datos de interés, esta vez muestra alguna tendencia de beneficio en OS y SLE de la bursectomía para el tratamiento de tumores localizados en el tercio medio o inferior del estómago y mantiene el sitio principal de recidiva a nivel peritoneal, como ya lo mostraban datos japoneses con recurrencia peritoneal en el cáncer subseroso de hasta un 10,7%20.
Esta revisión instala además otros puntos a la discusión, la bursectomía como un buen factor pronóstico de OS y, en forma contraria, el sexo masculino, el carácter histológico indiferenciado y la invasión sobre la serosa como factores de riesgo estadísticamente significativos.
Sin diferencia en la cosecha ganglionar en estudios previos ni en esta revisión, la realización de bursectomía sí se relacionó con un mayor tiempo operatorio y un mayor sangrado, de 41min y 65cc21, respectivamente, en reportes previos, y de 27min y 125cc para esta revisión.
Respecto a la seguridad del procedimiento, algunos reportes lo instalan como un procedimiento no exento de complicaciones, con mayor incidencia de obstrucción intestinal, síndrome de asa aferente, o responsabilizan a la amplia disección como aquella capaz, por ejemplo, de generar adhesiones al colon o al páncreas, ambos posibles responsables de retraso en el vaciamiento gástrico18. Temida es también la fístula pancreática, considerando que el 10% de fístulas subclínicas ocurren solo por decapsulación pancreática22. En esta línea, Blouhos et al.21 reportaron una morbilidad global del 19,4%, incluso con una incidencia de hasta el 4,2% de fístula pancreática y una mortalidad intrahospitalaria asociada al procedimiento del 1,4%.
Sin embargo, en centros de experiencia, cuyo procedimiento es realizado por cirujanos experimentados, puede ofrecer una mortalidad menor del 1% y una morbilidad de entre el 14 y el 24%23.
Shchepotin et al. ya reportan una morbilidad similar, tanto para la cirugía con bursectomía como para la cirugía sin bursectomía, del 18%14. Situación concordante y aún mejor para este estudio, en el cual la morbilidad alcanza un 14,3% y la mortalidad un 0,95%, iguales para ambas ramas. Sin embargo, cabe destacar que complicaciones menores como retraso en el vaciamiento gástrico sin obstrucción o linforrea quilosa autolimitada fueron más frecuentes en el grupo de bursectomía.
ConclusiónLa bursectomía no se presenta como estadísticamente superior a la no bursectomía en términos de OS ni SLE, sin embargo, presenta cierta tendencia de beneficio sobre tumores avanzados localizados en el tercio medio o inferior, sin asociarse a mayor morbimortalidad. Ante la ausencia de estudios aleatorizados a gran escala, no es posible realizar una conclusión definitiva, por lo que, para ser recomendada como parte de la cirugía estándar de cáncer gástrico, se requiere mayor evidencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaIdea y diseño del estudio: Quezada JL.
Redacción y revisión: Quezada JL., Fluxá P.
Conflicto de interesesSin conflicto.