La mayoría de los tumores óseos primarios pueden ser tratados mediante una resección amplia —muchas veces asociada a terapias adyuvantes— sin comprometer la sobrevida del paciente. La posibilidad de una resección conservadora depende de la localización y tamaño del tumor y de las partes blandas circundantes. Una cuidadosa evaluación de estudios imagenológicos permite al cirujano elaborar un plan quirúrgico que permita una resección con márgenes adecuados, al mismo tiempo que conservar la mayor cantidad de tejido sano, de modo de obtener una extremidad funcional. A veces, la ejecución quirúrgica de lo planeado se hace muy difícil, y la precisión de esta puede resultar afectada. La cirugía guiada por computador se ha constituido en una herramienta útil en estas situaciones. Está basada en la creación de un plan virtual en 3 dimensiones mediante el procesamiento de imágenes de tomografía computada (TC) y resonancia nuclear magnética (RNM). Este plan puede ser reproducido en el escenario quirúrgico mediante la correspondencia entre este escenario virtual y la anatomía real del paciente. Esta tecnología puede permitir una mayor precisión en la ejecución de osteotomías en zonas difíciles como la pelvis, minimizando la resección innecesaria de tejido sano, pero manteniendo un margen oncológico adecuado.
Describiremos los principios y el razonamiento que fundamentan el uso de la cirugía guiada por computador en la cirugía de tumores óseos, la cual se ha constituido en una herramienta útil para el manejo de situaciones clínicas específicas.
The majority of primary bone tumours can be effectively treated with wide resection —frequently associated with adjuvant therapy— without compromising the outcome of the patient. The feasibility of limb-sparing surgery in a particular scenario is dependent on the location and size of the tumour, as well as the involvement of the host bone and surrounding soft tissues. Careful evaluation of imaging studies allows the surgeon to plan the resection with adequate margins, while preserving as much normal tissues as possible, in order to achieve a functional limb. At times, the surgical execution of what was planned as resection becomes very difficult, and precision may be less than optimal. Computer-guided surgery has become a useful tool in these situations. It is based on the creation of a three-dimensional virtual plan by means of image processing from computed tomography (CT) and magnetic resonance (MRI) of the clinical situation. This plan is reproduced in the surgical field by means of the interaction between this virtual scenario and the actual anatomy of the patient. This technology could allow better precision in the execution of osteotomies in difficult areas, such as the pelvis, minimising unnecessary resection of normal tissue, while maintaining wide margins.
A description is presented of the principles and rationale of computer-guided surgery for bone tumours, which has become a useful tool for the management of selected clinical situations.
Los avances de los últimos años han permitido ofrecer nuevas opciones terapéuticas en cirugía oncológica. Escenarios quirúrgicos complejos, dados por la localización de un tumor en áreas geométricamente complejas como la pelvis, o la existencia de cirugías previas hacen que la cirugía conservadora de extremidades sea particularmente difícil. En la actualidad, es posible realizar resecciones de este tipo, minimizando la extensión hacia tejido sano y manteniendo un margen alejado del tumor mediante nuevas tecnologías1–5.
Parte de la dificultad de la cirugía ortopédica oncológica radica en la integración por parte del cirujano de imágenes preoperatorias del tumor en 2 dimensiones a un escenario real donde es fundamental la orientación en 3 dimensiones. Esto implica realizar una cuidadosa planificación preoperatoria, así como la reproducción de este plan durante el acto quirúrgico. La implementación de la asistencia por computador en la cirugía de tumores musculoesqueléticos permite realizar la planificación de la resección en un escenario virtual en 3 dimensiones basado en imágenes tomografía computada (TC) y resonancia nuclear magnética (RNM), y posteriormente reproducir este plan en el acto quirúrgico, mediante el uso de un navegador. Aun siendo una técnica bastante nueva en ortopedia oncológica1–5, existen reportes de navegación quirúrgica en otras especialidades, con buenos resultados5–16.
El objetivo de esta revisión consiste en describir los conceptos generales de esta técnica.
Imágenes (tomografía computada y resonancia nuclear magnética): adquisición y procesamientoEs esencial el diseño del plan quirúrgico. En este, se produce la interacción entre el cirujano y los análisis de las imágenes. Estas son obtenidas a partir de la RNM y la TC en formato Digital Imaging and Communications in Medicine (DICOM)17. En la TC los cortes varían en espesor entre 0,0625 y 1,25mm17. El espesor en las imágenes obtenidas de RNM es bastante similar, con cortes de 1mm de espesor principalmente1.
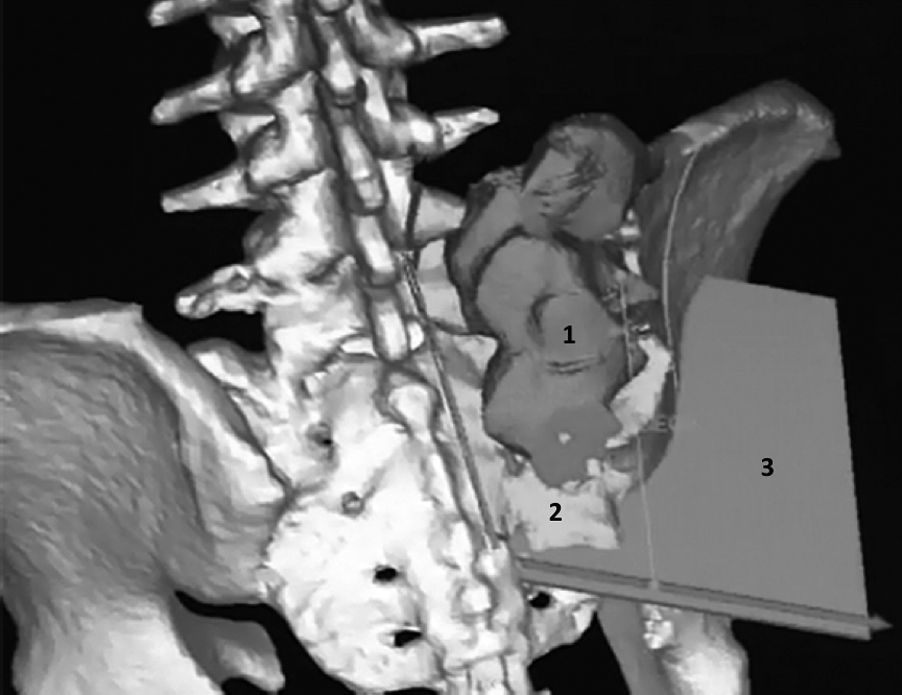
Estas imágenes son procesadas y reformateadas, utilizando la información de ambas para recrear un modelo de los huesos afectados en 3 dimensiones, mediante un software de diseño 3D18. Luego de obtener esta nueva imagen, corresponde eliminar aquellos elementos no óseos que puedan simular serlo. Ciertos autores describen el uso de la valoración colorimétrica y la posterior edición de la imagen para eliminar manualmente, por parte de un operador, aquellas estructuras no óseas como cartílago, músculo, grasa, piel, entre otros, que podrían ser confundidas con tejido óseo y alterar la conformación anatómica del hueso. Una vez realizado esto, se debe diferenciar del modelo inicial la porción tumoral de la parte sana del hueso y esto se hace de acuerdo con la información obtenida de RNM y TC, respectivamente17. Con esto, el cirujano puede efectuar la planificación de los planos de corte a partir de todas las imágenes y modelos obtenidos, en la cual debe considerar también la posición del paciente en la mesa operatoria (fig. 1). Los planos de osteotomía resultantes pueden ser uni-, bi- o multiplanares (mayor a 2 planos), dependiendo de la anatomía regional. En la planificación de las osteotomías debe considerarse el espesor del instrumento de corte y su oscilación en el caso de una sierra.
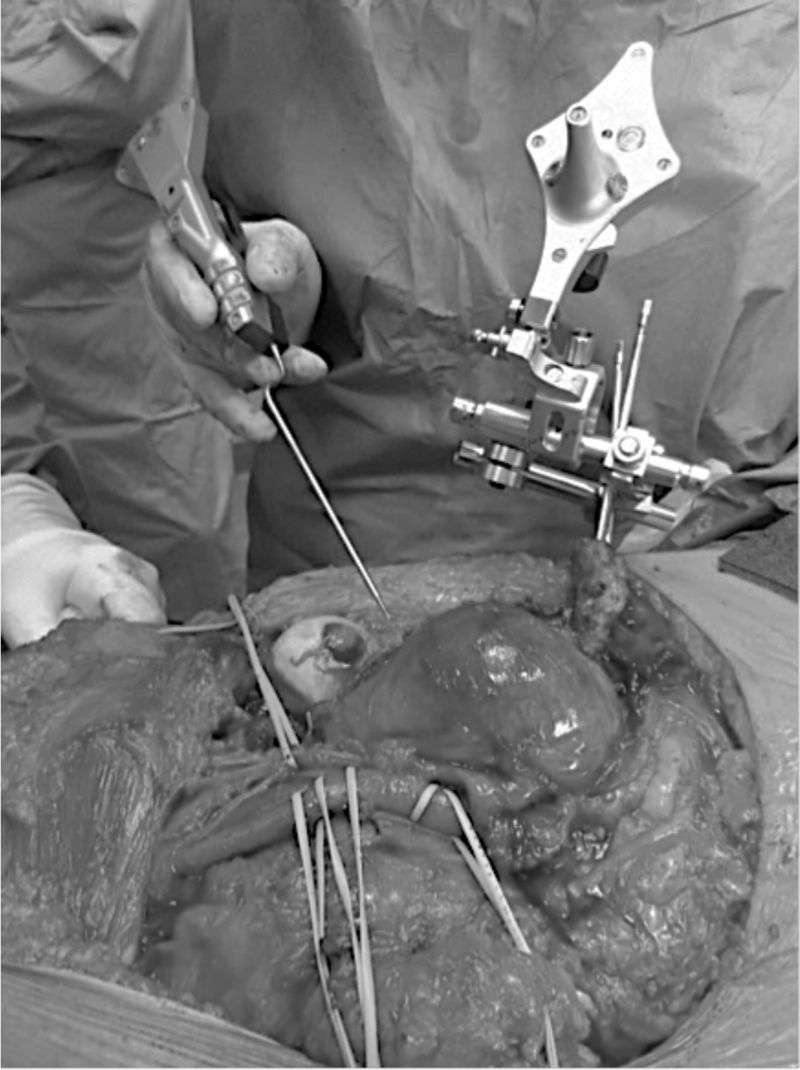
Navegación del plan quirúrgicoPara esto se requiere de un navegador, el instrumental adecuado (cámara, tracker o registrador, puntero). El plan quirúrgico es cargado en un sistema de navegación, que en nuestra institución es el Navigation System II (Stryker Inc., Kalamazoo, Michigan, EE. UU.) (fig. 2). Una vez preparado el campo quirúrgico y la posición definitiva del paciente, se procede a la colocación del registrador de superficie infrarrojo (tracker) en una estructura ósea cercana al sitio de osteotomía (fig. 3). Este dispositivo se debe fijar de manera estable, dado que para su correcto funcionamiento debe permanecer anclado e inmóvil al hueso. El tracker genera un sistema de coordenadas 3D circundantes al hueso afectado que permite una orientación inicial del navegador, de modo que permite hacer coincidir el modelo virtual del plan quirúrgico con la anatomía real del paciente durante la cirugía
Ejecución quirúrgica utilizando el método en un paciente con un tumor óseo de pelvis. A la izquierda se aprecia el puntero o pointer sostenido por el cirujano y, a la derecha, el tracker, inserto en una parte ósea cercana, que permanece inmóvil y apuntando a la cámara infrarroja del navegador.
La correlación imagen-paciente es un proceso clave, ya que, sin una adecuada correlación, la navegación no contará con la precisión suficiente como para ser confiable4,19. Existen varios métodos descritos en la literatura.
Correlación manualEn la correlación manual punto por punto, el cirujano, con la ayuda de un marcador navegado (puntero), va indicando al sistema de navegación dónde se encuentran puntos anatómicos de referencia (paired points) de fácil reconocimiento. Luego, para mejorar aún más la correlación, se hace un recorrido de puntos en la superficie del hueso para ir comparándolos con la imagen preoperatoria (surface matching). Este método logra buena correlación entre la realidad y lo virtual, con error de registro estimado menor a de 2mm4,17,19–22. En nuestra institución, hemos ido mejorando esta correlación a medida que nuestra experiencia y familiaridad con el equipo y la técnica se han incrementado. Se han planteado variaciones de este método de correlación. El uso de marcadores al momento de tomar las imágenes con TC preoperatoria y luego, con ayuda de un puntero navegado, realizar la correlación con respecto a esos marcadores en el momento de la cirugía, presupone una forma más rápida y precisa de realizar el emparejamiento de puntos (paired points). Para esto pueden utilizarse agujas de Kirschner, pero también se ha propuesto usar marcadores reabsorbibles al momento de tomar las imágenes con la RNM, con lo que se podría prescindir de la TC. Por último, se han utilizado marcadores cutáneos, sin embargo, estos tienen algunas limitaciones, en especial en paciente obesos, por la deformación del tejido blando, lo que podría contribuir a un error de correlación. Estos métodos consiguen buena correlación, con un error de registro de entre 0,3-1,7mm en el caso de los marcadores óseos, y entre 0,6 y 1,5mm para los marcadores cutáneos en pacientes seleccionados4,23.
Correlación semiautomáticaEste método incluye la toma de imágenes intraoperatoria mediante el dúo de un arco C especial «TC-fluoro» y marcadores de wolframio para tomar imágenes en 2 planos del paciente; luego el sistema de navegación utiliza esta información para realizar el proceso de correlación. En un estudio, este método resultó en cortes más precisos y logró valores de error de registro menores de 2mm4,20,21.
Este método, como contraparte, agrega radiación ionizante, al paciente y al grupo de profesionales.
Correlación automáticaOtra forma de correlación descrita en la literatura e inserta en el concepto precedente es la automática, que consiste en realizar una correlación de las imágenes en forma intraoperatoria, llevando a cabo el registro de manera inmediata por el sistema de navegación. Sin embargo, este método encuentra sus limitaciones en el equipo necesario para su realización (tabla operatoria radiolúcida, TC intraoperatoria) y en su utilidad solo para tumores pequeños (limitación dada por la capacidad de los escáneres intraoperatorios actuales)4.
Navegación de instrumental quirúrgicoBásicamente, a cualquier instrumento, con un eje principal recto y terminado en punta, se le puede adjuntar un marcador para que pueda ser reconocido. En la práctica, no suelen marcarse todos los instrumentos. Más bien se utiliza un puntero navegado para ayudar al cirujano a encontrar la ubicación, dirección e inclinación del corte y se procede a realizar este mediante una sierra u osteótomo no navegado (a mano alzada). La limitación del método es que el cirujano desconoce la profundidad del corte con certeza y, además, está sujeto a error humano. Otra opción similar es navegar una broca motorizada o un electrobisturí y usar estas herramientas para marcar el corte una vez definido4,18–20,22,24.
Idealmente, existe la llamada navegación en tiempo real, en la que se utiliza una sierra u osteótomo navegado, lo que permite al cirujano conocer la ubicación, dirección, inclinación y profundidad del corte, no solo al momento de comenzar, sino en tiempo real, lo que permite correcciones durante la ejecución. Un estudio de Cartiaux et al. señala que no hay diferencia significativa entre usar sierra a mano alzada y sierra navegada, debido en parte a que la oscilación de la sierra es una factor importante de error y está presente en ambas1,4,21,25.
Eficacia y precisión del métodoDependiendo de la técnica utilizada para realizar la correlación imagen-paciente, así como el reconocimiento espacial del instrumental quirúrgico, la precisión de corte puede variar respecto a la planificación preoperatoria22.
Para realizar una estimación de la precisión del método, se puede evaluar este en diferentes formas. Una es con relación a los bordes quirúrgicos vistos en el análisis histológico de la pieza operatoria. Para esto se utiliza la clasificación de la Union for International Cancer Control (UICC), que clasifica en R0 aquellas muestras que tienen márgenes quirúrgicos libres >1mm, R1 las que tienen residuos microscópicos posibles si el margen es de entre 0 y 1mm, y R2 como enfermedad residual macroscópica. El margen libre seguro corresponde a la distancia mínima entre el plano de corte y el límite del tumor26,27.
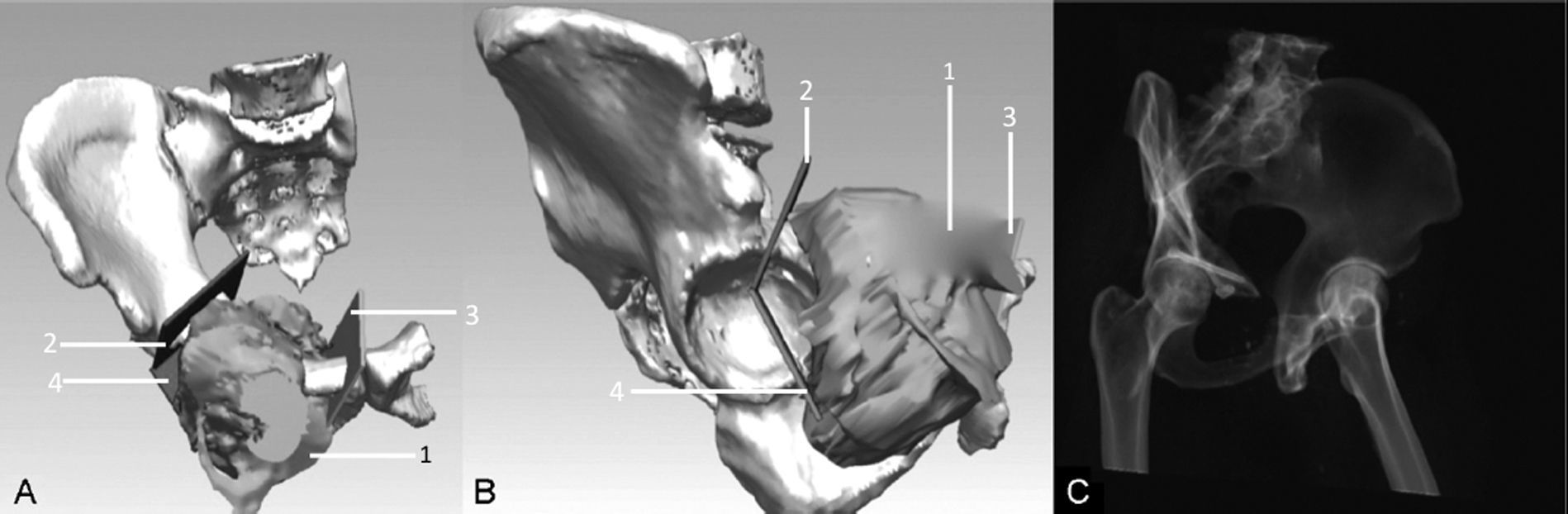
Otro parámetro es la precisión de la ubicación del corte planificado con relación al corte real de la pieza quirúrgica (fig. 4). Se requiere la imagen de la pieza quirúrgica ya procesada en un software de reconstrucción 3D para poder comparar con la imagen planeada, y se obtiene cuantificando la distancia máxima en milímetros entre ambas imágenes26. Estas convergen en un modelo de nube de puntos, el cual tiene la particularidad de considerar solo los puntos de una superficie18,28. De esta forma, es posible comparar punto por punto qué tan fiel a la imagen planificada resultó la imagen de la pieza quirúrgica.
A y B) Reconstrucción tridimensional preoperatoria de condrosarcoma de pelvis (1): se visualizan las osteotomías planificadas (2, 3 y 4) a partir de imágenes preoperatorias del tumor, obtenidas de la fusión de RNM y TC de pelvis. C) Imagen en la que se aprecia la reconstrucción tridimensional de tomografía computada postoperatoria del paciente. Se efectuó una resección que incluyó el arco anterior derecho y pared acetabular anterior. Esta última se utilizó como autoinjerto óseo (congelado en nitrógeno líquido y reimplantado) con el objeto de lograr una mejor cobertura del cotilo.
Cartiaux et al. proponen un tercer parámetro a evaluar en la pieza quirúrgica. En su estudio de cirugía navegada simulada, proponen cuantificar la nivelación del corte que corresponde a la distancia entre 2 líneas paralelas, siendo una de ellas el plano de corte25. En su estudio concluyen que la nivelación del corte, que se relaciona con la oscilación de la sierra, no presentaba diferencias significativas entre el procedimiento con instrumentos navegados y cuando es a mano alzada.
Desde el punto de vista clínico, existen escalas funcionales validadas para poder evaluar los resultados de la cirugía oncológica ortopédica19,29. Es interesante considerar este aspecto, que se refiere a la calidad de la función remanente del segmento operado y a la global del paciente. Se ha comprobado que el resultado funcional es superior en pacientes con conservación de la extremidad en comparación con pacientes amputados. Sin embargo, aún no es posible determinar si la cirugía oncológica asistida por computador ofrece mejores resultados funcionales por el supuesto «ahorro» de tejido sano no resecado y la mayor precisión.
Beneficios de la cirugía navegada en oncología ortopédicaEl uso de esta tecnología parece ofrecer ventajas respecto a la cirugía oncológica tradicional, aunque aún es temprano para sacar conclusiones definitivas.
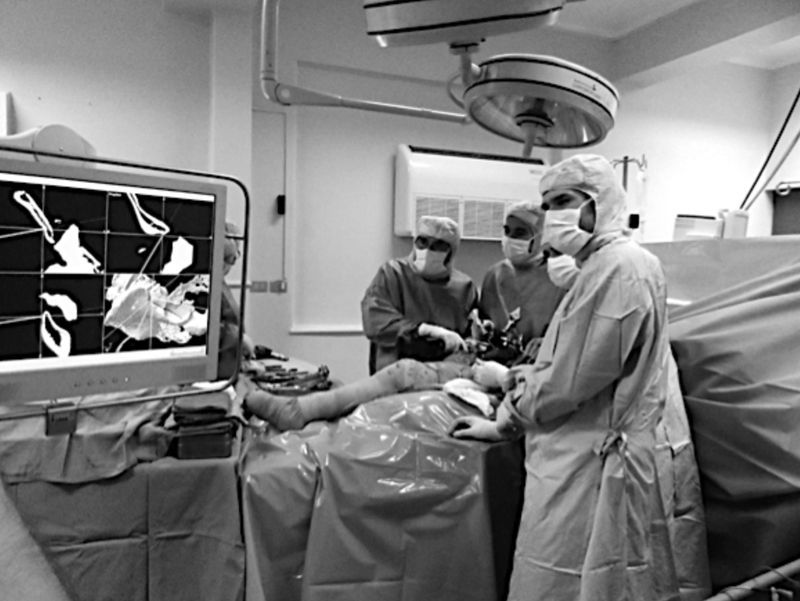
La ejecución de osteotomías complejas en áreas anatómicas difíciles es un procedimiento que se ve dificultado por problemas de visualización directa en la cirugía oncológica tradicional. La guía proporcionada por el navegador permite efectuar algunos de estos cortes, en los que el cirujano deberá guiarse solamente por el aparato, es decir en forma «ciega» a su intuición, pero manteniendo la precisión (fig. 5).
Otro punto de interés es que con la cirugía navegada en tumores ubicados en áreas anatómicas complejas como la pelvis se puede predecir la geometría de la pieza quirúrgica resecada. De este modo, es posible el diseño anticipado de reemplazos protésicos hechos a la medida del defecto ocasionado por la resección quirúrgica19.
Otro de los beneficios de la cirugía navegada es la reducción de la exposición a radiación de los cirujanos. El uso de la fluoroscopía intraoperatoria, a pesar de emitir pequeñas cantidades de radiación, produce un daño acumulativo. La cirugía navegada reduce esta exposición a radiación al no requerir múltiples tomas de imágenes intraoperatorias o, eventualmente, prescindir de ellas por completo.
Finalmente, en algunos centros, se está utilizando la navegación para la preparación de injertos óseos alogénicos en una mesa operatoria separada y con antelación a la resección quirúrgica. La precisión del método ha permitido que el injerto óseo esté preparado con las dimensiones exactas para el reemplazo del segmento resecado, resección que también es navegada, todo lo cual permite el ahorro de tiempo operatorio.
ConclusionesLa cirugía oncológica ortopédica asistida por computador es un método promisorio que puede permitir una mejor precisión en las resecciones esqueléticas de tumores óseos, en particular en localizaciones anatómicas difíciles. Esta tecnología puede ayudar a minimizar la resección de tejidos sanos, manteniendo un margen oncológico adecuado, y, por lo tanto, mejorando las posibilidades de obtener una extremidad funcional.
Por otra parte, al guiar la ejecución quirúrgica, puede ayudar a disminuir el tiempo operatorio. Si todo lo anterior se logra, finalmente redunda en un beneficio para el paciente. El desafío está en lograr la mayor correspondencia entre el escenario virtual de la planificación preoperatoria basada en imágenes y la realidad del campo operatorio.
Conflicto de interesesLos autores declaran no tener conflictos de interés, sean personales o financieros por la realización de este trabajo.