Existe evidencia respecto a que los niños que nacen prematuros moderados y tardíos (PMT) tendrían mayor riesgo de hospitalización, morbilidad neonatal y deficiencias del desarrollo psicomotor (DSM).
ObjetivoDeterminar, en PMT, la asociación entre el déficit de DSM, edad gestacional y la morbilidad neonatal.
Pacientes y métodoEstudio caso control anidado en una cohorte de niños nacidos PMT entre los años 2006 y 2009, en una institución privada de la Región Metropolitana. Los niños fueron evaluados con la Escala de Bayley-III de desarrollo infantil a los 8 o 18 meses de edad corregida, o a los 30 meses de edad cronológica. Retrospectivamente se revisaron los registros neonatales. Se generó un modelo de análisis de asociación multivariado para conocer el efecto de la morbilidad neonatal sobre el desarrollo alcanzado.
ResultadosSe estudiaron 130 PMT, 25 casos y 105 controles. El 83,8% fue hospitalizado en el periodo neonatal. Hubo diferencias estadísticamente significativas entre casos y controles solo en relación con la edad materna y la hipoglucemia sintomática (OR cruda 3,5, OR ajustada 8,18); se encontró que las variables que afectan de forma negativa el coeficiente de desarrollo son el género masculino, la gemelaridad y la menor edad gestacional.
ConclusionesLa hipoglucemia sintomática es el principal factor de riesgo de déficit del DSM, mientras que la gemelaridad, el género masculino y la edad gestacional influyen en el coeficiente de desarrollo global obtenido. Es fundamental desarrollar estrategias de prevención, pesquisa y manejo precoz de esta alteración metabólica para prevenir dificultades del DSM posteriores.
There is evidence that children born moderate-to-late preterm (MLP) have a higher risk of hospitalisation, neonatal morbidity, and developmental delay (DD).
ObjectiveTo determine the association between DD, gestational age, and neonatal morbidity in MLP children.
Patients and methodA case control study design nested in a cohort of MLP children born between 2006 and 2009 at a private hospital located in the Metropolitan area of Santiago. The children were assessed with the Bayley-III Scales of Infant Development at 8 or 18 months corrected age, or at 30 months of chronological age. Neonatal records were retrospectively reviewed. A multivariate analysis was performed to determine the effect of neonatal morbidity on development.
ResultsA total of 130 MLP children, 25 cases and 105 controls, were studied. Most of them (83.8%) were hospitalised during the neonatal period. Significant differences between cases and controls regarding maternal age and symptomatic hypoglycaemia were observed (crude OR 3.5, adjusted OR 8.18). It was concluded that the variables that negatively affect the rate of development are male gender, being a twin, and gestational age.
ConclusionsSymptomatic hypoglycaemia is the main risk factor for DD, while being a twin, male gender, and gestational age influenced the total development rate obtained. It is essential to develop strategies for prevention, screening, and early management of this metabolic disorder to prevent future DD.
En las últimas décadas en países desarrollados la natalidad ha descendido, con aumento relativo de los nacimientos antes de las 40 semanas de gestación1. Esta misma tendencia se ha dado en Chile, en que el total de partos prematuros aumentó de 5,0% a 6,6% en los últimos 17 años, fundamentalmente en función del aumento de partos prematuros moderados y tardíos (PMT: 320/7 a 366/7 semanas de EG)2,3.
A partir del año 2005 se ha generado evidencia creciente acerca de que los niños que nacen PMT tendrían un elevado riesgo de morbilidad perinatal4–7 y, posteriormente, dificultades en el desarrollo, aprendizaje y comportamiento8–14. Según un análisis de Lindström, el 5% de la discapacidad en adultos jóvenes de Suecia es atribuible a la prematuridad no extrema15.
Se plantea que el riesgo de dificultades en el desarrollo psicomotor (DSM) se debe fundamentalmente la exposición de un cerebro aún inmaduro a las noxas del ambiente extrauterino, determinadas por las enfermedades relacionadas con la prematuridad16,17. No obstante, las investigaciones que consideran la hospitalización en el periodo neonatal como una aproximación de la morbilidad de los PMT muestran resultados diversos; Baron et al. evidenciaron que los prematuros tardíos complicados tenían un menor rendimiento que los no complicados18; Huddy y Van Baar separadamente demostraron que las hospitalizaciones más prolongadas se asociaban a mayor riesgo de dificultades en el desarrollo19,20, mientras que McGowan no encontró diferencias estadísticamente significativas entre prematuros tardíos que estuvieron hospitalizados en una Unidad de Cuidados Intensivos Neonatales (UCIN) y aquellos no admitidos21.
Con relación al análisis de morbilidad específica, Kerstjens et al. evidenciaron que el mayor riesgo de déficit del DSM se concentraba en los PMT que nacieron de gestaciones múltiples, los pequeños para la edad gestacional y los que presentaron hipoglucemia22,23. Al analizar retrospectivamente prematuros tardíos que estuvieron hospitalizados en UCIN en el periodo neonatal, Wachtel describió que la morbilidad respiratoria era el principal factor asociado a las dificultades en el desarrollo a los 24 meses de vida24. Por otro lado, Demestre no encontró asociación entre la morbilidad neonatal y el rendimiento alcanzado por una cohorte de niños nacidos prematuros tardíos, de una población privilegiada socioeconómica y culturalmente en España25. No hay otras publicaciones que analicen la asociación de morbilidad neonatal específica con el desarrollo alcanzado en niños que nacieron prematuros moderados o tardíos.
En prematuros extremos hay mayor evidencia respecto a la asociación de la morbilidad con dificultades del desarrollo posteriores; así, por ejemplo, Martell et al. describieron que cada enfermedad neonatal disminuye la puntuación cognitiva en 10 puntos26. En este grupo incluso se han desarrollado distintas escalas para ayudarnos a predecir el desarrollo psicomotor en función del número y la severidad de las afecciones que presentan los recién nacidos27. Uno de estos instrumentos es el Inventario de riesgo perinatal (PERI), que en su validación original demostró tener una sensibilidad de 76% y especificidad de 79%28.
En publicaciones previas reportamos que comparados con los niños nacidos a término, los PMT tendrían un mayor riesgo de déficit del DSM y menor rendimiento cognitivo, siendo la edad gestacional el principal factor asociado a dichos resultados. La ausencia de asociación del rendimiento obtenido con la hospitalización neonatal podría deberse a la alta tasa de hospitalización de los PMT en dicha muestra, pero no fue analizado el impacto de la morbilidad neonatal específica29,30.
Los objetivos de este estudio fueron determinar, en prematuros moderados y tardíos, la existencia de asociación entre el déficit de DSM, la edad gestacional y la morbilidad neonatal, y estimar una medida de magnitud y dirección de asociación.
Pacientes y métodoDiseñoEl diseño es de caso control anidado en una cohorte de niños nacidos entre las 320/7 y 366/7 semanas de gestación, independiente del peso de nacimiento, en una institución privada de la Región Metropolitana de Santiago de Chile. Cada niño fue evaluado en una oportunidad entre los años 2008 y 2011 con la Escala de Bayley de desarrollo infantil, 3.a edición (Bayley-III), a los 8 o 18 meses de edad gestacional corregida, o a los 30 meses de edad cronológica (Schonhaut et al. 2012)29. Para este estudio se revisaron de forma retrospectiva la totalidad de fichas neonatales de todos los PMT incluidos previamente en el estudio (n=131).
La determinación de la EG se basó en el reporte de los padres, y se corroboró con la ficha clínica, basado en la fecha de la última regla y/o una ecografía precoz (<12 semanas). Para la corrección de la EG se restaron las semanas faltantes al nacimiento para llegar a las 40 semanas.
En el estudio prospectivo se excluyeron los niños con factores de riesgo biológico importante, como diagnóstico conocido de enfermedad neurológica, congénita o metabólica, los nacidos prematuros extremos (menores de 32 semanas de edad gestacional). En este análisis se excluyeron los niños con antecedentes perinatales incompletos.
Definición de grupos de casos y controlesCasos: lactantes y preescolares nacidos entre las 320/7 y 366/7 semanas de EG con rendimiento bajo (igual o inferior a –1DS) en la escala de Bayley-III.
Controles: lactantes y preescolares nacidos entre las 320/7 y 366/7 semanas de EG con rendimiento normal (sobre –1DS) en la escala de Bayley-III.
InclusiónEntre los años 2008 y 2011 los padres de los pacientes fueron contactados telefónicamente, aceptando participar a través de un consentimiento informado. Los niños participaron de una evaluación clínica con el test de Bayley-III, aplicado por una terapeuta capacitada. Los resultados de la evaluación fueron enviados a los pediatras tratantes, y en los casos en que se encontró dificultades del DSM, se sugirió una evaluación o intervención adicional, individualizada para cada niño.
La información biodemográfica se obtuvo de un formulario completado por los padres o cuidadores principales. El antecedente médico se extrajo de las fichas clínicas correspondientes.
InstrumentosEscala de Bayley de desarrollo infantil, 3.a edición, 2005 (Bayley-III)31: escala que evalúa el desarrollo en niños de 1 a 42 meses. En el presente estudio los niños fueron evaluados mediante 3 subescalas diferenciadas, que miden separadamente 3 áreas del desarrollo: cognitiva, comunicación (comprensiva y expresiva) y motora (gruesa y fina). Las puntuaciones totales de cada subescala son llevadas a puntuaciones estándar, donde la media es 100 puntos y 1DS es 15 puntos. Se consideró retraso del desarrollo si el niño evaluado tenía, al menos en un dominio, una puntuación menor o igual a –1DS.
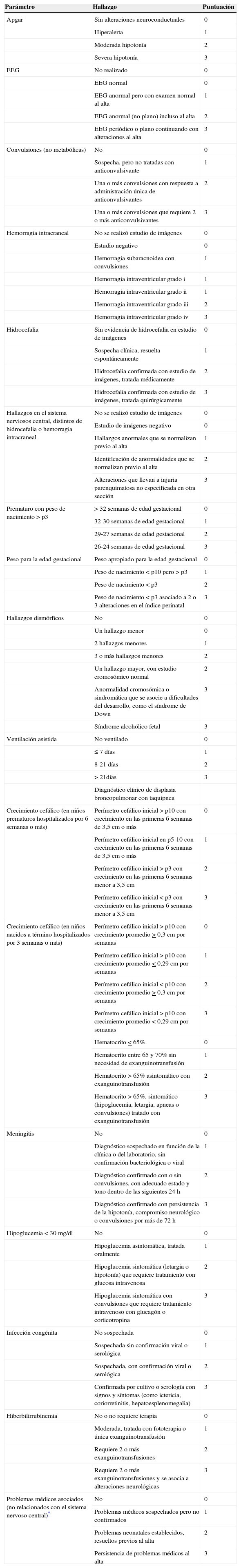
La definición de morbilidad neonatal se basó en el PERI28: este inventario está compuesto por 18 ítems que evalúan: 1) puntuaciones del test de Apgar; 2) edad gestacional; 3) peso (adecuado para la edad gestacional);32 4) presencia o ausencia de infecciones congénitas; 5) existencia de crisis convulsivas (no metabólicas); 6) presencia o ausencia de meningitis; 7) crecimiento cefálico (para niños pretérmino hospitalizados 6 o más semanas)32; 8) crecimiento cefálico (en niños a término hospitalizados más de 3 semanas)32; 9) naturaleza del electroencefalograma; 10) hemorragia intracraneal; 11) hidrocefalia; 12) hallazgos en el SNC (no hidrocefalia o hemorragia intracraneal); 13) rasgos dismórficos; 14) duración de la ventilación; 15) policitemia; 16) hipoglucemia; 17) hiperbilirrubinemia; y 18) problemas médicos asociados (no del SNC). El PERI gradúa cada uno de los ítems en una puntuación de 0 a 3 puntos, según la gravedad, y permite obtener puntuaciones totales de riesgo biológico (anexo 1).
Determinación de potencia estadística: se incorporó en el estudio la totalidad de niños nacidos entre las 32 y 36 semanas de edad gestacional que cumplían los criterios de selección. Se obtuvo una muestra conformada por 25 casos y 105 controles. Basado en los supuestos que la tasa estimada de déficit del DSM en PMT es del orden del 30%30,33 y que es esperable el triple de riesgo de déficit del DSM en PMT complicados u hospitalizados comparado con los no complicados19, considerando una relación de 4 controles por cada caso (que fue la proporción obtenida de casos y controles en la muestra analizada) y un intervalo de confianza de 95%, se obtuvo una potencia del 75% para este estudio.
Análisis estadístico: el análisis estadístico fue realizado en etapas. Inicialmente se hizo un análisis descriptivo exploratorio para caracterizar los casos y los controles, de modo de determinar comparabilidad entre los grupos y necesidad de ajuste en los análisis inferenciales. El análisis de asociación entre variables categóricas se hizo mediante tablas de contingencia usando pruebas de Chi cuadrado o test exacto de Fisher. En el caso de variables continuas se compararon promedios entre grupos usando t-test o análisis de varianza según corresponda. Finalmente se usaron modelos de regresión lineal y logística cuando la variable de respuesta fue continua o dicotómica. Estos modelos se usaron para obtener medidas de efecto de las exposiciones en las variables de respuesta ajustando por otros factores.
Las 2 partes del estudio, independientemente, contaron con la aprobación del Comité de Ética de la Investigación de Facultad de Medicina Clínica Alemana-Universidad del Desarrollo.
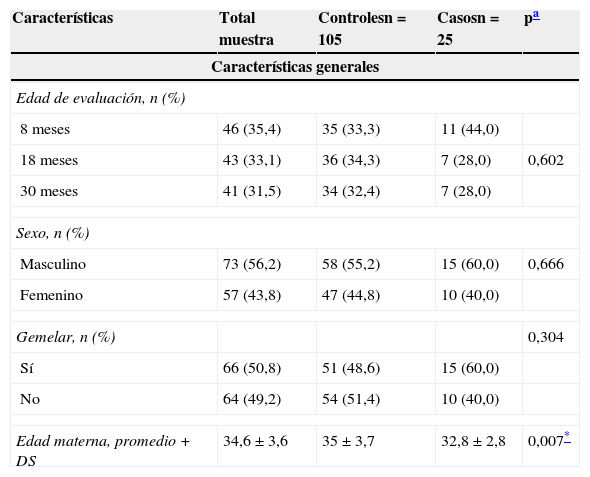
ResultadosSe incluyeron 131 niños, 25 casos y 105 controles; un niño fue excluido por tener los antecedentes perinatales incompletos. El 56% era de género masculino, y el 50,8% era producto de parto gemelar. Las madres tenían entre 27 y 45 años en el momento del parto, con una media de 34,6±3,6 años. La totalidad de los niños tenía al menos uno de los padres con educación superior; el promedio de educación materna fue de 17,3 años. Cerca de un tercio de los niños había sido evaluado con la escala de Bayley-III a los 8 meses de edad corregida, un tercio a los 18 meses de edad corregida y un tercio a los 30 meses de edad cronológica. Se encontraron diferencias estadísticamente significativas entre los casos y los controles solo en relación con la variable de edad materna (tabla 1).
Características biodemográficas, neonatales y de morbilidad neonatal de acuerdo a los criterios del PERI de la muestra
| Características | Total muestra | Controlesn=105 | Casosn=25 | pa |
|---|---|---|---|---|
| Características generales | ||||
| Edad de evaluación, n (%) | ||||
| 8 meses | 46 (35,4) | 35 (33,3) | 11 (44,0) | |
| 18 meses | 43 (33,1) | 36 (34,3) | 7 (28,0) | 0,602 |
| 30 meses | 41 (31,5) | 34 (32,4) | 7 (28,0) | |
| Sexo, n (%) | ||||
| Masculino | 73 (56,2) | 58 (55,2) | 15 (60,0) | 0,666 |
| Femenino | 57 (43,8) | 47 (44,8) | 10 (40,0) | |
| Gemelar, n (%) | 0,304 | |||
| Sí | 66 (50,8) | 51 (48,6) | 15 (60,0) | |
| No | 64 (49,2) | 54 (51,4) | 10 (40,0) | |
| Edad materna, promedio+DS | 34,6±3,6 | 35±3,7 | 32,8±2,8 | 0,007* |
| Características perinatales | ||||
|---|---|---|---|---|
| Edad gestacional, promedio±DS | 34±1,3 | 33,8±1,3 | 34,0±1,5 | 0,506 |
| Prematuridad, n (%) | ||||
| Moderada | 46 (35,4) | 35 (33,3) | 11 (44,0) | 0,361 |
| Tardía | 84 (64,6) | 70 (66,7) | 14 (56,0) | |
| Peso nacimiento, promedio±DS | 2128,0±454 | 2108,4±441 | 2207,6±504 | 0,330 |
| Pequeño para edad gestacional, n (%) | ||||
| No | 78 (60,0) | 61 (58,1) | 17 (68,0) | 0,328 |
| Sí | 52 (40,0) | 44 (41,9) | 8 (32,0) | |
| Hospitalización, n (%) | ||||
| No | 21 (16,2) | 15 (14,3) | 6 (24,0) | 0,236 |
| Sí | 109 (83,8) | 90 (85,7) | 19 (76,0) | |
| Días hospitalización, promedio (DS) | 12,4±10,8 (0-39) | 12,4 (10,5) | 12,4 (12,2) | 0,490 |
| Score total de PERI, promedio (DS) | 1,88±198 (0-10) | 1,89 (1,99) | 1,84 (1,95) | 0,450 |
| Morbilidad neonatal específica | ||||
|---|---|---|---|---|
| Apgar, n (%) | ||||
| Sin alteraciones neuroconductuales | 129 (99,2) | 104 (99,1) | 25 (100) | 0,624 |
| Hiperalerta | 0 | 0 | 0 | |
| Moderada hipotonía | 0 | 0 | 0 | |
| Severa hipotonía | 1 (0,8) | 1 (0,90) | 0 | |
| Hallazgos dismórficos, n (%) | ||||
| No | 127 (97,7) | 102 (97,1) | 25 (100) | |
| Un hallazgo menor | 2 (1,5) | 2 (1,9) | 0 | 0,694 |
| Dos hallazgos menores | 1 (0,8) | 1 (1,0) | 0 | |
| Hemorragia intreventricular, n (%) | ||||
| No | 128 (98,4) | 103 (98,1) | 25 (100) | 0,785 |
| Sí | 2 (1,6) | 2 (1,9) | 0 | |
| Asistencia ventilatoria, n (%) | ||||
| No | 106 (81,5) | 85 (81,0) | 21 (84,0) | 0,724 |
| Sí | 24 (18,5) | 20 (19,0) | 4 (16,0) | |
| Hipoglucemia sintomática, n (%) | ||||
| No | 118 (90,8) | 98 (93,3) | 20 (80,0) | |
| Sí | 12(9,2) | 7 (6,7) | 5 (20,0) | 0,038* |
| Hiberbilirrubinemia, n (%) | ||||
| No | 76 (58,5) | 59 (56,6) | 17 (68,0) | 0,282 |
| Sí | 54 (41,5) | 46 (43,8) | 8 (32,0) | |
PERI: inventario de riesgo perinatal. Se incluyeron solo las variables en que hubo casos positivos.
El 83,8% de la muestra había estado hospitalizada en el periodo neonatal, con un promedio de 12,4 días. La puntuación PERI varió entre 0 y 10 puntos, con una moda de 0 y promedio de 1,88. En cuanto a la morbilidad perinatal, destaca que solo un niño presentó una puntuación de Apgar baja con severa hipotonía al nacer, recuperado a los 5min; ningún niño tuvo convulsiones, en 2 se pesquisó hemorragia intraventricular grado i en ecografía cerebral de rutina. Veinticuatro niños requirieron ventilación asistida (18,5%), solo uno de ellos por más de una semana; 12 niños tuvieron hipoglucemia sintomática, 54 niños (41,5%) presentaron hiperbilirrubinemia, todos ellos fueron tratados solo con fototerapia. Al comparar los casos y controles en relación con la morbilidad neonatal, solo la hipoglucemia resultó estadísticamente significativa (tabla 1).
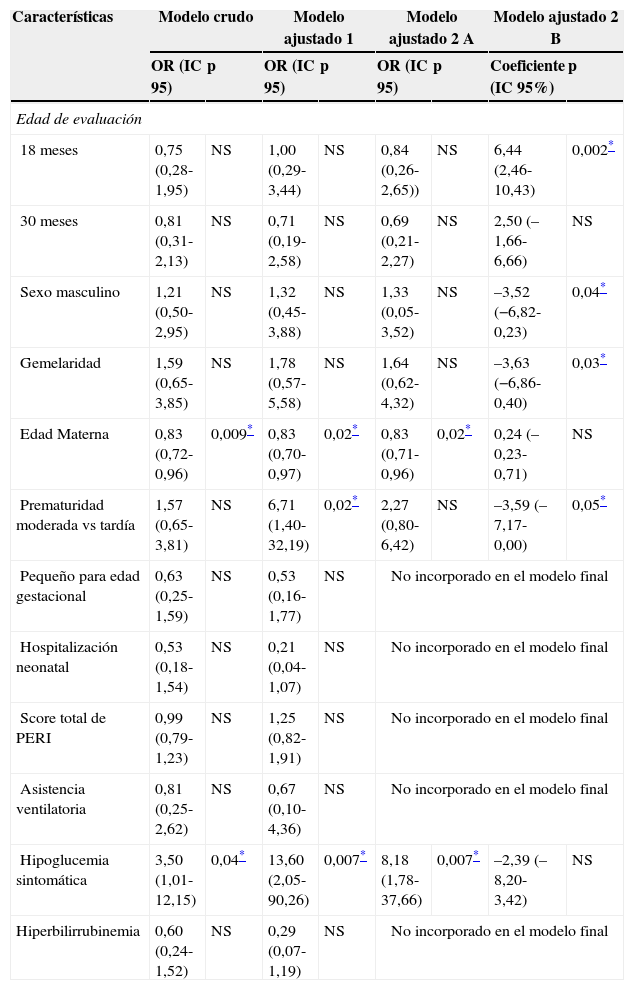
En el análisis crudo de riesgo de déficit de DSM aparece estadísticamente significativa la hipoglucemia sintomática (OR: 3,5), mientras que la mayor edad materna aparece como protectora (OR: 0,83). En un modelo multivariado que incluye todas las variables estudiadas ambos factores se mantuvieron estadísticamente significativos además de la edad gestacional. Al implementar un modelo que incluye las variables clínicamente relevantes y evalúa la interacción de estas con las variables de control (como la edad gestacional, la edad materna, la gemelaridad y el género), la hipoglucemia sintomática continuó siendo estadísticamente significativa con una OR ajustada de 8,18 para el déficit del DSM (tabla 2). Siguiendo el mismo modelo se analizó la influencia de cada uno de los factores analizados en el coeficiente global del desarrollo, encontrando que afectan de forma negativa al género masculino (p=0,04), la gemelaridad (p=0,03) y la edad gestacional en el límite de la significación (p=0,05); los niños evaluados a la edad corregida de 18 meses tuvieron menos déficit del DSM comparado con los niños evaluados a los 8 meses (p=0,002), y no hubo diferencias estadísticamente significativas entre las evaluaciones realizadas a los 8 y 30 meses y entre los 18 y 30 meses.
Análisis de asociación entre el déficit del desarrollo, coeficiente de desarrollo alcanzado y las variables del estudio
| Características | Modelo crudo | Modelo ajustado 1 | Modelo ajustado 2 A | Modelo ajustado 2 B | ||||
|---|---|---|---|---|---|---|---|---|
| OR (IC 95) | p | OR (IC 95) | p | OR (IC 95) | p | Coeficiente (IC 95%) | p | |
| Edad de evaluación | ||||||||
| 18 meses | 0,75 (0,28-1,95) | NS | 1,00 (0,29-3,44) | NS | 0,84 (0,26-2,65)) | NS | 6,44 (2,46-10,43) | 0,002* |
| 30 meses | 0,81 (0,31-2,13) | NS | 0,71 (0,19-2,58) | NS | 0,69 (0,21-2,27) | NS | 2,50 (–1,66-6,66) | NS |
| Sexo masculino | 1,21 (0,50-2,95) | NS | 1,32 (0,45-3,88) | NS | 1,33 (0,05-3,52) | NS | –3,52 (−6,82-0,23) | 0,04* |
| Gemelaridad | 1,59 (0,65-3,85) | NS | 1,78 (0,57-5,58) | NS | 1,64 (0,62-4,32) | NS | –3,63 (−6,86-0,40) | 0,03* |
| Edad Materna | 0,83 (0,72-0,96) | 0,009* | 0,83 (0,70-0,97) | 0,02* | 0,83 (0,71-0,96) | 0,02* | 0,24 (–0,23-0,71) | NS |
| Prematuridad moderada vs tardía | 1,57 (0,65-3,81) | NS | 6,71 (1,40-32,19) | 0,02* | 2,27 (0,80-6,42) | NS | –3,59 (–7,17-0,00) | 0,05* |
| Pequeño para edad gestacional | 0,63 (0,25-1,59) | NS | 0,53 (0,16-1,77) | NS | No incorporado en el modelo final | |||
| Hospitalización neonatal | 0,53 (0,18-1,54) | NS | 0,21 (0,04-1,07) | NS | No incorporado en el modelo final | |||
| Score total de PERI | 0,99 (0,79-1,23) | NS | 1,25 (0,82-1,91) | NS | No incorporado en el modelo final | |||
| Asistencia ventilatoria | 0,81 (0,25-2,62) | NS | 0,67 (0,10-4,36) | NS | No incorporado en el modelo final | |||
| Hipoglucemia sintomática | 3,50 (1,01-12,15) | 0,04* | 13,60 (2,05-90,26) | 0,007* | 8,18 (1,78-37,66) | 0,007* | –2,39 (–8,20-3,42) | NS |
| Hiperbilirrubinemia | 0,60 (0,24-1,52) | NS | 0,29 (0,07-1,19) | NS | No incorporado en el modelo final | |||
NS: no significativo.
Modelo 1: análisis de regresión logística múltiple considerando todas las variables.
Modelo 2 A: análisis de regresión logística múltiple con el modelo final, luego de descartar las modificaciones de efecto por no ser significativas.
Modelo 2 B: regresión lineal múltiple de la influencia de las variables del modelo en el coeficiente de desarrollo global de la Escala de Bayley III de desarrollo infantil, 3.a edición (Bayley-III).
El presente estudio agrega nueva evidencia respecto al riesgo de deficiencias en el DSM en el grupo de niños nacidos PMT. Es sabido que los niños que nacen antes de las 37 semanas de gestación tienen mayor riesgo de dificultades del DSM y mayor probabilidad de hospitalización que los niños nacidos a término, con un efecto dosis respuesta, cuyo nadir se encuentra a las 39-40 semanas30,34,35, así como es conocida la elevada asociación entre edad gestacional, hospitalización y morbilidad neonatal36.
En un estudio previo, en el que comparamos el rendimiento de los PMT con una muestra pareada de niños nacidos a término, encontramos diferencias estadísticamente significativas en el rendimiento cognitivo29, coincidiendo con lo reportado por distintos autores y con diferentes instrumentos de evaluación37. La gran interrogante es si la diferencia es explicada exclusivamente por la prematuridad o por la morbilidad y complicaciones asociadas a ella. Para despejar esta variable analizamos exclusivamente en los niños nacidos PMT los registros de morbilidad perinatal.
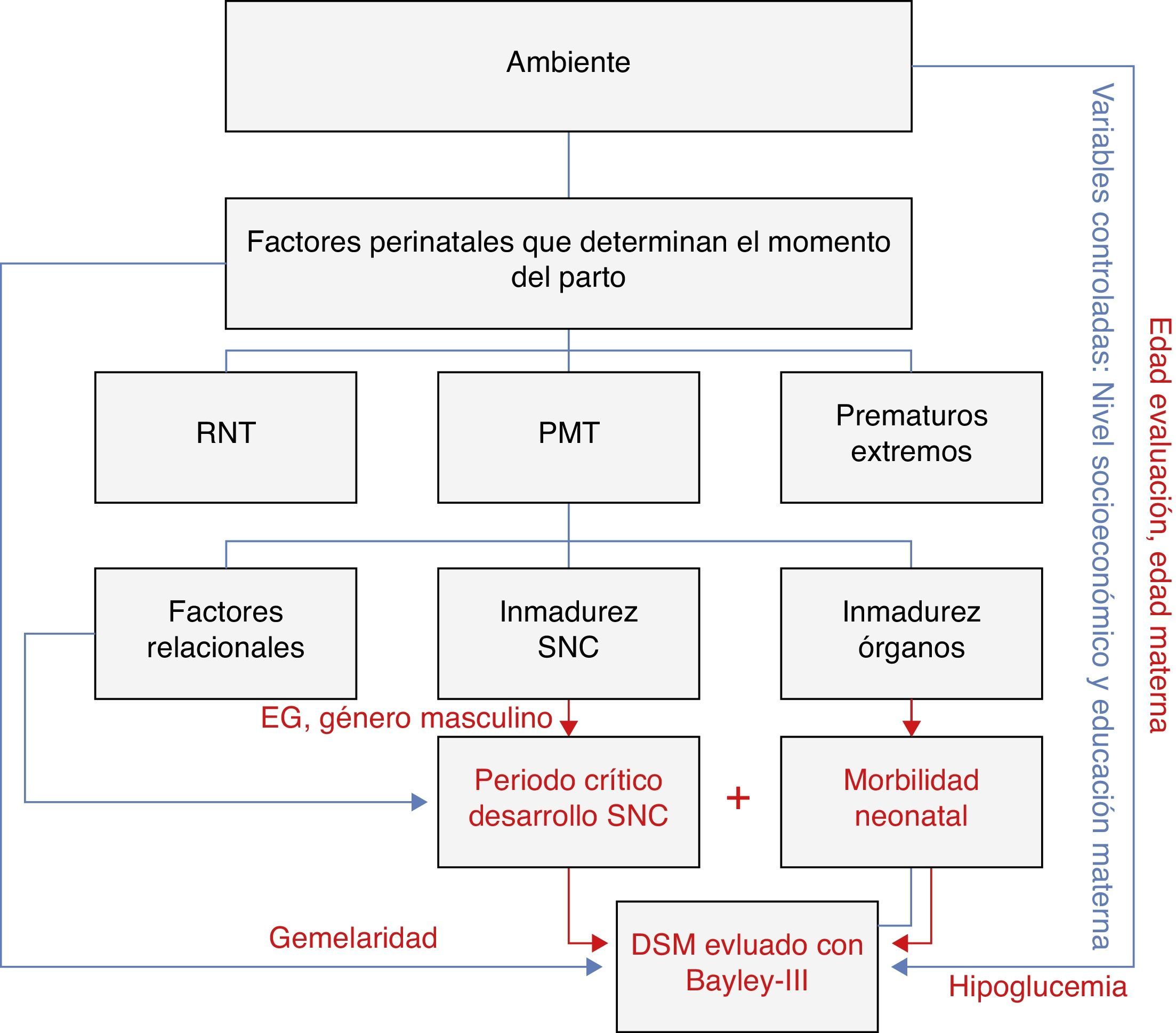
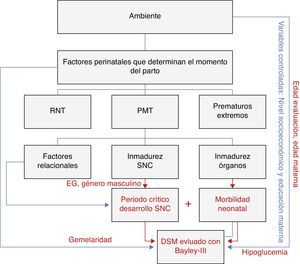
Al controlar variables ambientales, como el nivel socioeconómico y la educación de los padres, la hipoglucemia sintomática fue el factor de riesgo estadísticamente significativo para el déficit del DSM, tanto en el análisis crudo como en el ajustado, con una OR cruda de 3,5 y ajustada de 8,18, sin demostrarse interacciones con las demás variables analizadas. Los coeficientes de desarrollo se asociaron negativamente con la gemelaridad y el género masculino, y en el límite de la significación con la edad gestacional (fig. 1).
Modelo explicativo de las conclusiones de la asociación de las variables del estudio.
En el presente modelo, al controlar las variables ambientales, se encontró asociación entre el déficit del DSM y la hipoglucemia como morbilidad neonatal. La inmadurez del SNC (dada por la EG), la gemelaridad, el género masculino se asociaron con los coeficientes de desarrollo alcanzados. Otras variables significativas fueron la edad materna y la edad de evaluación.
Bayley-III: Escala de Bayley de desarrollo infantil, 3.a edición; DSM: desarrollo psicomotor; EG: edad gestacional; PMT: prematuros moderados y tardíos; RNT: recién nacidos a término; SNC: sistema nervioso central.
La hipoglucemia es uno de los problemas metabólicos más frecuente en la medicina neonatal, existiendo mayor riesgo de desarrollarla en prematuros comparado con niños nacidos a término36. A pesar que las revisiones sistemáticas no son categóricas en cuanto a su asociación con el desarrollo posterior, posiblemente debido a falta de estudios prospectivos y bien diseñados38, nuestros resultados coinciden con publicaciones realizadas tanto en PMT como en niños de término, que muestran que la hipoglucemia es un factor de riesgo de dificultades del desarrollo e incluso se asocia a alteraciones en las neuroimágenes realizadas de forma diferida, independiente de la severidad y duración de esta alteración metabólica22,39. Por este motivo se han implementado guías clínicas para la pesquisa e intervención en niños con riesgo de hipoglucemia, como podrían ser los PMT40.
A diferencia de otras investigaciones no encontramos asociación entre la hospitalización neonatal, puntuación de riesgo de PERI y otras condiciones patológicas con en el desempeño psicomotor18,28,41, probablemente debido al elevado porcentaje de niños hospitalizados en nuestra muestra y a los bajos índices de morbilidad evidenciada en el score analizado.
Los coeficientes de desarrollo se asociaron negativamente con la gemelaridad y el género masculino, aspecto que ha sido reportado por otros autores42, mientras que la edad gestacional se encontró en el límite de la significación; estas diferencias alcanzan mayor significación estadística en estudios que amplían la muestra incluyendo grupos de edad gestacional más extrema, como serían los niños nacidos a término o los prematuros extremos30,33,42–45.
Otras variables que resultaron estadísticamente significativas, y para lo cual no tenemos interpretación, fueron la edad materna (dentro de un rango etario bastante estrecho, sin presencia de progenitoras en edades extremas) y la edad de evaluación de 18 meses comparado con los 8 o 30 meses en el modelo multivariado. En un estudio previo, realizado en niños nacidos a término de similares características socioeconómicas, observamos una tendencia a aumentar las puntuaciones de la escala de Bayley-III en relación con la mayor edad de los niños46. En poblaciones de nivel cultural y socioeconómico medio-alto, a diferencia de lo que ocurre en niños que crecen en ambiente de pobreza47, los efectos de la prematuridad sobre el desarrollo a largo plazo podrían ser compensados por un ambiente protector y quizás también por programas de estimulación, variables no analizadas en el presente estudio.
Las limitaciones del estudio podrían relacionarse con el hecho de que su diseño fue retrospectivo, por lo que podría haber algún sesgo de registro, especialmente en los niños que no fueron hospitalizados. La baja potencia estadística podría explicar la falta de asociaciones encontradas cuando en realidad las hay, pero le da más fuerza a las asociaciones encontradas.
Por otro lado, es importante tener presente en el análisis que fueron consideradas solo variables biodemográficas y de hospitalización neonatal, sin incorporar otros factores genéticos y ambientales. En futuras investigaciones podrían ser analizadas las características del embarazo6, la vía del parto48, la lactancia materna25, la depresión posparto49, la escolarización del niño y las intervenciones recibidas, variables que sin duda pueden tener importante impacto en el desarrollo alcanzado por cada niño.
ConclusionesRespecto a la pregunta de si es la prematuridad o las condiciones patológicas asociadas a ella los responsables de la diferencia del DSM en niños nacidos entre las 320 y 366 semanas de edad gestacional, concluimos que, al controlar las variables ambientales, la hipoglucemia sintomática es el principal factor de riesgo de déficit del DSM, mientras que la gemelaridad, el género masculino y la edad gestacional influyen en el coeficiente de desarrollo global obtenido. La relevancia de aclarar los factores asociados al menor desempeño de los prematuros moderados y tardíos radica en la posibilidad de desarrollar estrategias de prevención, como la pesquisa y manejo de la hipoglucemia.
FinanciaciónEl estudio fue financiado por fondo de proyectos SOCHIPE 2012.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.
Nuestros agradecimientos al Dr. Xavier Demestre, por la completa y prolija revisión del manuscrito, y al Sr. Gabriel Cavada, por su asesoría estadística.
| Parámetro | Hallazgo | Puntuación |
|---|---|---|
| Apgar | Sin alteraciones neuroconductuales | 0 |
| Hiperalerta | 1 | |
| Moderada hipotonía | 2 | |
| Severa hipotonía | 3 | |
| EEG | No realizado | 0 |
| EEG normal | 0 | |
| EEG anormal pero con examen normal al alta | 1 | |
| EEG anormal (no plano) incluso al alta | 2 | |
| EEG periódico o plano continuando con alteraciones al alta | 3 | |
| Convulsiones (no metabólicas) | No | 0 |
| Sospecha, pero no tratadas con anticonvulsivante | 1 | |
| Una o más convulsiones con respuesta a administración única de anticonvulsivantes | 2 | |
| Una o más convulsiones que requiere 2 o más anticonvulsivantes | 3 | |
| Hemorragia intracraneal | No se realizó estudio de imágenes | 0 |
| Estudio negativo | 0 | |
| Hemorragia subaracnoidea con convulsiones | 1 | |
| Hemorragia intraventricular grado i | 1 | |
| Hemorragia intraventricular grado ii | 1 | |
| Hemorragia intraventricular grado iii | 2 | |
| Hemorragia intraventricular grado iv | 3 | |
| Hidrocefalia | Sin evidencia de hidrocefalia en estudio de imágenes | 0 |
| Sospecha clínica, resuelta espontáneamente | 1 | |
| Hidrocefalia confirmada con estudio de imágenes, tratada médicamente | 2 | |
| Hidrocefalia confirmada con estudio de imágenes, tratada quirúrgicamente | 3 | |
| Hallazgos en el sistema nerviosos central, distintos de hidrocefalia o hemorragia intracraneal | No se realizó estudio de imágenes | 0 |
| Estudio de imágenes negativo | 0 | |
| Hallazgos anormales que se normalizan previo al alta | 1 | |
| Identificación de anormalidades que se normalizan previo al alta | 2 | |
| Alteraciones que llevan a injuria parenquimatosa no especificada en otra sección | 3 | |
| Prematuro con peso de nacimiento >p3 | >32 semanas de edad gestacional | 0 |
| 32-30 semanas de edad gestacional | 1 | |
| 29-27 semanas de edad gestacional | 2 | |
| 26-24 semanas de edad gestacional | 3 | |
| Peso para la edad gestacional | Peso apropiado para la edad gestacional | 0 |
| Peso de nacimiento <p10 pero>p3 | 1 | |
| Peso de nacimiento<p3 | 2 | |
| Peso de nacimiento<p3 asociado a 2 o 3 alteraciones en el índice perinatal | 3 | |
| Hallazgos dismórficos | No | 0 |
| Un hallazgo menor | 0 | |
| 2 hallazgos menores | 1 | |
| 3 o más hallazgos menores | 2 | |
| Un hallazgo mayor, con estudio cromosómico normal | 2 | |
| Anormalidad cromosómica o sindromática que se asocie a dificultades del desarrollo, como el síndrome de Down | 3 | |
| Síndrome alcohólico fetal | 3 | |
| Ventilación asistida | No ventilado | 0 |
| ≤7 días | 1 | |
| 8-21 días | 2 | |
| >21días | 3 | |
| Diagnóstico clínico de displasia broncopulmonar con taquipnea | ||
| Crecimiento cefálico (en niños prematuros hospitalizados por 6 semanas o más) | Perímetro cefálico inicial >p10 con crecimiento en las primeras 6 semanas de 3,5cm o más | 0 |
| Perímetro cefálico inicial en p5-10 con crecimiento en las primeras 6 semanas de 3,5cm o más | 1 | |
| Perímetro cefálico inicial >p3 con crecimiento en las primeras 6 semanas menor a 3,5cm | 2 | |
| Perímetro cefálico inicial <p3 con crecimiento en las primeras 6 semanas menor a 3,5cm | 3 | |
| Crecimiento cefálico (en niños nacidos a término hospitalizados por 3 semanas o más) | Perímetro cefálico inicial >p10 con crecimiento promedio >0,3cm por semanas | 0 |
| Perímetro cefálico inicial >p10 con crecimiento promedio <0,29cm por semanas | 1 | |
| Perímetro cefálico inicial <p10 con crecimiento promedio >0,3cm por semanas | 2 | |
| Perímetro cefálico inicial >p10 con crecimiento promedio <0,29cm por semanas | 3 | |
| Hematocrito <65% | 0 | |
| Hematocrito entre 65 y 70% sin necesidad de exanguinotransfusión | 1 | |
| Hematocrito >65% asintomático con exanguinotransfusión | 2 | |
| Hematocrito >65%, sintomático (hipoglucemia, letargia, apneas o convulsiones) tratado con exanguinotransfusión | 3 | |
| Meningitis | No | 0 |
| Diagnóstico sospechado en función de la clínica o del laboratorio, sin confirmación bacteriológica o viral | 1 | |
| Diagnóstico confirmado con o sin convulsiones, con adecuado estado y tono dentro de las siguientes 24h | 2 | |
| Diagnóstico confirmado con persistencia de la hipotonía, compromiso neurológico o convulsiones por más de 72h | 3 | |
| Hipoglucemia <30 mg/dl | No | 0 |
| Hipoglucemia asintomática, tratada oralmente | 1 | |
| Hipoglucemia sintomática (letargia o hipotonía) que requiere tratamiento con glucosa intravenosa | 2 | |
| Hipoglucemia sintomática con convulsiones que requiere tratamiento intravenoso con glucagón o corticotropina | 3 | |
| Infección congénita | No sospechada | 0 |
| Sospechada sin confirmación viral o serológica | 1 | |
| Sospechada, con confirmación viral o serológica | 2 | |
| Confirmada por cultivo o serología con signos y síntomas (como ictericia, coriorretinitis, hepatoesplenomegalia) | 3 | |
| Hiberbilirrubinemia | No o no requiere terapia | 0 |
| Moderada, tratada con fototerapia o única exanguinotransfusión | 1 | |
| Requiere 2 o más exanguinotransfusiones | 2 | |
| Requiere 2 o más exanguinotransfusiones y se asocia a alteraciones neurológicas | 3 | |
| Problemas médicos asociados (no relacionados con el sistema nervoso central)* | No | 0 |
| Problemas médicos sospechados pero no confirmados | 1 | |
| Problemas neonatales establecidos, resueltos previos al alta | 2 | |
| Persistencia de problemas médicos al alta | 3 |