Knowledge about celiac disease continues to grow and amaze those who investigate, seek and treat this condition. Gone are the days when it was considered just a rare child's digestive disease. It is now recognized as a highly prevalent autoimmune condition that affects children and adults with digestive and extra-digestive symptoms of diverse intensity, disorder that may be either mono, oligo or asymptomatic from a digestive point of view. Today, it is an underdiagnosed condition, not actively considered, and often mistakes are made regarding its diagnosis, treatment and gluten-free diet monitoring. This article reviews the current definition of the disease, clinical presentations, potential patients, how to search for the disease, how the diagnosis is made and characteristics of the treatment and monitoring of celiac patients, all based on internationally agreed standards, and emphasizing those aspects that have proven to be useful in other countries regarding the management of the disease.
El conocimiento acerca de la enfermedad celíaca continúa creciendo y sorprendiendo a aquellos que la investigan, la buscan y la tratan. Lejos están los tiempos en que se consideraba una patología digestiva del niño, poco frecuente. Actualmente se reconoce como una condición autoinmune altamente prevalente, que afecta a niños y adultos, con manifestaciones digestivas y extradigestivas de muy diversa intensidad, y que puede ser monosintomática, oligosintomática o incluso asintomática desde el punto de vista digestivo. Hoy en día está subdiagnosticada, no se busca activamente, y se incurre en errores tanto al diagnosticarla como en la indicación del tratamiento y seguimiento de la dieta sin gluten. En este artículo se revisa el estado actual del conocimiento sobre la enfermedad, sus formas de presentación clínica, en quiénes y cómo se debe sospechar, actuales métodos de diagnóstico y tratamiento, y recomendaciones para el seguimiento del paciente celíaco, basándonos en los criterios internacionales actualmente consensuados, y poniendo énfasis en aquellos aspectos que han demostrado ser útiles en otros países para mejorar el manejo de la enfermedad.
Introducción
El conocimiento acerca de la enfermedad celíaca (EC) continúa creciendo y sorprendiendo a aquellos que la investigan, la buscan y la tratan. Lejos están los tiempos en que se consideraba una patología digestiva del niño, poco frecuente. Actualmente se reconoce como una de las condiciones autoinmunes más altamente prevalente, que afecta a niños y adultos de todo el mundo1, con manifestaciones digestivas y extradigestivas de muy diversa intensidad, y que puede ser monosintomática, oligosintomática o incluso asintomática. La EC deteriora en forma considerable la calidad de vida de los afectados, frecuentemente tiene manifestaciones autoinmunes de altos costos de tratamiento y se le ha reportado una mortalidad más elevada que en el resto de la población2,3. Su tratamiento -que obliga una dieta especial, sin gluten, estricta y permanente, y que en general no incluye fármacos- es de alto costo económico y social. Tratándose de una condición que cada día se diagnostica con mayor frecuencia, es importante que los profesionales de la salud que atendemos a la población de celíacos del país nos pongamos al día en el tema; eso es lo que nos motiva a revisar en este artículo aquellos aspectos considerados cruciales para mejorar el manejo médico-nutricional de esta condición. Dado los importantes cambios actualmente en curso derivados del mejor conocimiento sobre esta condición, la opinión generalizada de los especialistas es seguir rigurosamente los criterios de la Sociedad Europea de Gastroenterología Pediátrica y Nutrición (ESPGHAN), que aúna un enorme grupo de expertos quienes se reúnen periódicamente y revalúan los últimos avances en el conocimiento de la EC, estableciendo los criterios de cómo manejarla. En este artículo seguiremos sus conceptualizaciones, centrándonos en aquellos puntos aún poco claros y en los que guías de otros grupos de especialistas pueden tener algunas diferencias4.
¿Ha variado la definición de enfermedad celíaca?
Desde que se describió la enfermedad en 1950, rápidamente se hizo evidente que sus manifestaciones clínicas eran a tal punto variables que no era conveniente definirla ni basar los criterios diagnósticos en la clínica de la enfermedad. En 1969 se logró el consenso internacional y se estableció que la enfermedad sería definida y manejada por los criterios que estableciera la Sociedad Europea de Gastroenterología Pediátrica y Nutrición (ESPGHAN), criterios que se han revaluado periódicamente y hasta hoy son establecidos por el mismo grupo de especialistas5. A lo largo del tiempo se han incorporado otros grupos de opinión experta, por ejemplo el Colegio Americano de Gastroenterólogos (ACG)4. Dado que no existe un modelo animal que permita estudiar esta patología en forma experimental, los últimos avances se fundamentan principalmente en series de pacientes descritos en todo el mundo6,7; hoy en día, la biología celular y molecular contribuyen a entender aspectos específicos de la etiopatogenia y genética de la EC8, aunque hay que mantener presente que muchos de los conocimientos en estas áreas se basan en experimentación en modelos que constituyen un "proxi" y no la enfermedad propiamente tal.
La definición propuesta en la última actualización hecha por ESPGHAN en 20125 dice que la EC es una condición que va más allá de solo una enteropatía inducida por gluten, que era la definición aceptada hasta hace poco tiempo; es un desorden sistémico mediado inmunológicamente, gatillado por el gluten y prolaminas relacionadas, en individuos genéticamente predispuestos, y caracterizada por la presencia de una combinación variable de: 1) manifestaciones clínicas dependientes del gluten, 2) anticuerpos específicos de EC (anti-tTG2 [tTG] y antiendomisio [EMA]), 3) perfil genético de riesgo (haplotipos HLA DQ2 y DQ8), y 4) enteropatía (diferentes grados de infiltrado linfoplasmocitario y aplanamiento vellositario en la biopsia duodenal-yeyunal).
Presentaciones clínicas
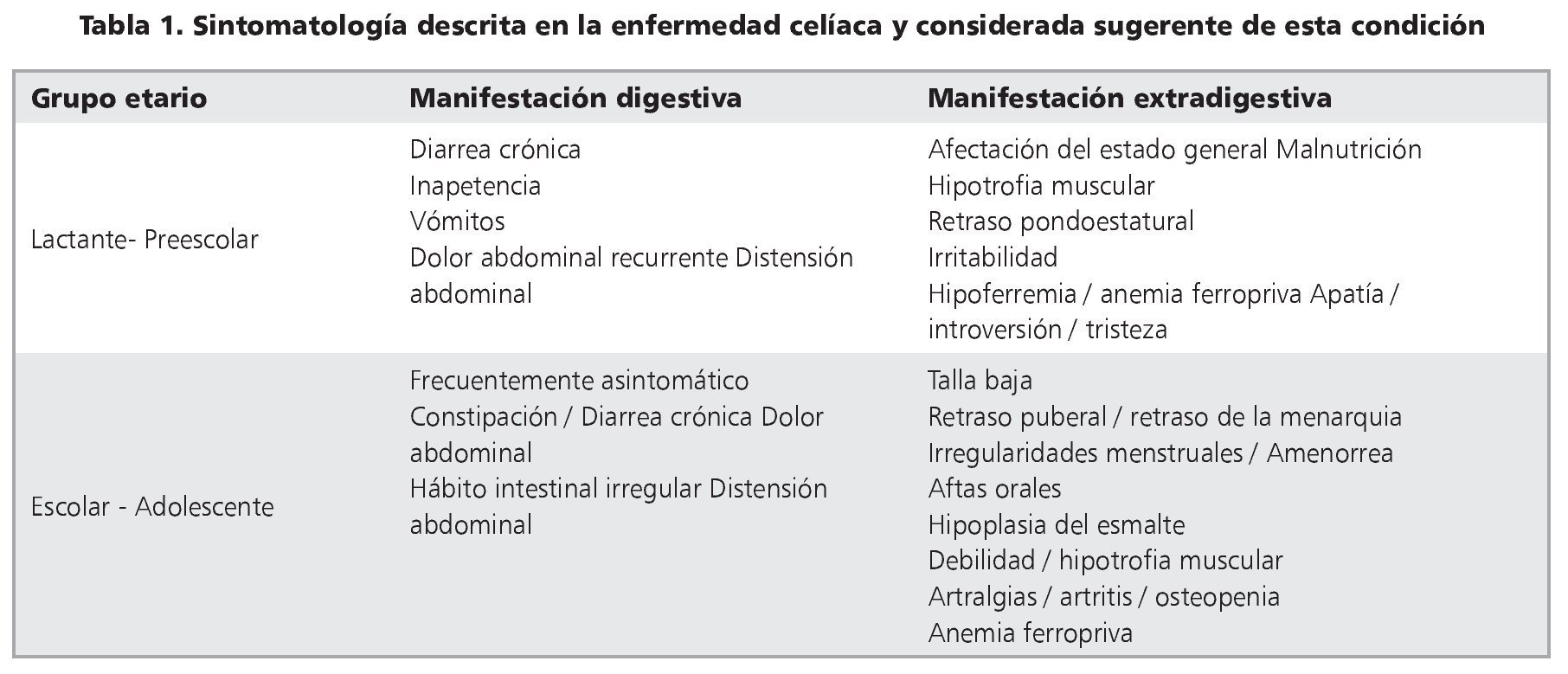
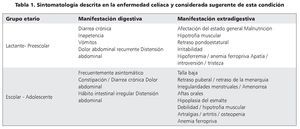
Las manifestaciones clínicas son diversas, desde pacientes oligosintomáticos, monosintomáticos o aparentemente asintomáticos hasta el cuadro clásico con síndrome de malabsorción asociado a desnutrición (tabla 1). Las últimas Guías de ESPGHAN ponen énfasis en que la sintomatología debe responder al retiro del gluten de la dieta y distingue actualmente cinco presentaciones5:
1. Con síntomas y signos gastrointestinales (diarrea crónica, dolor abdominal, distensión abdominal, estreñimiento, etc.). Representa la forma típica o clásica, con síndrome de malabsorción intestinal, aplanamiento importante (o total) de las vellosidades, y aparece más frecuentemente durante la infancia.
2. Con síntomas y signos extraintestinales. Pueden predominar manifestaciones que son consecuencia del síndrome de malabsorción subclínico (anemia por deficiencia de hierro que reaparece o no responde a tratamiento habitual, osteopenia u osteoporosis en edades tempranas, talla baja). Puede incluir procesos autoinmunes diversos (tiroiditis, hepatitis, nefropatía), infertilidad y alteraciones neuropsiquiátricas.
3. Silente: se define por la presencia de anticuerpos específicos (EMA y/o tTG), marcadores HLA (DQ2/DQ8), y biopsia de intestino delgado compatible (grados 2 a 4 en la escala de Marsh)9, en ausencia de manifestaciones clínicas que sugieran o apoyen el diagnóstico de EC. Actualmente, estos casos se descubren frecuentemente por "búsqueda activa", al estudiar individuos que pertenecen a grupos de riesgo y a familiares directos de pacientes ya diagnosticados.
4. Latente: se define por la presencia de marcadores genéticos compatibles (HLA DQ2/ DQ8) en ausencia de enteropatía, o bien son pacientes con diagnóstico de EC en algún momento de su vida, que respondieron clínica e histológicamente a la dieta sin gluten, y hoy permanecen asintomáticos, con anticuerpos negativos e histología del intestino delgado normal en circunstancias en que su dieta contiene gluten en las cantidades habituales.
5. Potencial: se define por presencia de anticuerpos específicos y marcadores genéticos HLA compatibles, sin manifestaciones clínicas ni anormalidades histológicas en biopsias duodenales.
Recientemente se han comenzado a reconocer cuadros aledaños a la EC, como son la sensibilidad al gluten y la alergia al trigo. Al respecto, se entiende por sensibilidad al gluten a un grupo de reacciones adversas asociadas a la ingesta de gluten, en las cuales el estudio del paciente no demuestra la presencia de fenómenos alérgicos o autoinmunes. Estos pacientes se caracterizan por presentar marcadores serológicos negativos (excepto IgG antigliadina, que puede ser positivo) y biopsias de duodeno normales10, con sintomatología sugerente de EC. Aunque actualmente se desconoce su patogenia y su relación con la EC, la información disponible sugiere una desregulación inmune, con disminución de la actividad de linfocitos T reguladores y el aumento de marcadores de inmunidad innata10. La alergia al trigo, en cambio, se trata de una reacción adversa de origen inmune, gatillada por las proteínas del trigo, en ausencia de fenómenos de autoinmunidad; actualmente, el mecanismo subyacente está demostrado para reacciones de tipo IgE. El alérgeno puede entrar en contacto con el individuo por vía cutánea, digestiva o respiratoria. Puede manifestarse con síntomas cutáneos, gastrointestinales y respiratorios. A menudo, el diagnóstico se basa en la presencia de un cuadro clínico caracterizado por una reacción rápida frente al contacto con trigo, asociado a la positividad en las pruebas cutáneas positivas para trigo y/o aumento de la IgE específica10. El tratamiento consiste en una dieta estricta de eliminación de alimentos que contengan trigo. La demostración de la presencia de IgE contra antígenos del trigo, en ausencia de síntomas asociados directamente a la exposición (sensibilización), no justifica la indicación de dieta de eliminación ni otras maniobras terapéuticas. En ambos casos se recomienda que el diagnóstico y manejo sea realizado por un especialista, quien, cuando se trata de un paciente pediátrico, deberá explicar a los padres que la alergia en la edad infantil habitualmente es transitoria, mientras que la EC es crónica y requiere dieta sin gluten a lo largo de toda la vida. También les debe explicar que en los cuadros de alergia se debe evitar toda presencia del alérgeno, mientras que en la EC la dieta sin gluten implica un punto de corte, bajo el cual el paciente puede consumir el alimento sin correr riesgos.
¿En quiénes debemos buscar enfermedad celíaca?
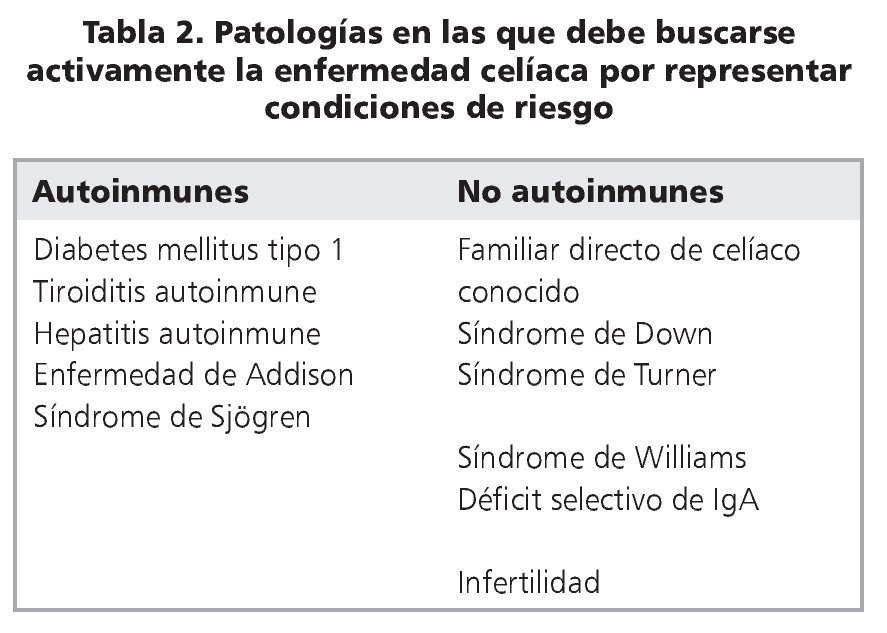
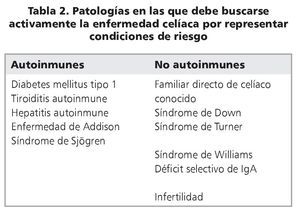
En la última década ha quedado claro que el número de pacientes celíacos conocidos es muy inferior al que está diagnosticado11-13. En buena parte esto se debe a que, anteriormente, la enfermedad se buscaba solamente en personas que se sentían enfermas y consultaban al médico. El acceso a los anticuerpos EMA y tTG, y posteriormente su uso como herramienta de rastreo en grandes grupos de población, permitió establecer la existencia de patologías en las que la EC es mucho más frecuente que en la población general14,15. Esto llevó al concepto de "búsqueda activa", es decir, buscar la presencia de estos anticuerpos en todos aquellos individuos que contactan el sistema de salud, por diversas sintomatologías, y que tienen alguna de las patologías en las que se han descrito frecuencias de EC más altas que en la población general (tabla 2); en aquellos que resultan positivos se debe confirmar el diagnóstico mediante biopsia de intestino delgado. Este protocolo es el que ha llevado a establecer que la prevalencia de la EC es del orden del 0,5-1% en la mayoría de las poblaciones estudiadas, de diversas etnias y orígenes11. En Chile, la segunda Encuesta Nacional de Salud16 determinó que poco menos del 1% de la población tiene IgA-tTG positivo, o sea, es población llamada "susceptible". La frecuencia de la enfermedad propiamente tal se estima actualmente en el ~0,5% de la población chilena, en contraste a la prevalencia de 1:1800 que se conocía anteriormente según los casos diagnosticados a propósito de su consulta al especialista17. Esta práctica de buscar activamente a los pacientes, sin esperar a que consulten, ha tenido dos consecuencias interesantes: los familiares de primer grado de celíacos, diagnosticados por búsqueda activa, representan alrededor del 10-15% de los casos actualmente diagnosticados; por otra parte, la proporción de casos diagnosticados ha aumentado considerablemente entre los adultos, con una disminución relativa de casos cuya sintomatología principal es diarrea durante la edad pediátrica18,19.
Diagnóstico
Ante la amplia variedad de presentaciones clínicas, el cómo se diagnostican algunos casos excepcionales de EC se ha convertido en tema de debate. Es por esto que ESPGHAN, en 2012, revisó y puso al día los criterios para hacer el diagnóstico. Establecen que se debe hacer búsqueda activa en individuos con condiciones de riesgo, que incluye a los familiares directos (hermanos, padres, hijos) de un caso ya diagnosticado (tabla 2) y se debe evaluar a los pacientes que desarrollan sintomatología (digestiva y/o extradigestiva) sugerente de la enfermedad. El diagnóstico se basa en5,19:
1. Información clínica sugerente, a excepción de ser un caso evaluado por búsqueda activa por pertenecer a un grupo de riesgo.
2. Anticuerpos IgA-tTG2* y/o IgA-EMA positivos* e IgA sérica normal**
3. Biopsia de intestino delgado*** con daño moderado a grave de la mucosa (categorías de Marsh 2 o más).
*Hoy en día, tTG2 es el autoantígeno más usado para estudios serológicos. Su medición es cuantitativa, mediante un test de ELISA, que mide la cantidad de anticuerpos presente en la sangre; su sensibilidad y especificidad están descritas en alrededor del 90%. Los kit desarrollados en años recientes usan anticuerpos dirigidos a nuevos epítopes, distintos a los originalmente usados, y están resultando más sensibles que las versiones iniciales. El endomisio es la matriz extracelular donde se expresa la tTG2. La determinación de EMA es cualitativa, se mide por inmunofluorescencia y demuestra la presencia o ausencia de anticuerpos. La sensibilidad descrita para IgA-EMA está entre el 86 y el 90% y la especificidad entre el 97 y el 100%. Cuando se hacen los dos anticuerpos, si son concordantes, su sensibilidad y especificidad son cercanas al 100%.
**La deficiencia de IgA es más frecuente entre los celíacos que en la población general. Junto con los anticuerpos IgA-EMA e IgA-tTG2, en todos los casos se debe solicitar la medición de IgA sérica20. En los pacientes con deficiencia de IgA se deberá repetir la medición de los anticuerpos en sus versiones IgG-tTG y/o IgG-EMA.
***La biopsia debe hacerse -siempre- antes de indicar la dieta libre de gluten (DLG). En los familiares que se estudian porque hay un celíaco conocido en la familia, debe asegurarse que tienen una ingesta habitual de gluten al momento de ser estudiados.
Es importante comentar el debate producido por una situación de excepción establecida por ESPGHAN5: establecen que, en niños evaluados por un especialista, en presencia de clínica típica y florida, además de niveles superiores a diez veces el valor límite de la normalidad en tTG2, con EMA positivo y haplotipos de riesgo positivos (DQ2/DQ8), se puede prescindir de la biopsia intestinal para el diagnóstico. Es muy importante hacer énfasis en que el estudio serológico y la biopsia deben hacerse -siempre- antes de iniciar la DLG.
¿Qué hay de nuevo en el tratamiento de enfermedad celíaca?
La piedra angular del tratamiento es la eliminación del gluten de la dieta. La DLG evita el consumo de las proteínas de almacenaje presentes en el trigo, el centeno y la cebada y algunos híbridos de estos cereales, tales como el kamut y el triticale, de consumo excepcional en nuestro país. Diversos estudios indican que estos granos contienen los epítopes en los cuales la deamidación es importante para la unión a DQ2 y el reconocimiento por las células T, conduciendo al daño observado en la EC21,22. En la gran mayoría de los pacientes, la DLG lleva a la resolución completa de la sintomatología y de las alteraciones histológicas propias de la enfermedad. El incumplimiento de la dieta es la causa principal de la falta de respuesta al tratamiento; estos pacientes deben diferenciarse de aquellos "refractarios", o sea, que no responden a la DLG o bien dejan de responder a ella; dicho diagnóstico diferencial debe hacerlo un especialista y a nivel terciario. Por esto, la evaluación minuciosa, la orientación al momento del diagnóstico y el cuidado continuo a lo largo de la vida resultan cruciales23.
Hasta hoy, la EC no puede ser prevenida. Actualmente, el gran estudio europeo PREVENTCD está evaluando si la modalidad de alimentación durante el primer año de vida puede prevenir o al menos retardar la aparición de la enfermedad. Un estudio reciente concluyó que el riesgo de desarrollar EC se redujo a la mitad cuando la introducción inicial del gluten ocurre cuando el lactante aún recibe lactancia materna, existiendo además una correlación inversa entre la duración de la lactancia materna y el riesgo de desarrollar EC24. La recomendación actual de la ESPGHAN es introducir el gluten por primera vez en la dieta, entre los 4 y 7 meses de edad25. Este rango de edad aumentaría la probabilidad de que el lactante aún esté recibiendo leche materna, que haya una mayor eficacia de los mecanismos de inducción de tolerancia oral y una adecuada maduración de la integridad de la mucosa intestinal.
La inclusión de avena y almidón de trigo en la DLG es controversial. Estudios a corto y largo plazo en la última década, que incluyen población adulta26-28 y pediátrica29,30, sugieren que la avena se puede incluir de forma segura en alimentos "libres de gluten". Más aún, Størsrud31 encontró que el uso de avena en la DLG aumentó la ingesta de hierro, fibra dietética, tiamina y zinc en pacientes celíacos. Sin embargo, estos estudios han sido relativamente pequeños, pocos han sido doble ciego o aleatorizados y solo uno ha tenido una duración superior a un año. Independientemente de la discusión de si las prolaminas de la avena tienen efectos adversos para el celíaco, la recomendación actual es no incluir avena en la DLG, porque se han demostrado altos niveles de contaminación en las avenas comerciales (se han descrito desde 1,5 ppm hasta más de 400 ppm, haciendo las mediciones en un mismo envase32); por otro lado, aunque escasas, existen descripciones de pacientes que han demostrado ser sensibles a la avena33.
La inclusión de productos a base de almidón de trigo también es motivo de controversia. Los primeros estudios realizados en este tema fueron de tipo transversal y de corta duración, mostrando un impacto negativo en pacientes celíacos. En un estudio de desafío abierto realizado por Chartrand, se encontró que los productos "libres de gluten" que contenían almidón de trigo causaban síntomas abdominales en algunos pacientes celíacos34. Sin embargo, en otro estudio, de un año de duración y realizado en pacientes adultos asignados al azar a una DLG con o sin almidón de trigo, aunque mostró que la recuperación de la mucosa no fue completa en todos los pacientes, no demostró diferencias entre los dos grupos en la morfología de la mucosa, la densidad de linfocitos intraepiteliales, anticuerpos séricos, densidad mineral ósea y estado nutricional después de 1 año35. Actualmente, el almidón de trigo se usa en la DLG en Europa, mientras que no se recomienda en América del Norte.
Otro aspecto que comentaremos son las deficiencias nutricionales. Numerosos estudios documentan el impacto de la mala absorción de nutrientes tanto en niños como en adultos, incluso cuando no es evidente un síndrome de malabsorción36. Un estudio realizado por Bona mostró que la baja ingesta alimentaria o la mala absorción de vitaminas del complejo B, hierro y ácido fólico parecen parcialmente responsables del retraso de la pubertad en niños con EC37. En adultos, también se ha descrito correlación entre la deficiencia de zinc y gravedad del aplanamiento de las vellosidades, junto con lesiones histológicas más importantes en sujetos cuyos niveles de hierro, cobre, ácido fólico y vitamina B12 eran menores38. La ingesta de calcio, vitamina D, magnesio y fibra (especialmente la fibra soluble), están limitados en la DLG. Es importante destacar que, en Chile, los productos "libres de gluten" no están fortificados, lo que aumenta la posibilidad de deficiencias de nutrientes. Los productos "libres de gluten" en general, no slo carecen de las fortificaciones más habituales, también resultan más bajos en fibra, hierro, ácido fólico, tiamina, riboflavina y niacina39,40.
Un último tema que queremos mencionar es la malnutrición por exceso u obesidad, cada vez más frecuente como presentación inicial de la enfermedad celíaca. Un estudio de cohorte retrospectivo de 679 pacientes con enfermedad celíaca confirmada por biopsia, que se centró en las modificaciones del peso corporal en sujetos siguiendo una DLG, mostró que el índice de masa corporal (IMC) promedio fue de 24, con un bajo número de sujetos con sobrepeso y obesidad. Después de estar en una DLG de 39,5 meses (en promedio), el IMC promedio aumentó a 24,6, consiguiendo que la mayoría de los pacientes lograran un peso normal; aquellos pacientes con sobrepeso y obesidad permanecieron sin cambios41. En la práctica diaria, el riesgo de aumento de peso es frecuente, considerando que los pacientes al iniciar la DLG se sienten mejor, su intestino mejora y aprenden a comer productos sin gluten sin sentir molestias. Esta es una de la razones de por qué es importante que el paciente celíaco en su seguimiento sea manejado por el equipo de salud, incluyendo no solo al médico (gastroenterólogo y de atención primaria) sino también al nutricionista. La consejería acerca del control del peso debe ser parte de los controles nutricionales periódicos. La DLG puede ser una dieta saludable, pero frecuentemente es baja en fibra, alta en grasas y deficiente en vitaminas del complejo B; todo esto como resultado de la falta de la fortificación de las harinas utilizadas42 y el añadido de grasa para mejorar los productos elaborados sin gluten. Hoy día, en que la obesidad es la gran epidemia mundial, es responsabilidad del equipo de salud el mantener la dieta del celíaco con características saludables. Una estrategia que ha tenido buenos resultados es la de incorporar productos que contengan granos alternativos, que no contienen gluten43.
En resumen, la EC ha demostrado tener una prevalencia alta y presentaciones clínicas diversas. El acceso a anticuerpos específicos de la enfermedad y el concepto de "búsqueda activa" han mejorado sustancialmente la capacidad diagnóstica, aunque hay que tener presente que si no se conocen los niveles de IgA del paciente, los exámenes habituales (IgA-ENMA e IgA-tTG2) pueden dar en falsos negativos. De su patogenia se sabe que existen factores genéticos (presencia de HLA-DQ2/DQ8) que dan la susceptibilidad, pero no explican la enfermedad en su totalidad. El diagnóstico -salvo excepción- continúa basándose en la biopsia de intestino delgado. La biopsia debe hacerse siempre antes de iniciar la dieta sin gluten, mientras el paciente tiene una ingesta habitual de gluten. La enfermedad tiene tratamiento efectivo mediante la DLG, que debe ser permanente, estricta y por toda la vida. El paciente debe ser seguido periódicamente por el equipo de salud, especialmente médico y nutricionista, que deben mantenerlo informado de cómo llevar a cabo los controles periódicos y las indicaciones alimentarias, promoviendo -como en toda la población- una alimentación saludable que lo proteja de la obesidad.
Potenciales conflictos de interés: Sin financiamiento.
Recibido el 14 de noviembre de 2013, última versión aceptada para publicación el 10 de octubre de 2014.
Magdalena Araya
E-mail: maraya@inta.uchile.cl