Con mayor aporte de proteínas y energía en la primera semana se ha observado hipofosfemia en prematuros extremos. Los menores niveles de fósforo se han presentado en prematuros con antecedentes de restricción de crecimiento intrauterino.
ObjetivosCaracterizar los niveles plasmáticos bioquímicos en el cordón de prematuros extremos, nacidos adecuados (AEG) y pequeños para edad gestacional (PEG) y la relación con calcemia y fosfemia en la primera semana de vida.
Pacientes y métodoEstudio clínico realizado en Neonatología del Hospital Doctor Sótero del Río, en los años 2013 y 2014. Se analiza el perfil bioquímico en el cordón y la calcemia y fosfemia en los primeros 7 días de vida, registrados en la ficha clínica según fueran AEG o PEG, según las curvas de Alarcón-Pittaluga. Análisis con significación de p<0,05.
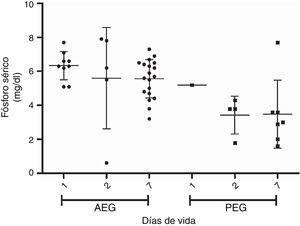
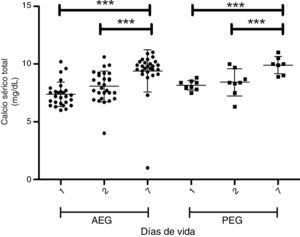
ResultadosLos niveles de colesterol, transaminasas, albúmina y creatinina fueron similares para los PEG y AEG. Los niveles de pH, fósforo, calcio, y fosfatasas alcalinas fueron menores en los PEG. El nitrógeno ureico, el ácido úrico y los triglicéridos fueron mayores en los PEG. Los PEG muestran marcada reducción de fosfemia en la primera semana, la calcemia tiende a subir proporcionalmente al descenso de la fosfemia.
ConclusionesEn prematuros extremos la desnutrición intrauterina se expresa en modificación de los niveles plasmáticos de calcio, fósforo, fosfatasas alcalinas, nitrógeno ureico, ácido úrico y triglicéridos. Posnatalmente, al recibir aporte nutricional, se manifiesta una disminución de la fosfemia y un aumento de calcemia, concordante con aportes insuficientes de fósforo durante el período.
The use of greater amounts of protein and energy during the first week of life is associated with hypophosphataemia in extreme preterm babies. The lowest phosphorus levels are described in intrauterine growth restricted (IUGR) babies.
ObjectivesTo describe biochemistry levels in cord blood plasma in extreme premature, adequate and small for gestational age babies (AGA/SGA) and their relationship with plasma calcium and phosphorus levels during the first week of life.
Patients and methodA descriptive clinical study was performed in the Neonatology Service at Hospital Dr. Sótero del Río during 2013 and 2014. A biochemical analysis of cord blood was performed on 43 premature babies, as well as plasma calcium and phosphorus levels during the first week. The adequacy for gestational age was obtained using Alarcón- Pittaluga growth curves. Statistical significance was P<.05.
ResultsCholesterol, transaminases, albumin and creatinine levels were similar for both AGA and SGA babies. Levels of pH, phosphorus, calcium and alkaline phosphatase were significantly lower in SGA babies. Urea nitrogen, uric acid and triglycerides levels were higher in SGA. The analysis during the first week showed a strong reduction in phosphorus levels, as well as an increase in calcium levels in proportion to the decrease in phosphorus in the SGA sub- group.
ConclusionsIntrauterine malnutrition in preterm babies is expressed in the modulation of plasma levels of calcium, phosphorus, alkaline phosphatase, urea nitrogen, uric acid and triglycerides. During post-natal life, when nutritional intake begins, a decrease in phosphorus and an increase in calcium levels appear, consistent with insufficient phosphorus intake during this period.
Existe poca información de las características metabólicas al nacer de los prematuros extremos, menores de 31 semanas de edad gestacional, especialmente sobre diferencias entre el prematuro con buen o mal crecimiento intrauterino. Con el uso de nutrición parenteral «agresiva»: iniciando aminoácidos en alta concentración desde el primer día de vida se ha observado mayor incidencia de hipofosfemia e hipocalemia, especialmente en el caso de restricción de crecimiento intrauterino (RCIU)1–6. Estas alteraciones metabólicas se han relacionado con el síndrome de realimentación, con ingreso de fósforo y potasio junto con los aminoácidos a la célula y un relativo hiperinsulinismo5,6. El objetivo de este estudio fue evaluar las características del perfil bioquímico al nacer, y la evolución de calcemia y fosfemia en la primera semana de vida en prematuros extremos con y sin RCIU.
Pacientes y métodoSe realiza perfil bioquímico en muestra de sangre de cordón de 43 prematuros de edad gestacional menores a 31 semanas en el Servicio de Recién Nacidos del Hospital Dr. Sótero del Río, durante los años 2013 y 2014. Las muestras fueron analizadas en el laboratorio clínico del hospital, inmediatamente de enviadas, con equipo automatizado Architec CI 8200 para análisis bioquímico, y Rapid Lab Modelo 248 de Cimes para gases sanguíneos. Se registró la información de los controles clínicos en la primera semana de vida, y los resultados de calcemia y fosfemia desde el registro de laboratorio y ficha clínica. Se clasificó en adecuados (AEG) o pequeños para edad gestacional (PEG) según el crecimiento intrauterino utilizando la curva Alarcón Pittaluga7.
El análisis estadístico se realizó por «t» de Student, Kruskal Wallis, Chi cuadrado o test de Fisher y se considera significativo un valor de p<0,05. Se utilizó programa Epi Info 6 para el análisis.
El estudio fue aprobado por el Comité de Ética y de Investigación del Servicio de Salud Metropolitano Sur Oriente.
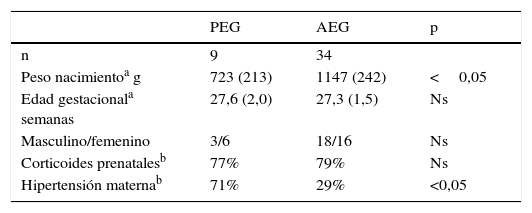
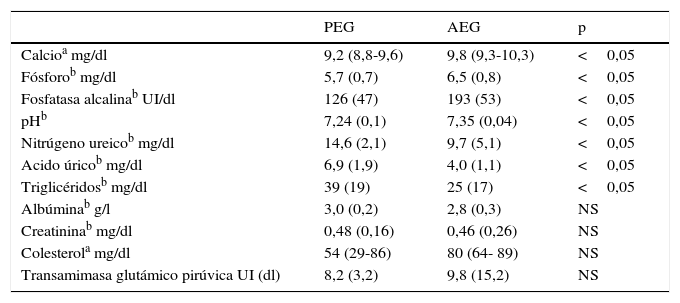
ResultadosSe ingresaron 43 casos con muestra de cordón, 9 PEG y 34 AEG. En la tabla 1 se muestran los antecedentes y las características al nacer de los grupos estudiados, que mostraron una diferencia en el peso de nacimiento y mayor frecuencia de madre hipertensa en el grupo PEG. En la tabla 2 se muestran los valores de cordón del perfil bioquímico en cada grupo. Los niveles de colesterol, transaminasas, albúmina y creatinina fueron similares para los PEG y AEG. Los niveles de pH, fósforo, calcio y fosfatasas alcalinas fueron significativamente menores en los PEG que en los AEG. Los niveles de triglicéridos, nitrógeno ureico y ácido úrico fueron más elevados en los PEG.
Resultados de análisis de muestras de cordón en PEG y AEG
| PEG | AEG | p | |
|---|---|---|---|
| Calcioa mg/dl | 9,2 (8,8-9,6) | 9,8 (9,3-10,3) | <0,05 |
| Fósforob mg/dl | 5,7 (0,7) | 6,5 (0,8) | <0,05 |
| Fosfatasa alcalinab UI/dl | 126 (47) | 193 (53) | <0,05 |
| pHb | 7,24 (0,1) | 7,35 (0,04) | <0,05 |
| Nitrúgeno ureicob mg/dl | 14,6 (2,1) | 9,7 (5,1) | <0,05 |
| Acido úricob mg/dl | 6,9 (1,9) | 4,0 (1,1) | <0,05 |
| Triglicéridosb mg/dl | 39 (19) | 25 (17) | <0,05 |
| Albúminab g/l | 3,0 (0,2) | 2,8 (0,3) | NS |
| Creatininab mg/dl | 0,48 (0,16) | 0,46 (0,26) | NS |
| Colesterola mg/dl | 54 (29-86) | 80 (64- 89) | NS |
| Transamimasa glutámico pirúvica UI (dl) | 8,2 (3,2) | 9,8 (15,2) | NS |
Durante la primera semana la calcemia fue sistemáticamente controlada (43 casos), pero la fosfemia fue menos controlada (26 casos), ya que este control acababa de establecerse como práctica clínica en la primera semana de vida.
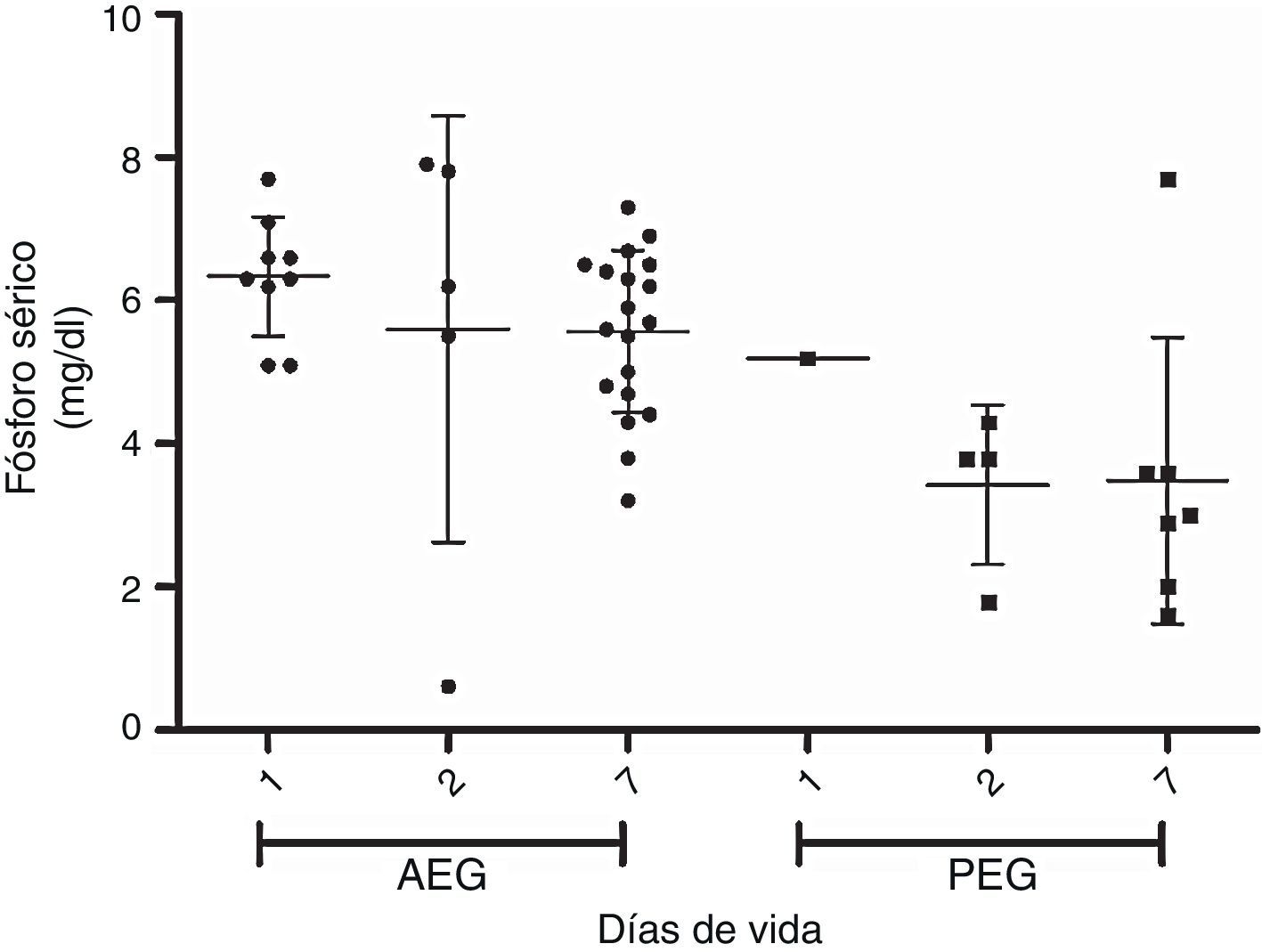
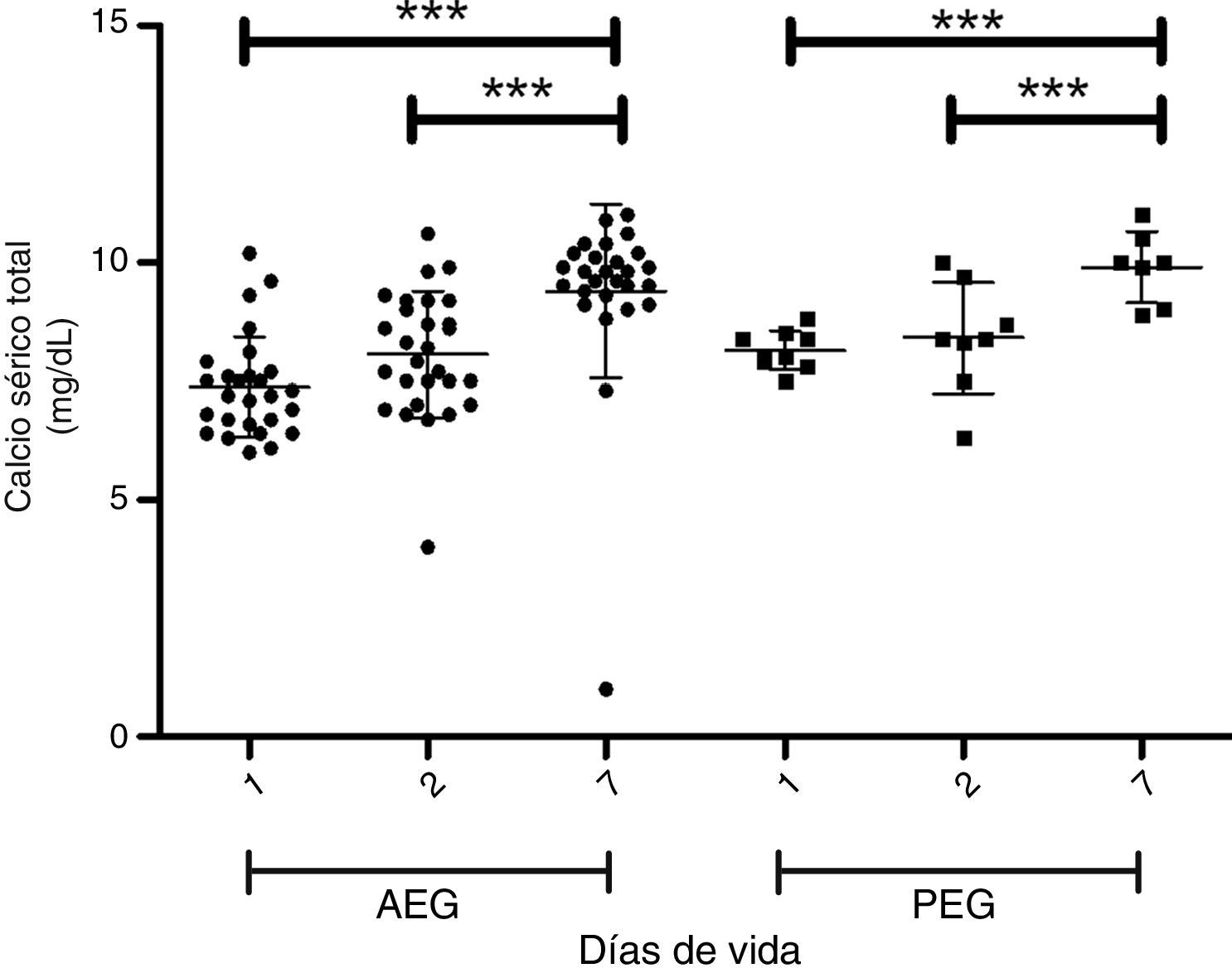
En las figuras 1 y 2 se muestra la evolución de la fosfemia y la calcemia en la primera semana de vida para los PEG y AEG, observándose una marcada reducción de la fosfemia en los PEG, que es significativa a los 7 días comparando con los adecuados. Dos de 34 casos AEG y 6 de 9 presentan PEG presentan hipofosfemia severa (<4mg/dl) en la primera semana de vida (test de Fisher p<0,05). La calcemia aumenta progresiva y significativamente en la primera semana de vida en ambos grupos.
El grupo PEG tuvo una frecuencia significativamente mayor de síndrome hipertensivo del embarazo, lo que es esperable (tabla 1). Se analizaron las diferencias en cordón según fueran SHE o no; se observaron niveles mayores de nitrógeno ureico y acido úrico en el grupo de hijos de SHE (nitrógeno ureico× [ds]: 15,5 [6,5] vs 8,1 [2,3]; ácido úrico: 5,9 [1,8] vs 3,8 [0,7]). Los resultados bioquímicos no mostraron diferencias significativas, como tampoco se observaron diferencias en los niveles de cordón por género.
DiscusiónSon interesantes las diferencias encontradas en los prematuros extremos según adecuación para la edad gestacional, que en general coinciden con diferentes reportes de la literatura. Lo que no logramos encontrar fueron datos de niveles de fósforo a nivel fetal o al nacer en prematuros extremos.
Los menores niveles de fósforo en el RCIU no están reportados, y su fisiopatología tampoco. La disminución de calcio está ampliamente reportada, probablemente relacionada con la disminución de la paratohormona placentaria. La placenta produce isoenzimas de fosfatasas alcalinas, por lo que es probable que la disminución observada en los PEG se deba a disfunción placentaria8. Los niveles de fosfatasa alcalina placentaria en niños de término están asociados directamente al peso del RN9.
La comparación de los niveles serológicos de prematuros extremos AEG o PEG permite anticipar mayores riesgos metabólicos en el prematuro PEG, como sería la hipofosfemia al aportar proteínas y energía desde el primer día, en cantidades que producen anabolismo, potenciando la presentación de un síndrome de realimentación. Dado un aporte alto de proteínas, en insuficiente aporte de electrolitos y minerales y mediado por insulina se produce entrada de fósforo, potasio y magnesio intracelular, con reducción de los niveles séricos de los mismos. En caso de déficit de fósforo este es primariamente orientado a metabolismo celular, aun a expensas de reabsorción ósea10. Como consecuencia de la hipofosfatemia, aumenta la 1,25 (OH)2 vitamina D, produciendo hipercalcemia e hipercalciuria, y disminuyendo la secreción de PTH11. El aumento de la calcemia puede ser marcado, ya que el calcio puede no ser excretado adecuadamente a nivel tubular en las primeras semanas en el prematuro12,13. El fosfato es el principal anión intracelular. Es componente de estructuras esencial de los fosfolípidos de membrana, ácidos nucleicos, nucleoproteínas. Su función metabólica en el metabolismo energético a través de la adenosina trifosfato, 2-3 difosfoglicerato y creatinfosfocinasa determina los importantes efectos colaterales de su déficit, observables en el tono y actividad muscular14. Además tiene un rol en el control ácido base, en el crecimiento celular y en la migración de los fagocitos y células inmunológicas. Clínicamente el recién nacido se ve comprometido e impresiona séptico. La asociación de hipofosfemia con hipercalcemia puede determinar un serio compromiso del tono y actividad muscular y dificultades para la retirada de la ventilación asistida por esta causa. Se ha planteado que parte del mayor riesgo de DBP observado en el RCIU de prematuro extremo pueda estar determinado por la mayor incidencia de hipofosfemia en estos niños5. El riesgo de hipofosfemia en la primera semana de vida en el RCIU tiene RR de 7,25 (IC: 5,45-9,65)5. Se ha reportado mayor incidencia de sepsis en un estudio aleatorizado de nutrición con altos aminoácidos, y en un estudio observacional recientemente publicado la hipofosfemia se asoció a mayor frecuencia de sepsis4,15.
La hipofosfemia con hipercalcemia precoz fue reportada por Lyon en 1984, en prematuros alimentados con leche materna y sin suplemento habitual de fósforo y aporte de calcio en los primeros 3 días, con un muy escaso aporte parenteral. Al suplementar fósforo el calcio cae13. El alto aporte de aminoácidos en la primera semana es el principal factor en los niveles de fosfemia y calcemia observados en un análisis secundario de diferentes aportes de macronutrientes en la nutrición parenteral del prematuro6 Aportar más de 2g/kg/día de AA triplica el riesgo de observar hipofosfemia severa.
En la nutrición parenteral precoz se debe considerar que se requiere aproximadamente 0,3mmol de fosfato por cada gramo de proteína retenida, además el PEG viene con niveles menores que hay que corregir16. Cristmann ha reportado que se requiere un aporte mayor de fósforo precoz para evitar hipofosfemia la primera semana, por lo que la relación CA y P debiera ser entre 1:1 y 1:1,6 en mmol17. El control de calciuria y fosfaturia permite ajustar los aportes16,17.
Los mayores niveles de nitrógeno ureico y ácido úrico pueden estar causados por el síndrome hipertensivo materno. Dado el tamaño de la muestra no fue posible hacer un análisis de regresión en relación con la influencia del SHE o PEG en los niveles bioquímicos.
El aumento de los niveles de triglicéridos en prematuros con RCIU está ampliamente reportado en la literatura, con estudios de cordocentesis18–20. También se reporta reducción de los niveles de colesterol, que en este caso no fue significativo, dada la variabilidad del nivel y el tamaño de la muestra. El aumento de los triglicéridos en el RCIU está reportado en conjunto con hipoxemia, hipercapnia, acidosis e hiperlactacidemia19. Se ha sugerido que la hipertrigliceridemia puede deberse a inhabilidad de hidroxilar los triglicéridos e incorporar al tejido adiposo20. La síntesis de colesterol se realiza fundamentalmente en el compartimento fetal, con escasa transferencia placentaria. Los niveles de colesterol caen paralelamente al oxígeno en el cordón en los prematuros con RCIU; se ha propuesto que se produce una menor síntesis hepática con la hipoxemia21. A nivel placentario se ha observado reducción de la lipasa lipoproteica y de la lipasa endotelial, lo que es paradójico para la hipertrigliceridemia, pero los mecanismos de transporte son complejamente regulados y el transporte de lípidos no está bien aclarado22.
La debilidad del estudio es que no todos los casos con niveles de cordón tuvieron control seriado de fosfemia después del nacimiento, dado que estos datos se obtuvieron según la práctica clínica y no fueron tomados en la perspectiva del estudio. La mayoría de los centros neonatales recién está incorporando la medición de fosfemia precoz, siendo solo habitual evaluarla en el período de crecimiento para controlar el riesgo de enfermedad metabólica ósea. La otra debilidad es que no todos los valores bioquímicos de cordón fueron determinados en todas las muestras de cordón, dado que el laboratorio solo realiza los exámenes individualmente solicitados. Los casos fueron clasificados como PEG y AEG, cuando idealmente debiéramos haber considerado el diagnóstico de RCIU por ecografías fetales seriadas, pero una minoría de pacientes tenían un estudio seriado para esta consideración. Hemos planteado que la diferencia está determinada por la RCIU, y el peso bajo el percentil 10 no necesariamente está determinado por un RCIU, como es el caso de pequeños constitucionales. Por otra parte, algunos AEG pueden haber tenido un RCIU con una caída en el crecimiento que no alcanza a estar bajo el percentil 10. Reunir un mayor número de PEG habría sido deseable, pero fueron de un 20% del estudio, lo que sugiere una muestra no sesgada.
La fortaleza es que no encontramos reportes previos de fosfemia fetal en RCIU o PEG, y el hecho que esté disminuida plantea la necesidad de un control precoz y seriado que no estaba incorporado en las prácticas clínicas habituales. Esta publicación pone de relevancia la necesidad del control seriado y de una intervención nutricional adecuada que minimize el riesgo de presentar hipofosfemia y las consecuencias clínicas que determina.
ConclusiónLa presentación de hipofosfemia en la primera semana de vida es un aspecto relevante en el prematuro extremo, sobre todo en el PEG, que ya tiene menor fosfemia desde la vida intrauterina. El control seriado de fosfemia debe incorporase con el control de calcemia, que es habitual en la primera semana de vida en el prematuro extremo, de manera de prevenir el riesgo de un descenso marcado modificando el aporte parenteral de calcio y fósforo.
Los aportes parenterales en la primera semana, especialmente en el PEG, requieren ser revisados11,16,17 Una relación 1:1,3 o 1,6 en mmol de calcio y fósforo en la nutrición parenteral parece más adecuado en el extremo prematuro con RCIU versus 1:1 a 1,3:1 habitualmente recomendada. Controlar precozmente la fosfemia y seguir monitorizando los aportes con calciuria y fosfaturia permitirá evitar el riesgo de desequilibrios.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.
A matronas y técnicos de la unidad de observación que contribuyeron a la obtención de muestras de cordón.