La enfermedad celíaca (EC) es un trastorno sistémico inmune mediado por la ingesta de gluten en individuos genéticamente susceptibles. Se caracteriza por manifestaciones clínicas variables, auto anticuerpos anti-endomisio, anti-transglutaminasa (tTG) y/o anti-péptidos de gliadina deamidados (PGD) en sangre, más daño variable de la mucosa intestinal. En Chile el 0,76% de los mayores de 15 años tiene IgA-tTG positiva y la prevalencia de EC se estima en ∼0,6%. En familiares de primer grado de celíacos se ha identificado ∼17% de casos tTG positivos. Hasta hoy el único tratamiento es la dieta libre de gluten (DLG), que para ser efectiva debe ser estricta, permanente y durante toda la vida. La DLG no contiene cero gluten, sino que lo disminuye hasta un «punto de corte», que en Chile es 3ppm (o mg/kg de producto). La mortalidad de la EC es mayor que la de la población general, y la falta de adherencia al tratamiento se asocia a complicaciones (procesos autoinmunes y cáncer principalmente). La DLG es difícil de mantener estrictamente, y las transgresiones son por lejos la principal causa de falta de respuesta al tratamiento. El seguimiento también es difícil, porque no existen marcadores objetivables que midan la adherencia. En la práctica clínica se utiliza la medición de auto anticuerpos anti-endomisio, tTG y/o PGD; más recientemente se están evaluando las entrevistas por una nutricionista especializada, cuestionarios validados y la medición de péptidos 33-mer en heces como alternativas o complementos de la evaluación de adherencia. En este artículo se revisan las herramientas de seguimiento actualmente utilizadas, poniendo énfasis en aquellas disponibles en Chile.
Coeliac disease (CD) is a systemic autoimmune disorder triggered by gluten consumption in genetically susceptible individuals. It exhibits several clinical features, such as blood auto-antibodies (anti-endomysial antibodies EMA, anti-transglutaminase antibodies tTG, anti-deamidated gliadin peptides PGD), plus variable degrees of damage in the small intestinal mucosa. In Chile, tTG is positive in 0.76% in individuals >15 years, with the prevalence of CD being estimated at 0.6%. Approximately17% of first-degree relatives of coeliac patients have been reported tTG positive. To date, the gluten free diet (GFD) is the only known treatment for CD. To be effective, this must be lifelong, permanent, and strict. Gluten content in the GFD is not zero, but is limited to a cut-off of 3ppm (ormg/kg of product) in Chile. Mortality higher than that of the general population has been reported among coeliac patients, and poor adherence to GFD is associated with complications (mainly autoimmune processes and cancer). GFD is difficult to maintain strictly and poor adherence is by far the main cause of lack of response to treatment. Follow-up of adherence is also difficult because there are no objective measurements to assess it. In clinical practice determination of serum EMA, tTG and PGD is routinely used for these purposes, although more recently, the interview by an expert dietitian, validated questionnaires and measurement of faecal 33-mer peptide are being assessed as alternatives or complements to measure adherence to GFD. A review is presented with the current concepts on the available tools to follow up patients on GFD, emphasising those available in Chilel.
La enfermedad celíaca (EC) es un trastorno sistémico inmune mediado por la ingesta de gluten y prolaminas relacionadas en individuos genéticamente susceptibles. Se caracteriza por la presencia de una combinación muy variable de manifestaciones clínicas, la presencia de anticuerpos específicos en sangre, principalmente anti-endomisio (EMA), anti-transglutaminasa (tTG) y anti-péptidos de gliadina deamidados (PGD), y daño también variable de la mucosa intestinal1. La disponibilidad de pruebas serológicas de alta precisión, sumadas a las biopsias de intestino delgado que confirman el diagnóstico, llevó a un aumento de la frecuencia global de los diagnósticos hechos, de cifras de 1:1.500 a 1:3.000 descritas hace algunas décadas, a 0,5% a 1% de la población2. En Chile el 0,76% de la población tiene IgA-tTG positivo («población susceptible»), y la prevalencia de la enfermedad propiamente dicha se estima actualmente en ∼0,6%3. Entre familiares de primer grado de celíacos se ha identificado un ∼17% de casos tTG positivo4.
La EC tiene tratamiento altamente efectivo, la dieta libre de gluten (DLG)5, que lleva a la resolución de la sintomatología y de las alteraciones histológicas propias de la enfermedad en la gran mayoría de los casos5,6. Para ser efectiva la DLG debe ser estricta, permanente y mantenida durante toda la vida. Esta dieta excluye el consumo del gluten del trigo, centeno y cebada y algunos híbridos de estos cereales (kamut y el triticale)7. Sin embargo, «libre de gluten» no significa que el gluten se elimina en el 100% de la dieta, sino que debe estar en cantidades por debajo de lo que se conoce como «punto de corte», que en Chile actualmente es 3ppm (o 3mg/kg de producto). La falta de tratamiento se asocia a complicaciones como desarrollo de procesos autoinmunes y cáncer. También se ha reportado que los celíacos tienen mayor tasa de mortalidad que la esperada. El incumplimiento de la DLG es la principal y gran causa de la falta de respuesta al tratamiento7,8, por lo que es crucial para el tratamiento hacer seguimiento de la DLG. Esto es difícil porque no existen marcadores objetivables que la midan. Durante la última década ha aumentado la frecuencia de 2 cuadros cercanos, pero hasta ahora considerados distintos a la EC, la sensibilidad al gluten no celíaca y la alergia al trigo9, los que junto al síndrome de intestino irritable, efectos de Fermentable Oligo-Di-Monosaccharides and Polyols y otras intolerancias alimentarias han hecho más complejo, tanto el diagnóstico diferencial como el seguimiento de los pacientes, ya que los requerimientos de adherencia a la DLG varían según cada cuadro. Esto también ha hecho más notorio el dilema de cómo medir adherencia, poniendo en evidencia la gran frecuencia de aplicación de criterios errados. Por esto es que hemos considerado de interés revisar las herramientas de seguimiento disponibles para evaluar la adherencia a la DLG, enfocada a la EC, analizando el contexto en que se usan y poniendo especial énfasis en aquellos métodos que están disponibles en nuestro país.
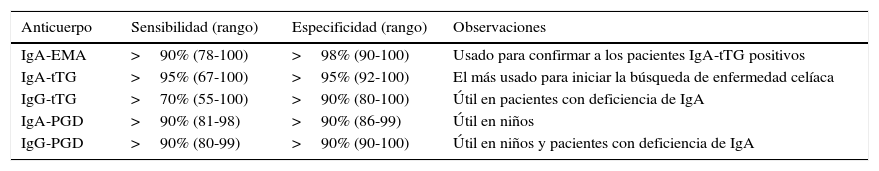
SerologíaDesde la década de los 80 está disponible la medición de los anticuerpos séricos tTG y EMA (tabla 1)10,11. Aunque los resultados pueden diferir dependiendo del laboratorio, en general su sensibilidad y especificidad es alta, mayor al 90% (tabla 2). Más recientemente, los anticuerpos PGD han demostrado tener también alta sensibilidad y especificidad, pero aún existen resultados controversiales12,13. En nuestro país, en la actividad clínica habitual la adherencia a la DLG se mide mediante tTG, con menor frecuencia EMA, y en general PGD no están libremente disponibles a la población.
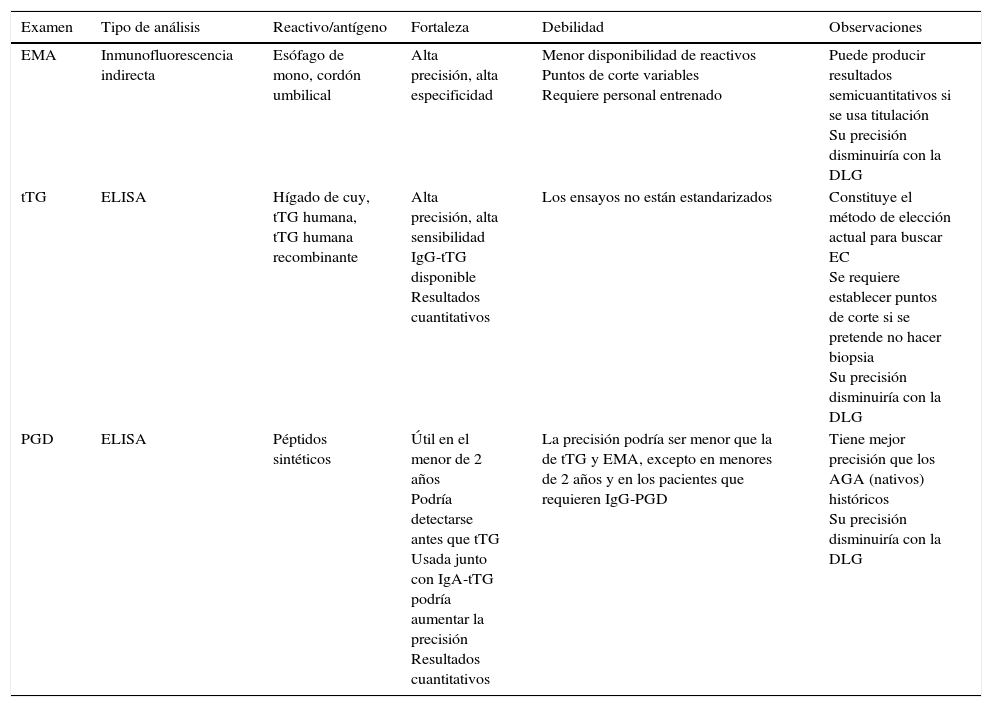
Características de los anticuerpos antiendomisio, anti-transglutaminasa y anti-péptidos de gliadina deamidada utilizados para diagnóstico y seguimiento de la enfermedad celíaca
| Examen | Tipo de análisis | Reactivo/antígeno | Fortaleza | Debilidad | Observaciones |
|---|---|---|---|---|---|
| EMA | Inmunofluorescencia indirecta | Esófago de mono, cordón umbilical | Alta precisión, alta especificidad | Menor disponibilidad de reactivos Puntos de corte variables Requiere personal entrenado | Puede producir resultados semicuantitativos si se usa titulación Su precisión disminuiría con la DLG |
| tTG | ELISA | Hígado de cuy, tTG humana, tTG humana recombinante | Alta precisión, alta sensibilidad IgG-tTG disponible Resultados cuantitativos | Los ensayos no están estandarizados | Constituye el método de elección actual para buscar EC Se requiere establecer puntos de corte si se pretende no hacer biopsia Su precisión disminuiría con la DLG |
| PGD | ELISA | Péptidos sintéticos | Útil en el menor de 2 años Podría detectarse antes que tTG Usada junto con IgA-tTG podría aumentar la precisión Resultados cuantitativos | La precisión podría ser menor que la de tTG y EMA, excepto en menores de 2 años y en los pacientes que requieren IgG-PGD | Tiene mejor precisión que los AGA (nativos) históricos Su precisión disminuiría con la DLG |
EC: enfermedad celíaca; EMA: anticuerpos antiendomisio; PGD: anticuerpos anti-péptidos deamidados de gliadina; tTG: anticuerpos antitransglutaminasa; AGA: anticuerpos antigliadina; DGL: dieta libre de gluten.
Sensibilidad y especificidad de los anticuerpos EMA, tTG y PGD
| Anticuerpo | Sensibilidad (rango) | Especificidad (rango) | Observaciones |
|---|---|---|---|
| IgA-EMA | >90% (78-100) | >98% (90-100) | Usado para confirmar a los pacientes IgA-tTG positivos |
| IgA-tTG | >95% (67-100) | >95% (92-100) | El más usado para iniciar la búsqueda de enfermedad celíaca |
| IgG-tTG | >70% (55-100) | >90% (80-100) | Útil en pacientes con deficiencia de IgA |
| IgA-PGD | >90% (81-98) | >90% (86-99) | Útil en niños |
| IgG-PGD | >90% (80-99) | >90% (90-100) | Útil en niños y pacientes con deficiencia de IgA |
EMA: anticuerpos antiendomisio; IgA: inmunoglobulina A; PGD: anticuerpos antipéptidos deamidados de gliadina; tTG: anticuerpos antitransglutaminasa.
Este examen se basa en que los pacientes celíacos desarrollan anticuerpos contra la transglutaminasa tisular presente en la mucosa intestinal, detectables mediante una técnica de ELISA (tabla 1)1. Son altamente sensibles y específicos, y en la actualidad se usan para iniciar la búsqueda de la EC (tabla 2)1,10. Los resultados de tTG deben ser informados como valores numéricos, junto con la especificación de la clase de inmunoglobulina (Ig) medida, el fabricante, el valor de corte definido para el kit específico y los niveles considerados altos, limítrofes y bajos1,10. Los informes que expresan los resultados como «mayor de» impiden evaluar la evolución de pacientes que al diagnóstico tienen valores muy altos, por ejemplo sobre 160U, y que pueden demorar meses o años en lograr valores por debajo del punto de corte. Para la interpretación de los resultados se debe tener en cuenta el nivel de IgA sérica, la edad del paciente, el patrón de consumo de gluten y la ingesta de fármacos inmunosupresores. Si la exposición al gluten fue por un corto período, o si el paciente ya había retirado el gluten de la dieta por un período de tiempo mayor de 2 semanas antes de realizar la determinación, el resultado negativo no es fiable1, y el paciente debe someterse a un período de consumo de gluten previo a la realización de la tTG. Los kits recientemente desarrollados usan anticuerpos dirigidos a nuevos epítopes, distintos a los originalmente usados, buscando ser más sensibles que las versiones iniciales.
Habitualmente los valores de tTG están elevados en el momento del diagnóstico y luego bajan hasta quedar por debajo del punto de corte en el plazo de 6 a 24 meses de DLG1, en la gran mayoría de los pacientes, aunque entre los pacientes adultos hay mayor porcentaje de casos en que tTG permanece alto5. Se utilizan primero para hacer el rastreo (screening) previo a la biopsia y luego para el seguimiento del paciente y su dieta. Actualmente, y a menos que se especifique lo contrario, los laboratorios clínicos miden las versiones IgA-tTG. Esto explica la necesidad de, además, medir inicialmente la IgA total sérica para evitar falsos negativos. En sujetos con deficiencia de IgA sérica se debe repetir el examen determinando la versión IgG-tTG1,5,14. Varios estudios sugieren que altas concentraciones de tTG en el suero pueden predecir atrofia vellositaria mejor que valores bajos o límite1,10,15. Estos estudios sugieren que niveles altos de tTG pueden ser definidos como aquellos que exceden 10 veces el límite que define la normalidad para ese laboratorio.
Anticuerpos antiendomisio (EMA)La base para esta medición es que los celíacos expuestos a gliadina producen anticuerpos contra el endomisio de las fibras musculares. Estas se pueden detectar en las capas musculares de esófago de mono, donde genera un patrón de tinción específico de las fibras que circundan los paquetes de células de músculo liso, visualizables por inmunofluorescencia indirecta (tabla 1)10,16. En general, la determinación es cualitativa (presencia/ausencia) y mide versiones IgA-EMA. Los resultados deben incluir la especificación de la clase de Ig utilizada, la dilución de corte, interpretación (positivo o negativo), dilución más alta usada para definir positividad y el tejido sustrato cuando no se usa esófago de mono. La prueba se evalúa por medio de un microscopio de inmunofluorescencia indirecta, y por lo tanto depende del observador. Esto se considera su principal limitación, pero aun así la sensibilidad descrita para IgA-EMA es entre el 86-90% y la especificidad del 97% o más (tabla 2). Cuando se realizan EMA y tTG2 concomitantemente, la sensibilidad y especificidad conjuntas son cercanas al 100%1,10. Se ha descrito que en pacientes con aplanamiento vellositario total la sensibilidad de EMA es mayor que en aquellos con atrofia parcial16. Cuando se usa la medición de este u otro anticuerpo para seguir al paciente en tratamiento, se debe tomar el cuidado de medir el anticuerpo inicialmente positivo y usando los mismos métodos de laboratorio que se utilizaron anteriormente.
Anticuerpos antipéptidos deamidados de gliadinaEstos anticuerpos son los últimos que se han desarrollado13,17, y la experiencia con ellos es aún insuficiente. Después de pasar el epitelio, la deamidación selectiva de la gliadina por medio de la transglutaminasa tisular lleva a la sustitución de glutamina por ácido glutámico18, lo que cambia la carga eléctrica de la molécula y aumenta la afinidad del complejo por los bolsillos HLA de las células presentadoras de antígenos19. El examen está construido para medir la presencia del complejo formado por los péptidos deamidados y la transglutaminasa, mediante técnica de ELISA (tabla 1). Al igual que con tTG, el resultado del examen debe comunicarse como valor numérico, especificando la clase de Ig usada, el fabricante, el valor de corte definido por ese kit específico. No es suficiente expresarlo en positivo/negativo1. La sensibilidad y especificidad de PGD es alta (tabla 2), pero todavía no está claro cómo se compara con los tTG; algunos autores proponen usarlos principalmente en niños menores de 2 años de edad, mientras que otros postulan que serían de precisión diagnóstica comparable o ligeramente inferior a IgA-tTG18; sin embargo, estudios recientes sugieren que las tTG podrían ser significativamente más sensibles y específicas13. Existe también alguna evidencia que sugiere que PGD sería útil para hacer seguimiento. Monzani et al.20 encontraron en niños que tanto IgA-PGD como la medición concomitante de IgA/IgG-PGD tuvieron una sensibilidad más alta que la IgA-tTG para detectar el cumplimiento estricto de DLG, aunque la especificidad de IgA-PGD fue significativamente más baja que IgA-tTG20. Al igual que con tTG, la medición de IgG-PGD permite la identificación de los casos con déficit de IgA, con mayor sensibilidad en niños pequeños21. Se requieren más estudios para establecer hasta qué punto la medición de anticuerpos sanguíneos es eficiente para medir adherencia a largo plazo.
Inmunoglobulina A totalLa deficiencia selectiva de IgA es más frecuente entre los pacientes celíacos que en población general1. Dado que la medición habitual de tTG y PGD es en sus versiones IgA-, es fundamental que en el momento de la pesquisa inicial se mida la IgA total sérica. En aquellos pacientes identificados deficientes en IgA se debe medir IgG-tTG e IgG-PGD1,18. Se ha reportado que hay enfermedades en las que puede detectarse IgA-tTG positiva en ausencia de EC, como la giardiasis22,23, pero estos hallazgos no han sido confirmados por otros autores. Los falsos positivos también se han descrito, por ejemplo en pacientes con gammapatía monoclonal IgA, enfermedad hepática crónica, linfoma y enfermedad reumatológica18.
Biopsia intestinalConstituye el elemento clave para el diagnóstico, y en ocasiones también es necesaria para el seguimiento. La biopsia intestinal debe incluir muestras de las distintas partes del duodeno (al menos 4) y de bulbo (al menos una). Las alteraciones características de EC incluyen que el epitelio se hace cúbico pseudo estratificado y con el ribete estriado poco visible o ausente, hay aumento del número de linfocitos interepiteliales (>25/100enterocitos), elongación de las criptas y aplanamiento de las vellosidades con disminución de relación altura V:C, índice mitótico aumentado, e infiltración de la lámina propria (principalmente por células plasmáticas y linfocitos). Estas modificaciones han sido clasificadas por Marsh en una graduación de 1 a 324; actualmente el criterio vigente es que para hacer diagnóstico es necesario que el daño histológico sea grado Marsh 2 o más, y que los grados 0 y 1 no son diagnósticos de EC1,5. Algunos autores, sin embargo, plantean que la infiltración epitelial por leucocitos podría representar un estado inicial de EC. Será necesario esperar nuevas evidencias que permitan confirmar o descartar esta posibilidad. En las situaciones límites es importante tomar en cuenta el resto de los datos disponibles, tanto clínicos como serológicos para decidir el diagnóstico.
El grado de los cambios histológicos de enteropatía celíaca es variable al diagnóstico, habitualmente es intenso, y en algunos casos puede ser detectable solo en el bulbo duodenal. El informe histológico debe incluir la descripción de la orientación, presencia o no de elongación de las criptas, relación altura de V:C, número de linfocitos interepiteliales por cada 100 enterocitos y la clasificación de los cambios observados según Marsh-Oberhuber. Aunque típicos de EC, estos cambios no son patognomónicos de ella, y tanto al diagnóstico como durante el seguimiento se pueden encontrar también en otras entidades, como hipersensibilidad a proteína de leche de vaca o soja, diarrea intratable de la infancia, infestación masiva por Giardia lamblia, inmunodeficiencias, esprúe tropical o sobrecrecimiento bacteriano intestinal. Aunque la clasificación de Marsh-Oberhuber es ampliamente utilizada, actualmente hay autores que cuestionan esta clasificación y se están proponiendo nuevas ideas de cómo evaluar las alteraciones histológicas25,26.
Hoy en día se acepta que un paciente ya diagnosticado y en DLG no es necesario que se someta a una nueva biopsia para reevaluación histológica. El curso habitual después del diagnóstico es que disminuyen los síntomas, los anticuerpos bajan hasta quedar por debajo del punto de corte y la histología mejora, ya sea total o parcialmente. La caída de los anticuerpos puede tomar de pocos meses a un año o algo más. Cuando la respuesta a la DLG es pobre la causa más común de ello es el incumplimiento a la dieta, ya sea por exposición voluntaria o inadvertida a alimentos que contienen gluten «oculto», o porque están contaminados con gluten9. Si se descarta la mala adherencia a la dieta se debe evaluar la posibilidad de una EC refractaria, en la cual la evaluación histológica toma nuevamente importancia. Durante el primer año de seguimiento importa más la tendencia serológica a la baja que los valores absolutos; por otro lado, considerando las variaciones de un laboratorio a otro, es aconsejable que las mediciones se realicen en un mismo lugar.
Entrevista y cuestionario de adherencia a la dietaLuego del diagnóstico el paciente y su familia deben recibir asesoría dietética profesional para aprender qué es y cómo se logra una dieta sin gluten, hecha por un nutricionista entrenado y experto en EC. Los anticuerpos tTG, EMA y PGD no son infalibles, y la evidencia indica que pueden demorarse en bajar; Nasr encontró que el 65% de los pacientes en DLG mejoraba a los 2 años, el 85,3% a los 5 años y el 89,9% luego de 5 años de seguimiento27. Dado que solo excepcionalmente se utilizan las biopsias intestinales para controlar la evolución de la enfermedad, y no hay otras herramientas capaces de medir objetivamente la adherencia a la dieta, hoy se plantea internacionalmente la posibilidad de desarrollar otros métodos capaces de medir adherencia a la DLG; en muchos países el seguimiento es responsabilidad de nutricionistas pertenecientes al equipo de salud a cargo del paciente y tienen amplia experiencia. Publicaciones recientes comparan el rendimiento de la entrevista con el médico, el nutricionista, la serología y la biopsia de duodeno, revelando la importancia de la evaluación de la dieta por un profesional experto; autores como Hall y otros postulan que «[…] la evaluación por experto, basada generalmente en una entrevista o diario de alimentación, se considera el método más objetivo y no invasivo para medir adherencia»28–31. Estas propuestas tienen la desventaja de no estar aún estandarizadas, lo que limita la precisión, reproducibilidad y comparabilidad; por otro lado, la disponibilidad de los profesionales capaces de evaluar la adherencia de manera competente es escasa.
Leffler et al. desarrollaron un cuestionario con estos propósitos, utilizando técnicas psicométricas estándar30. En estudios recientes este instrumento fue comparado con métodos que incluían la evaluación dietética y títulos de IgA-tTG; fue sensible y específico para medir adherencia a DLG, mostrando una buena correlación con mediciones de tTG-IgA y con la entrevista por experto. Los componentes del cuestionario son potencialmente válidos para cualquier población, ya que se basan en preguntas generales de síntomas, autoeficacia y hábitos de evasión del gluten. Sin embargo, los mismos autores señalan que es necesario confirmar que sea aplicable a otras poblaciones, con otras culturas e idiomas. Por otro lado, si se confirma que la puntuación de este cuestionario se correlaciona con el grado de daño intestinal, podría ser utilizado como marcador biológico para evaluar la actividad de la enfermedad.
Medición de péptido 33-merSe denomina gluten a las proteínas de almacenamiento del trigo, centeno, cebada. En individuos sanos alrededor del 98% de las proteínas de la dieta son digeridas por proteasas gastrointestinales hasta aminoácidos, dipéptidos y tripéptidos; sin embargo, las proteínas del gluten no son digeridas eficientemente por el sistema digestivo humano, y algunos péptidos, producto de digestión incompleta, permanecen en la luz digestiva. La α-gliadina 33-mer es uno de estos péptidos, altamente afín a células T. Se le considera uno de los principales responsables de la cadena de reacciones que lleva a desarrollar la enfermedad en los pacientes genéticamente susceptibles19. Recientemente, y buscando detectar péptidos tóxicos en muestras de alimentos, se desarrollaron 2 anticuerpos monoclonales (MoAbs), G12 y A132,33; luego se desarrolló una técnica de ELISA sándwich altamente sensible utilizando estos 2 MoAbs, capaz de reconocer el péptido 33-mer originado a partir de gliadinas, hordeínas y secalinas. El límite de detección fue de 0,6ng/gliadina/ml, lo que corresponde a 0,6ppm de gliadina o 1/3 de la concentración obtenida por otros métodos descritos hasta la fecha. Utilizando hidrólisis en un modelo de digestión in vitro los inmunoensayos basados en el MoAb G12 33-mer permitieron establecer que sobre el 30% de péptidos de gliadina reactivos se mantienen intactos después de la digestión enzimática fisiológica. En función de estos resultados se planteó que la detección de gluten digerido en las heces mediante estos anticuerpos sería útil en la vigilancia de DLG y ayudaría a definir los casos de EC refractaria. El mismo grupo de investigadores, en un estudio de sujetos celíacos34, pacientes con otras enfermedades digestivas y controles sanos encontraron que la medición de 33-mer fecal fue capaz de detectar gluten en sujetos sanos (controles) después de consumir dieta habitual con gluten, dieta libre de gluten y dieta con gluten agregado en cantidades conocidas (100mg gluten/día). En los pacientes celíacos recién diagnosticados y puestos en DLG se detectaron cambios en los valores medidos antes y después del inicio de la DLG, y también se pudieron detectar diferencias cuando —estando en DLG— se les desafió con pequeñas cantidades conocidas de gluten oral34.
A menudo los pacientes celíacos consideran que el consumo de hasta 50mg gluten/día no sería dañino para ellos35. En el estudio realizado por Comino et al. (2012) la ingesta de 50mg (en pan procesado) pudo ser detectada en las heces34. Aunque el método parece interesante y promisorio, para aceptarlo como método alternativo de medición de adherencia es crucial evaluar cómo influye la enorme variabilidad interindividual que presentan los celíacos, y también el rol de la microbiota intestinal, que al menos conceptualmente, a partir de su propio metabolismo, podría aportar péptidos que produzcan reacción positiva con los MoAbs propuestos, o utilizar como sustrato parte de los péptidos 33-mer, disminuyendo o anulando la positividad del examen.
Desafío con gluten o contrapruebaEn general, hoy en día el desafío con gluten no es necesario para confirmar el diagnóstico o seguir la evolución de la enfermedad1. Sin embargo, es útil: a) cuando hay mala aceptación del paciente a seguir la DLG y existe duda sobre el diagnóstico inicial o este no incluyó la biopsia intestinal, cualquiera sea la edad del paciente; y b) en adolescentes que son reticentes a seguir la DLG por no desarrollar sintomatología intensa cuando ingieren gluten. Resultados preliminares (no publicados) que la contraprueba resulta útil como herramienta de seguimiento de la enfermedad para mejorar el manejo de la DLG a lo largo del tiempo y demostrar la necesidad de tratamiento. De acuerdo a las últimas Guías ESPGHAN 2012, «se considera que un paciente ha recaído (y por lo tanto el diagnóstico de EC es confirmado) si los anticuerpos se positivizan y/o si aparece sintomatología clínica y/o histología concordante»1. Por otro lado, «en ausencia de serología (+) o de síntomas y de alteraciones histológicas detectables, para efectos prácticos el desafío es considerado completo después de 2 años, aunque hay que tener presente que el seguimiento del paciente debe continuar porque la recaída puede ocurrir posteriormente»1. Si se decide realizar una prueba de desafío debe evitarse los períodos de alta velocidad de crecimiento; siempre debe ser realizado bajo estricta supervisión, preferiblemente por un gastroenterólogo pediatra; debe ir precedido por la tipificación HLA, si es que no se ha realizado previamente y de una evaluación histológica de la mucosa duodenal. Mientras se realiza el desafío, se debe asegurar que el paciente ingiera una cantidad habitual de gluten en la dieta (15g/día). Durante el desafío se debe seguir al paciente con las versiones que correspondan de anticuerpos (IgA- o IgG-).
En resumen, aunque en la práctica clínica actual el seguimiento se basa largamente en la medición de autoanticuerpos sanguíneos (principalmente tTG), la evidencia sugiere que la serología no debiera aceptarse como gold standard, y debieran investigarse otras posibilidades que mejoren o complementen las metodologías existentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Esta actualidad forma parte de un ciclo de 5 actualidades consecutivas sobre el tema de Epigenética, a ser publicados en los números de 1 a 5 Vol. 87 de Revista Chilena de Pediatría 2016.