El uso de biomarcadores podría constituir una herramienta en el diagnóstico, pronóstico y estratificación en la sepsis. El objetivo fue analizar el valor de la procalcitonina (PCT), proteína C reactiva (PCR) y lactato en la predicción de shock séptico, mortalidad y en la estratificación en niños con sospecha de sepsis.
Pacientes y métodoEstudio prospectivo en 81 pacientes en los cuales se midió niveles plasmáticos de PCT, PCR y lactato al ingreso en la unidad de cuidados intensivos. Los pacientes se categorizaron en síndrome de respuesta inflamatoria sistémica, sepsis, sepsis grave y shock séptico.
ResultadosLas concentraciones de la PCT (ng/mL) aumentaron significativamente de acuerdo a la gravedad de la sepsis: 0,36 (0-1,2) para síndrome de respuesta inflamatoria sistémica; 1,96 (0,4-3,5) para sepsis; 7,5 (3,9-11,1) en sepsis grave; y 58,9 (35,1-82,7) para shock séptico (p<0,001). Comparada con la PCR y el lactato, el área bajo la curva ROC reveló un poder discriminativo favorable de la PCT para predecir shock séptico y mortalidad: 0,91 (IC95%: 0,83-0,97) y 0,80 (IC95%: 0,69-0,88), respectivamente.
ConclusionesA diferencia de la PCR y el lactato, la determinación de la PCT al ingreso en la unidad de cuidados intensivos es un buen predictor de shock séptico y mortalidad, y permite estratificar a los pacientes de acuerdo a la gravedad de la sepsis.
The use of biomarkers could be a tool for diagnosis, prognosis and stratifying children with sepsis. Our main goal was to analyze the value of procalcitonin (PCT), C reactive protein (CRP) and lactate in predicting mortality, septic shock and the stratification in children with suspected sepsis
Patients and methodProspective study in 81 patients. Plasma levels of PCT, CRP and lactate were measured at admission in the pediatric intensive care unit. Patients were categorized into systemic inflammatory response syndrome, sepsis, severe sepsis and septic shock.
ResultsConcentrations of PCT (ng/mL) increased significantly according to the severity of sepsis: 0.36 (0-1.2) for systemic inflammatory response syndrome; 1.96 (0.4-3.5) for sepsis; 7.5 (3.9-11.1) for severe sepsis; and 58.9 (35.1-82.7) for septic shock (P<.001). Compared to CRP and lactate, the area under the ROC curve revealed a good discriminative power of PCT to predict septic shock and mortality, 0.91 (95% CI: 0.83-0.97) and 0.80 (95% CI: 0.69-0.88), respectively.
ConclusionsIn contrast to CRP and lactate, the determination of PCT in pediatric intensive care unit admission is a good predictor of mortality and septic shock and can stratify patients according to severity of sepsis.
El shock séptico es una causa importante de mortalidad en pediatría, estimándose que cerca de 4.000 niños fallecen anualmente en EE. UU. por esta causa1. El tratamiento antibiótico precoz combinado con una adecuada estrategia hemodinámica tiene el mayor impacto en su pronóstico2.
Sin embargo, la sepsis puede ser difícil de diferenciar de la inflamación sistémica de causa no infecciosa. Ambas condiciones comparten características clínicas y de laboratorio como cambios en la temperatura, taquicardia, leucocitosis o leucopenia. Estos factores dificultan un diagnóstico temprano de la infección, por lo que el desarrollo de biomarcadores capaces de mejorar el diagnóstico de la sepsis podría eventualmente mejorar la proporción de pacientes que reciban un tratamiento efectivo y así mejorar el pronóstico3. En el contexto de ensayos clínicos intervencionales de la sepsis, el uso de un biomarcador capaz de estratificar objetivamente a pacientes de mayor gravedad permitiría elegir a aquellos pacientes para terapias más agresivas o de mayor riesgo, excluyendo así a aquellos menos graves de ser expuestos a terapias innecesarias4.
La procalcitonina (PCT) es un propéptido de la hormona calcitonina, constituido por 116 aminoácidos, desprovisto de actividad hormonal, que se eleva rápidamente en pacientes con infecciones bacterianas. La PCT es producida en todos los tejidos en respuesta a endotoxinas o mediadores liberados en infecciones bacterianas (IL-1B, factor de necrosis tumoral, IL-6). Esta respuesta se ha relacionado con la severidad de la infección, ya que en infecciones severas puede alcanzar concentraciones de 10-1.000ng/mL, niveles que decrecen rápidamente después de una terapia antibiótica adecuada. Los valores descritos con máxima sensibilidad y especificidad son<0,5ng/mL para inflamación de origen no infeccioso y >2ng/mL para sepsis bacteriana5. La PCT ha sido usada en la diferenciación entre síndrome de respuesta inflamatoria sistémica (SRIS) de origen no infeccioso y la sepsis, para determinar la progresión del síndrome séptico, evaluar la respuesta al tratamiento y estimar pronóstico6.
La proteína C reactiva (PCR) es una proteína reactante de la fase aguda, cuyos niveles plasmáticos están aumentados en enfermedades inflamatorias agudas y crónicas. Es liberada por el hígado después de una inflamación o daño tisular, siendo la IL-6 el principal estímulo para su producción7. Este biomarcador es probablemente el más usado en pacientes críticos y ha sido estudiado en adultos y niños8–9.
El lactato es un marcador de sepsis severa que se ha asociado con riego de mortalidad en el escenario prehospitalario, unidades de urgencia y unidad de cuidado intensivo (UCI)10. Niveles elevados de lactato podrían servir de herramienta de screening, identificando a pacientes con hipoperfusión tisular, antes del desarrollo de signos clínicos de shock séptico. Guías de manejo de la sepsis establecen que niveles de lactato>4mmol/L son indicativas de sepsis grave o shock séptico11.
El objetivo de la presente investigación es analizar el valor de la PCT, la PCR y el lactato en la predicción de shock séptico y mortalidad, y en la estratificación en niños con sospecha de sepsis ingresados en la UCI.
Pacientes y métodoPacientesEstudio prospectivo observacional aprobado por el comité de ética del Hospital Guillermo Grant Benavente. No se requirió consentimiento informado. Se incluyeron todos los pacientes con sospecha de sepsis ingresados en la UCI Pediátrica entre septiembre del 2009 a abril del 2011 y que no hayan recibido antibióticos sistémicos durante más de 24h. El SRIS, sepsis, sepsis severa y shock séptico se definieron usando los criterios de la International Pediatric Consensus Conference12. Se recogieron las siguientes variables: edad, género, requerimientos de volumen o fármacos vasoactivos, necesidad y duración de ventilación mecánica y estadía en la unidad en días, sitio de infección, microorganismo aislado y desenlace.
Colección de muestras sanguíneas y ensayosAl ingreso o en las primeras 24h de estadía en la UCI, se tomaron 2mL de sangre para la medición de PCT, PCR y lactato. La medición de PCT se realizó por el sistema VIDAS® BRAHMS PCT (Biomerieux, Lyon, Francia) usando la técnica Enzyme–Linked Fluorescent Assay (ELFA). Este test tiene un límite de detección analítico<0,05ng/mL con un límite de detección funcional de 0,09ng/mL. La PCR fue medida por turbidimetría (Turbitimer® Dade Behring, Marburg, Alemania). El lactato se midió utilizando un analizador de gases OMNI Roche (Basilea, Suiza). Los hemocultivos fueron procesados por el laboratorio de microbiología del Hospital Guillermo Grant Benavente usando el sistema BACTEC (Becton Dickinson MD, EE. UU.).
Análisis estadísticoSe usó el test no paramétrico de Kruskal-Wallis y comparaciones mediante la prueba de Mann-Whitney aplicando la corrección de Bonferroni. La prueba chi-cuadrado, de la probabilidad exacta de Fisher o su generalización y la prueba de Freeman-Halton se usaron para testear la relación entre variables categóricas. Además se realizó análisis de curvas receiver operating characteristic (ROC), para mortalidad y shock séptico con las variables PCT, PCR y lactato. Se llevó a cabo regresión logística para determinar las variables relacionadas con la mortalidad. Todos los valores de p fueron con 2 colas y un valor de p<0,05 fue considerado como estadísticamente significativo. Los cálculos estadísticos se realizaron con el paquete estadístico SPSS 17 (Chicago, IL, EE. UU.).
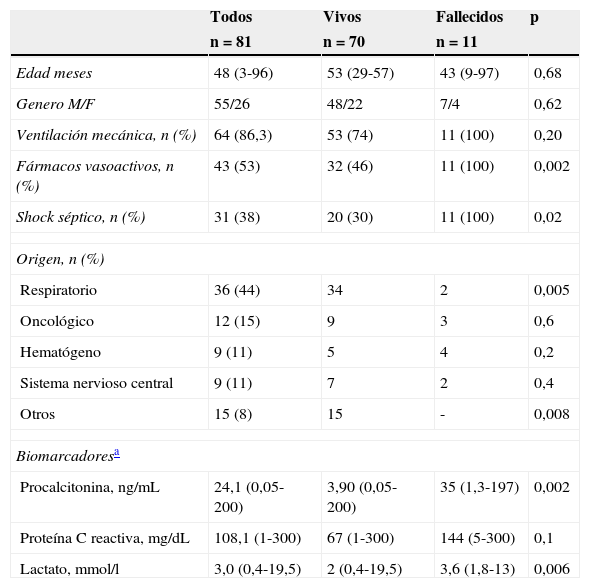
ResultadosOchenta y un pacientes fueron incluidos, 11 (13,5%) fallecieron en la UCI. El origen de la sepsis fue respiratorio en 36 (44%) casos, oncohematológico en 12 (15%) y sistema nervioso central en 9 (11%) casos. Al ingreso en la UCI, 3 (4%) pacientes cumplieron criterios de SRIS, 20 (25%) de sepsis, 27 (33%) de sepsis severa y 31 (38%) pacientes presentaron shock séptico. Se aislaron microorganismos en 41 (51%) pacientes, encontrándose bacterias gramnegativas en 24 (58%) de los casos, con predominio de Klebsiella pneumoniae. El Streptococcus pneumoniae fue la bacteria grampositiva más aislada con 8 casos.
Todos los pacientes fallecidos presentaron un shock séptico. Los niveles de la PCT al ingreso fueron significativamente más elevados (p=0,002) en aquellos pacientes que fallecieron en la UCI en comparación con los supervivientes (35 vs. 3,9ng/mL). Lo mismo ocurrió con la concentración de lactato, donde los valores fueron 3,6mmol/L para los fallecidos vs. 2mmol/L para los supervivientes (p=0,006). Los niveles de PCR no mostraron una diferencia significativa (tabla 1).
Características de los pacientes al ingreso en UCI
| Todos | Vivos | Fallecidos | p | |
|---|---|---|---|---|
| n=81 | n=70 | n=11 | ||
| Edad meses | 48 (3-96) | 53 (29-57) | 43 (9-97) | 0,68 |
| Genero M/F | 55/26 | 48/22 | 7/4 | 0,62 |
| Ventilación mecánica, n (%) | 64 (86,3) | 53 (74) | 11 (100) | 0,20 |
| Fármacos vasoactivos, n (%) | 43 (53) | 32 (46) | 11 (100) | 0,002 |
| Shock séptico, n (%) | 31 (38) | 20 (30) | 11 (100) | 0,02 |
| Origen, n (%) | ||||
| Respiratorio | 36 (44) | 34 | 2 | 0,005 |
| Oncológico | 12 (15) | 9 | 3 | 0,6 |
| Hematógeno | 9 (11) | 5 | 4 | 0,2 |
| Sistema nervioso central | 9 (11) | 7 | 2 | 0,4 |
| Otros | 15 (8) | 15 | - | 0,008 |
| Biomarcadoresa | ||||
| Procalcitonina, ng/mL | 24,1 (0,05-200) | 3,90 (0,05-200) | 35 (1,3-197) | 0,002 |
| Proteína C reactiva, mg/dL | 108,1 (1-300) | 67 (1-300) | 144 (5-300) | 0,1 |
| Lactato, mmol/l | 3,0 (0,4-19,5) | 2 (0,4-19,5) | 3,6 (1,8-13) | 0,006 |
UCI: unidad de cuidados intensivos.
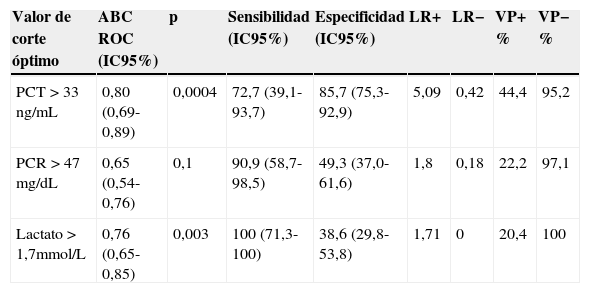
El área bajo la curva ROC reveló un poder discriminativo favorable de la PCT y el lactato de 0,80 (IC95%: 0,69-0,88) (p=0,0004) para la PCT y 0,76 (IC95%: 0,65-0,85) (p=0,003) para el lactato, respectivamente, en predecir mortalidad en la UCI. La PCR con un área bajo la curva de 0,65 (IC95%: 0,54-0,76) (p=0,1) no presentó un valor predictivo adecuado. Valores de PCT>33ng/mL presentaron una sensibilidad del 73% (IC95%: 39-93) y una especificidad del 86% (IC95%: 75-93) para predecir mortalidad en UCI con un LR positivo de 5 y un valor predictivo negativo del 95,2% (tabla 2). En el análisis de regresión logística, solo la PCT fue relevante en la predicción de mortalidad en la UCI, con un OR (IC95%) de 11 (2,4-51) (p=0,02).
Precisión diagnóstica de la procalcitonina, proteína C reactiva y lactato para mortalidad en UCI
| Valor de corte óptimo | ABC ROC (IC95%) | p | Sensibilidad (IC95%) | Especificidad (IC95%) | LR+ | LR− | VP+ % | VP− % |
|---|---|---|---|---|---|---|---|---|
| PCT>33ng/mL | 0,80 (0,69-0,89) | 0,0004 | 72,7 (39,1-93,7) | 85,7 (75,3-92,9) | 5,09 | 0,42 | 44,4 | 95,2 |
| PCR>47mg/dL | 0,65 (0,54-0,76) | 0,1 | 90,9 (58,7-98,5) | 49,3 (37,0-61,6) | 1,8 | 0,18 | 22,2 | 97,1 |
| Lactato>1,7mmol/L | 0,76 (0,65-0,85) | 0,003 | 100 (71,3-100) | 38,6 (29,8-53,8) | 1,71 | 0 | 20,4 | 100 |
ABC: área bajo curva; LR+: likelihood ratio positivo; LR−: likelihood ratio negativo PCR: proteína C reactiva; PCT: procalcitonina; ROC: receiver operating characteristic; UCI: unidad de cuidados intensivos; VP+: valor predictivo positivo; VP−: valor predictivo negativo.
Los valores de corte óptimo de los biomarcadores se obtuvieron de los análisis de la curva ROC.
Resultados expresados como porcentaje (IC95%).
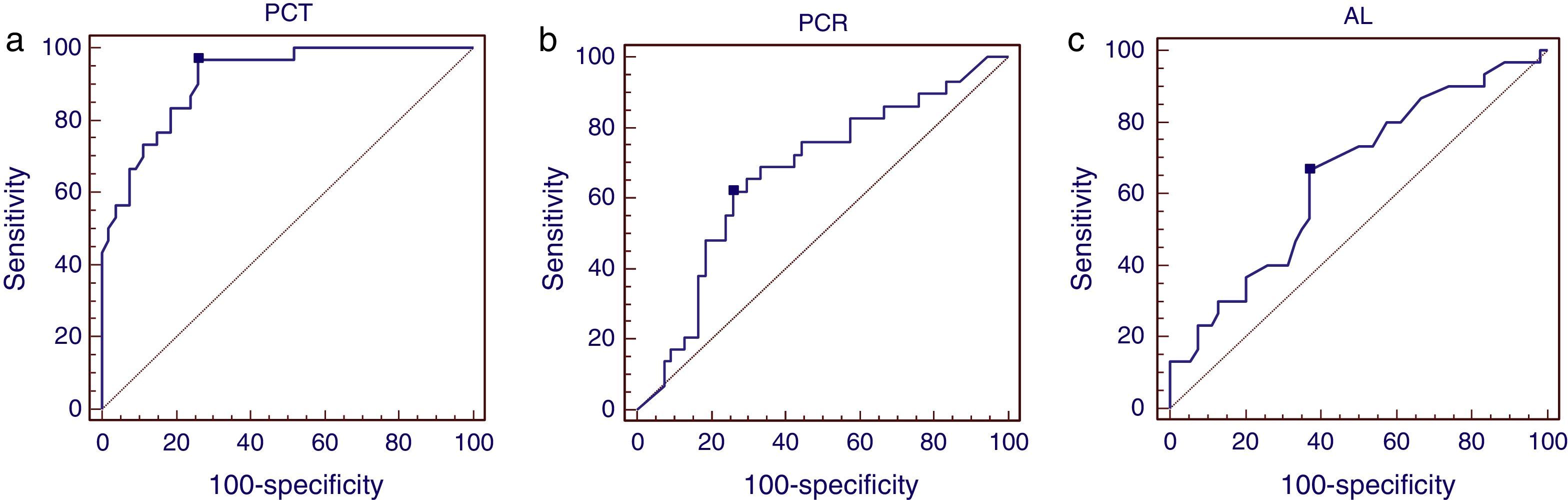
La PCT fue un excelente predictor de shock séptico, con un área bajo la curva ROC de 0,91 (IC95%: 0,83-0,97), valores de PCT>5ng/mL presentaron una sensibilidad del 97% (IC95%: 83-99) y una especificidad del 74% (IC95%: 60-85) para el diagnóstico de shock séptico. El área bajo la curva ROC de la PCR y el lactato para la predicción de shock séptico fueron de 0,67 (IC95%: 0,55-0,72) y 0,65 (IC95%: 0,53-0,75), respectivamente (fig. 1).
Figura 1a. Curvas ROC de la PCT para la predicción de shock séptico. Área bajo la curva ROC de la PCT 0,91 (IC95%: 0,83-0,97). Valor de corte optimo 5ng/mL. Sensibilidad del 97% y especificidad del 74%. Figura 1b. Curvas ROC de la PCR para la predicción de shock séptico. Área bajo la curva ROC de la PCR 0,67 (IC95% 0,55-0,72). Valor de corte óptimo de la PCR obtenido a partir de curva ROC fue de 116mg/dL, con una sensibilidad y especificidad del 62 y 74%, respectivamente. Figura 1c. Curvas ROC del lactato para la predicción de shock séptico. Área bajo la curva ROC del lactato 0,65 (IC95% 0,53-0,75). Valor de corte óptimo obtenido a partir de curva ROC 2mmol/L. Sensibilidad 67%, especificidad 63%.
El valor de corte de la PCR para el diagnóstico de shock séptico fue de 116mg/dL con una sensibilidad y especificidad del 62 y 74%, respectivamente. El valor de corte del lactato fue de 2mmol/L con una sensibilidad del 67% y una especificidad del 63%.
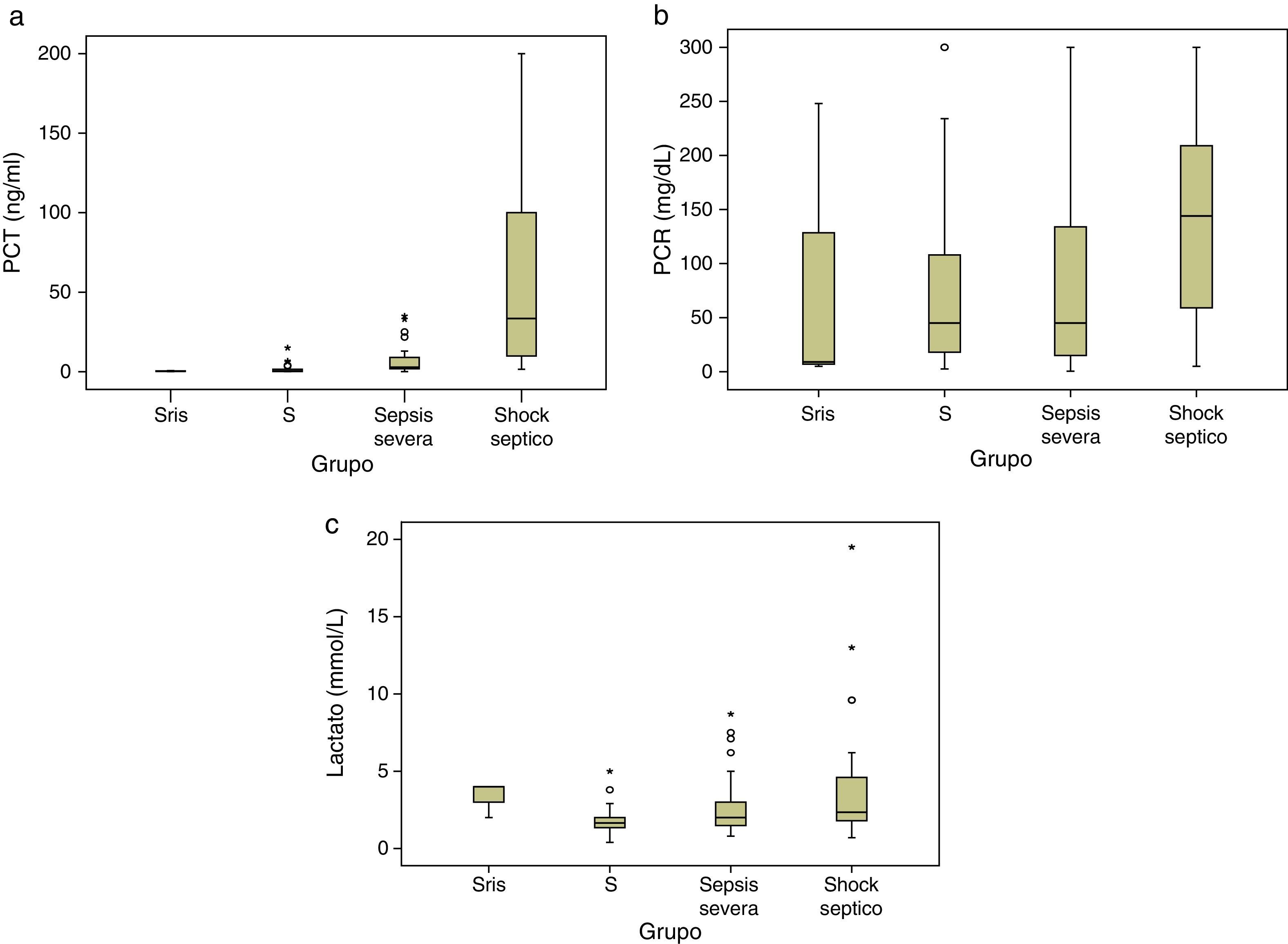
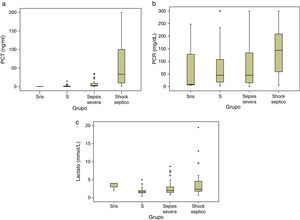
Al categorizar a los pacientes en los diferentes grupos diagnósticos se observó que las concentraciones plasmáticas de PCT (ng/mL) (IC95%) aumentaron significativamente de acuerdo a la gravedad de la sepsis en toda las categorías diagnósticas (p<0,001): 0,36 (0-1,2) para SRIS; 1,96 (0,4-3,5) para sepsis; 7,5 (3,9-11,1) para sepsis grave; y 59 (35,1-82,7) para shock séptico. Los niveles de lactato (mmol/L) fueron 3,3 (0,5-6,2); 1,8 (1,4-2,3); 2,9 (2,1-3,7) y 4,1 (2,6-5,6) para SRIS, sepsis, sepsis grave y shock séptico, respectivamente. Estos valores presentaron diferencias significativas solo entre la sepsis y el shock séptico (p<0,002). La PCR (mg/dL) no permitió estratificar a los pacientes de acuerdo a la severidad de la sepsis ya que sus valores fueron en mg/dL: 87,3 (0-433); 78,6 (42-115); 93,7 (53,7-133,7) y 146,7 (109,2-184,2) para SRIS, sepsis, sepsis grave y shock séptico (fig. 2).
Figura 2a. Box plot de niveles plasmáticos de procalcitonina, en los diferentes grupos diagnósticos. Línea central mediana, boxes percentil 25-percentil 75. p<0,05 para PCT en todas las categorías diagnósticas. Figura 2b. Box plot de niveles plasmáticos de proteína C reactiva en los diferentes grupos diagnósticos. Línea central mediana, boxes percentil 25-percentil 75. No existen diferencias significativas. Figura 2c. Box plot de niveles plasmáticos de lactato en los diferentes grupos diagnósticos. Línea central mediana, boxes percentil 25-percentil 75. p<0,05 para lactato entre sepsis y shock séptico. S: sepsis; SRIS: síndrome de respuesta inflamatoria sistémica.
En este estudio comparamos 3 biomarcadores utilizados frecuentemente en el diagnóstico de la sepsis. En contraste a la PCR y al lactato, nuestros hallazgos confirman que la medición de la PCT al ingreso en la UCI presenta el mejor valor predictivo para la mortalidad y el shock séptico. La PCT es capaz de categorizar a los pacientes de acuerdo a la gravedad del síndrome séptico.
Se ha demostrado previamente en adultos la superioridad del valor pronóstico de la PCT sobre la PCR, lactato y algunas interleucinas en la predicción de pronóstico adverso en UCI y en determinar la severidad del cuadro séptico13–15. Concordante a nuestros hallazgos, Hatherill et al., en 175 niños también describen que valores de PCT>5ng/mL al ingreso en la UCI tienen una sensibilidad del 99% y una especificidad del 78% para el diagnóstico de shock séptico con un área bajo la curva ROC de 0,96: estos valores fueron superiores a la PCR y el recuento de leucocitos16. Casado-Flores et al., en una cohorte de 80 niños ingresados en la UCI por sospecha de sepsis, reportaron que los niveles de PCT fueron más elevados en los pacientes que evolucionaron con shock séptico, falla multisistémica y que posteriormente fallecieron en la UCI. En ese estudio, la PCR no fue capaz de discriminar aquellos pacientes que evolucionaron a shock séptico17.
Nuestro estudio demuestra que los niveles de PCR no permiten diferenciar entre el SRIS y etapas más avanzadas del síndrome séptico. Rey et al., en 96 niños hospitalizados en la UCI y categorizados previamente en 6 grupos, desde ausencia de infección, infección localizada, SRIS, sepsis, sepsis severa y shock séptico, demostraron que la PCT permite una estratificación adecuada de los pacientes en los diferentes grupos diagnósticos al compararla con la PCR y el recuento de leucocitos18. Rey et al., en un estudio de 254 niños, demostraron posteriormente que concentraciones de PCT>2ng/mL en las primeras 12h en la UCI podrían identificar a aquellos niños con mayor riesgo de mortalidad19.
Una efectiva estratificación de la sepsis a través de un biomarcador puede identificar a los pacientes que son propensos a tener buenos resultados con las terapias estándar, por tanto, objetivamente se puede excluir a los pacientes de ser expuestos a terapias innecesarias20. Al excluir a pacientes con bajo riesgo de mortalidad, el riesgo-beneficio de una intervención terapéutica experimental tendría mayor posibilidad de éxito.
Algunas limitaciones de nuestro estudio son su carácter monocéntrico, con escaso número de pacientes incluidos, por lo que los resultados obtenidos no pueden ser generalizados. El valor de corte de 33ng/mL de la PCT, como predictor de mortalidad en UCI, debe ser validado en cohortes independientes de pacientes pediátricos con sepsis. El diseño de este estudio no permitió investigar los cambios temporales de los biomarcadores estudiados. Se ha sugerido que la persistencia de concentraciones elevadas o el aumento diario de la PCT se asocia a una mayor mortalidad en UCI6. Por el contrario, su aclaramiento o disminución a las 48h se relacionaría con un pronóstico favorable21. A pesar de que se hizo lo posible por obtener las muestras de los biomarcadores al ingreso de los pacientes en la UCI, muestras obtenidas varias horas después del ingreso podrían introducir un sesgo en función de la velocidad de elevación de la PCT y la PCR.
Si bien nuestros resultados apoyarían la medición de rutina de la PCT al ingreso en la UCI, especialmente en términos de capacidad de la PCT para el diagnóstico de shock séptico, no nos parece prudente asumir que la medición única de este u otro biomarcador pueda diferenciar la compleja respuesta del organismo a una infección bacteriana o a un estímulo no infeccioso22. En este contexto, el uso de una combinación de biomarcadores aparece como una aproximación promisoria para mejorar el diagnóstico de la sepsis en pacientes ingresados en la UCI con sospecha de infección23. En conclusión, la determinación de la PCT en niños con sospecha de sepsis, al ingreso en la UCI, constituye un buen predictor de mortalidad y shock séptico, permitiendo estratificar a los pacientes de acuerdo a la severidad de la sepsis.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.