La positron emission tomography (PET) cerebral con F18-FDG ha sido utilizado para estudiar epilepsias focales con alta sensibilidad en la detección del área epileptógena, aun con resonancia magnética (RM) normal. La PET ha mostrado positividad en algunos casos de síndrome de Landau-Kleffner (SLK), la mayoría de las veces evidenciando hipometabolismo temporoparietal uni o bilateral, aunque un grupo heterogéneo de alteraciones asociadas ha sido descrito. Presentamos un caso de SLK con un área hipermetabólica temporooccipital izquierda, que respondió al tratamiento, con mejoría clínica y regresión del foco hipercaptante a la PET.
Brain F18-FDG Positron Emission Tomography (PET) has been used for studying focal epilepsy, with high sensitivity in detection of epileptogenic foci, even with normal magnetic resonance imaging (MRI). Some cases of Landau-Kleffner Syndrome (LKS) have shown PET abnormalities, mostly showing uni- or bilateral temporoparietal hypometabolism, although a heterogeneous group of alterations have been described. We report a case of LKS with a left hypermetabolic temporo-occipital area that responded to treatment, with clinical improvement and remission of PET hypermetabolic focus.
La positron emission tomography (PET) cerebral utilizando 2-[18F]-2-deoxi-D glucosa (F18-FDG) ha sido utilizada en el estudio de epilepsias focales con el objeto de ayudar en la localización del foco epileptógeno y evaluar su opción quirúrgica1. El área epileptógena suele corresponder a corteza cerebral alterada morfológica o funcionalmente, que concentra en menor proporción la glucosa marcada que la corteza normal, detectándose hipometabolismo cortical correspondiente al área de la lesión, aun en casos con resonancia magnética (RM) normal2,3.
La PET cerebral se realiza habitualmente en fase interictal, es decir, sin ocurrencia de crisis epilépticas, inyectando la glucosa marcada por vía endovenosa y esperando a que esta se distribuya en el parénquima cerebral, proceso que tarda aproximadamente 30 a 45min. En caso de existir crisis epilépticas en el período periinyección del radiotrazador, es posible obtener una PET ictal, en donde la captación de F18-FDG en la lesión cortical puede ser distinta a la de la PET interictal: hipo, iso o hipercaptante dependiendo de diversos factores como la duración de las crisis, su frecuencia y su temporalidad respecto a la inyección.
El síndrome de Landau-Kleffner (SLK) es un raro tipo de epilepsia de la infancia caracterizada clínicamente por afasia y alteraciones cognitivas, que aparecen en un niño previamente sano. Todos los pacientes cursan con alteración del electroencefalograma (EEG), aunque solo un 70% de los casos se asocia a crisis convulsivas. La RM cerebral es típicamente normal4.
La PET ha mostrado positividad en algunos casos de SLK, la mayoría de las veces hipometabolismo temporoparietal uni o bilateral, aunque un grupo heterogéneo de alteraciones asociadas ha sido descrito, incluyendo compromiso frontal, occipital y talámico5-9.
En el caso reportado, el SLK se asoció a aumento de captación de F18-FDG (hipermetabolismo) temporal izquierdo en correspondencia con intensa actividad al EEG realizado durante la PET, que luego de un exitoso tratamiento revierte a discreto hipometabolismo, estando el paciente sin crisis clínicas ni actividad ictal al EEG.
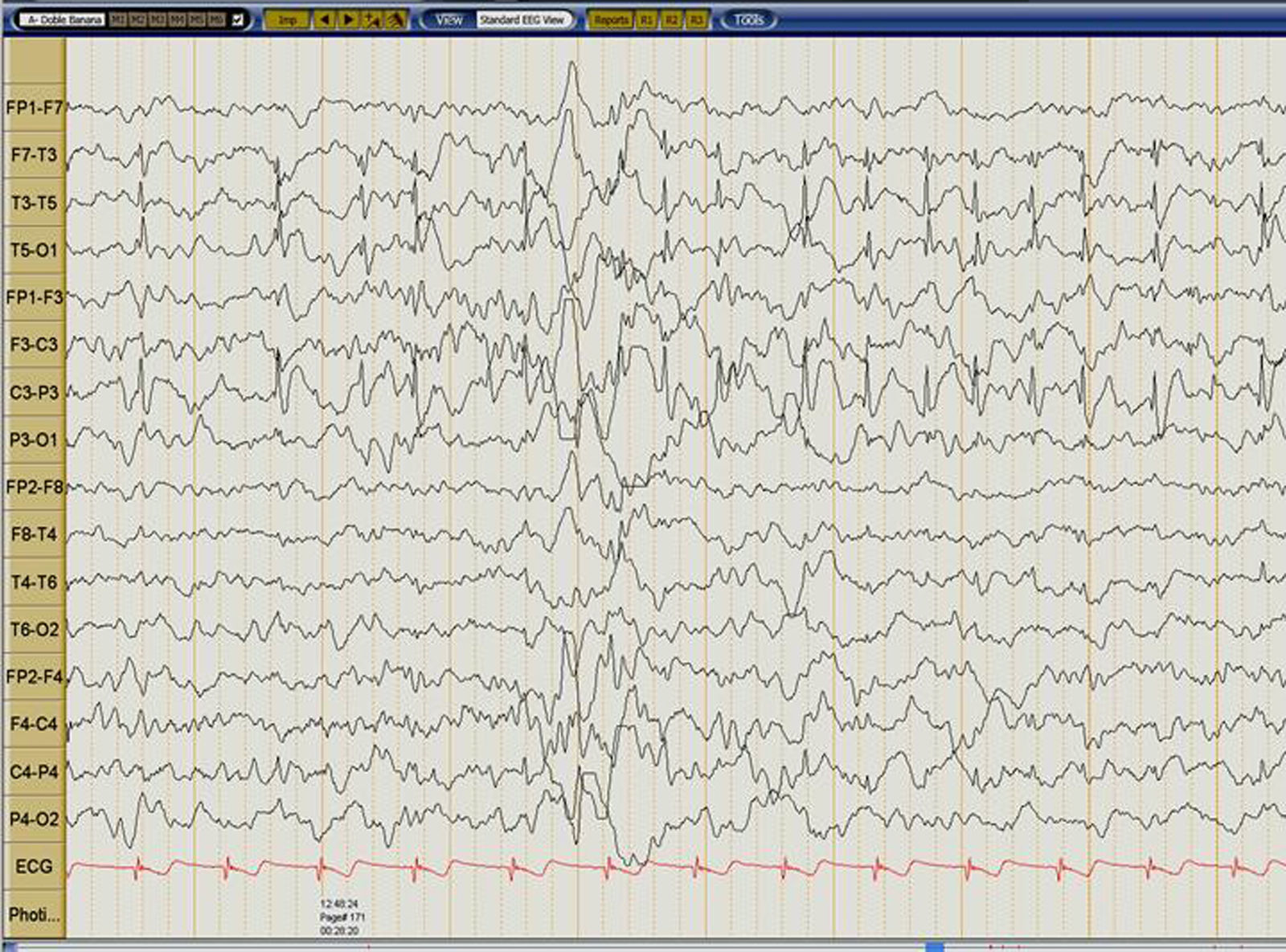
Caso clínicoPaciente varón de 6años, sano hasta los 4años y 6meses cuando inició mientras dormía crisis focal; acudió a urgencias donde presentó una segunda crisis tipo tónico-clónica generalizada. Desde entonces inició deterioro progresivo y fluctuante del lenguaje. Inició manejo con ácido valproico y clobazam sin respuesta favorable. A los 5 meses de evolución se constató evidente deterioro del lenguaje, con bradilalia importante y agnosia auditivoverbal; EEG con actividad epileptiforme fronto-centro-temporal izquierda que ocupaba más del 85% del sueño No REM compatible con un SLK (fig. 1). La RM cerebral fue normal.
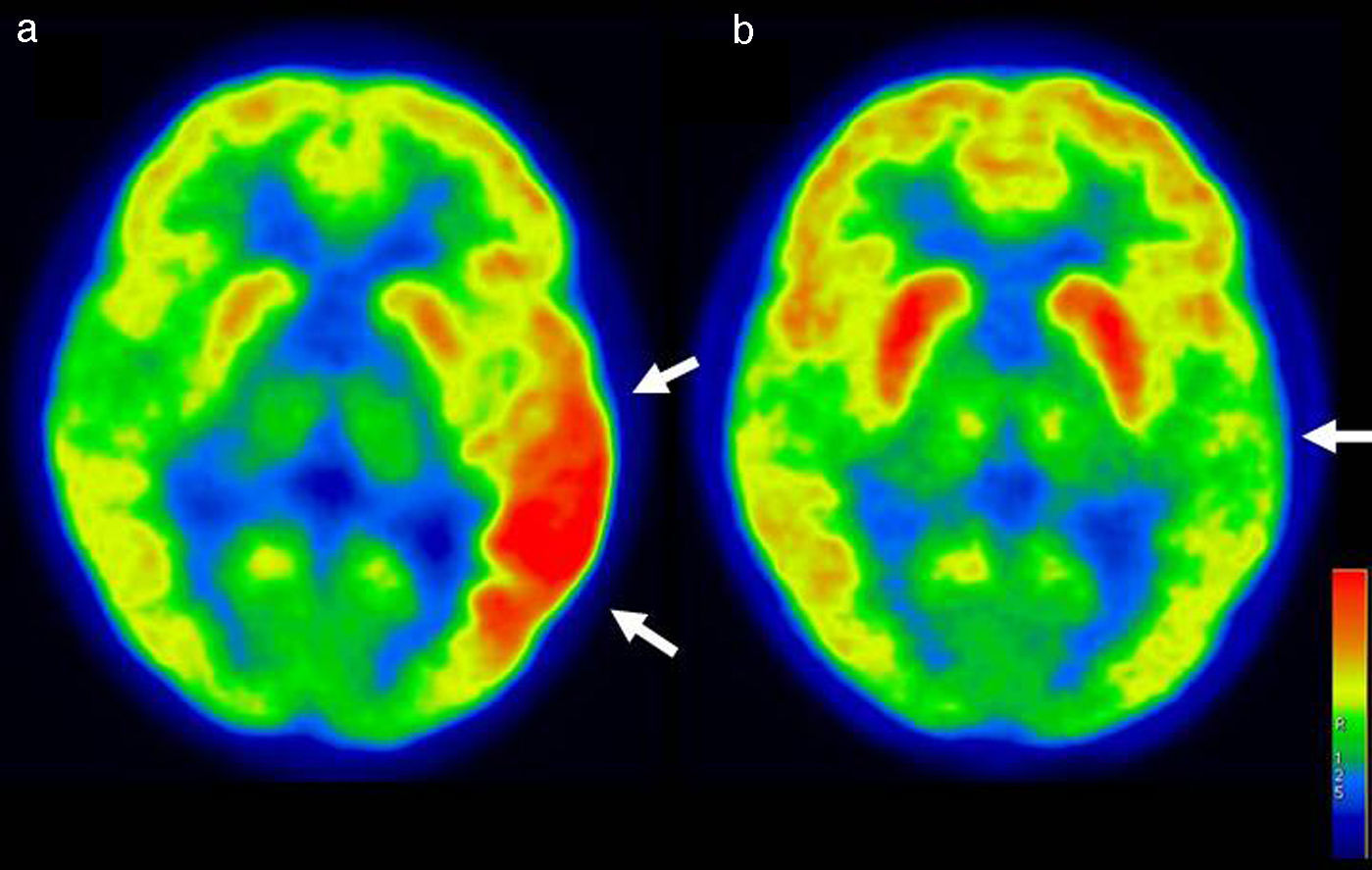
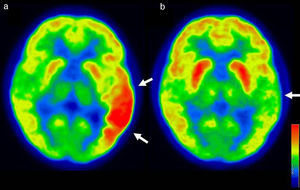
La PET/CT con F18-FDG realizada en sueño y bajo monitorización EEG mostró una moderada hipercaptación en neocorteza temporal izquierda con extensión a corteza temporooccipital y en menor grado giro frontal inferior ipsilateral (fig. 2a). Según el método de semicuantificación de Phi et al.10, el área hipermetabólica presentó un 69% más de captación que la corteza contralateral análoga, y un 66% más que la corteza contralateral no análoga (índices 1,69 y 1,66, respectivamente). La monitorización electroencefalográfica realizada durante la PET demostró abundantes descargas espiga-onda durante la fase de captación del radiofármaco. Se observó además mínimo hipometabolismo en la corteza temporal contralateral, no significativo en la comparación con bases de datos normales (Cortex ID GE®).
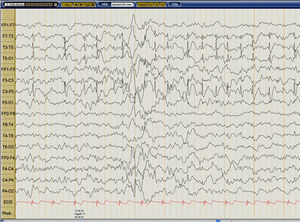
a) El corte axial muestra marcada hipercaptación del F18-FDG en corteza temporal y temporo-occipital izquierda en paciente con intensa actividad ictal espiga-onda durante el PET. b) Un segundo PET realizado en remisión clínica y EEG completa, evidencia leve hipometabolismo temporal izquierdo.
Recibió cura corticoidal, con excelente respuesta clínica, evidenciando 15días después normalización del EEG. En los siguientes 3meses el lenguaje se recuperó por completo. El control clínico a los 6meses describió examen neurológico y EEG normales.
Una segunda PET/CT realizada en paciente asintomático, 7meses después de la primera PET, evidenció leve hipometabolismo temporal izquierdo, más circunscrito y de menor extensión que la alteración hipermetabólica descrita en la PET/CT anterior (fig. 2b). La hipocaptación mostró significación en la comparación con bases de datos normales (Cortex ID GE®). A 10meses de la cura se encuentra libre de crisis, con evaluación fonoaudiológica normal y en tratamiento con levetiracetam 2g/día.
DiscusiónEl SLK fue descrito por primera vez en 1957 por el Dr. William M. Landau y el Dr. Frank R. Kleffner, en 6 niños con afasia relacionada a desórdenes convulsivos que mostraban severas anormalidades en el EEG, dándole el denominativo de «síndrome de afasia adquirida en la infancia con desórdenes convulsivos»11. Es reconocido por la International League Against Epilepsy (ILAE) desde 1989 y actualmente se encuentra dentro de las encefalopatías epilépticas de la infancia. Usualmente se inicia entre los 2 a 8años en niños previamente sanos con desarrollo del lenguaje normal. Las manifestaciones clínicas incluyen alteraciones del lenguaje (afasia) y/o compromiso de habilidades cognitivas, con crisis epilépticas ocasionales (focales orofaciales, tónico-clónica generalizada, mioclónicas, ausencias y atónicas).
El EEG durante el sueño presenta actividad tipo espiga y espiga-onda repetitivas de 1,5 a 5Hz, de alta amplitud, cuya topografía puede variar en el mismo paciente. Las descargas unilaterales son más comunes y el foco puede estar localizado en el lóbulo temporal (50%) y en regiones parietooccipitales (30%). La ocupación de espigas es igual o mayor a 85% durante el sueño No REM, y durante el sueño REM estas descargas tienden a desaparecer, al igual que en vigilia4.
El tratamiento antiepiléptico influye en la respuesta a las crisis y muy poco en la afasia y/o desórdenes conductuales. Entre los fármacos antiepilépticos que han demostrado eficacia se citan al ácido valproico, etosuximida, benzodiacepinas, siendo los corticoides los que han demostrado mejor respuesta con normalización del EEG y la recuperación del lenguaje, siempre y cuando el tratamiento se administre dentro del tiempo oportuno. El pronóstico del SLK es variable, la epilepsia y las alteraciones EEG no siempre desaparecen, y las alteraciones del lenguaje tienden a persistir en la mayoría de los pacientes, determinando una disminución de la calidad de vida en estos casos12.
Existen escasos reportes de la utilización de PET en el SLK, y cada uno de ellos con hallazgos disímiles, reportando alteraciones uni o bilaterales, hipo o hipermetabólicas.
Shirashi et al. encontraron hipometabolismo temporal bilateral más extenso a izquierda en una niña de 8años con SLK, complementando con un estudio PET de receptores de benzodiacepina que mostró un déficit de estos receptores en el polo del lóbulo temporal izquierdo5.
Da Silva et al. realizaron PET con F18-FDG a 17 pacientes con SLK, encontrando en 88% (15/17) hipometabolismo temporal bilateral, con otras áreas corticales hipocaptantes asociadas en algunos de ellos. Solo en 2 casos se observó hipermetabolismo cortical, ambos en ubicación temporal izquierda6.
Maquet et al. describieron un patrón asimétrico temporal en 2 niños, e hipometabolismo temporal bilateral simétrico en otro7. El mismo autor en un estudio posterior encontró un patrón metabólico muy variable entre los pacientes e incluso en PET realizadas separadamente en un mismo sujeto8.
Rintahaka et al. demostraron hipermetabolismo temporal bilateral en PET realizadas durante el sueño en 2 niños, que se revirtieron en un estudio del mismo paciente despierto9. En ambos individuos el examen realizado en vigilia mostró áreas hipocaptantes temporales, además de hipometabolismo severo occipital y moderado frontal y talámico en uno de ellos.
Luat et al. describen los hallazgos de la PET en pacientes con epilepsia intratable y estado epiléptico eléctrico durante el sueño (ESES), con incremento del metabolismo de glucosa concordante con el origen de las descargas interictales del análisis cuantitativo del EEG13. Un año más tarde describen cambios dinámicos del metabolismo de glucosa en el lóbulo temporal durante el episodio de afasia y remisión en un niño con SLK; los hallazgos del EEG sugieren que el metabolismo de la glucosa en el SLK no puede atribuirse solamente a la actividad de las descargas interictales del EEG de superficie14.
El caso presentado es coincidente con el reporte de Laut et al.14 en el sentido que realiza 2 estudios de PET con monitorización EEG, uno antes y otro después del tratamiento, resultando en un área intensamente hipermetabólica temporal izquierda asociada a actividad eléctrica, que cambia a hipocaptación en la PET realizada en remisión. Ambos reportes apuntan al uso obligado de monitorización EEG durante la realización de la PET en todo paciente con SLK, con el objetivo de correlacionar la información metabólica con la actividad eléctrica presente durante y después de la inyección del F18-FDG.
No conocemos el significado de la persistencia del hipometabolismo temporal en pacientes que ya fueron tratados. Sin embargo, es posible que la corteza presente algún grado de secuela focal que pudiera ser solo funcional o bien asociada a pérdida neuronal, y que este hallazgo tenga cierta relación con las alteraciones del lenguaje con que suelen quedar estos pacientes. Al no haber confirmación histopatológica en esta patología habitualmente sin indicación quirúrgica, la interrogante es difícil de contestar.
A pesar de la similar presentación clínica de los pacientes con SLK, existe una alta variabilidad en las alteraciones metabólicas encontradas en los estudios de PET cerebral. Dicha variabilidad puede estar relacionada con el estado sueño o vigilia durante el cual se realiza la PET, y a la actividad eléctrica presente durante el examen. Las alteraciones demostradas en la corteza temporal, con hipometabolismo en ausencia de actividad eléctrica anormal y con hipermetabolismo en presencia de ondas espiga-onda rápidas, parecen ser un factor común en estos pacientes.
ConclusiónLa PET con F18-FDG puede ser una herramienta muy útil en el diagnóstico y evaluación de la respuesta a tratamiento del SLK, existiendo una estrecha correlación entre la sintomatología clínica, la actividad electroencefalográfica y las alteraciones metabólicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.