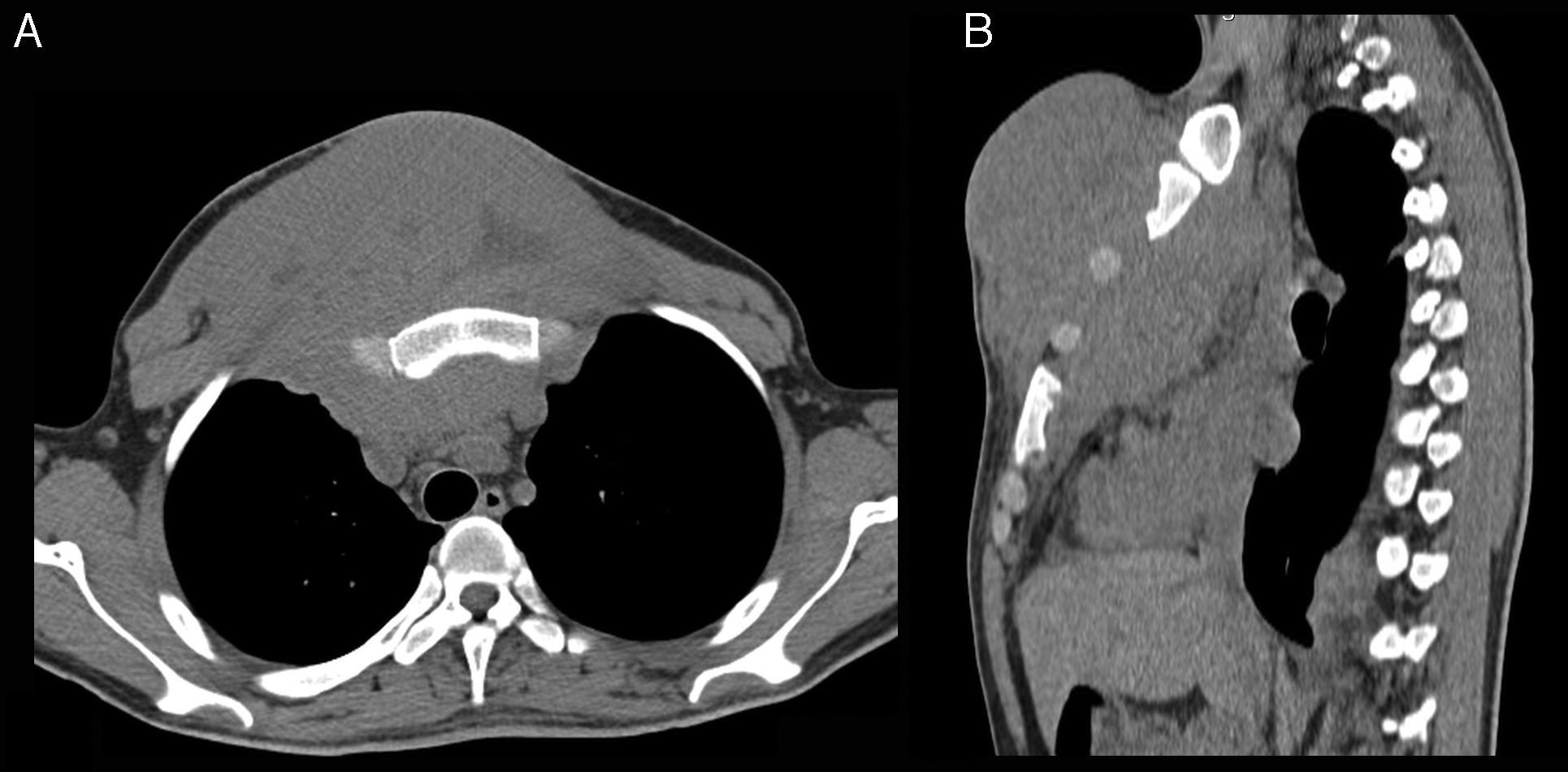
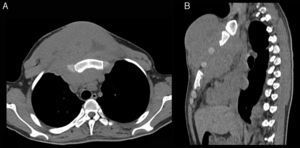
La TC de tórax sin medio de contraste (fig. 1) muestra una gran masa sólida en la pared torácica que compromete el mediastino anterior, el primer y segundo espacios intercostales y partes blandas de la cara anterior del tórax. La lesión rodea el esternón y los arcos costales anteriores, sin evidencias de osteolisis. Hacia atrás, desplaza las estructuras mediastínicas, y hacia delante, ejerce un importante efecto de masa sobre los músculos pectorales mayores hasta alcanzar el plano celular subcutáneo. Su densidad es similar a la del músculo, aunque con áreas hipodensas en su espesor.
Corte axial (imagen A) y reconstrucción sagital (imagen B). Se observa una gran masa sólida en la pared torácica, que compromete el mediastino anterior, primer y segundo espacios intercostales y partes blandas de la cara anterior del tórax. La densidad de la masa es similar al músculo, con áreas hipodensas en su espesor. No hay evidencias de osteolisis.
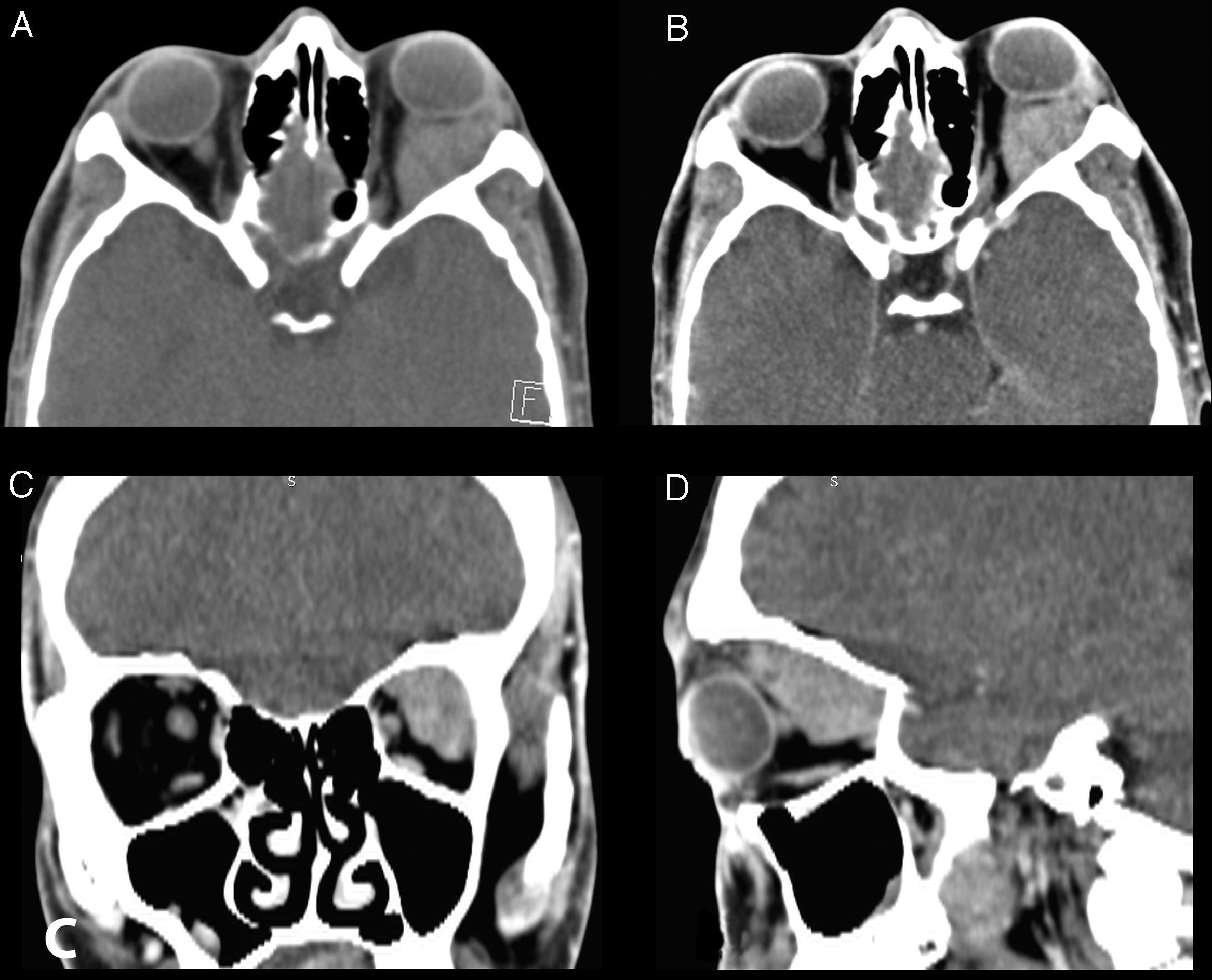
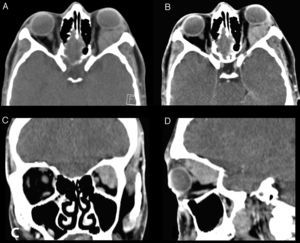
La TC de órbitas con medio de contraste (fig. 2) muestra en el aspecto lateral y superior de la órbita izquierda una masa con densidad de partes blandas, sin calcificaciones en el estudio no contrastado, la cual presenta refuerzo homogéneo tras la administración de medio de contraste. Esta masa compromete el espacio intra y extraconal, determinado desplazamiento de los músculos extraoculares adyacentes, el nervio óptico, y ocasiona proptosis del globo ocular. No se evidencia osteolisis.
Cortes axiales sin y con medio de contraste (imágenes A y B respectivamente), reconstrucciones coronal y sagital con medio de contraste (imágenes C y D respectivamente). Se observa una masa con densidad de partes blandas en el aspecto lateral y superior de la órbita izquierda, la cual presenta refuerzo homogéneo tras la administración de medio de contraste. Esta masa compromete el espacio intra y extraconal, determinado desplazamiento de los músculos extraoculares adyacentes, el nervio óptico y proptosis del globo ocular. No se evidencia osteolisis.
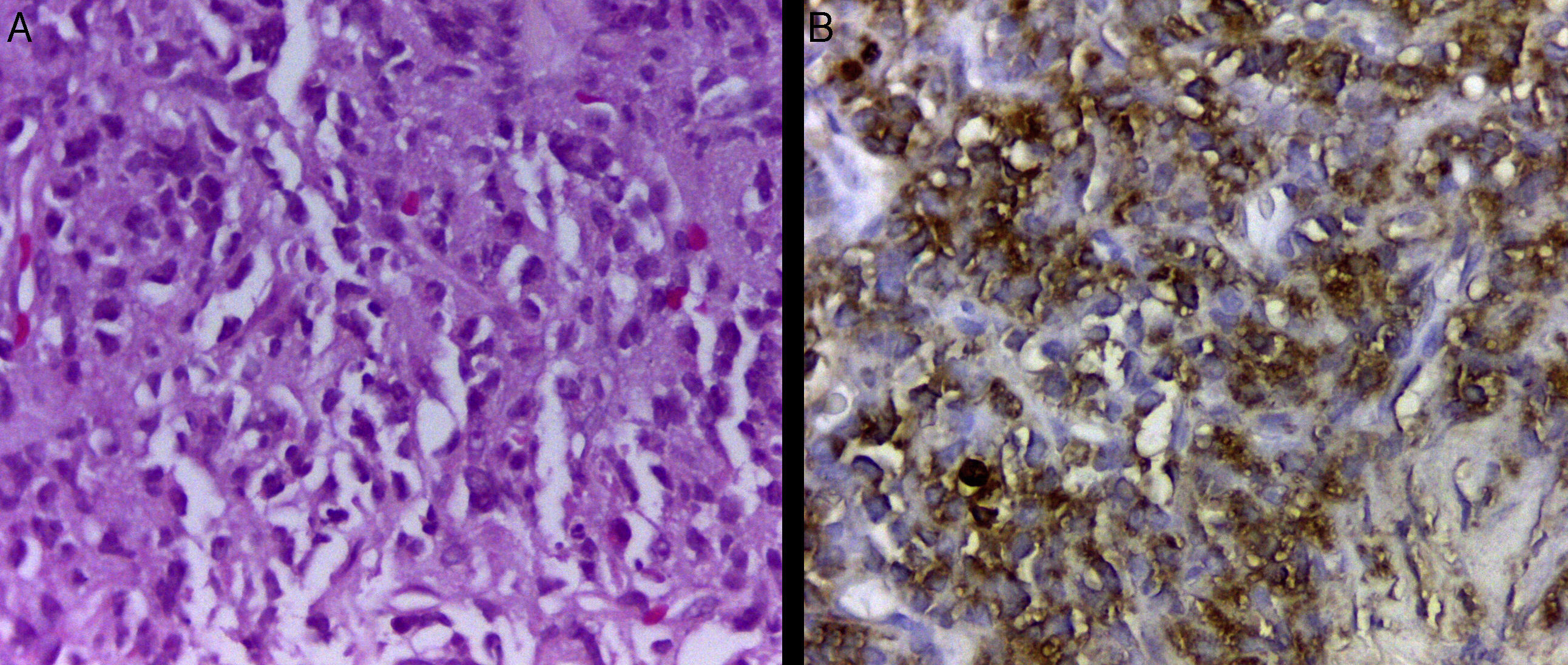
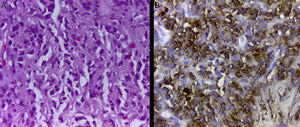
Se realiza una biopsia percutánea de la masa torácica, sin incidentes. El estudio histológico y la inmunohistoquímica (fig. 3) son compatibles con un sarcoma granulocítico (cloroma).
Biopsia de la masa torácica. A. Histología con tinción de hematoxilina-eosina (×400): se observa una proliferación hematolinfoide de células medianas y grandes, con poco citoplasma, núcleos ovalados y algunos arriñonados, mezclados con elementos más maduros, de tipo baciliformes y polimorfonucleares. B. Tinción inmunohistoquímica de mieloperoxidasa: se observan gránulos citoplasmáticos color café positivos, demostrando diferenciación de línea granulocítica.
En consideración al diagnóstico histológico se decide hospitalizar al paciente, que fue evaluado por el equipo de Hematología. Se realiza un hemograma que evidencia un recuento de leucocitos de 44.000cél/ul, con un 90% de blastos y un 8% de promielocitos, un recuento de plaquetas de 36.000cél/ul, una hemoglobina de 8,8mg/dl y una VHS de 140mm/h. En el frotis se aprecian abundantes blastos y células con bastones de Auer. De esta forma se confirma el diagnóstico de leucemia mieloide aguda.
DiscusiónEl sarcoma granulocítico es un tumor sólido poco frecuente que se presenta en el contexto de enfermedades neoplásicas hematológicas, compuesto por precursores de glóbulos blancos de la serie granulocítica que incluye mieloblastos, promielocitos y mielocitos1,2. Fue descrito por primera vez el año 1811 por Burns1. En 1853 King lo llamó cloroma por la coloración verde distintiva, dada la alta concentración de mieloperoxidasa en las células inmaduras1. Sin embargo, en 1966 se establece el nombre de sarcoma granulocítico, ya que no todas las células presentan color verde y, dependiendo del estado de oxidación de la enzima pigmentada, hasta un 30% de las células pueden observarse blancas, grises o color café1.
Este tumor se presenta en el 2,5 a 9,1% de los pacientes con leucemia mieloide aguda. También está descrito en leucemia mieloide crónica, mielofibrosis con metaplasia mieloide, síndromes hipereosinofílicos y policitemia vera1. Tiene igual ocurrencia en hombres que en mujeres, siendo más frecuente en niños que en adultos (el 60% de los casos se da en menores de 15 años)1. Puede desarrollarse durante el transcurso o, menos frecuentemente, como presentación inicial de una leucemia. En el 35% de los casos precede a la neoplasia hematológica en meses o años, y en este contexto es difícil diferenciarlo de un linfoma o sarcoma por las imágenes1.
Existe controversia sobre el pronóstico del sarcoma granulocítico, pero se estima que en la leucemia mieloide aguda no cambia la sobrevida. Por el contrario, en la leucemia mieloide crónica y en otros síndromes mieloproliferativos crónicos es un signo ominoso ya que se asocia y suele preceder a las crisis blásticas1,3. Es importante reconocer estos tumores ya que son sensibles a la radioterapia y se resuelven completamente en aproximadamente 3 meses. Tienen una recurrencia reportada del 23%1.
Alrededor del 50% de estos tumores son asintomáticos1,3. Pueden aparecer en cualquier parte del cuerpo. En general son múltiples, secuenciales y en lugares anatómicos distintos. Los sitios más frecuentemente comprometidos son las órbitas y las partes blandas; sin embargo, hay casos reportados en cavidades paranasales, sistema nervioso central, linfonodos, hueso, médula espinal, serosas, mamas, tiroides e intestino1,4,5.
El compromiso orbitario del sarcoma granulocítico precede a la fase blástica de la leucemia y causa una progresiva proptosis. Lo más frecuente en los estudios de imágenes es la presencia de una masa focal intra o extraconal, con realce homogéneo, bien definida, que remodela el hueso adyacente1,6. El compromiso puede ser bilateral7. En la resonancia magnética esta masa es isointensa al músculo en secuencias T1 e hiperintensa en secuencias T21,7. Si bien la imagen no es específica, el hecho de que aparezca una lesión con las características descritas en la evolución de una leucemia es altamente indicativa del diagnóstico. Noh et al.6 consideran que en el contexto clínico adecuado, una masa orbitaria bien definida, con realce homogéneo, con remodelación del hueso adyacente y especialmente en el aspecto superolateral de la órbita, es una imagen diagnóstica de sarcoma granulocítico. En el diagnóstico diferencial de masas orbitarias retrobulbares en pacientes jóvenes se debe considerar el rabdomiosarcoma, el neuroblastoma metastásico, el linfoma y el pseudotumor inflamatorio1. Otras manifestaciones orbitarias menos frecuentes son la infiltración de los músculos extraoculares y del nervio óptico, y el compromiso de estructuras anexas como la úvea y la retina.
El sarcoma granulocítico de partes blandas en la TC se manifiesta como una masa isodensa respecto al músculo, que puede presentar áreas hipodensas centrales debido a necrosis, incluso sin tratamiento1,8. En la resonancia magnética tiene características similares al compromiso orbitario, isointensa al músculo en secuencias T1 e hiperintensa en secuencias T2, con realce homogéneo1,4. Cuando nos enfrentamos a una masa de partes blandas en un paciente con leucemia, el absceso es un importante diagnóstico diferencial a descartar. El realce en anillo periférico e irregular con un centro hipodenso o hipointenso en T1 son signos indicativos de absceso4. Es fundamental definir el origen de la lesión de partes blandas del sarcoma granulocítico. Si bien la manifestación imagenológica es la misma que hemos descrito, el inicio puede ser el hueso, el músculo o, incluso, los linfonodos mediastínicos4, como podría ser el caso en nuestro paciente.
Cuando el sarcoma granulocítico compromete el hueso, forma parte de un grupo heterogéneo de tumores óseos llamados tumores de células pequeñas. Estos se caracterizan histológicamente por presentar células tumorales pequeñas, redondas y azules9. El compromiso óseo de la leucemia es frecuente en la etapa aguda y se caracteriza por lesiones progresivas e indolentes. Patológicamente tiene las mismas características que la enfermedad sistémica, y en la inmunohistoquímica las células del sarcoma granulocítico son positivas para CD45, CD43 y mieloperoxidasa, pero negativas para CD209. Para un diagnóstico correcto se deben evaluar las características clínicas, radiológicas, patológicas, genéticas y, actualmente, inmunohistoquímicas9. Como hemos comentado, una lesión de partes blandas puede tener su origen en la médula ósea, ya que las células leucémicas cruzan los conductos de Havers para alcanzar el periostio, generando lisis ósea y periostitis y, posteriormente, alcanzando los planos más superficiales. Esto es más frecuente de observar en el esternón, la órbita, el cráneo, el sacro, las costillas y los cuerpos vertebrales1. Con la presencia de osteolisis y masa de partes blandas, el diagnóstico diferencial en niños se debe plantear con neuroblastoma, metástasis, sarcoma de Ewing, granuloma eosinófilo y tumor neuroectodérmico primitivo1. En los adultos, el diagnóstico diferencial es con metástasis, plasmocitoma, linfoma, osteomielitis e histiocitoma fibroso maligno1. El músculo también puede ser el tejido inicial afectado, siendo la localización parameníngea la más frecuente1.
Los linfonodos mediastínicos son los más comprometidos en el tórax, y están habitualmente subdiagnosticados, ya que las adenopatías en esta región son más indicativas de linfoma1.
La tabla 1 resume los elementos clínicos e imagenológicos altamente indicativos de sarcoma granulocítico.
Elementos clínicos e imagenológicos altamente indicativos de sarcoma granulocítico
| Contexto de una neoplasia hematológica, más frecuentemente LMA |
| Masa sólida bien definida |
| Realce homogéneo con el medio de contraste |
| Pueden ser múltiples, más frecuentes en órbitas y partes blandas |
| Aparición secuencial en el tiempo |
LMA: leucemia mieloide aguda.
Los autores declaran no tener ningún conflicto de intereses.