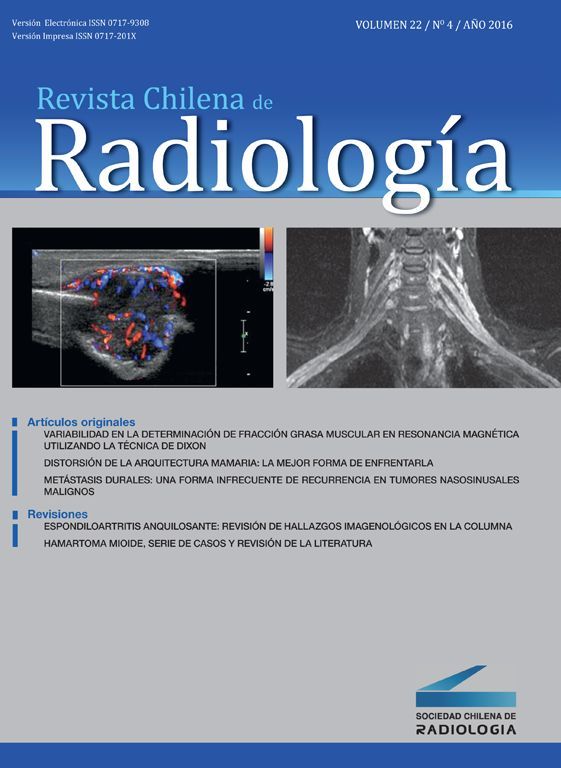
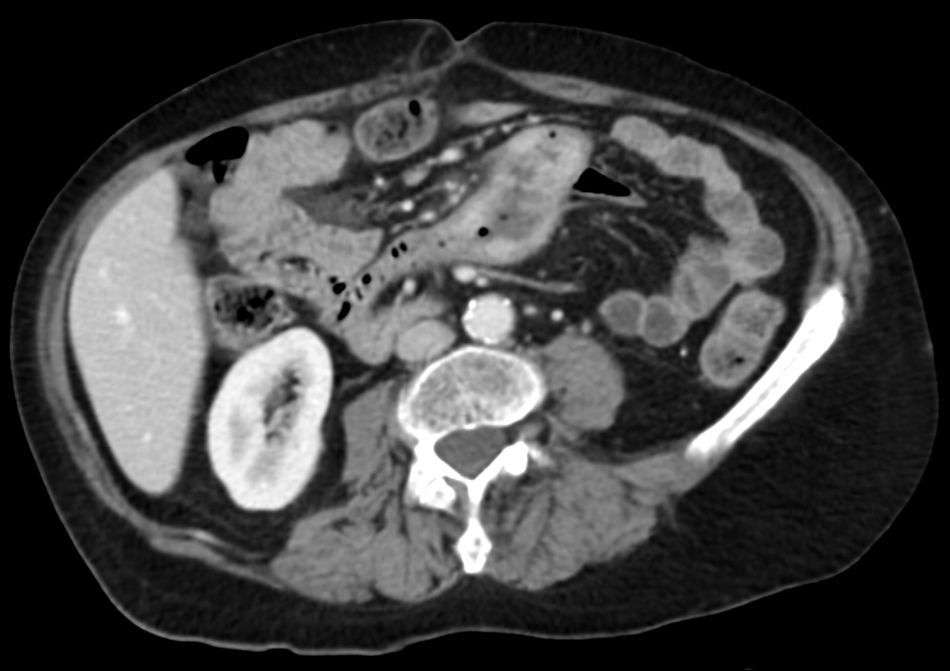
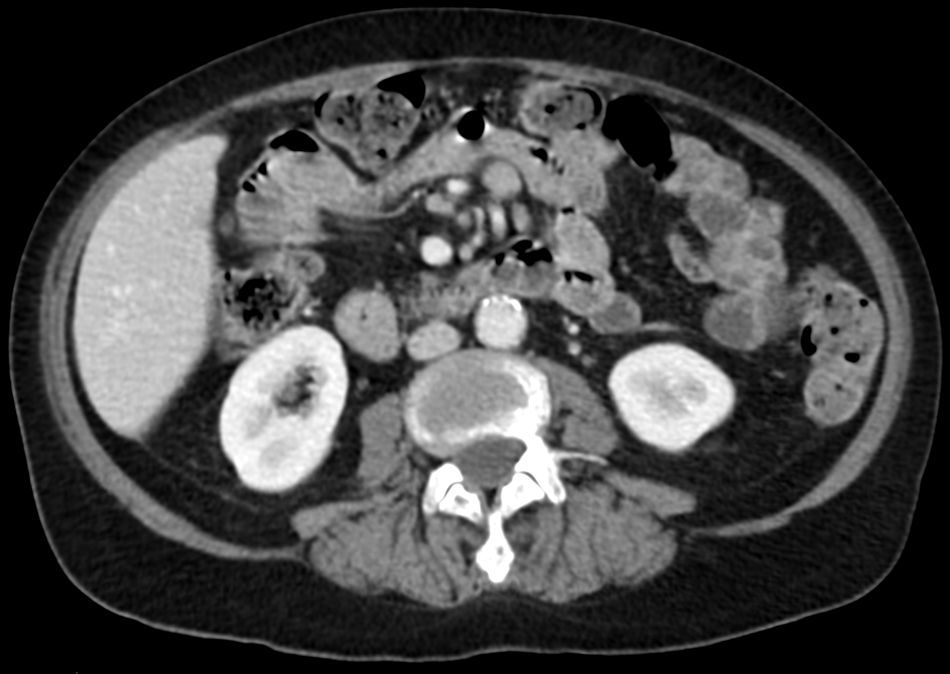
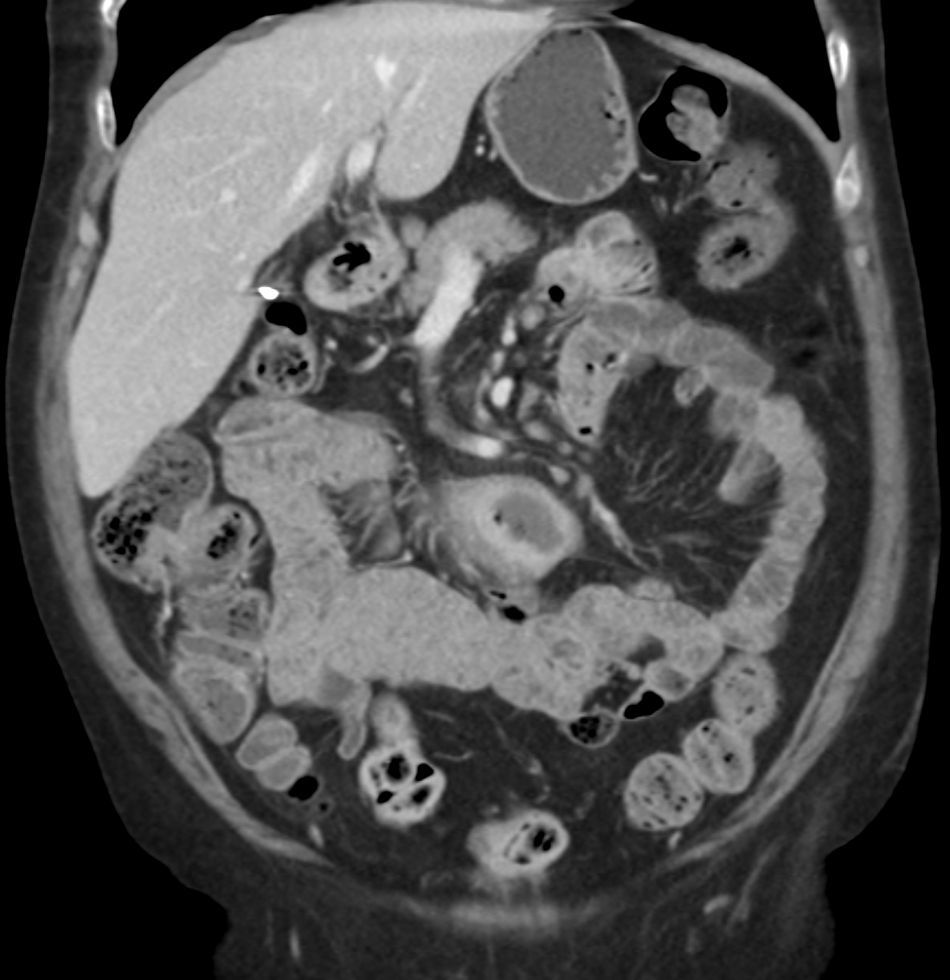
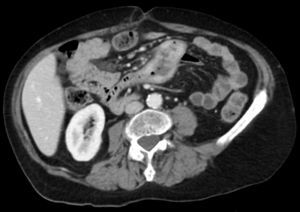
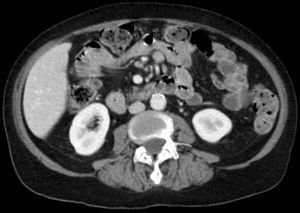
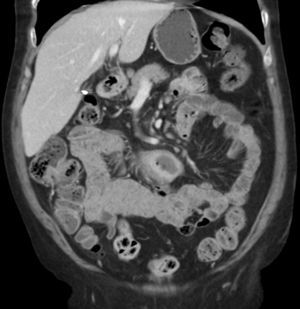
Entre yeyuno e íleon, en la región periumbilical, se observa un segmento de intestino delgado de paredes engrosadas, con marcado realce tras la administración de contraste, de contorno interno irregular, sin estenosis, inclusive existiendo cierta dilatación luminal, asociado a linfonodos mesentéricos aumentados de tamaño.
Diagnostico histológicoLinfoma no Hodgkin de células T variedad anaplásica.
Linfoadenopatías crónicas, inespecíficas.
Biopsia de médula ósea normal.
DiscusiónLos linfomas son neoplasias primarias del sistema linforreticular, y se clasifican en 2 tipos principales: enfermedad de Hodgkin y linfoma no-Hodgkin (LNH), y suponen aproximadamente un 4% de los tumores malignos de nuevo diagnóstico1.
Los linfomas que afectan al tracto digestivo pueden ser primarios o secundarios. Para señalar que un linfoma del sistema digestivo es primario, este debe de carecer de adenopatías, hepatoesplenomegalia palpable, signos de linfoma en la radiografía de tórax, en la tomografía computarizada (TC), ni en el frotis de sangre periférica, aspirado o biopsia de médula ósea (criterios de Dawson)2.
Los linfomas primarios del tracto gastrointestinal corresponden entre el 4-20% de todos los LNH, y pueden afectar a todo el tubo digestivo, pero se presentan principalmente en el estómago3. Su localización primaria en el intestino delgado es una presentación poco frecuente4. Corresponde al 0,9% de todos los tumores gastrointestinales y ocurre preferentemente en personas que cursan la sexta década de la vida en ambos sexos, aunque se ha demostrado la presencia de un doble peak de incidencia, uno en pacientes inferiores a 10 años y otro en pacientes con una edad media de 53 años5.
Actualmente se utiliza la clasificación de la OMS5, la que divide al LNH en casi 40 subtipos, siendo más frecuentes los derivados de las células B, mientras que el de células T es el menos común de los linfomas gastrointestinales6, y se asocia fuertemente a enteropatía celíaca cuando se presenta en el intestino delgado, sin embargo, una gran parte de los pacientes no tienen historia previa de enteropatía clínica. Son casos escasos, propios del adulto y de naturaleza agresiva. Se manifiestan como un tumor ulcerado de yeyuno o íleon, con áreas vecinas de atrofia vellositaria7.
El lugar que se ve afectado con mayor frecuencia por el linfoma de células B, es el íleon distal y esto se debe a la gran cantidad de tejido linfoide que existe en esa porción de intestino. Generalmente se puede presentar como una masa abultada en la pared, a menudo asociado a extensión a linfonodos regionales y mesentéricos. También puede comprometer un segmento relativamente largo de intestino, el que puede ulcerarse, perforarse e incluso formar un absceso1,7.
La obstrucción es poco frecuente en el intestino delgado, aunque en ocasiones puede adoptar una apariencia radiológica similar al adenocarcinoma con obstrucción intestinal e infiltración de estructuras adyacentes. También se ha descrito que puede manifestarse como una masa intraluminal, lesión focal o polipoidea, sin ensanchamiento de la pared o adenopatías. La linfomatosis peritoneal de un linfoma gastrointestinal primario es rara, comparada con la carcinomatosis, y el patrón de compromiso del mesenterio, omento y peritoneo es indistinguible de la que se ve en la carcinomatosis o peritonitis tuberculosa8,9. En el 31% de los pacientes, secundario a la destrucción de plexos del sistema nervioso autónomo entéricos y la debilidad de la muscular propia por la infiltración se producen dilataciones murales aneurismáticas, como en este caso, lo que permite diferenciarlo de otros diagnósticos diferenciales9,10.
En los estudios baritados se demuestra el engrosamiento mural, la nodularidad, las lesiones polipoideas únicas o múltiples, la ulceración y la estenosis, principalmente en el segmento proximal del intestino delgado.
La TC es precisa en la evaluación de linfoma gastrointestinal, ya que entrega información acerca de la localización, morfología, extensión, compromiso linfático y extensión a otros órganos11. La manifestación más común en la TC y la resonancia magnética (RM) es un engrosamiento circunferencial del yeyuno, íleon o ambos (fig. 1). Se puede acompañar de linfoadenopatías e infiltración del mesenterio (figs. 2 y 3). La perforación se puede ver con una frecuencia que va desde el 16 al 33%6. Estos hallazgos pueden ser mejor demostrados realizando una enteroclisis12.
En la ecografía, estos tumores son hipoecogénicos y comúnmente se demuestra un engrosamiento circunferencial de la pared, aunque también se pueden ver otros patrones como nodular o masas voluminosas. La dilatación aneurismática de la luz y la invaginación pueden ser vistos con ecografía3.
En los últimos años la tomografía con emisión de positrones (PET) con fluorodeoxiglucosa (FDG) ha demostrado una alta sensibilidad para las lesiones intestinales malignas, pero su especificidad es baja, debido a que las condiciones fisiológicas y malignas del intestino, que consumen FDG12, a pesar de eso esta puede ser aumentada al combinar con la TC12. Otro aspecto a tener en consideración es la captación heterogénea de bajo nivel en forma normal, principalmente en zonas de interposición de asas, como ocurre en la pelvis13. Dentro del espectro de enfermedades que son captantes del trazador se identifica enfermedad infecciosa e inflamatoria, como la enfermedad de Crohn y la colitis ulcerosa14. Además del linfoma intestinal, hay afección tumoral como los GIST y las metástasis, como las del melanoma, son ávidos captadores de trazador15. Con respecto al linfoma, la información entregada por el PET permite realizar una mejor estadificación inicial y una aproximación pronóstica, así como, también, planificar un tratamiento adecuado monitorizando la respuesta, eventual recidiva y reestadificación16,17. El problema surge en los linfomas indolentes o de bajo grado, que por su menor metabolismo glucolítico intracelular, presentan menor captación del radiotrazador, traduciendo un menor rendimiento diagnóstico18.
Los patrones de presentación del linfoma antes descritos, también pueden observarse en otras entidades patológicas neoplásicas, inflamatorias o infecciosas19. Entre las neoplásicas que pueden presentarse como engrosamiento parietal, efecto de masa, ulceración y adenopatías, cabe mencionar el adenocarcinoma, infrecuente en el intestino delgado; el carcinoide, el primario más frecuente; y las metástasis20. Otras causas a tener en consideración en las que se pueden observar engrosamientos parietales difusos o focales son el edema, la isquemia intestinal, la hemorragia submucosa y la enfermedad inflamatoria intestinal, como la enfermedad de Crohn, las que tienen otras características propias, que sumado al contexto clínico permiten diferenciarlas la mayoría de las veces del linfoma21,22.
El tratamiento va a depender de la edad del paciente, del escenario clínico, de la comorbilidad y de la histología tumoral. Los de linfomas de bajo grado van a requerir solo resección quirúrgica. El rol de la radioterapia es limitado a compromiso localizado, y en casos avanzados o de histología agresiva el tratamiento se asocia a quimioterapia7,23.
En el caso de nuestra paciente no dispuso de PET y la biopsia de médula ósea fue normal y no identificaron otras lesiones linfomatosas, se procedió a realizar cirugía resectiva. Posteriormente, debido principalmente a su histología se continuó el tratamiento con quimioterapia adyuvante, con buena respuesta y sin complicaciones significativas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.