Introducción
En epilepsia, al igual que en otras patologías médicas y neurológicas, el análisis inicial empieza por la anamnesis. Es fundamental obtener una historia clínica detallada que nos permita orientar y organizar el estudio, para así solicitar adecuadamente las pruebas complementarias y elegir el tratamiento más preciso. Con los datos obtenidos en la entrevista con el enfermo podemos orientar el diagnóstico con bastante certeza. No obstante, en algunas ocasiones resulta más complicado llegar a un diagnóstico definitivo. En epilepsia, el diagnóstico erróneo no es infrecuente y, según diferentes series, puede representar hasta el 15-20 % de los pacientes remitidos a una unidad de epilepsia para su evaluación 1,2. Las principales causas de error son una anamnesis imprecisa y una incorrecta interpretación del electroencefalograma (EEG).
Existen dos tipos principales de errores en el diagnóstico de epilepsia: a) confusión de la epilepsia con otros fenómenos paroxísticos, o viceversa, y b) clasificación incorrecta del tipo de epilepsia (p. ej., focal en lugar de generalizada). En este sentido, los datos semiológicos para clasificar correctamente el tipo de crisis y epilepsia, y los hallazgos del EEG pueden ser insuficientes o equívocos, lo cual dificulta la clasificación correcta en un grupo de pacientes. La confusión en el diagnóstico ocurre fundamentalmente entre las epilepsias generalizadas idiopáticas (EGI) y las epilepsias focales (EF), y dentro de éstas principalmente con las frontales; la causa principal es el hecho de que en el EEG las EGI pueden tener hallazgos focales y las EF pueden mostrar actividad epileptiforme (AE) generalizada 3. Además, ambas epilepsias pueden cursar con crisis con semiología parecida (p. ej., desconexión del medio sin otros datos añadidos).
Las consecuencias de un diagnóstico erróneo conllevan en muchos casos una inadecuada terapia y un peor pronóstico (mayor dificultad para controlar las crisis y mayor posibilidad de efectos secundarios). Estas razones justifican desde el principio un mayor esfuerzo en el diagnóstico, haciendo el mejor uso posible de todas las herramientas diagnósticas disponibles.
En el diagnóstico del paciente con epilepsia se emplean protocolos de activación cerebral, generalmente con hiperventilación (HV), estimulación luminosa intermitente (ELI) y privación de sueño, maniobras que permiten aumentar el rendimiento del estudio mediante EEG y demostrar AE en pacientes epilépticos que de forma espontánea no la tendrían. En un esfuerzo por aumentar el rendimiento diagnóstico del EEG, algunos autores han ampliado el protocolo de activación habitual con otras tareas. Matsuoka et al. han mostrado que la realización de tareas cognitivas durante el estudio con EEG aumenta la capacidad diagnóstica de esta prueba al desencadenar AE en pacientes que previamente tenían registros normales o inespecíficos 4. Estas tareas son especialmente eficaces en pacientes con EGI y en menor medida en pacientes con EF. Por ello, estos autores proponen utilizar tareas cognitivas de forma sistemática en la monitorización mediante EEG para así facilitar la diferenciación entre EF y EGI. El rendimiento de tareas de este tipo podría ser incluso mayor si se realiza una monitorización videoelectroencefalográfica (VEEG) prolongada, no sólo para evaluar la AE, sino también para intentar llegar a un diagnóstico definitivo documentando las crisis habituales del paciente. El objetivo de nuestro trabajo es evaluar la capacidad diagnóstica de un protocolo de activación ampliado en pacientes estudiados con VEEG con antecedentes de estudios previos no concluyentes y/o sin AE generalizada espontánea.
Pacientes y métodos
Se realizó un análisis prospectivo de los todos los pacientes ingresados en la unidad de VEEG del Hospital Ruber Internacional, desde enero de 2009 hasta mayo de 2010. Se incluyeron todos los pacientes con diagnóstico previo de epilepsia que pudieron realizar el protocolo de activación ampliado. Se estudiaron 181 pacientes (75 mujeres y 106 hombres) con una edad media de 28,7 años (rango de 8-87 años). Todos, salvo 13 pacientes, recibían tratamiento con fármacos antiepilépticos en el momento de realizar el VEEG.
El protocolo de activación convencional consistió en: HV, ELI y privación de sueño.
— ELI: el paciente se encuentra en una habitación con luz ambiente tenue, se le somete a un haz de luz procedente de un foco situado a una distancia de 30 cm. De forma estandarizada se inicia a una frecuencia de 1 Hz que se va incrementando progresivamente hasta llegar a 30 Hz. Posteriormente, se disminuye la frecuencia del estímulo luminoso de manera inversa. Con cada frecuencia explorada, se estimula primero con los ojos abiertos, posteriormente al cerrarlos y a continuación con los ojos cerrados. La duración de cada ciclo es de aproximadamente 7 minutos. La exploración se realiza inicialmente al final de la mañana y se repite al final de la tarde y cuando el paciente despierta a primera hora de la mañana.
— HV: la técnica consiste en pedir al paciente que inspire profundamente por la nariz y expulse el aire rápidamente por la boca. Se realiza inmediatamente después de cada ELI y el ejercicio dura aproximadamente 5 minutos. El paciente es informado de que este procedimiento puede producir una ligera sensación de mareo, parestesias peribucales y en los dedos.
— Privación parcial de sueño: consiste en disminuir las horas de sueño. El paciente se acuesta aproximadamente a las 2 a.m. y es despertado a las 7 a.m. A continuación se realizan la ELI y la HV de forma secuencial.
El protocolo de activación ampliado añade al convencional las siguientes tareas cognitivas:
— Cálculo matemático: se le entregan al paciente ejercicios de sumas, restas y multiplicaciones. La complejidad de estas tareas son acordes a su nivel intelectual.
— Puzle (praxias): durante 30 minutos el paciente debe completar el rompecabezas chino denominado Tangram. Este puzle está compuesto por siete figuras geométricas que pueden combinarse para formar distintas figuras.
— Lectura/escritura: esta tarea consiste en 30 minutos de lectura continua, sin interrupciones, en voz alta, de cualquier libro elegido por el paciente, con una redacción posterior de lo leído.
En cada paciente se anotaron los períodos de realización de cada maniobra de activación. Los cambios documentados en el EEG fueron anotados por el personal de enfermería. Para excluir la contaminación accidental de descargas no relacionadas con la activación, se definió cada maniobra de activación de una forma operacional, contabilizando el número de descargas por minuto encontrado en cada tarea y dividiéndolo por el número de descargas por minuto en el registro basal. Este último se definió como el EEG de vigilia que se registró separado al menos en 2 horas del despertar y en 1 hora de cada maniobra de activación. La maniobra o tarea realizada se consideró activadora si el cociente de esa división era ≥ 2. Se utilizó esta ratio tomando como base estudios previos 4.
En la monitorización VEEG se emplearon al menos 32 electrodos de cuero cabelludo (electrodos de disco en oro), colocados siguiendo las directrices del sistema internacional 10-20. Los estudios VEEG fueron revisados por neurólogos especialistas en epilepsia. De acuerdo con la semiología de las crisis documentadas, las características del trazado basal y de la actividad epileptiforme registrada, se clasificó la epilepsia en EF o EGI siguiendo la clasificación vigente recomendada por la Liga Internacional contra la Epilepsia 5.
Resultados
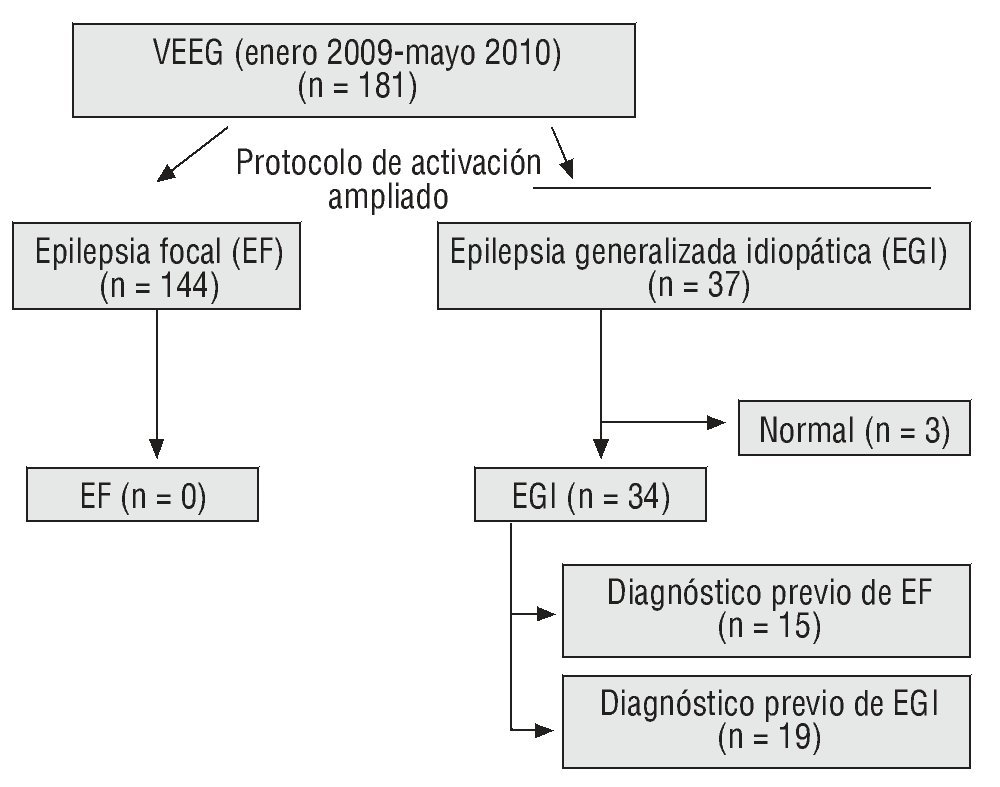
En nuestra cohorte, 144 pacientes fueron diagnosticados finalmente de EF y 37 de EGI tras la monitorización VEEG con protocolo de activación ampliado (fig. 1). Analizamos únicamente a los pacientes diagnosticados de EGI debido a que en ningún paciente con EF se registró actividad epileptiforme o crisis tras aplicar el protocolo ampliado. Los pacientes con EGI tenían una edad media de 30,4 años (rango 5-70 años), de los cuales 24 (65 %) fueron mujeres. Del total de 37 pacientes con EGI, 34 (92 %) mostraron AE generalizada y/o crisis tras la aplicación del protocolo de activación ampliado. En este subgrupo, un 41 % (15 pacientes) había sido diagnosticado previamente, y de forma incorrecta, de EF tomando como base estudios anteriores (fig. 1). En el subgrupo de pacientes con EGI (34 pacientes), 21 (62 %) tuvieron AE espontánea y 13 pacientes (38 %) presentaron AE exclusivamente desencadenada con el protocolo convencional y/o ampliado. Cuando analizamos de forma separada la activación facilitada por el protocolo ampliado, documentamos AE y/o crisis en 19 pacientes (56 %) (tabla 1).
Figura 1 Modificación del diagnóstico tras la aplicación del protocolo de activación ampliado.
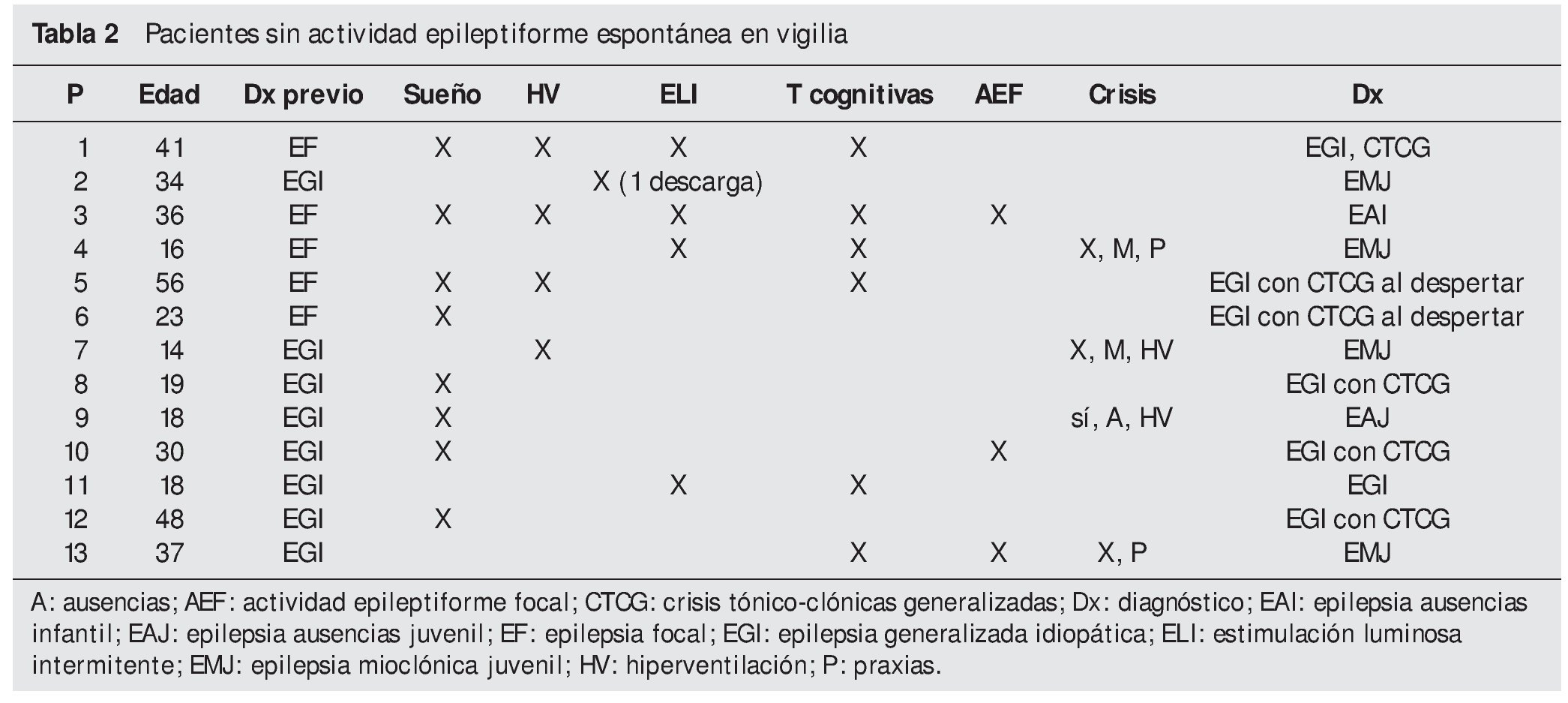
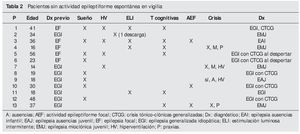
El grupo con EGI sin AE espontánea (tabla 2) incluyó 13 pacientes (38 %), con una edad media de 27,6 años (rango 12-56 años), de los cuales nueve (70 %) fueron mujeres. Del total, nueve pacientes (70 %) presentaron AE en sueño, cinco (38 %) AE con la HV, uno (7,5 %) AE con la ELI y seis (46 %) AE con tareas cognitivas. De forma significativa, seis de los 13 pacientes (46 %) sin AE espontánea habían sido clasificados inicialmente como EF cuando realmente tras el estudio con protocolo ampliado se confirmó que tenían una EGI. Pudimos registrar crisis (ausencias o mioclonías) en cuatro pacientes; en dos pacientes fueron desencadenadas por el protocolo de activación convencional y en dos por el protocolo ampliado. En estos dos pacientes uno de ellos sólo presentó crisis tras la activación con las praxias (paciente 11, tabla 1).
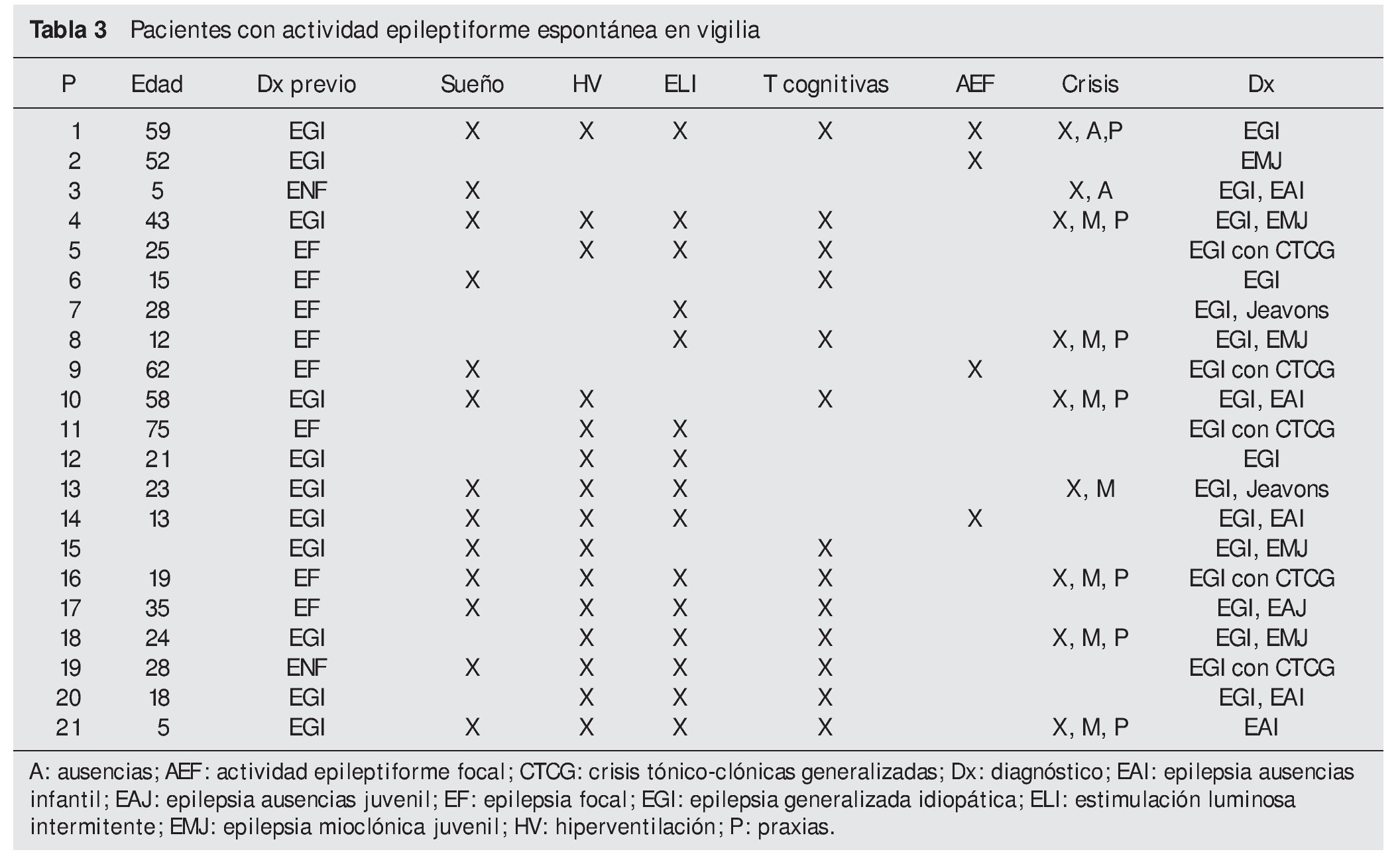
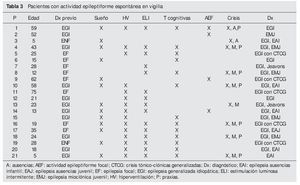
El grupo con EGI con AE espontánea (tabla 3) incluyó 21 pacientes (62 %), con una edad media de 31,5 años (rango 5-75 años), de los cuales 12 (57 %) fueron mujeres. Del total de pacientes, 11 (52 %) presentaron AE durante el sueño, 15 (71,5 %) con HV, 15 (71,5 %) con la ELI y 13 (62 %) con tareas cognitivas. De igual forma que en el grupo anterior, nueve pacientes (43 %) habían sido diagnosticados erróneamente de EF previo a la realización del protocolo de activación ampliado.
Discusión
Matsuoka et al. han mostrado que las tareas cognitivas pueden precipitar descargas de punta onda generalizada, a veces asociadas con crisis de ausencia o mioclónicas 4. En nuestro estudio, las tareas cognitivas desencadenaron AE en un 56 % de los pacientes, de manera que nuestros resultados apoyan los hallazgos observados por otros autores y animan a utilizar estas tareas en la práctica clínica habitual. Cuando se registra AE generalizada espontánea, es decir, sin maniobras de activación, el diagnóstico puede establecerse de una forma fiable sin necesidad de otros datos complementarios. No obstante, no es infrecuente encontrar pacientes con estudios previos no concluyentes o sin actividad epileptiforme. Es en este subgrupo de pacientes donde puede ser más interesante aplicar protocolos más extensos que ayuden a esclarecer el diagnóstico. El protocolo de activación ampliado puede ser especialmente útil en pacientes sin AE espontánea, donde puede ser difícil determinar, tomando como base la historia clínica, si el paciente presenta una EF o una EGI. En nuestro estudio, este subgrupo de pacientes no es infrecuente y constituyó el 38 % de los pacientes evaluados. En este grupo de pacientes, las tareas cognitivas desencadenaron descargas en casi un 50 % de los casos, y esta tarea de activación tan sólo fue superada por la privación del sueño.
La rentabilidad del estudio VEEG es máxima cuando, además de registrar actividad epileptiforme, podemos registrar las crisis habituales del paciente, contribuyendo de manera definitiva a clasificar el tipo de epilepsia. En este sentido, en el subgrupo de pacientes sin AE espontánea y por lo tanto difíciles de clasificar, cuatro pacientes tuvieron crisis epilépticas desencadenadas por el protocolo ampliado. De ellos, en un paciente la praxis fue la única tarea de activación que precipitó las crisis habituales del paciente, modificando el diagnóstico de EF a EGI. En nuestro estudio, los hallazgos (crisis y/o AE generalizada) registrados durante la monitorización VEEG con protocolo de activación ampliado modificó el diagnóstico en un número sustancial de pacientes; un 41 % de los pacientes que inicialmente fueron clasificados como EF por los estudios realizados previamente cambiaron su diagnóstico a EGI. Los resultados de este estudio son relevantes porque implican una mayor capacidad para llegar a un diagnóstico más correcto, lo que a su vez permite establecer un tratamiento más adecuado y un pronóstico más preciso.
Conclusión
La aplicación de un protocolo de activación ampliado es un procedimiento sencillo que puede ser aplicado por un equipo de enfermería entrenado en VEEG y epilepsia. Este protocolo complementa los procedimientos de activación cerebral convencionales, sin aumentar el coste ni la duración del estudio, y es especialmente útil en pacientes con epilepsias no clasificadas o sin AE espontánea, donde aumenta el rendimiento diagnóstico de la monitorización VEEG.
Agradecimientos
Agradecemos a los pacientes evaluados en la Unidad de Epilepsia del Hospital Ruber Internacional su disposición para realizar las tareas incluidas en los protocolos de activación; sin su colaboración este trabajo no habría sido posible.
Premio de Investigación en Enfermería Neurológica en la XVII Reunión Anual de Barcelona, 18-19 de noviembre de 2010.
*Autor para correspondencia.
Correo electrónico:agnagel@ruberinternacional.es (A. Gil-Nagel)
aceptado el 12 de abril de 2011