La enfermedad de Parkinson es una enfermedad neurodegenerativa que puede llevar progresivamente a la pérdida de calidad de vida y a la discapacidad. El tratamiento convencional es efectivo en los primeros años de evolución de la enfermedad, pero cuando aparecen complicaciones motoras y no motoras que repercuten claramente en su calidad de vida, es momento de plantearse otros tipos de terapias. En la actualidad disponemos de tres terapias avanzadas que han demostrado ser beneficiosas para este tipo de pacientes: la estimulación cerebral profunda, la terapia con bomba de apomorfina subcutánea y la terapia con bomba de Duodopa® a través del duodeno.
ObjetivosConocer el impacto de las terapias avanzadas en la calidad de vida de los pacientes con EP, medida con la escala PDQ39.
MétodoEstudio observacional, prospectivo, no aleatorizado. Se realizaron tres mediciones (n=20) con la PDQ39 en diferentes momentos: 1.ª previa al inicio de la TAV, 2.ª a los 3-5 meses y 3.ª a los 6-10 meses.
ResultadosLos hombres que se tratan con terapias avanzadas son menores y con menos años de evolución de la enfermedad que las mujeres. Existen diferencias significativas entre las tres medidas para el bienestar emocional, el estigma, el estado cognitivo y la valoración total de la PDQ39. Asimismo, hay diferencias significativas, por parejas, a largo plazo para los mismos. El apoyo social empeora al someterse a estas terapias.
ConclusionesSe refleja la mejoría, de manera global (PDQ39 total), en la calidad de vida medida con la escala PDQ39 en los pacientes sometidos a TAV en el Complejo Hospitalario de Navarra en un periodo de 10 meses.
Parkinson's disease is a neurological chronic degenerative disorder which can lead to a progressive loss of quality of life and to incapacitation. Conventional treatment is effective in the first years of the disease, but other kinds of therapy should be considered upon the onset of motor and non-motor complications that are clearly impacting quality of life. At present we have three advanced therapies which have proven beneficial for these types of patients, namely: deep cerebral stimulation, subcutaneous apomorphine infusion pumps, and continuous intestinal levodopa infusion to the duodenum (Duodopa®).
ObjectivesTo assess the impact of advanced therapies on the quality of life of patients with Parkinson's disease, measured using the PDQ39 scale.
MethodsObservational, prospective, non-randomized study. Three measurements (n=20) using the PDQ39 scale were taken: the first before initiating advanced therapy, the second at 3-5 months, and the third at 6-10 months.
ResultsMen who receive treatment with advanced therapies are younger and have fewer years of progression of the disease than women. There were significant differences between the three measurements in terms of emotional well-being, stigmatization, cognitive state and overall assessment of PDQ39. Similarly, significant differences were found in pairs in the long term in these parameters. Social support deteriorated after entering advanced therapy.
ConclusionsSignificant global improvements were observed in quality of life, measured using the PDQ39 scale, of patients with Parkinson's disease, treated with advanced therapy in the Hospital of Navarre for 10 months.
La enfermedad de Parkinson (EP) es una enfermedad neurodegenerativa que pertenece a un grupo de enfermedades denominadas trastornos del movimiento1 (TTMM). Afecta al área encargada de coordinar la actividad, el tono muscular y los movimientos. Es el segundo trastorno neurodegenerativo con mayor prevalencia detrás de la enfermedad de Alzheimer2–4.
Consiste en una pérdida progresiva de neuronas específicas para el correcto funcionamiento de los movimientos, que implica menos conexiones con otras células nerviosas, lo que conlleva gradualmente a la pérdida de calidad de vida y a la discapacidad5.
El tratamiento convencional oral y transdérmico, basado en la combinación de levodopa y agonistas dopaminérgicos principalmente, resulta beneficioso durante, al menos, 3 o 5 años de evolución de la enfermedad6. Después de 5 a 10 años tratados con estos fármacos, en un 50-70% de los pacientes, comienzan a aparecer fluctuaciones motoras y no motoras que repercuten en su calidad de vida7. Este fenómeno hace que los pacientes experimenten periodos de buena movilidad y otros de mala situación motora y es entonces cuando se hace necesario realizar ajustes en la medicación oral que, en la mayor parte de los pacientes, consigue un razonable control de los síntomas8. Sin embargo, hay pacientes en los que, aun cuando siguen respondiendo de forma positiva, la duración de la respuesta es insuficiente, haciéndolos pasar una gran parte del día (por consenso se suele considerar>25% del tiempo despierto) en mala situación motora. Esta fase de la enfermedad se denomina enfermedad de Parkinson avanzada (EPA)6, para la cual disponemos de tres estrategias diferentes para el mejor manejo de su situación clínica, mediante terapias avanzadas (TAV)9:
- •
La cirugía con estimulación cerebral profunda (ECP) en el núcleo subtalámico/pálido10.
- •
La terapia con bomba de apomorfina subcutánea en perfusión contínua11,12.
- •
La terapia con infusión continua de levodopa en gel a través del duodeno, Duodopa®13.
Siendo la EP una enfermedad fundamentalmente motora cabe pensar que el control de la sintomatología de la enfermedad tiene repercusión en la calidad de vida. Existe relación entre la escala motora Unified Parkinson's Disease Rating Scale (UPDRS) y la calidad de vida y la duración del tiempo en OFF14, para mayor puntación alcanzada en la Unified Parkinson's Disease Rating Scale y más duración del tiempo en OFF, peor calidad de vida. No se debe obviar que también aparecen síntomas no motores que pueden causar gran sufrimiento, y que pueden llegar a provocar la aceleración en la progresión de la discapacidad15,16. Las TAV disminuyen el tiempo OFF por lo que esto repercute en una mejor calidad de vida.
Los pacientes candidatos, la elección del tipo de TAV y el momento en que esta debe iniciarse es competencia de los neurólogos expertos en TTMM, que lo llevan a cabo de acuerdo con las guías de práctica clínica de la Sociedad Española de Neurología y el consenso de expertos9. La selección de pacientes, está condicionada al balance entre el beneficio previsible y los riesgos e inconvenientes de cada uno de ellos por lo que no todos los pacientes van a ser subsidiarios de alguna de las TAV7,17.
En la década de los 90 el Dr. Martínez-Martín estudia la calidad de vida de los pacientes con EP y se hace palpable la necesidad de desarrollar instrumentos de medición de la misma. En uno de sus estudios validó la versión española del cuestionario Parkinson's Disease Questionnaire (PDQ39), para la evaluación de la calidad de vida que hemos utilizado en nuestro artículo. La PDQ39 evalúa aspectos físicos, emocionales y psicosociales de la calidad de vida18.
Según García-Ramos et al. se hallan mejorías estadísticamente significativas en la PDQ39 en pacientes sometidos a ECP, y señalan la importancia de la valoración pre- y posquirúrgica de los pacientes con EP19.
Santos-García et al. demuestran, en pacientes tratados con Duodopa®, la mejoría en las fluctuaciones motoras y discinesias con reducción del tiempo off/día y tiempo con discinesias/día después de un periodo de 3-31 meses. Además mejora la escala PDQ39 y Schwab & England20.
Según Kulisevsky, el tratamiento con apomorfina subcutánea mejora la calidad de vida de los pacientes, aunque, al parecer, se está instaurando de manera tardía la terapia9.
En Martí y Kulisevsky, el 52% de los pacientes y cuidadores consideraron que se podían haber beneficiado antes del tratamiento con infusión de apomorfina, al tratarse de una terapia menos invasiva, completamente reversible, fácil de instaurar, y de menor coste12.
HipótesisLos pacientes con EP avanzada tratados con TAV mejoran en las respuestas motoras y no motoras repercutiendo favorablemente en su calidad de vida medida a través del cuestionario PDQ39.
ObjetivosConocer el impacto de las TAV en la calidad de vida de los pacientes con EPA medida a través del cuestionario PDQ39.
Evaluar y comparar la calidad de vida medida con la PDQ39 de los pacientes con EPA antes de iniciar el tratamiento con una TAV, a los 3-5 meses, y a los 6-10 meses.
MétodosEstudio observacional, prospectivo, de serie de casos con muestreo condicional. Se ha llevado a cabo en las consultas de Neurología de Atención Especializada del Complejo Hospitalario de Navarra. La población a estudio estuvo formada por todos los pacientes diagnosticados de EP que recibieron tratamiento con alguna de las tres tipologías de tratamiento avanzado arriba mencionadas en el tiempo de reclutamiento de los mismos. La selección de los pacientes comenzó en mayo de 2014 y finalizó en junio de 2016. Asumiendo un nivel de confianza del 95%, con valores medios para las dimensiones del PDQ39 de 40 puntos y desviación típica igual a 20, el tamaño muestral de 20 permitiría detectar como significativo, con una potencia del 80%, un cambio en las dimensiones del PDQ39 de 12 puntos tras el inicio de la TAV. Los cálculos se realizaron con la librería «samplesize» del programa estadístico R, versión 2.13.2.
Se solicitó la colaboración de los pacientes para la cumplimentación de la primera medición del cuestionario PDQ39 en el momento en el que el neurólogo experto en TTMM consideró que era un buen candidato a iniciar una TAV. La segunda, se hizo coincidir con la visita médica al centro hospitalario en un periodo de 3-5 meses posteriores al inicio de la TAV. Se realizó una tercera medición, también haciéndola coincidir con las visitas al centro hospitalario a los 6-10 meses, con el fin de observar la evolución a largo plazo. Se le entregó un consentimiento informado para su firma. El estudio recibió la aprobación del Comité de Ética asistencial del Complejo Hospitalario de Navarra.
La escala PDQ39 contiene 39 ítems distribuidos en 8 dominios diferentes que corresponden a la movilidad (10 ítems), las actividades de la vida diaria (6 ítems), el bienestar emocional (6 ítems), el estigma (4 ítems), el apoyo social (3 ítems), el estado cognitivo (4 ítems), la comunicación (3 ítems), el malestar corporal (3 ítems).
La movilidad mide las dificultades: en realizar una actividad de ocio, dificultad en realizar las tareas de la casa, dificultad para cargar paquetes, problemas para caminar distancias cortas, preocupación por caerse en público. Las actividades de la vida diaria miden dificultades para el aseo personal, para vestirse solo, cortar alimentos, sostener un vaso firme y los problemas en abotonarse la ropa o atarse los zapatos. El bienestar emocional valúa la sensación de depresión, soledad, enfado, o ansiedad. El estigma valora la tendencia a ocultar su enfermedad, a evitar comer o beber en público, y los sentimientos de vergüenza por tener EP y preocupación por la reacción de la gente hacia ellos. El apoyo social evalúa los problemas en las relaciones personales de su entorno, falta de apoyo de sus familiares según las necesidades del paciente. El estado cognitivo evalúa los problemas de concentración, la sensación de tener mala memoria, alucinaciones y/o pesadillas. La comunicación mide: la dificultad para hablar, para comunicarse adecuadamente con la gente, sensación de sentirse ignorado. El malestar corporal contabiliza: los calambres musculares, dolores en articulaciones, sensaciones desagradables de calor o frío.
En cada ítem de cada dominio, se les pregunta con qué frecuencia ha tenido el problema en el último mes, y las posibles opciones de respuesta son: 0 (nunca), 1 (ocasionalmente), 2 (algunas veces), 3 (frecuentemente), 4 (siempre o incapaz de hacerlo). La puntuación de los dominios se calcula sumando las puntuaciones obtenidas en cada uno de los ítems y se divide por la máxima puntuación posible en ese dominio. El resultado representa porcentaje de problemas, así pues a mayor número más problemas presentan.
La descripción de la muestra se realizó mediante los estadísticos descriptivos como media, mediana, desviación estándar y rango intercuartíl, según el tipo de variable. Hemos estudiado la posible asociación de los tipos de tratamiento aplicados sobre cada uno de los dominios que estudia la PDQ39. Paso previo al estudio se analizó la normalidad de los datos en los tres tiempos de medición de las variables utilizando el estadístico Shapiro-Wilk. En el caso en que se obtuvo normalidad en los datos, se utilizó el test de ANOVA de medidas repetidas y en el de no normalidad se realizó el test no paramétrico para muestras emparejadas de Friedman. Además para determinar en qué momento se producen las diferencias, se llevó a cabo la comparación de medias por pares, con el test de Bonferroni, en el caso de normalidad y de medianas con el test de Wilcoxon, para no normal. La significación se consideró para p<0,05. Todo ello se llevó a cabo con el programa estadístico SPSS versión 20.
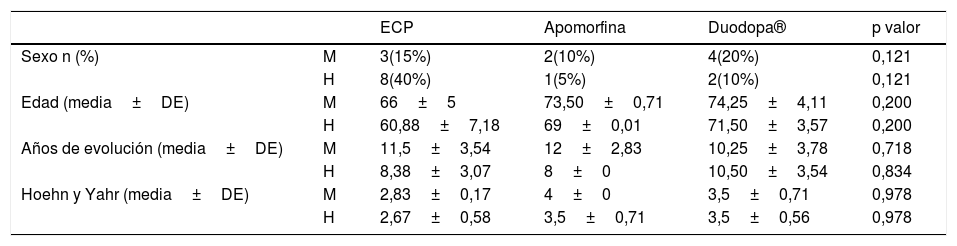
ResultadosDe los 20 pacientes que iniciaron TAV, 11 fueron hombres y 9 mujeres. La media de edad estuvo comprendida entre 67,5±7,67, y observamos que los hombres sometidos a ECP fueron menores que las mujeres que se operaron, con una media de edad de 60,88±7,18 frente a los 66±5 años de las mujeres (tabla 1). Los hombres que iniciaron tratamiento con Duodopa® o con bomba de apomorfina, también fueron menores que las mujeres que iniciaron dichos tratamientos. Según los estadios de Hoehn y Yahr de la enfermedad, los pacientes tratados con ECP presentaban menor evolución de la misma, siendo menor en hombres frente a mujeres. En la terapia de infusión de apomorfina, no existen diferencias de estadificación. En cuanto a la Duodopa ® los hombres presentaban enfermedad más evolucionada que las mujeres (tabla 2).
Características basales de la muestra
| ECP | Apomorfina | Duodopa® | p valor | ||
|---|---|---|---|---|---|
| Sexo n (%) | M | 3(15%) | 2(10%) | 4(20%) | 0,121 |
| H | 8(40%) | 1(5%) | 2(10%) | 0,121 | |
| Edad (media±DE) | M | 66±5 | 73,50±0,71 | 74,25±4,11 | 0,200 |
| H | 60,88±7,18 | 69±0,01 | 71,50±3,57 | 0,200 | |
| Años de evolución (media±DE) | M | 11,5±3,54 | 12±2,83 | 10,25±3,78 | 0,718 |
| H | 8,38±3,07 | 8±0 | 10,50±3,54 | 0,834 | |
| Hoehn y Yahr (media±DE) | M | 2,83±0,17 | 4±0 | 3,5±0,71 | 0,978 |
| H | 2,67±0,58 | 3,5±0,71 | 3,5±0,56 | 0,978 |
DE: desviación estándar; ECP: estimulación cerebral profunda;. H: hombre; M: mujer.
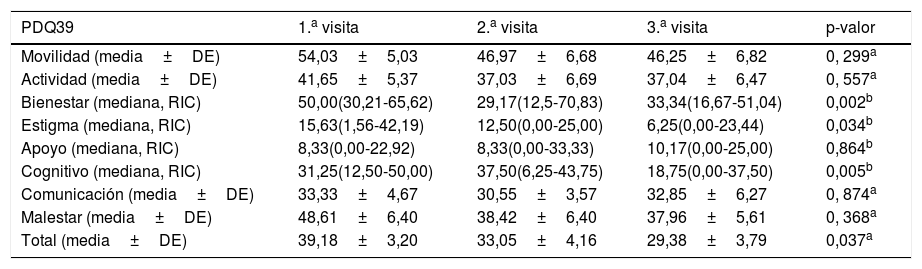
Resultados contrastes multivariantes de PDQ39
| PDQ39 | 1.a visita | 2.a visita | 3.a visita | p-valor |
|---|---|---|---|---|
| Movilidad (media±DE) | 54,03±5,03 | 46,97±6,68 | 46,25±6,82 | 0, 299a |
| Actividad (media±DE) | 41,65±5,37 | 37,03±6,69 | 37,04±6,47 | 0, 557a |
| Bienestar (mediana, RIC) | 50,00(30,21-65,62) | 29,17(12,5-70,83) | 33,34(16,67-51,04) | 0,002b |
| Estigma (mediana, RIC) | 15,63(1,56-42,19) | 12,50(0,00-25,00) | 6,25(0,00-23,44) | 0,034b |
| Apoyo (mediana, RIC) | 8,33(0,00-22,92) | 8,33(0,00-33,33) | 10,17(0,00-25,00) | 0,864b |
| Cognitivo (mediana, RIC) | 31,25(12,50-50,00) | 37,50(6,25-43,75) | 18,75(0,00-37,50) | 0,005b |
| Comunicación (media±DE) | 33,33±4,67 | 30,55±3,57 | 32,85±6,27 | 0, 874a |
| Malestar (media±DE) | 48,61±6,40 | 38,42±6,40 | 37,96±5,61 | 0, 368a |
| Total (media±DE) | 39,18±3,20 | 33,05±4,16 | 29,38±3,79 | 0,037a |
DE: desviación estándar; RIC: rango intercuartíl.
En el estudio tenemos 1 fumador, 5 exfumadores y 14 nunca han fumado.
Los dominios en los cuales se observan mayores porcentajes de problemas previos al inicio de la TAV en orden de importancia son (tabla 2): la movilidad, seguido del malestar corporal, el bienestar emocional y las actividades de la vida diaria, los que menos problemas presentaron fueron el apoyo social, el estigma y la comunicación. Hay diferencias estadísticamente significativas intrasujetos en el bienestar emocional, el estigma, el estado cognitivo y la valoración total de la escala.
A continuación, nuestro interés estuvo enfocado en determinar el momento en el cual se produjeron las diferencias. En la valoración total de la escala PDQ39, hay mejorías (p=0,029), entre la medición basal y a más de 6 meses tras el inicio de la TAV. Encontramos cambios significativos en el bienestar emocional, entre la primera medición y la segunda (p=0,034) y se mantiene en el tiempo, entre la primera medición y la última (p=0,004). En el estado cognitivo encontramos diferencias entre la primera y última valoración (p=0,013).
Analizando por separado los datos de los pacientes sometidos a ECP, hemos hallado mejorías en el bienestar emocional, malestar corporal (p=0,033, p=0,027), el estigma, el estado cognitivo (p=0,025, p=0,004) y la valoración total de la escala PDQ39 (p=0,017). Y por parejas, hemos encontrado que la mejoría en el bienestar emocional y malestar corporal se presenta entre la primera medición y la segunda medición (p=0,001 y p=0,010), no manteniéndose en el tiempo. Observamos que las diferencias se encuentran entre la primera medición y la última en el caso del estado cognitivo (p=0,004). En cuanto a la valoración total de la PDQ39, se encuentra entre la primera medición y la segunda (p=0,007) y también entre la primera y la última (p=0,013) evidenciando que se mantiene en el tiempo la mejoría global de la calidad de vida.
En la tabla 2 se aprecia que la movilidad, las actividades de la vida diaria, el apoyo social, la comunicación y el malestar corporal, no presentan diferencias. En los casos de la movilidad, de las actividades de la vida diaria y del malestar corporal las tendencias muestran un descenso pronunciado al iniciar la TAV y se suaviza entre la segunda y tercera medición. Sin embargo, la comunicación desciende rápidamente de la primera a la segunda medición para que después aumente de nuevo, llegando a valores muy parecidos a los recogidos en la primera medición. Por el contrario, en el apoyo social, aumentan los problemas al comenzar con la TAV y se mantienen prácticamente igual hasta la última medición. Se puede apreciar que en estas variables estudiadas en esta escala de calidad de vida, los pacientes van mejorando de la primera visita a la tercera, a excepción de apoyo social que tiene un comportamiento contrario.
Discusión y conclusionesEn el presente trabajo se refleja la mejoría, de manera global (PDQ39 total), en la calidad de vida medida en esta escala en los pacientes sometidos a TAV en el Complejo Hospitalario de Navarra en un periodo de 10 meses.
Con respecto a las características epidemiológicas, resulta interesante observar que los hombres acceden a cualquiera de las TAV con menor edad, menos años de evolución de la enfermedad y estadio menor que las mujeres, a excepción de los tratados con Duodopa®, que se encuentran en estadios similares. La media de edad de los pacientes sometidos a ECP es mayor haciendo una comparativa con otros estudios21–24. Se tiene en cuenta que para la ECP existe un criterio de exclusión por edad superior a 70-72 años10.
Con respecto a los pacientes que inician tratamiento con Duodopa®, también observamos que en nuestro estudio son de mayor edad acorde con los estudios13,25–27.
En la terapia con bomba de apomorfina también son las mujeres las que inician las TAV más tarde, dato contrastado también con otros estudios28,29.
Aunque la EP afecta alrededor de un 50% más a hombres que a mujeres30, la selección de pacientes candidatos (9 mujeres y 10 hombres) no ha mostrado esa proporción al tratarse de una muestra que no ha sido aleatorizada, y además, se ha llevado a cabo en un único centro.
En el presente estudio se puede destacar que hay un impacto (mejoría) en la percepción de la calidad de vida en los pacientes con EPA, a más de 6 meses tras la instauración de la TAV. A la hora de la comparación intrasujetos, considerándose que la primera valoración hace referencia a los pacientes con la terapia convencional, que van a iniciar una TAV para mejor control de los síntomas, y la segunda y tercera medición corresponde a los mismos pacientes con la TAV instaurada, comprobamos que perciben mejoría a medio plazo, aun cuando se trata de una enfermedad neurodegenerativa crónica y progresiva.
En la muestra, el 95% de los pacientes son no fumadores. Cabe señalar que el hecho de fumar está asociado a un riesgo reducido de padecer EP coincidiendo con Campdelacreu31.
El único dominio que no experimenta mejoría es el apoyo social, ya que estos pacientes presentan mayor demanda de apoyo social al iniciar las TAV, hallazgo que concuerda con otros estudios consultados32,33.
En cuanto a la comunicación, se demuestra que en los problemas en el habla, se produce un leve descenso a corto plazo tras iniciar la TAV, que no se mantiene a medio plazo. Este efecto podría estar justificado por el hecho de que, más de la mitad de la muestra, fue sometida a ECP y según Kulisevky et al.9 los problemas del habla que no mejoran con la levodopa, tampoco lo hacen con la cirugía.
Con respecto al malestar corporal, nos encontramos con una contrastada mejoría a corto y medio plazo. El porcentaje más bajo de problemas se asocia a los pacientes tratados con terapia de Duodopa® y ECP, tal y como se refleja en la literatura existente10,13.
Las líneas futuras de investigación podrían ser ampliar el tamaño muestral, diversificar el tipo de pacientes y extender el estudio a otros centros de referencia. Se podrían recoger datos relevantes sobre sociodemográficos para tener una vista más amplia sobre la muestra. Estudiar a fondo las características de la población de estudio: comorbilidades, tratamientos previos, factores educacionales y psicológicos. Medir desde otra perspectiva la calidad de vida de los pacientes de Parkinson: UDPRS, alteración de la marcha, Swang & England, síntomas no motores, quejas de memoria, síntomas psicóticos asociados. Además, identificar otros factores que influyan en la CVRS de estos pacientes y sus cuidadores.
Ya que en Navarra se inician más tarde que en otros hospitales nacionales e internacionales, se puede analizar la influencia de una temprana intervención terapéutica con las TAV y los efectos sobre la CVRS de los pacientes de Parkinson.
LimitacionesEl presente estudio tiene importantes limitaciones, por un lado las derivadas de la metodología empleada, no permitiendo llegar a conclusiones más allá de la descripción de los participantes de la muestra. Por otro lado, las ocasionadas por no haber tenido en cuenta otras variables importantes en la asociación, como por ejemplo las descritas anteriormente o las relacionadas con el estado socioeconómico, o con la sobrecarga del cuidador etc. que tienen mucho que ver con la valoración integral del paciente desde un modelo biopsicosocial.
A destacar la limitación del reducido tamaño muestral.
Consideramos que la falta de significación estadística en el grupo de terapia con bomba de Duodopa®, a pesar de la tendencia marcada de mejoría podría ser debida a la escasez de la muestra.
Respecto a las pérdidas, teniendo en cuenta el tipo de población del que procede la muestra (pacientes con una enfermedad crónica avanzada, con mayor morbimortalidad y un importante porcentaje sometido a cirugía intracraneal), es interesante señalar que solo hubo dos. La pérdida de estos dos pacientes no ha afectado significativamente la potencia del estudio y, por tanto, no invalida sus resultados y conclusiones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.