El objetivo de este ensayo clínico aleatorizado, doble ciego, de brazos paralelos y controlado por placebo fue evaluar el efecto clínico del consumo de Lactobacillus rhamnosus SP1 en un polvo de disolución oral, adicional a la terapia periodontal no quirúrgica.
Material y métodoCuarenta y nueve sujetos fueron examinados para participar en este estudio. Veintiocho participantes sistémicamente sanos, con diagnóstico de periodontitis crónica, fueron reclutados y monitorizados clínicamente en el tiempo basal, 3 y 6 meses después de la terapia periodontal. Los parámetros clínicos registrados fueron presencia de placa, sangrado al sondaje, profundidad al sondaje y pérdida de inserción clínica. Todos recibieron terapia periodontal no quirúrgica, incluyendo pulido y alisado radicular (PAR), y fueron asignados aleatoriamente al grupo experimental (PAR+probiótico, n=14) o control (PAR+placebo, n=14). Luego de la última sesión de PAR debieron ingerir un sobre con polvo de disolución oral de Lactobacillus rhamnosus SP1 o placebo, una vez al día durante 3 meses.
ResultadosAmbos grupos mejoraron sus parámetros clínicos en todos los tiempos evaluados. Además, el grupo experimental redujo significativamente el porcentaje de sitios, dientes y número de participantes con profundidad al sondaje≥5mm entre el tiempo basal y los 6 meses postratamiento.
ConclusionesLa administración oral de L. rhamnosus SP1 asociado a la terapia periodontal genera similares mejorías en los parámetros clínicos comparado con solo usar terapia periodontal en el tratamiento de la periodontitis crónica en adultos.
The aim of this double- blind, placebo- controlled parallel- arm, randomised clinical trial was to evaluate the clinical effects of a sachet of Lactobacillus rhamnosus SP1-containing probiotic as an adjunct to non-surgical therapy.
Material and methodFourty- nine subjects were screened for their elegibility to participate in this study. Twenty-eight systemically healthy volunteers with chronic periodontitis were enrolled and monitored clinically at baseline, and at 3 and 6 months after therapy. Clinical parameters measured included plaque index, bleeding on probing, pocket probing depths (PPD), and clinical attachment loss. Patients received non-surgical therapy including scaling and root planing (SRP), and were randomly assigned to a test (SRP+probiotic, n=14) or control (SRP+placebo, n=14) group. The administration of a sachet of Lactobacillus rhamnosus SP1 probiotic once a day for 3 months commenced after the last session of SRP.
ResultsBoth test and control groups showed improvements in clinical parameters at all time points evaluated. Furthermore, at initial visits and after 6 months follow-up, the test group showed a statistically significant reduction in percentage of sites, teeth, and number of participants with PPD≥5mm.
ConclusionsThe results of this trial indicate that oral administration of L. rhamnosus SP1 sachets during initial therapy resulted in similar clinical improvements compared to SRP alone.
La periodontitis crónica es una enfermedad inflamatoria producida por una infección que afecta a la integridad de los tejidos de soporte del diente1, y que implica la interacción del biofilm subgingival con la respuesta inmunoinflamatoria del hospedero y la subsecuente alteración de la homeostasis ósea y conectiva2. Se considera un problema de salud pública debido a la alta prevalencia de destrucción periodontal en la población mundial3, y también en la población adulta chilena4, considerándose como una causa significativa de pérdida dentaria5, teniendo un impacto negativo en la calidad de vida de la población6 y asociándose a un tratamiento de alto costo5.
El tratamiento gold standard para la periodontitis es el pulido y alisado radicular (PAR), cuyo objetivo es el control de la infección, eliminando los organismos patogénicos que se encuentran en el biofilm subgingival y en otros nichos, y estableciendo una comunidad microbiana compatible con la salud del hospedero7. Sin embargo, no siempre es efectivo como tratamiento único en la mejoría de los parámetros clínicos, por lo que se puede asociar a la prescripción de antibioterapia sistémica8. Esta modalidad de tratamiento elimina toda la microbiota, independiente de su patogenicidad, además de asociarse con el incremento de la resistencia antibiótica y la frecuente recolonización de los sitios tratados9. Por este motivo ha sido necesaria la búsqueda de nuevos paradigmas de tratamiento periodontal.
Los probióticos son «microorganismos vivos, principalmente bacterias, que son seguros para el consumo humano y, cuando son ingeridos en cantidades suficientes, tienen efectos benéficos para la salud humana, más allá de la nutrición básica»10.
A nivel periodontal se ha reportado un mayor aumento de los niveles de inserción clínica y una mayor disminución de la profundidad al sondaje, índice gingival, índice de placa, índice de sangrado y recuento de periodontopatógenos en los pacientes con periodontitis crónica a los que se les han administrado probióticos orales. Sin embargo, revisiones recientes han concluido que se requieren más estudios que evalúen la eficacia de los probióticos en el mantenimiento de la salud oral, y que permitan comprender sus mecanismos de acción11.
El objetivo de este trabajo fue evaluar la efectividad del uso sistémico del probiótico Lactobacillus rhamnosus SP1 en los parámetros clínicos periodontales de pacientes con periodontisis crónica tratados con terapia periodontal no quirúrgica.
Material y métodoSe realizó un ensayo clínico aleatorizado, doble ciego, de brazos paralelos y controlado por placebo.
Población de estudio y criterios de selecciónEl universo consistió en participantes adultos que acudían a la Facultad de Odontología de la Universidad de Chile en busca de tratamiento periodontal. El tamaño muestral se determinó considerando una diferencia ≥1mm entre los grupos para cambios en el nivel de inserción clínica (NIC), una desviación estándar de 0,9mm, un α de 0,05 y un poder estadístico de un 80%, siendo 14 participantes en cada grupo. Los criterios de inclusión fueron: tener al menos 35 años de edad, ≥14 dientes naturales, excluyendo los terceros molares, y ≥10 dientes posteriores. Se diagnosticó periodontitis crónica en presencia de ≥5 dientes con profundidad al sondaje ≥5mm, pérdida de inserción clínica ≥3mm, sangrado al sondaje ≥20% de los sitios periodontales examinados y pérdida ósea alveolar determinada radiográficamente. Se excluyeron los sujetos que habían recibido tratamiento periodontal previo, con enfermedades sistémicas diagnosticadas, estado de gravidez, uso de terapia con anticoagulantes o antibióticos o antiinflamatorios no esteroideos en los 6 meses anteriores al estudio.
Ensayo clínicoLuego del reclutamiento (Alicia Morales) los participantes fueron asignados aleatoriamente mediante una tabla de números aleatorios generada computacionalmente (Carolina Galaz) al grupo control o al grupo experimental, considerando el género, la edad y el hábito tabáquico. La examinadora y los tratantes estuvieron cegados frente a esta asignación durante toda la duración del estudio.
Todos los participantes, luego del examen clínico, recibieron una instrucción de higiene oral y tratamiento periodontal completo por periodoncistas expertos calibrados (Paola Carvajal y Claudia Godoy), consistente en terapia periodontal no quirúrgica con pulido y alisado radicular (PAR) por cuadrante. El grupo experimental (PAR+probiótico) recibió sobres con polvo de disolución oral que contenían L. rhamanosus SP1 (2×107 CFU/sobre) (Macrofood SA, Santiago, Chile). El grupo control (PAR+placebo) recibió sobres con polvo de disolución oral que contenía placebo con el mismo sabor, textura y apariencia que los del grupo experimental. Luego de terminado el PAR ambos grupos debían disolver un sobre en 150ml de agua, y consumirlo una vez al día, después del cepillado dental nocturno, durante 3 meses. La aleatorización fue ocultada mediante el uso de contenedores de igual apariencia, numerados secuencialmente, que contenían las dosis para el período comprendido del estudio. Se realizó una monitorización del seguimiento de las indicaciones durante todo el período del estudio.
Se efectuó un seguimiento de los participantes, hasta los 6 meses postratamiento realizando terapia de soporte periodontal cada 3 meses.
Examen clínicoSe realizó un examen clínico basal, 3 y 6 meses postratamiento periodontal por un investigador (Alicia Morales) previamente calibrado (correlación intraclase mayor a 0,8). Se examinaron todos los dientes en 6 sitios periodontales (mesio-bucal, medio-bucal, disto-bucal, mesio-lingual/palatino, medio-lingual/palatino, disto-lingual/palatino), excepto los terceros molares. Mediante el uso de una sonda periodontal manual de primera generación (UNC-15, Hu Friedy Mfg. Co. Inc., Chicago, IL, EE. UU.), se registró la profundidad al sondaje (PS), posición de la encía, presencia y/o ausencia de placa y sangrado y se calcularon el índice de sangrado (IS), índice de placa (IP) y el nivel de inserción clínica (NIC).
Variables primarias y secundariasLa variable primaria fue el cambio en la media del NIC. Las variables secundarias fueron cambio en el promedio de la PS, IS e IP, cambio en el porcentaje promedio de sitios, dientes y sujetos con PS≥5mm, ≥6mm, ≥7mm.
Un subanálisis se realizó teniendo en consideración la PS inicial, lo que permite la comparación con otros ensayos clínicos del tema12,13. Un saco periodontal se consideró como leve si su PS inicial fue ≤3mm, como moderado si su PS inicial era de 4-6mm y como severo si era ≥7mm.
Consideraciones éticasEl protocolo de este estudio fue revisado y aprobado por el Comité Ético y Científico de la Facultad de Odontología de la Universidad de Chile (n.° 2012/08). Además, se rigió según el marco legal que regula a los ensayos clínicos en Chile, y en conformidad con la Declaración de Helsinki de 1975, revisada en el año 2000. El número de identificación del ensayo fue NCT02283736 (clinicaltrials.gov).
A cada participante se le explicó de forma detallada los objetivos del estudio y le fue entregado el formulario de consentimiento informado para que fuese firmado por él con su aprobación para el ingreso al estudio.
Análisis de resultados y métodos estadísticosEl análisis de datos se realizó según intención de tratar. Se consideró al paciente como la unidad de análisis.
Se utilizó el test de Shapiro Wilk para determinar la normalidad de las variables cuantitativas continuas. Los test U-Mann Whitney y el test exacto de Fisher fueron utilizados para evaluar la existencia de diferencias entre el grupo probiótico y placebo de variables continuas y categóricas, respectivamente. Para realizar comparaciones múltiples intergrupales de variables continuas, fue utilizado el test de U-Mann Whitney con corrección de Bonferroni. El análisis de las diferencias intragrupo, es decir, de la variación entre la medición final y la inicial tanto en el grupo probiótico como placebo fue realizado con el test de McNemar, prueba de rango con signo de Wilcoxon y prueba de rango con signo de Wilcoxon con corrección de Bonferroni, para las comparaciones múltiples. Para los test U-Mann Whitney, prueba de rango con signo de Wilcoxon, test de McNemar y test exacto de Fisher la significación estadística fue p<0,05. Para todos los test con corrección de Bonferroni se consideró como estadísticamente significativo p<0,005.
Para el análisis se utilizó Microsoft Excel® 2011 y el paquete estadístico Stata® 11 para Mac (StataCorp, College Station, TX).
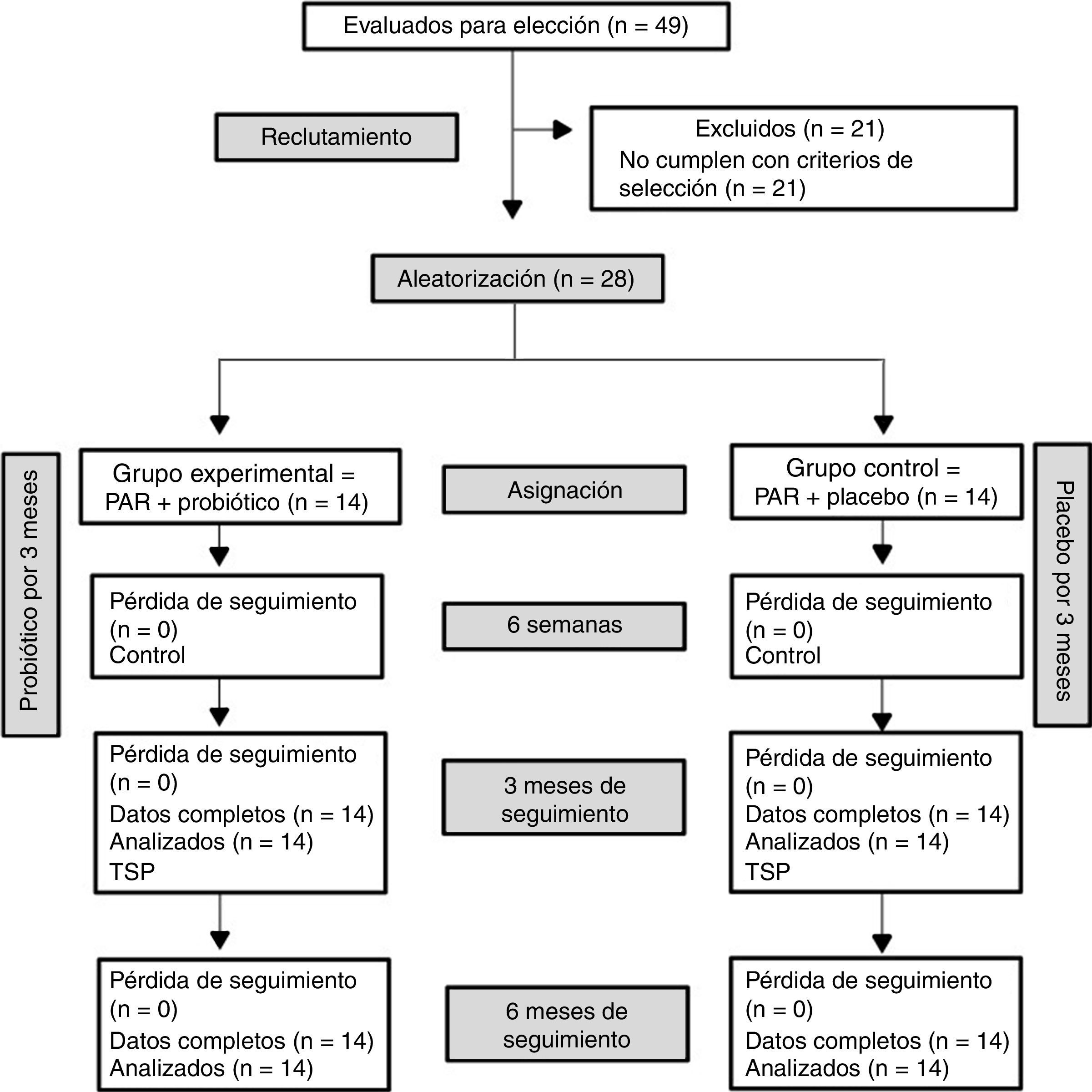
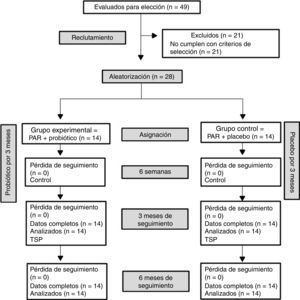
ResultadosEste ensayo clínico aleatorizado fue realizado entre los años 2014 y 2015. Luego de la fase de reclutamiento, donde 21 individuos fueron excluidos por no cumplir con los criterios de selección, 28 ingresaron en el estudio clínico, 14 en el grupo experimental y 14 en el grupo control, sin pérdidas durante la ejecución del estudio o reportes de efectos adversos (fig. 1). Todos los pacientes asistieron a los controles y terapias de soporte periodontal.
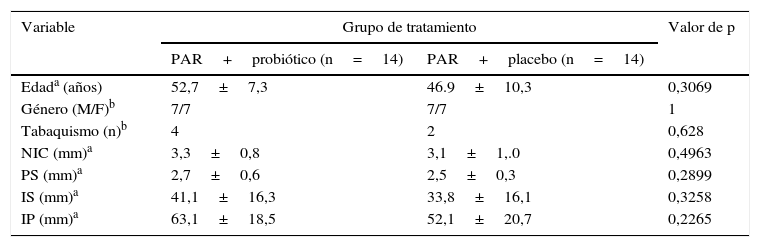
En los parámetros basales de los adultos no se observaron diferencias significativas (p>0,05) entre ambos grupos (tabla 1).
Mediciones clínicas basales
| Variable | Grupo de tratamiento | Valor de p | |
|---|---|---|---|
| PAR+probiótico (n=14) | PAR+placebo (n=14) | ||
| Edada (años) | 52,7±7,3 | 46.9±10,3 | 0,3069 |
| Género (M/F)b | 7/7 | 7/7 | 1 |
| Tabaquismo (n)b | 4 | 2 | 0,628 |
| NIC (mm)a | 3,3±0,8 | 3,1±1,.0 | 0,4963 |
| PS (mm)a | 2,7±0,6 | 2,5±0,3 | 0,2899 |
| IS (mm)a | 41,1±16,3 | 33,8±16,1 | 0,3258 |
| IP (mm)a | 63,1±18,5 | 52,1±20,7 | 0,2265 |
IP: índice de placa; IS: índice de sangrado; NIC: nivel de inserción clínica; PAR: pulido y alisado radicular; PS: profundidad al sondaje.
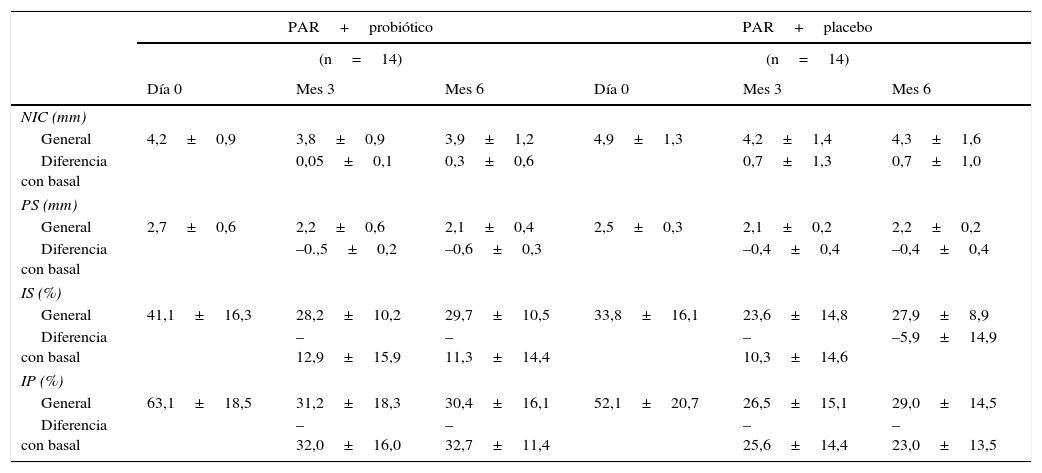
En la tabla 2 se reportan los cambios en la media del NIC, PS, IS e IP a los días 0, así como a los 3 y 6 meses después del tratamiento periodontal. La disminución de la PS fue mayor en el grupo experimental a los 3 meses postratamiento periodontal (–0,5 vs –0,4mm, p>0,005) y a los 6 meses (–0,6mm vs –0,4mm, p>0,005). Resultados similares se observaron en relación con el IS e IP (p>0,005). La media de la ganancia de inserción fue mayor en el grupo control que en el experimental (mes 3: 0,7 vs 0,05; mes 6: 0,7 vs 0,3; p>0,005). Sin embargo, no se reportaron diferencias significativas inter ni intragrupales.
Comparación intragrupo e intergrupo de los parámetros clínicos de ambos grupos de tratamiento (media±DE)
| PAR+probiótico | PAR+placebo | |||||
|---|---|---|---|---|---|---|
| (n=14) | (n=14) | |||||
| Día 0 | Mes 3 | Mes 6 | Día 0 | Mes 3 | Mes 6 | |
| NIC (mm) | ||||||
| General | 4,2±0,9 | 3,8±0,9 | 3,9±1,2 | 4,9±1,3 | 4,2±1,4 | 4,3±1,6 |
| Diferencia con basal | 0,05±0,1 | 0,3±0,6 | 0,7±1,3 | 0,7±1,0 | ||
| PS (mm) | ||||||
| General | 2,7±0,6 | 2,2±0,6 | 2,1±0,4 | 2,5±0,3 | 2,1±0,2 | 2,2±0,2 |
| Diferencia con basal | –0.,5±0,2 | –0,6±0,3 | –0,4±0,4 | –0,4±0,4 | ||
| IS (%) | ||||||
| General | 41,1±16,3 | 28,2±10,2 | 29,7±10,5 | 33,8±16,1 | 23,6±14,8 | 27,9±8,9 |
| Diferencia con basal | –12,9±15,9 | –11,3±14,4 | –10,3±14,6 | –5,9±14,9 | ||
| IP (%) | ||||||
| General | 63,1±18,5 | 31,2±18,3 | 30,4±16,1 | 52,1±20,7 | 26,5±15,1 | 29,0±14,5 |
| Diferencia con basal | –32,0±16,0 | –32,7±11,4 | –25,6±14,4 | –23,0±13,5 | ||
DE: desviación estándar; IP: índice de placa; IS: índice de sangrado; NIC: nivel de inserción clínica; PAR: pulido y alisado radicular; PS: profundidad al sondaje.
Comparación intragrupo: prueba de rango con signo de Wilcoxon con corrección de Bonferroni, p<0,005.
Comparación intergrupo: prueba U-Mann Whitney con corrección de Bonferroni, p<0,005.
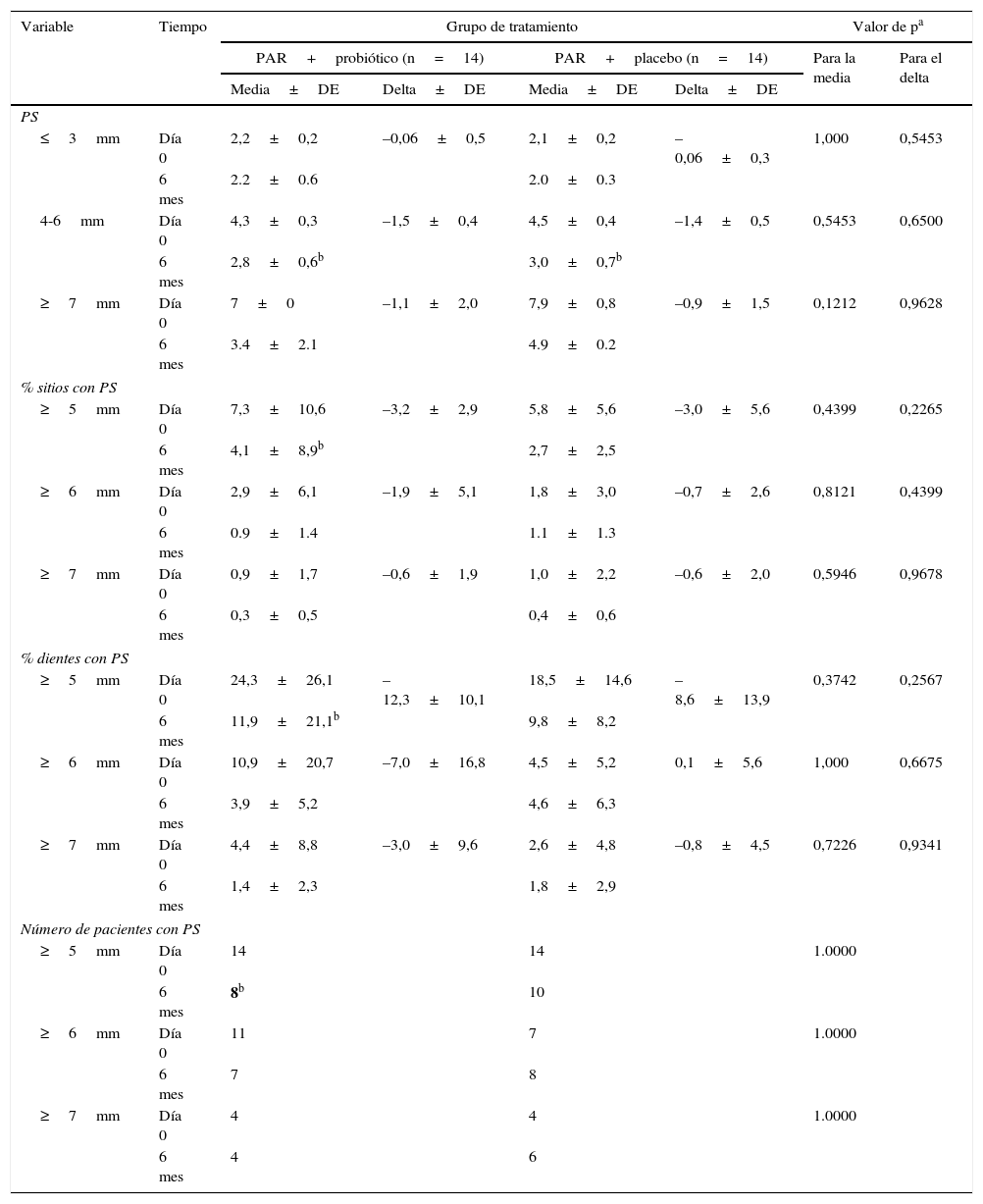
Al estratificar la PS en sitios periodontales leves, moderados y severos, comparando el mes 6 postratamiento periodontal versus las mediciones basales, se observa una disminución significativa en la media de la PS de los sitios moderados, tanto en el grupo experimental (2,8 vs 4,3, p<0,05) como en el control (3,0 vs 4,5mm, p<0,05). Al analizar diferentes umbrales de PS se observó una disminución significativa del porcentaje de sitios con PS≥5mm en el grupo experimental (4,1% vs 7,3%, p<0,05). Lo mismo ocurrió con porcentaje de dientes (11,9 vs 24,3%, p<0,05) y de participantes (8 vs 14, p<0,05) en este grupo. El porcentaje de sitios y dientes con PS≥6mm también presentó una mayor disminución en el grupo experimental (p>0,05). Sin embargo, no se reportaron diferencias significativas intergrupales (tabla 3).
Media±DE de las mediciones de la profundidad al sondaje en el día 0 y al sexto mes postratamiento clínico
| Variable | Tiempo | Grupo de tratamiento | Valor de pa | ||||
|---|---|---|---|---|---|---|---|
| PAR+probiótico (n=14) | PAR+placebo (n=14) | Para la media | Para el delta | ||||
| Media±DE | Delta±DE | Media±DE | Delta±DE | ||||
| PS | |||||||
| ≤3mm | Día 0 | 2,2±0,2 | –0,06±0,5 | 2,1±0,2 | –0,06±0,3 | 1,000 | 0,5453 |
| 6 mes | 2.2±0.6 | 2.0±0.3 | |||||
| 4-6mm | Día 0 | 4,3±0,3 | –1,5±0,4 | 4,5±0,4 | –1,4±0,5 | 0,5453 | 0,6500 |
| 6 mes | 2,8±0,6b | 3,0±0,7b | |||||
| ≥7mm | Día 0 | 7±0 | –1,1±2,0 | 7,9±0,8 | –0,9±1,5 | 0,1212 | 0,9628 |
| 6 mes | 3.4±2.1 | 4.9±0.2 | |||||
| % sitios con PS | |||||||
| ≥5mm | Día 0 | 7,3±10,6 | –3,2±2,9 | 5,8±5,6 | –3,0±5,6 | 0,4399 | 0,2265 |
| 6 mes | 4,1±8,9b | 2,7±2,5 | |||||
| ≥6mm | Día 0 | 2,9±6,1 | –1,9±5,1 | 1,8±3,0 | –0,7±2,6 | 0,8121 | 0,4399 |
| 6 mes | 0.9±1.4 | 1.1±1.3 | |||||
| ≥7mm | Día 0 | 0,9±1,7 | –0,6±1,9 | 1,0±2,2 | –0,6±2,0 | 0,5946 | 0,9678 |
| 6 mes | 0,3±0,5 | 0,4±0,6 | |||||
| % dientes con PS | |||||||
| ≥5mm | Día 0 | 24,3±26,1 | –12,3±10,1 | 18,5±14,6 | –8,6±13,9 | 0,3742 | 0,2567 |
| 6 mes | 11,9±21,1b | 9,8±8,2 | |||||
| ≥6mm | Día 0 | 10,9±20,7 | –7,0±16,8 | 4,5±5,2 | 0,1±5,6 | 1,000 | 0,6675 |
| 6 mes | 3,9±5,2 | 4,6±6,3 | |||||
| ≥7mm | Día 0 | 4,4±8,8 | –3,0±9,6 | 2,6±4,8 | –0,8±4,5 | 0,7226 | 0,9341 |
| 6 mes | 1,4±2,3 | 1,8±2,9 | |||||
| Número de pacientes con PS | |||||||
| ≥5mm | Día 0 | 14 | 14 | 1.0000 | |||
| 6 mes | 8b | 10 | |||||
| ≥6mm | Día 0 | 11 | 7 | 1.0000 | |||
| 6 mes | 7 | 8 | |||||
| ≥7mm | Día 0 | 4 | 4 | 1.0000 | |||
| 6 mes | 4 | 6 | |||||
DE: desviación estándar; PAR: pulido y alisado radicular; PS: profundidad al sondaje.
Este ensayo clínico aleatorizado, doble ciego, de brazos paralelos y controlado por placebo evaluó el efecto de la administración diaria por 3 meses de L. rhamnosus SP1 en conjunto con la terapia periodontal no quirúrgica con PAR en el tratamiento de adultos con periodontitis crónica. Los resultados de este estudio muestran que los parámetros clínicos periodontales mejoraron en el grupo experimental y en el control, sin embargo en el grupo que consumió probiótico además se observó una disminución significativa en el porcentaje promedio de sitios, dientes y participantes con PS≥5mm a los 6 meses de seguimiento.
La fortaleza de este ensayo es que sigue las propuestas de la única revisión sistemática sobre los efectos de los probióticos en la enfermedad periodontal11, y es el primer estudio que evalúa el efecto clínico del probiótico L. rhamnosus SP1 en el tratamiento de la periodontitis crónica, y que tiene un seguimiento de 6 meses postratamiento. A pesar de que adicionar el probiótico a la terapia periodontal en estos pacientes no generó efectos benéficos superiores a la terapia periodontal por sí sola en las variables determinadas por la media, los datos sí sugieren un efecto benéfico del probiótico al realizar el subanálisis debido a la disminución en promedio de sitios y de dientes con PS≥5mm, y por lo tanto de pacientes con esa característica. Según la valoración de riesgo de Lang y Tonetti14, el número de sitios residuales con PS<5mm se asocia con estabilidad periodontal. Además, estos resultados son congruentes con la literatura. Es así como Tekce et al.12 evaluaron el efecto clínico del uso de Lactobacillus reuteri Prodentis en conjunto con el PAR en el tratamiento de la periodontitis crónica, reportando una mejora en los parámetros clínicos en el grupo experimental versus el placebo. Ince et al.15 evaluaron el efecto de L. reuteri Prodentis en el tratamiento inicial de la periodontitis crónica, concluyendo que este probiótico puede ser un suplemento útil en el tratamiento de sacos periodontales moderados. Además, la evidencia sugiere que el uso de probióticos genera mayor reducción en el número de periodontopatógenos en la placa subgingival posterior al tratamiento periodontal12,13,16, así como una disminución de las citoquinas proinflamatorias17.
La selección del «mejor» probiótico para la salud oral es aún un tema controvertido18. Seleccionamos a L. rhamnosus SP1, también conocido como L. rhamnosus GG, como el probiótico del presente estudio por su capacidad de inhibir el crecimiento de periodontopatógenos a través de bacteriocinas19, su resistencia al estrés medioambiental20, su efecto inmunomodulador17,21 y su incapacidad para influenciar la acidogenicidad de la placa supragingival22.
Los modos, dosificación y frecuencia de administración también puede afectar los resultados del tratamiento, aunque los motivos subyacentes aún no están dilucidados23. En este estudio se utilizó polvo de disolución oral de L. rhamnosus SP1 con 2×107 unidades formadoras de colonia (UFC) al día, iniciando el tratamiento inmediatamente posterior a la última sesión de PAR, con una frecuencia de consumo de un sobre al día durante 3 meses. Teughels et al.13 utilizaron comprimidos de L. reuteri Prodentis 1×108UFC, 2 veces al día por 3 meses, siendo administrado inmediatamente después de un procedimiento de desinfección de boca completa. Un método similar fue usado por Vivekananda et al.24, con la excepción que los pacientes iniciaron el uso del probiótico 21 días después del PAR, y no se realizó ninguna desinfección adicional de la cavidad oral. En ambos estudios se reportó una mejoría significativa en la media del NIC, PS, IS, IP e índice gingival. Shimauchi et al.25 utilizaron comprimidos de Lactobacillus salivarius WB21 6,7×108UFC, 3 veces al día por 2 meses, reportando una mayor reducción en la PS e IP en los pacientes fumadores. Al parecer, independiente de los diferentes métodos de administración, el uso de ciertas cepas de probiótico en conjunto con el PAR genera beneficios consistentes a lo largo de los estudios.
El asunto de la seguridad también genera un interés especial durante el uso de probióticos. Ninguno de los participantes de nuestro estudio presentó reacciones adversas. Estos resultados son congruentes con lo reportado en la literatura12,13,15,20,24,25. Además, el cumplimiento fue exitoso según lo reportado por los participantes, lo que indica que el uso del probiótico no representaría una molestia para ellos. A pesar de lo anterior, la principal limitación de este estudio es la variable que se utilizó para determinar el tamaño muestral (NIC). Sin embargo, este estudio muestra la aplicabilidad del uso de probióticos, y puede servir de base para estudios con cohortes más grandes.
ConclusionesEl uso de L. rhamnosus SP1 durante la terapia inicial genera resultados similares en los parámetros clínicos al ser comparado con el tratamiento periodontal solo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio fue financiado por FONDECYT 1130570 y CONICYT-PCHA/Magíster Nacional/2013-22130172.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.