La clorhexidina (CHX) en solución acuosa se hidroliza generando paracloroanilina (PCA), proceso acelerado por el aumento de temperatura y pH. El uso de ultrasonido endodóntico (USE), basado en fenómenos de oscilación, cavitación, microcorriente acústica, genera calor afectando la CHX.
ObjetivoIdentificar y cuantificar in vitro cambios fisicoquímicos, temperatura y pH, y la cantidad de PCA formada con el uso de ultrasonido endodóntico sobre soluciones de CHX al 2%.
Materiales y métodosLa CHX 2% se activó durante 30, 60, 90 y 120seg con USE a 24.500Hz, midiendo antes y después de activación: pH, temperatura y cantidad de PCA, leyendo a 375nm en curva de calibración de estándares de PCA y formación, registrando el espectro de absorción mediante espectrofotómetro UV-visible.
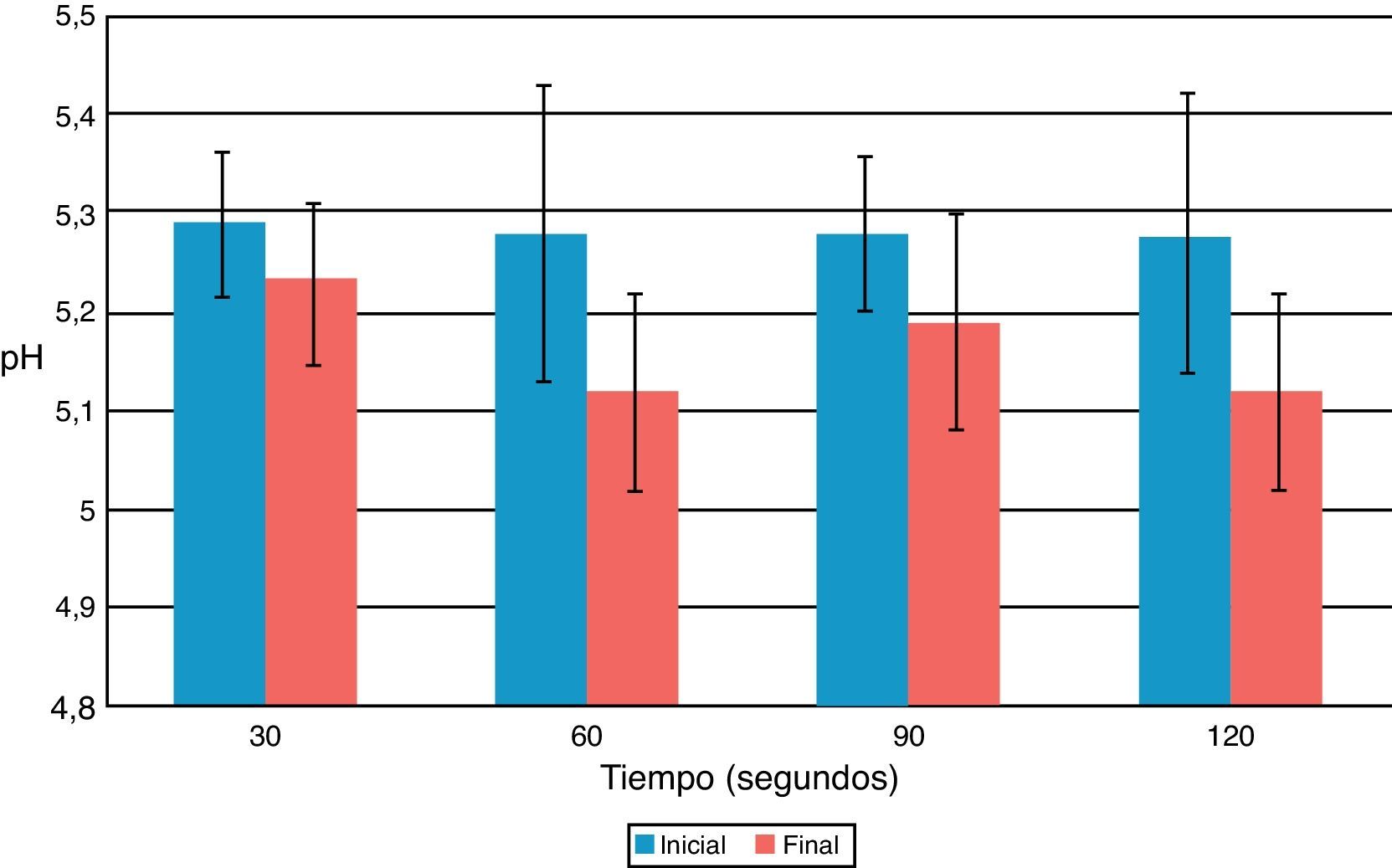
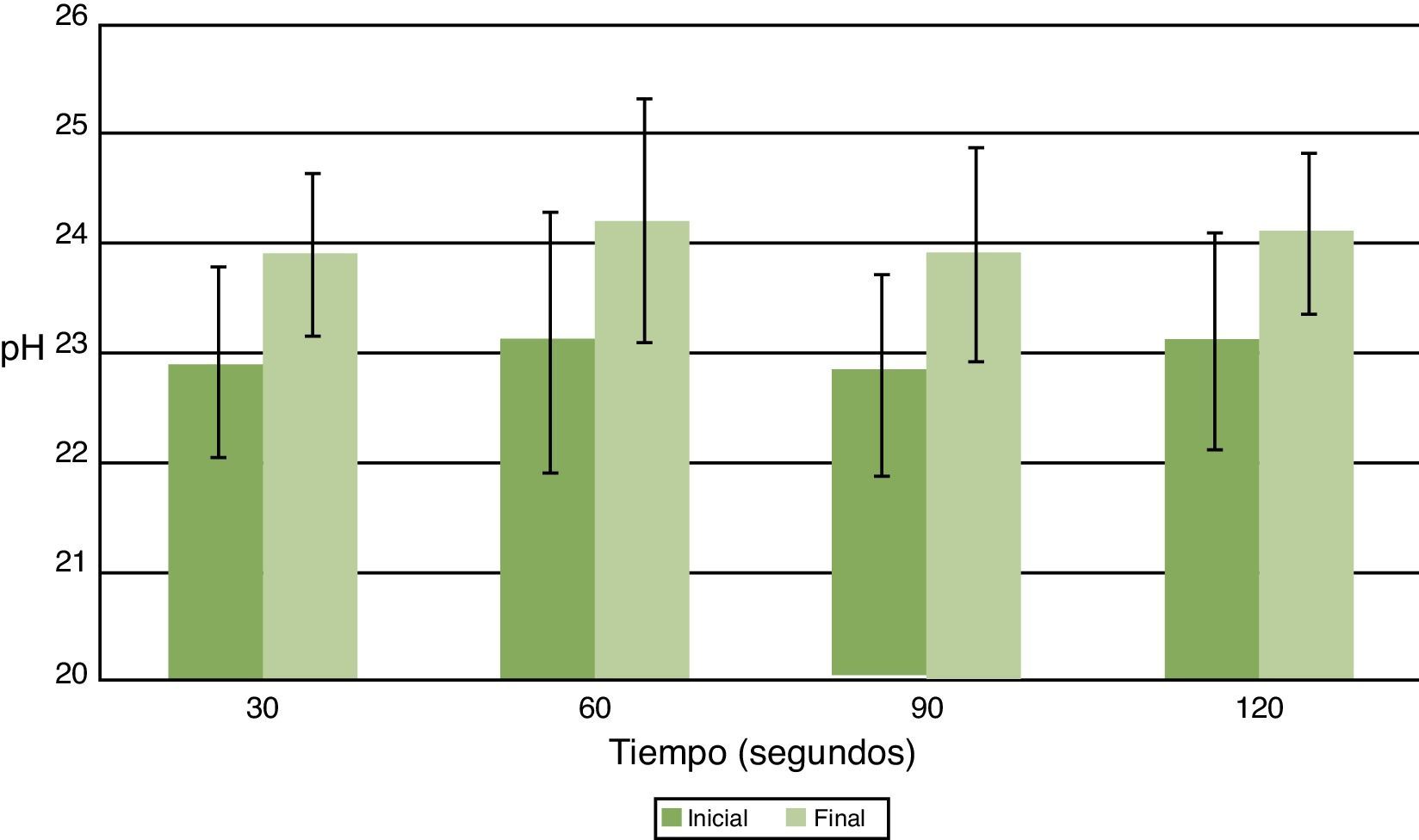
ResultadosEl USE aumentó la temperatura en 1°C independiente del tiempo de aplicación y acidificó la solución de CHX 2%, sin variaciones significativas en pH y temperatura. No se observó coloración ni formación de precipitado en muestras activadas por USE a los diferentes tiempos. Las muestras no presentaron valores medibles de PCA a 375nm. Los espectros de absorción de CHX 2% y activadas por USE por más de 60seg presentaron curvas espectrales, peaks y valores de absorbancia diferentes.
ConclusionesEl USE aumenta la temperatura y acidifica la solución de la CHX en todos los tiempos de aplicación. No se detectó presencia de PCA por espectrofotometría visible. Muestras activadas por USE por 60seg o más presentan espectros de absorción diferentes a las muestras sin activar.
Diferencias en los espectros de absorción entre CHX activadas con USE y con CHX sin activar indicarían degradación de la CHX y posible presencia de PCA.
Chlorhexidine (CHX) in aqueous solution is hydrolysed to p-chloroaniline (PCA), a process accelerated by increasing temperature and pH. Using endodontic ultrasound based on oscillation phenomena, cavitation, and acoustic microstreaming generates heat, affecting the CHX.
ObjectiveThe aim of this in vitro study was to identify and quantify the physical-chemical changes, temperature and pH, and the amount of PCA formed by increasing the temperature of 2% CHX by endodontic ultrasound.
Materials and methodsSamples of 2% CHX were activated for 30, 60, 90, and 120seconds with endodontic ultrasound 24,500Hz. The pH and temperature were measured before and after activation, as well as the formation and amount of PCA, by reading and recording the result obtained from a standard calibration curve reading at 375nm in a UV-visible light spectrophotometer.
ResultsIndependent of time, ultrasound increased the temperature of 2% CHX by 1°C and acidified the solution. No significant changes were recorded in pH and temperature. No staining or precipitates were observed in samples ultrasonically activated at different times. Samples read at 375nm showed no measurable PCA values. Absorption spectra of 2% CHX and 2% CHX activated for more than 60seconds showed different spectral curves, peaks, and absorbance values.
ConclusionsUltrasound increased the temperature and acidified the solution of CHX for all application times. No PCA was detected by visible spectrophotometry. Absorption spectra of 2% CHX activated with ultrasound at different times differs from 2% CHX without activation.
These differences indicate degradation of CHX and possible presence of PCA.
El tratamiento endodóntico tiene como objetivo lograr un canal desinfectado y sellado tridimensionalmente para prevenir su contaminación. La compleja anatomía del sistema de canales impide que el tejido orgánico e inorgánico residual, y las bacterias que pudieran estar alojadas en ellos, puedan ser completamente eliminados, por lo que usualmente persisten1,2.
Variadas terapias antimicrobianas se han recomendado para eliminar los microorganismos desde los canales radiculares, incluyendo la instrumentación del canal radicular y el uso de diferentes irrigantes, apósitos intracanales y sellantes coronarios3,4. El éxito del tratamiento antiinfeccioso endodóntico se asocia directamente con el control de microorganismos y la disrupción del biofilm bacteriano5. La medicación del canal es la aplicación de un fármaco en el interior de la cavidad pulpar necesaria para eliminar la infección6; es requerida en infecciones crónicas, rebeldes y en tratamientos endodónticos fallidos. La clorhexidina (CHX) se utiliza como medicación intracanal por su sustantividad y por su concentración7. La sustantividad antimicrobiana depende del número de moléculas de CHX disponibles para interactuar con la dentina. Por lo tanto, medicar el canal con una preparación CHX más concentrada da lugar a un aumento de la resistencia a la colonización microbiana. La sustantividad antibacteriana a concentraciones diferentes de CHX después de 5min de aplicación ha sido evaluada. Los resultados revelaron una relación directa entre la concentración de CHX y su sustantividad (Mohammadi et al., 2008)7.
La CHX se usa como irrigante endodóntico en concentraciones de 0,2% a 2%8–10. Se ha utilizado como agente antiséptico de rutina en el control de la placa dental y la reducción de la microbiota endodóntica durante la irrigación del canal radicular sin eliminar endotoxinas11,12. La molécula de CHX plantea un riesgo sistémico debido a que, al descomponerse, genera subproductos reactivos tales como para-cloroanilina (PCA)9,13. La PCA es generada por la hidrólisis de CHX en función del tiempo, pH alcalino y calor9,10. Adicionalmente, la presencia de PCA se ha detectado en soluciones de CHX9,13. Basrani et al. han observado que al calentar CHX por encima de 45°Celsius se produce la formación de PCA como subproducto14. La PCA ha sido clasificada por la Agencia Internacional para la Investigación sobre el Cáncer (IARC, 2006) en su grupo 2B, como agente posiblemente cancerígeno para los seres humanos14,15.
En la irrigación activa se integra a la terapia endodóntica el uso del ultrasonido a modo de incrementar la eliminación de detritus y microorganismos, basándose en los fenómenos de oscilación, cavitación, microcorriente acústica que además genera calor16.
El objetivo de este estudio fue identificar y cuantificar in vitro cambios fisicoquímicos, temperatura y pH, y la cantidad de PCA formado con el uso de ultrasonido endodóntico sobre soluciones de CHX al 2%.
Material y métodoConsideraciones éticasEste estudio prospectivo, experimental y explicativo in vitro recibió la aprobación del Comité de Ética de Investigación Humana de la Facultad de Odontología de la Universidad de Chile (Chile), bajo el número de protocolo FIOUCH 13-015.
MaterialesSe empleó 4-cloroanilina (Sigma-Aldrich, St. Louis, MO., EE. UU.), solución digluconato de clorhexidina al 20% en H2O (Sigma-Aldrich, St. Louis, MO., EE. UU.). Todas las soluciones y diluciones usadas en la investigación fueron preparadas en el laboratorio de química de la Facultad de Odontología de la Universidad de Chile.
Tamaño de la muestraDebido a las mínimas variaciones observadas en las mediciones experimentales intraparámetro (pH, temperatura) se fijó el tamaño de muestra en 10.
Mediciones fisicoquímicas en solución de clorhexidina al 2%En tubos eppendorf de 1,5ml se colocaron 10 muestras de 1ml de CHX al 2% y se procedió a aplicar ultrasonido endodóntico (USE) con equipo marca MECTRON® Model piezo smart (Mectron s.p.a., Carasco [GE], Italia) a una frecuencia de 24.500Hz con lima #55K de 31mm marca KERR-SYBRONENDO Model K3 (SybronEndo Corporation, 1717 West Collins Orange, CA 92867) por 30, 60, 90 y 120seg. En las muestras se procedió a medir antes y después de USE: pH, temperatura, concentración de PCA y espectrogramas de absorción.
Determinación de pHLas mediciones de pH antes y después de la aplicación de USE se hicieron con el pHmeter marca WTW, modelo pH 537 (WTW Wissenschaftlich-Technische Werkstätten GmbH, Weilheim, Alemania) calibrado entre pH 4-11.
Determinación de la temperaturaSe usó un sensor de temperatura marca WTW, modelo TFK 325 (WTW Wissenschaftlich-Technische Werkstätten GmbH, Weilheim, Alemania) conectado al pHmeter marca WTW.
Determinación de concentración de 4-cloroanilinaEstándares de PCA al 0,039mg/ml, 0,0237mg/ml, 0,0117mg/ml y 0,0039mg/ml se leyeron al máximo de 375nm en espectrofotómetro UV-visible (Thermo Spectronic Unicam UV-530 UV-Visible, Rochester, NY, EE. UU.). Se construyó curva de calibración absorbancia vs concentración de PCA y se determinó concentración de PCA de muestras tratadas con USE leyendo su absorbancia.
Espectrogramas de absorciónMuestras de CHX tratadas con USE y no tratadas y estándares de PCA se les determinó sus espectrogramas de absorción (absorbancia vs longitud onda) de 400 a 600nm en espectrofotómetro UV-visible.
Análisis estadísticoLos datos fueron analizados mediante el paquete estadístico para ciencias sociales (SPSS para Windows, versión 18.0, SPSS Inc, Chicago, IL, EE. UU.). El análisis descriptivo de las variables se realizó para caracterizar la muestra. Resultados de pH y temperatura antes y después de la aplicación de USE fueron comparados. Se llevaron a cabo los test de Shapiro Wilk y de Levene para determinar la normalidad de la distribución de datos y la homogeneidad de las varianzas. Se utilizó la prueba de «t»-test para comparar ambos grupos. Se adoptó un nivel de significación de 0,05 para todas las pruebas.
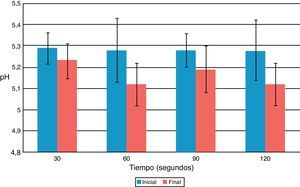
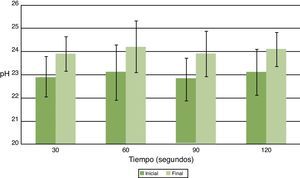
ResultadosDespués de aplicarUSE a una frecuencia de 24.500Hz por 30, 60, 90 y 120seg los valores de pH se acidificaron entre 0,06 y 0,16 unidades de pH, pero sin variaciones significativas entre el antes y el después para todos los tiempos de aplicación (fig. 1). La temperatura se incrementó entre 1,0 y 1,1°C, pero sin variaciones significativas previo y posterior a la aplicación de USE (fig. 2).
Los estándares de PCA leídos a 375nm permiten obtener la curva de calibración, de ecuación: absorbancia=1,427 [PCA]-0,040 y con un coeficiente de correlación de R2=0,999.
Determinación de p-cloroanilinaUtilizando la ecuación de la curva se transformaron los valores de absorbancia en concentración de PCA. En ninguna de la muestras tratadas con USE a diferentes tiempos se observó coloración. Todos los valores de absorbancia medidos en las muestras tratadas con USE a diferentes tiempos fueron inferiores al valor mínimo de PCA estándar de 0,0039mg/ml.
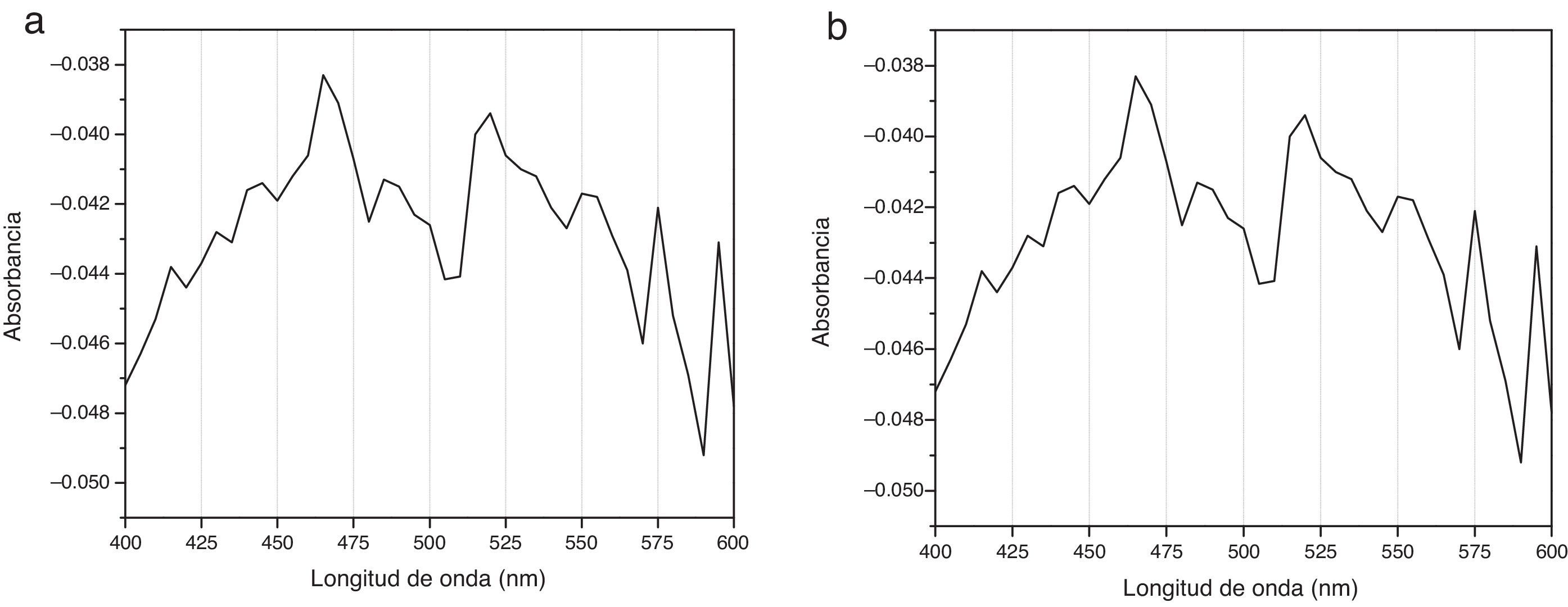
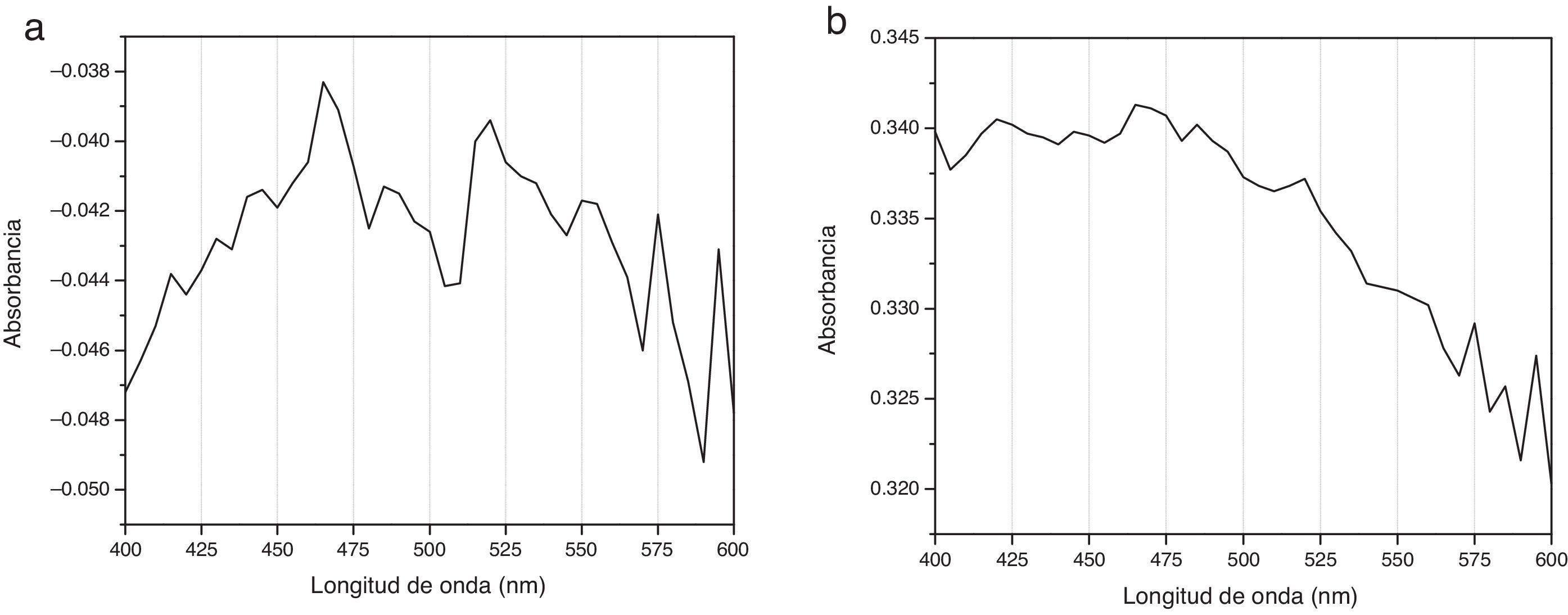
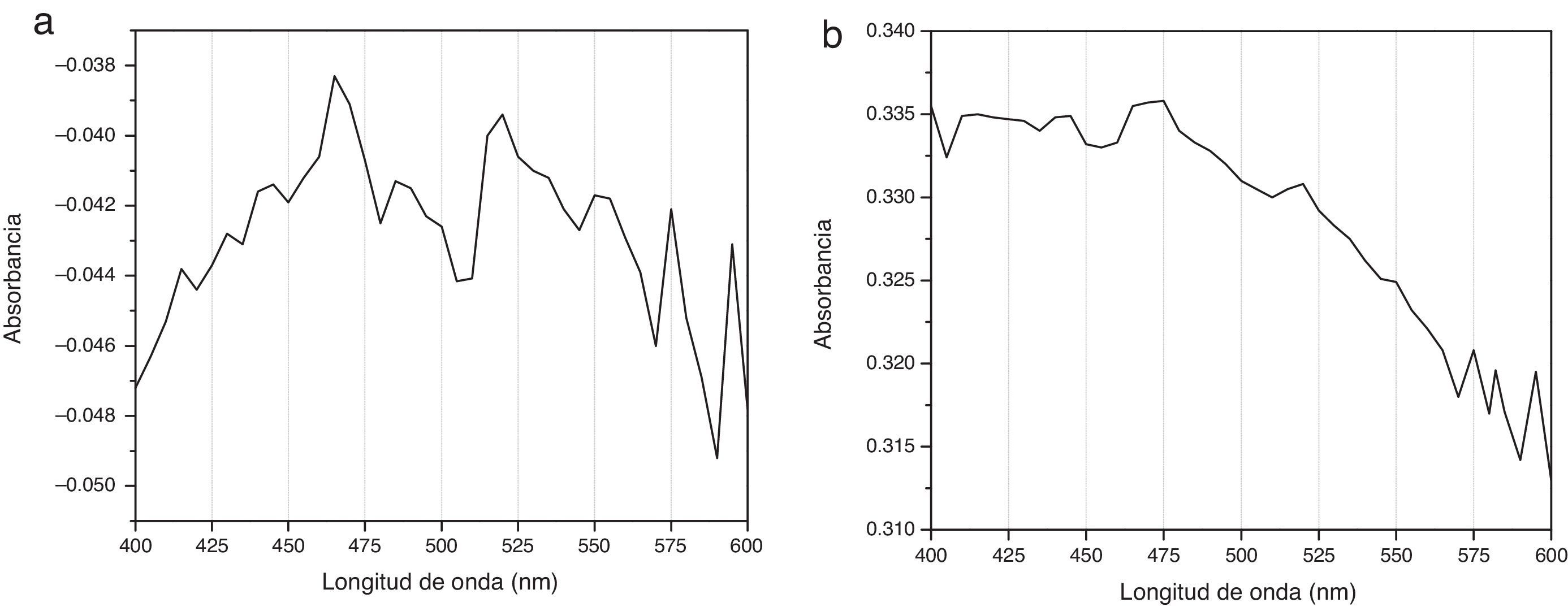
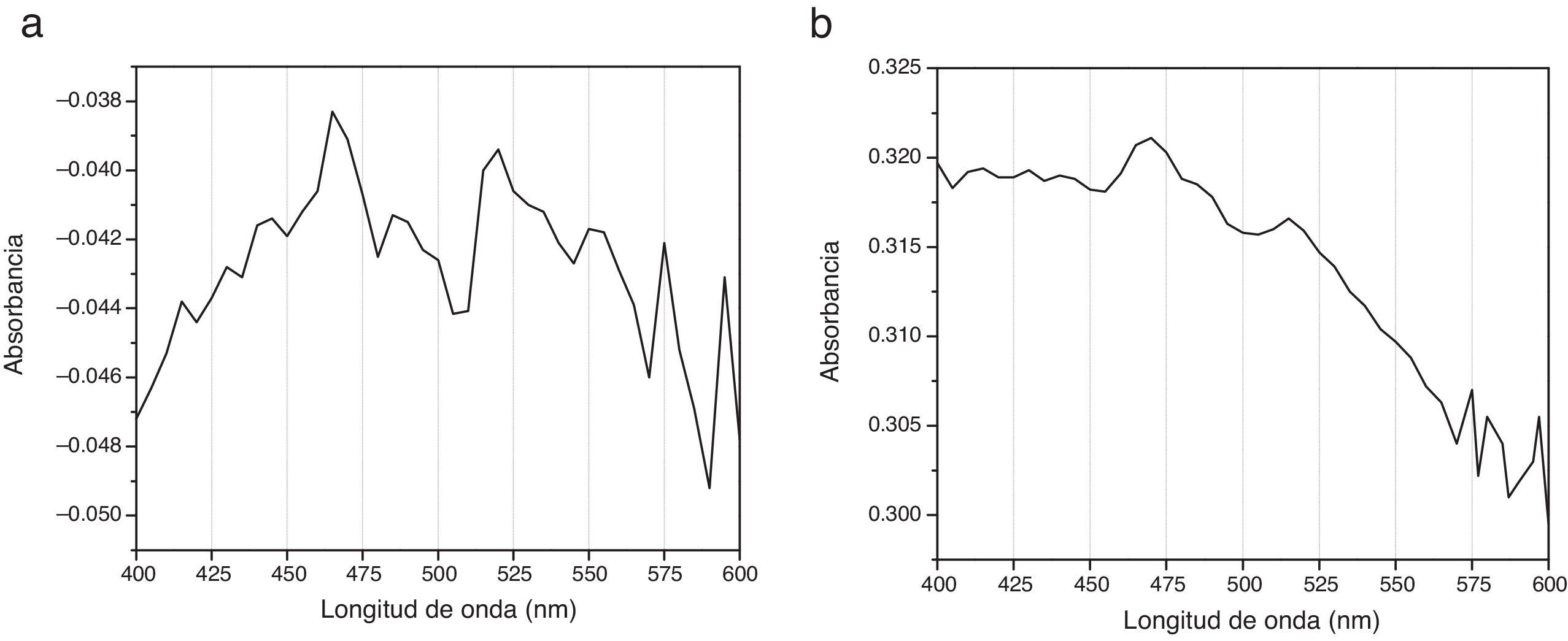
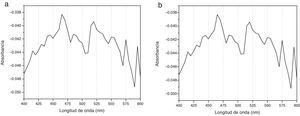
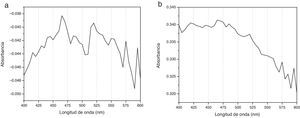
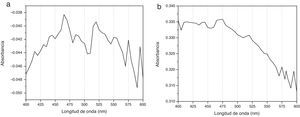
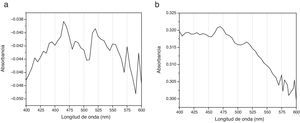
Espectrogramas de absorciónLos espectros de absorción de CHX 2% y activadas por USE presentaron curvas espectrales, peaks y valores de absorbancia diferentes. Los espectrogramas obtenidos a los diferentes tiempos de aplicación de ultrasonido endodóntico sobre clorhexidina al 2% se visualizan en la figuras 3–6.
La generación de PCA es consecuencia de la hidrólisis de la CHX, que se puede conseguir aumentando su temperatura y/o sometiéndola a un pH alcalino15.
Se evidenció que el pH de las soluciones de CHX activadas por USE presentaron una baja, pero sin variaciones significativas, lo que explicaría la ausencia de PCA coloreado o precipitado. Las soluciones de CHX son estables en el intervalo de pH de 5,0-8,0. Sobre pH 8,0 la clorhexidina precipita, y en condiciones más ácidas se produce un deterioro de la actividad debido a que es menos estable17. El ultrasonido produjo un aumento de la acidez; esto se explica por el carácter ácido de la CHX, donde un aumento de la temperatura produce una disminución de su pKa, que lleva a una disminución del pH18.
La generación de calor y aumento de la temperatura son efectos que produce la aplicación de ultrasonido dentro del canal radicular. Esto resulta de la energía liberada durante la cavitación, con implosión de microburbujas de gas o por fricción de la lima oscilatoria con las paredes del canal radicular19. La generación de calor producido por la fricción del instrumento con las paredes potencia el efecto sobre los compuestos orgánicos como hipoclorito de sodio y la clorhexidina, tal como lo proponen Cunninghan y Balekjian20, pero que puede producir la formación de microfracturas en la estructura dentinaria debido al calor generado por la fricción del instrumento y por la instrumentación con una intensidad de energía excesiva. En clínica el volumen de irrigante empleado en canales radiculares está confinado a un espacio reducido e inextensible, dándole a la microcorriente acústica o circulación del fluido una menor área de movimiento que la utilizada en este trabajo, donde el tubo eppendorf es de mayor tamaño y volumen. Por esta razón se podría esperar un mayor aumento de temperatura en los canales. Al llevar nuestros resultados a la clínica debiéramos esperar resultados equivalente pero aumentados, es decir, una mayor acidez y un mayor aumento de la temperatura, valores no descritos en la literatura. En próximos estudios se deben comprobar estos resultados, utilizando condiciones similares a las existentes en la clínica.
La hidrólisis de CHX produce PCA, reducida a temperatura ambiente, pero aumenta por calentamiento especialmente a pH alcalino21. Esta última se incrementó en 1°C en promedio por el uso del USE. Esta variación de temperatura no produjo cambios en CHX que se tradujeran en un cambio visible de color o aparición de precipitado15. Esto corroborado con mediciones cuantitativas de PCA en las muestras de CHX activadas con USE, donde no se detectaron valores mayores de PCA de 0,0039mg/ml, mínimo cuantificable por espectrofotometría visible. Estos resultados permiten establecer que el USE en la CHX al 2% no genera cambios de color ni precipitado coloreado, al utilizar parámetros similares de frecuencia (24.500Hz) y tiempo de aplicación (30, 60, 90 y 120seg) a los usados en la práctica clínica, lo que sugiere un comportamiento similar al interior de los canales radiculares.
Los efectos tóxicos de la PCA se presentan a concentraciones de 0,1 a 1,0mg/ml, y los efectos inmunotóxicos a concentraciones de 0,01 a 0,001mg/ml22. El valor mínimo cuantificable de PCA con la metodología usada es de 0,0039mg/ml, concentración que produciría efectos inmunotóxicos, pero la cuantificación espectrofotométrica no arrojó valores medibles, por lo tanto no podemos conocer cuánto PCA se formó; en última instancia se puede sostener que la PCA formada por acción del ultrasonido sería menor a 0,0039mg/ml bajo el límite de toxicidad. Para cuantificar la PCA formada se podría utilizar un método simple y rápido descrito en la literatura que permite cuantificar simultáneamente CHX y PCA mediante HPLC con detección UV. Este método presenta una buena resolución entre PCA y la CHX y tiempo de ejecución corto, permitiendo detectar PCA entre 0,05 a 10μg/l23.
Los espectros de absorción de la CHX al 2% y de las muestras tratadas con USE por 60seg o más mostraron diferentes peaks de absorbancia y curvas espectrales. El espectro de absorción de la CHX al 2% no activada presenta su máxima absorbancia a los 460nm, similar a la CHX al 2% activada por 30seg y con curvas espectrales similares, evidenciando que la CHX al 2% después de 30seg de activación con USE a 24.500Hrtz no varía su estructura molecular (fig. 3).
Diferente es el resultado de las muestras activadas por 60seg (fig. 4), 90seg (fig. 5) y 120seg (fig. 6), hay un corrimiento en el máximo de absorbancia (464nm, 470nm, 474nm) y con curvas espectrales diferentes a la molécula de CHX al 2% sin activación; esto permite postular un cambio estructural de la CHX, ya que cualquier sustancia química sometida a interacción con otro compuesto, o al variar su temperatura o presión, se asocian los cambios en propiedades fisicoquímicas como indicadores de cambio molecular. Se puede inferir entonces que la estructura de la CHX sufre un cambio, evidenciable a causa de la activación con USE a partir de los 60seg. Los resultados no permiten comprobar que la molécula generada por USE sea paracloroanilina; se sugiere que la molécula resultante de la activación por más de 60seg podría ser PCA, ya que presentan curvas espectrales y valores de absorbancia muy similares a los obtenidos con el espectro visible de la PCA estándar1. Es importante cuantificar PCA donde pueda producirse y asegurar que sus niveles sean menores al límite aceptado (0,001mg/ml), porque la PCA, como principal producto de la degradación de CHX14, puede tener efectos tóxicos, atendiendo a la recomendación actual para impurezas genotóxicas24.
ConclusionesEl USE aumenta la temperatura y acidifica la solución de la CHX en todos los tiempos de aplicación.
No se detectó presencia de PCA por espectrofotometría visible.
Muestras de CHX activadas por USE por 60seg o más presentan espectros de absorción diferentes a las muestras sin activar.
Diferencias en los espectros de absorción entre CHX activadas con USE y con CHX 2% sin activar indicarían degradación de la CHX y posible aparición de PCA.
FinanciaciónPublicación financiada por el proyecto FIOUCH 13-015, Facultad de Odontología, Universidad de Chile.
Conflicto de interesesLos autores declaran no presentar conflicto de intereses de ningún tipo.