La enfermedad periodontal es causada por complejos bacterianos subgingivales organizados en una biopelícula, que genera beneficios ecológicos y metabólicos a los microorganismos que residen en ella. Por otro lado, la biopelícula también genera ventajas contra los mecanismos de defensa del huésped representados en antimicrobianos naturales o contra los antibióticos sintéticos. Pacientes de Centroamérica y Sudamérica tienen perfiles microbiológicos similares en periodontitis agresivas como crónicas. En ambas entidades, los periodontopatógenos más frecuentes asociados con la enfermedad periodontal en los pacientes latinoamericanos son Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Prevotella nigrescens, Tannerella forsythia, Eikenella corrodens y bacilos entéricos gramnegativos. Los antibióticos han sido prescritos como apoyo a la terapia mecánica para reducir la carga bacteriana a nivel subgingival. Sin embargo, algunas especies bacterianas han desarrollado resistencia antimicrobiana debido a la prescripción indiscriminada de antibióticos, en especial en Latinoamérica. Las quinolonas representan una nueva alternativa en la terapia periodontal debido a su actividad contra los periodontopatógenos y los bacilos entéricos gramnegativos puesto que tienen una reducida resistencia bacteriana, y tienen alta difusión tisular y buena absorción. Se realizó una revisión de literatura con el propósito de brindar una actualización en el uso de antimicrobianos como terapia coayudante en el tratamiento de la periodontitis, enfocando el potencial terapéutico de la moxifloxacina como nueva alternativa.
Periodontal disease results from infection by specific subgingival bacterial complexes organized in a biofilm. Biofilm protects bacteria and other microbial pathogens from host immune system defenses and from natural and artificial antibiotics. Patients with aggressive and chronic periodontitis from Central and South American countries have similar microbiological profiles. In both entities, the most frequent periodontopathogens associated with periodontal disease in Latin American patients are Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Prevotella nigrescens, Tannerella forsythia, Eikenella corrodens and gram negative enteric rods. Supplemental antibiotics to the mechanical periodontal treatment are prescribed to reduce periodontopathic bacteria in the subgingival environment. Nonetheless, some bacterial species have developed antibiotic resistance due to their indiscriminate prescription in Latin America. Quinolones represent a new alternative in periodontal therapy, due to their activity against periodontopathogens and gram negative enteric rods, to reduced bacterial resistance, high tissue penetration, and good absorption. The aim of this review is to present an update on the use of antimicrobials as adjunctive therapy in the treatment of periodontitis, focusing on the potential therapeutic use of moxifloxacin.
La enfermedad periodontal es una infección causada por microorganismos que han colonizado los tejidos subgingivales creando una comunidad bacteriana o biopelícula adherida a la superficie dura del diente pero también asociada con el epitelio gingival crevicular. La biopelícula facilita los procesos de colonización, crecimiento y comunicación entre diversas especies microbianas, y les otorga protección contra los mecanismos de defensa del huésped y sustancias antimicrobianas naturales como sintéticas presentes en la saliva y fluido crevicular1,2.
Hoy en día se reconoce la periodontitis como una infección causada por ciertos periodontopatógenos (teoría de la placa bacteriana específica) que despiertan en el huésped, una respuesta inmuno-inflamatoria que destruye los tejidos de protección y soporte de los dientes. Socransky et al. (1998), identificaron complejos microbianos con una organización ecológica y temporal dentro de la biopelícula subgingival, donde los complejos rojo y naranja, son los más patogénicos y se denominan colonizadores tardíos; complejos amarillo, verde y púrpura, representan a los colonizadores iniciales e intermedios1.
La prescripción de los antibióticos puede estar influenciada por las diferencias en el perfil microbiológico que varía según la región geográfica o procedencia de los pacientes3,4. Así, los perfiles microbiológicos encontrados en pacientes de España, Chile y Colombia revelaron marcadas diferencias. En pacientes chilenos y colombianos, se encontró una alta prevalencia de Porphyromonas gingivalis (P. gingivalis) mayor del 83 y 65% respectivamente mientras que, pacientes españoles, revelaron una prevalencia para Prevotella intermedia (P. intermedia), Prevotella nigrescens (P. nigrescens), Peptostreptococcus micros (P. micros), Porphyromonas gingivalis (P. gingivalis), Fusobacterium spp. superior al 70%. Al comparar la prevalencia de bacilos entéricos gramnegativos (BEGN) entre pacientes españoles, chilenos y colombianos, estos últimos presentaron la mayor prevalencia (36%), seguido por los pacientes chilenos (17%); no fueron detectados BEGN en pacientes españoles. Por lo tanto, la variación en los perfiles microbiológicos entre países debe considerarse para la selección de antibióticos y de este modo, mientras en la mayoría de los países europeos, una combinación de amoxicilina y metronidazol sería quizá la más adecuada como ayudante al tratamiento mecánico periodontal, para algunos países latinoamericanos la selección puede variar.
Los BEGN son microorganismos superinfectantes resistentes a la amoxicilina y metronidazol4,5. Aunque se desconoce el papel de los BEGN en la patogénesis de las periodontitis, estos microorganismos son responsables de infecciones nosocomiales, así como de otras infecciones de carácter relevante en humanos. Enterobacter cloacae, Acinetobacter sp., Pseudomonas aeruginosa (P. aeruginosa), Klebsiella oxytoca (K. oxytoca), Enterobacter agglomerans y Klebsiella pneumoniae (K. pneumoniae), causan infecciones a nivel de las vías respiratorias superiores, vías urinarias y tracto gastrointestinal, las cuales pueden ser letales en pacientes hospitalizados, inmunocomprometidos y ancianos6,7.
Adicionalmente, los BEGN son capaces de invadir tejidos y producir diversos factores de virulencia que causan destrucción tisular, predisponen la acumulación de grasa dentro de las arterias, aumentan el colesterol y los triglicéridos. Adicionalmente, son capaces de liberar endotoxinas microbianas, producir mediadores intracelulares y moléculas de adhesión, que alteran el tráfico de granulocitos e inactivan el sistema del complemento5.
En los protocolos clínicos, la prescripción de antibióticos como coayudante del raspado y alisado radicular (RAR), es frecuentemente tomada con base en la severidad y las características clínicas de la enfermedad periodontal. Sin embargo, dado que la enfermedad periodontal es una infección polimicrobiana, tanto los complejos bacterianos como su sensibilidad antimicrobiana varían ampliamente de un sujeto a otro, e incluso en un mismo sujeto con el transcurrir del tiempo. Así, la individualización de la terapia antibiótica por medio de un diagnóstico microbiológico como de un antibiograma, son de gran utilidad para el clínico7,8.
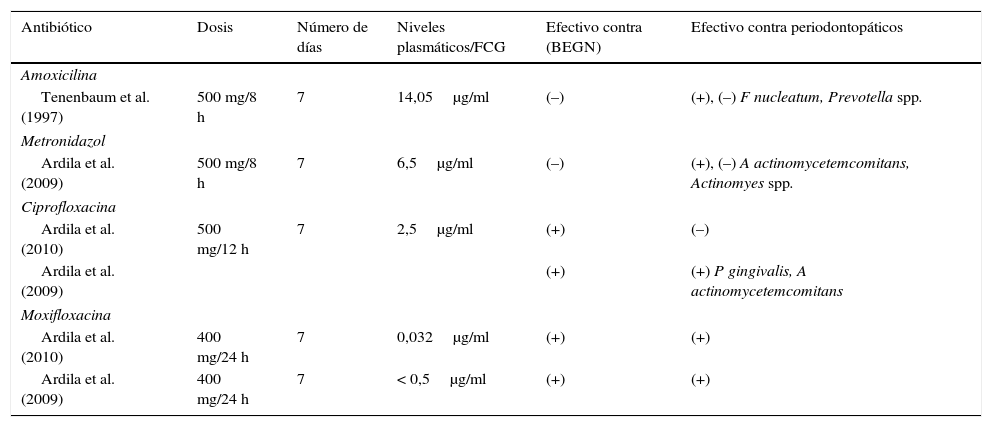
Jaramillo et al. (2008), evaluaron los perfiles antimicrobianos de la microbiota subgingival en pacientes colombianos con periodontitis, encontrando una remarcable sensibilidad del Aggregatibacter actinomycetecomitans (A. actinomycetecomitans) a la mayoría de los antimicrobianos excepto al metronidazol y clindamicina9. Por su parte, Prevotella spp. fueron resistentes a la amoxicilina. En este mismo estudio, ciprofloxacina fue altamente efectiva in vitro contra BEGN (tabla 1)9. Más recientemente Ardila et al., (2010) estudió la resistencia antibiótica en pacientes con periodontitis crónica e incluyó la moxifloxacina, en donde reportó total susceptibilidad frente 5 de importantes periodontopatógenos10. Análisis adicionales de la microbiota subgingival podrían: a) determinar la sensibilidad microbiana y la selección del antibiótico más adecuado, 2) determinar la efectividad del tratamiento y c) establecer el tiempo de recolonización bacteriana posterapia periodontal8,10–12.
Susceptibilidad microbiana de los antibióticos reportados contra bacterias periodontopatógenas y bacilos entéricos gramnegativos (BEGN)
| Antibiótico | Dosis | Número de días | Niveles plasmáticos/FCG | Efectivo contra (BEGN) | Efectivo contra periodontopáticos |
|---|---|---|---|---|---|
| Amoxicilina | |||||
| Tenenbaum et al. (1997) | 500 mg/8 h | 7 | 14,05μg/ml | (–) | (+), (–) F nucleatum, Prevotella spp. |
| Metronidazol | |||||
| Ardila et al. (2009) | 500 mg/8 h | 7 | 6,5μg/ml | (–) | (+), (–) A actinomycetemcomitans, Actinomyes spp. |
| Ciprofloxacina | |||||
| Ardila et al. (2010) | 500 mg/12 h | 7 | 2,5μg/ml | (+) | (–) |
| Ardila et al. (2009) | (+) | (+) P gingivalis, A actinomycetemcomitans | |||
| Moxifloxacina | |||||
| Ardila et al. (2010) | 400 mg/24 h | 7 | 0,032μg/ml | (+) | (+) |
| Ardila et al. (2009) | 400 mg/24 h | 7 | < 0,5μg/ml | (+) | (+) |
FCG: fluido crevicular gingival.
Valor de la susceptibilidad (μg/ml) fueron interpretados de acuerdo a Clinical and Laboratory Standards Institute (CLSI).
Bacterias periodontopáticas (F. nucleatum, Prevotella spp., T forsythia, C. rectus, P gingivalis, Actinomyces spp., Peptostreptococcus spp., A. actinomycetemcomitans, S. constellatus): BEGN: bacilos entéricos gramnegativos (K. pneumoniae, P aeruginosa, Serratia marcescens, K oxytoca, Enterobacter sakazaki); (+): susceptible; (–): resistente.
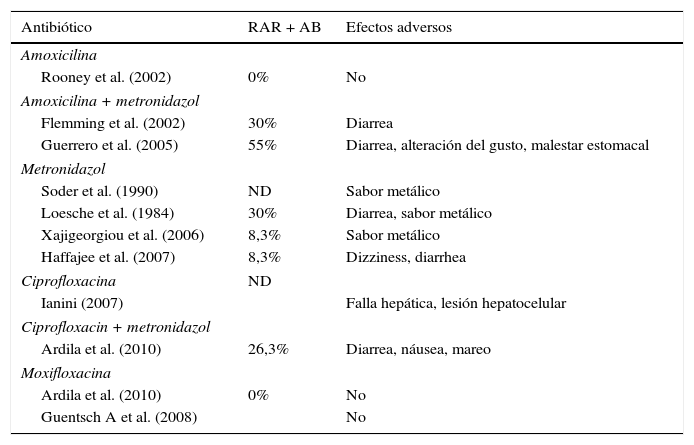
La terapia mecánica junto con la terapia antibiótica podría ser el tratamiento más racional para la enfermedad periodontal avanzada de acuerdo con la hipótesis de la placa bacteriana específica. Sin embargo, se requiere la prescripción racional de los antimicrobianos para seleccionar el antibiótico apropiado y minimizar efectos medicamentosos adversos (malestares gastrointestinales, colitis pseudomembranosa y alergia medicamentosa), (tabla 2). Algunos estudios que incluyen ensayos clínicos controlados13–20, revisiones sistemáticas y metaanálisis7,21,22 han demostrado los beneficios microbiológicos y clínicos del uso de antibióticos asociado con la terapia mecánica periodontal y han demostrado una mayor reducción de la profundidad de la bolsa en sitios profundos con reducción del sangrado al sondaje y una mayor ganancia de inserción clínica periodontal7,8,20,21.
Efectos adversos de antibióticos reportados
| Antibiótico | RAR + AB | Efectos adversos |
|---|---|---|
| Amoxicilina | ||
| Rooney et al. (2002) | 0% | No |
| Amoxicilina + metronidazol | ||
| Flemming et al. (2002) | 30% | Diarrea |
| Guerrero et al. (2005) | 55% | Diarrea, alteración del gusto, malestar estomacal |
| Metronidazol | ||
| Soder et al. (1990) | ND | Sabor metálico |
| Loesche et al. (1984) | 30% | Diarrea, sabor metálico |
| Xajigeorgiou et al. (2006) | 8,3% | Sabor metálico |
| Haffajee et al. (2007) | 8,3% | Dizziness, diarrhea |
| Ciprofloxacina | ND | |
| Ianini (2007) | Falla hepática, lesión hepatocelular | |
| Ciprofloxacin + metronidazol | ||
| Ardila et al. (2010) | 26,3% | Diarrea, náusea, mareo |
| Moxifloxacina | ||
| Ardila et al. (2010) | 0% | No |
| Guentsch A et al. (2008) | No | |
AB: antibiótico; ND: no disponible; RAR: raspaje y alisado radicular.
La presente revisión de literatura se realizó con el propósito de brindar una actualización en el uso de antimicrobianos como terapia coayudante en el tratamiento de la periodontitis, enfocando el potencial terapéutico de la moxifloxacina como nueva alternativa.
Terapia antibiótica coadyuvante de la terapia mecánica periodontalEl uso de la terapia antibiótica como parte del tratamiento periodontal ha sido debatido durante décadas, y recientemente, en la revisión sistemática de Herrera et al. (2008b) rescataron la efectividad de los antibióticos en combinación con la terapia mecánica3. Diferentes esquemas de antibióticos contra la enfermedad periodontal han sido evaluados: a) terapia antibiótica sistémica más raspado supragingival (monoterapia) descrita por López (2006)23 y b) terapia antibiótica en combinación con RAR (terapia combinada)3.
Terapia antibiótica sin raspado y alisado radicular (monoterapia)La terapia periodontal con antibióticos sistémicos se fundamenta en la acción antimicrobiana contra microorganismos específicos que causan la destrucción de los tejidos periodontales (hipótesis de la placa dental específica) con el objetivo de obtener un efecto benéfico en los parámetros clínicos como a nivel de la microbiota subgingival; adicionalmente, busca ofrecer una opción terapéutica costo-efectiva para controlar la infección periodontal en poblaciones donde el acceso al tratamiento periodontal es limitado8,21,24.
Es de esperar que, reduciendo los patógenos periodontales por medio del control efectivo de la biopelícula utilizando antimicrobianos junto con el RAR, la infección se detendrá y en consecuencia, la inflamación local y sistémica del paciente8.
MetronidazolEl metronidazol ha sido el antimicrobiano más frecuentemente utilizado como monoterapia en el tratamiento de la periodontitis. Este antimicrobiano es capaz de erradicar espiroquetas y anaerobios, por esta razón, fue introducido para eliminar las bacterias anaerobias relacionadas con la enfermedad periodontal. Después de la administración oral del metronidazol en tabletas de 250mg, 500mg, o 2g, este alcanza su máxima concentración plasmática de una a 3 horas en promedio 4,6μg/ml, 6,5μg/ml, u 11,5μg/ml, respectivamente. Además, puede penetrar en el fluido cerebroespinal, saliva y fluido crevicular. Después de su ingestión, metronidazol penetra por difusión a las células humanas como bacterianas. Cuando se encuentra dentro de la célula bacteriana, gracias al proceso de óxido-reducción, la molécula del metronidazol es precipitada liberando radicales libres y derivados de la hidroxilamina, enzima que interfiere la síntesis de ADN bacteriano, causando la disrupción de las bacterias anaerobias25.
En el estudio de Lindhe et al. (1983a), el metronidazol como monoterapia fue comparado con RAR debido a su capacidad de modificar los parámetros clínicos como microbiológicos. Los resultados obtenidos por el metronidazol fueron menores o iguales a la terapia mecánica26; por lo tanto, su uso como monoterapia no está indicado. Cuando este medicamento fue utilizado en combinación con amoxicilina, no se encontró una eficacia superior a la terapia mecánica en términos de reducción del sangrado al sondaje, profundidad de bolsa, ganancia de inserción clínica27,28.
Sin embargo, existen ciertas situaciones donde el metronidazol puede ser prescrito como monoterapia; por ejemplo, en presencia de gingivitis necrosante ulcerativa (GUN), periodontitis úlcero-necrosante (PUN) o un caso de estomatitis gangrenosa, patologías donde el paciente refiere un dolor intenso y profundo, que limita realizar RAR y también, se logra un rápido control de la infección por microorganismos anaerobios27,28.
AmoxicilinaLa amoxicilina parece ser eficaz contra la mayoría de los periodontopatógenos y su actividad antimicrobiana ha mostrado alcanzar altos niveles dentro del fluido crevicular. El mecanismo de acción de la amoxicilina consiste en la inhibición del proceso de transpeptidación necesario para la síntesis de la pared celular bacteriana, como consecuencia esta se debilita y se produce una lisis osmótica durante la fase de crecimiento y multiplicación bacteriana29.
Los efectos de la amoxicilina en el tratamiento de la periodontitis han sido bien documentados, gracias a su amplio espectro, actúa contra especies bacterias anaeróbicas facultativas subgingivales. No obstante, estudios han mostrado que la mayoría de la microbiota subgingival en periodontitis ha desarrollado resistencia antimicrobiana gracias a la producción de betalactamasa, por lo tanto, se sugiere la utilización de la amoxicilina junto con ácido clavulánico29.
Cuando se comparó la eficacia de la amoxicilina como monoterapia con la terapia mecánica en términos de reducción de los parámetros clínicos, los beneficios brindados por la monoterapia con amoxicilina fueron menores a los obtenidos por RAR29. Sin embargo, el controversial estudio de López et al. (2006) indica que el uso de antibióticos como el metronidazol junto con amoxicilina y raspado supragingival cada 3 meses, es efectivo no solo para detener la progresión de la enfermedad periodontal sino también para aumentar la inserción clínica y disminuir la profundidad de bolsa como el sangrado al sondaje23.
Estos resultados deben ser evaluados cuidadosamente ya que López et al. (2006) fundamentaron el uso de la terapia antibiótica como una medida de salud pública paliativa para aquellas circunstancias en donde los sistemas de salud no puedan garantizar la atención profesional con RAR de pacientes con periodontitis en donde el uso de los antibióticos sistémicos logró reducir o erradicar a los periodontopatógenos, por lo tanto, la carga bacteriana alcanzó niveles que lograron ser controlados por la respuesta inmune del huésped23. Sin embargo, el tratamiento exitoso de la enfermedad periodontal requiere el control no solo de las bacterias periodontopatógenas sino también la disrupción de la biopelícula, quien les provee las condiciones necesarias para su permanencia en la cavidad bucal y la resistencia ante los antimicrobianos. Por esta razón, la terapia mecánica es necesaria para la disrupción de la biopelícula y retardar la recolonización bacteriana.
Combinación de antibióticos sin terapia mecánicaVarios estudios han evaluado los resultados clínicos y microbiológicos del uso de antibióticos como monoterapia, en el tratamiento de la periodontitis25,26 Haffajee et al. (2003) realizaron una revisión sistemática donde se evaluó el uso de la terapia antimicrobiana como ayudante de la terapia mecánica no quirúrgica, quirúrgica, y como monoterapia. Los resultados obtenidos sugieren claramente que el uso de antimicrobianos sistémicos como monoterapia para el tratamiento de la periodontitis, no es recomendable30. Adicionalmente, el Consenso de la Academia Americana de Periodoncia (1996), Slots (2004), Herrera et al. (2008b), sugieren que para alcanzar los efectos clínicos y microbiológicos deseados, la terapia antimicrobiana debe ser usada como ayudante de la terapia mecánica, y no como monoterapia3,30–32.
Uso de antibióticos en pacientes con compromiso sistémicoLos antibióticos no solo han sido utilizados como coayudantes del RAR en pacientes con periodontitis, sino también para mejorar las condiciones locales y sistémicas de pacientes con compromisos sistémicos, tales como diabetes, inmunosupresión por VIH o por fármacos entre otros.
La diabetes mellitus representa un grupo de desórdenes metabólicos caracterizados por la elevación de los niveles de glucosa en sangre (American Diabetes Association, 2005)33, la cual, se ha considerado como factor de riesgo para desarrollar enfermedad periodontal, ya que modifica la respuesta inmuno-inflamatoria del huésped, específicamente, la adherencia, quimiotaxis y fagocitosis de los macrófagos, facilitando la persistencia de las bacterias en las bolsas periodontales34. De hecho, pacientes diabéticos con poco control de placa bacteriana presentan mayor sangrado, pérdida ósea y pérdida de inserción clínica que pacientes diabéticos con buen control de placa bacteriana35,36. Actualmente, el uso de antibióticos junto con RAR ha demostrado mejorar los parámetros clínicos en términos de reducción del sangrado, profundidad de bolsa y ganancia de inserción clínica en pacientes diabéticos tipo 1 y 2 con periodontitis, probablemente por la reducción de los periodontopatógenos y el restablecimiento de una microbiota local compatible con la salud periodontal37,38.
A su vez, dado el número creciente de pacientes inmunosuprimidos con enfermedad periodontal que presentan perfiles microbiológicos similares a pacientes sistémicamente sanos, y el riesgo de presentar infección en cualquier intervención, se hace racional el uso de antibioticoterapia como coayudante del RAR. Consecuentemente, el RAR junto con la terapia antibiótica con una dosis de carga de 500mg de metronidazol y cuatro dosis diarias de 250mg, enjuagues de clorhexidina 012%, ha mostrado ser un protocolo efectivo para reducir el dolor agudo, controlar la infección periodontal, y mejorar los parámetros clínicos en dichos pacientes39.
Uso de antibióticos como coadyuvantes de la terapia mecánicaSe ha estudiado ampliamente el uso de los antimicrobianos junto con la terapia mecánica. Respecto a la combinación de metronidazol junto con el RAR, los resultados obtenidos indican que el antimicrobiano no provee un beneficio adicional a RAR en bolsas poco profundas. No obstante, metronidazol fue efectivo al reducir la profundidad de bolsas periodontales ≥7mm, quizás, debido a la susceptibilidad microbiana y las condiciones anaeróbicas21,22.
En la revisión sistemática de Herrera et al. (2002) evaluaron los efectos de antimicrobianos sistémicos como coayudantes del RAR en pacientes con periodontitis, encontrando un efecto adicional sobre la terapia mecánica en términos de aumento del nivel de inserción clínico y la profundidad al sondaje fueron observados3,29. Adicionalmente, ensayos clínicos controlados demostraron que la administración de metronidazol junto con amoxicilina como coayudantes del RAR, mejoraron el nivel de inserción clínico y disminuyó la profundidad de bolsa29. Sin embargo, dado el riesgo de presentar efectos adversos por la prescripción de dos medicamentos, se debe evaluar la relación riesgo/beneficio al momento de tomar la decisión de utilizar o no la terapia antimicrobiana como coayudante de la terapia mecánica.
Recientemente, los BEGN han sido encontrados en pacientes fumadores con periodontitis incrementando la severidad de la lesión de los tejidos periodontales. Debido a su alta patogenicidad, se puede explicar la pobre respuesta encontrada ante RAR en pacientes con periodontitis severa, así como su recurrencia10.
Teniendo en cuenta aquellos pacientes con alergia o intolerancia al Metronidazol, penicilinas y tetraciclinas, es necesaria la utilización de nuevos antimicrobianos que sean igualmente efectivos contra los periodontopatógenos presentes en la enfermedad periodontal.
Uso de moxifloxacina en enfermedad periodontalLas quinolonas representarían una nueva opción en la terapia antimicrobiana como coayudantes del RAR debido a su amplio espectro, alta penetración tisular y buena absorción. El mecanismo de acción de las quinolonas consiste en la interrupción de la reproducción bacteriana, por medio del bloqueo de la actividad de la subunidad-A de la ADN girasa, enzima que disminuye la tensión molecular del ADN bacteriano durante su replicación, y adicionalmente, regula el proceso de enrollado de las cadenas de ADN en las bacterias gramnegativas.
Dentro de las quinolonas de cuarta generación, la moxifloxacina ha sido utilizada en el tratamiento de infecciones respiratorias, abdominales, de tejidos blandos y orales, por su acción antimicrobiana contra bacterias grampositivas y gramnegativas40. Además, moxifloxacina puede ser administrada en dosis orales de 400mg diariamente o en soluciones de 250ml, cantidades apropiadas para el tratamiento de una infección periodontal. Una vez administrada la moxifloxacina, esta alcanza una biodisponibilidad oral del 90% y una rápida y completa absorción en el tracto gastrointestinal, mostrando concentraciones plasmáticas en 3 horas41.
Dado que las infecciones de la cavidad oral como caries, periodontitis, abscesos periodontales y periapicales, pericoronitis entre otras, son causadas por microorganismos aerobios pero predominantemente anaerobios42 y la similitud de los perfiles microbiológicos encontrados en los abscesos periodontales con la periodontitis43, se ha comparado el efecto antimicrobiano moxifloxacina con antimicrobianos tales como metronidazol, clindamicina, amoxicilina + ácido clavulánico tanto en estudios in vitro como in vivo.
Dentro de los estudios in vitro, cuando se comparó la sensibilidad antimicrobiana de la moxifloxacina con amoxicilina, clindamicina y azitromicina, se reportó una resistencia bacteriana de anaerobios estrictos del 45,3% para amoxicilina, 18,6% para clindamicina; por el contrario, moxifloxacina, amoxicilina + ácido clavulánico y metronidazol, mostraron ser efectivos contra los anaerobios estrictos44.
Estos resultados concuerdan con los hallazgos en diferentes estudios en Colombia. La sensibilidad de la moxifloxacina ha sido evaluada y comparada in vitro con diferentes antibióticos para periodontopatógenos como Tannerella forsythia, Prevotella melaninogenica, P. intermedia, Prevotella spp., Fusobacterium nucleatum (F. nucleatum), Campylobacter rectus, Actinomyces spp., Peptostreptococcus, A. actinomycetemcomitans. Todas las cepas fueron inhibidas por una concentración menor de 0,5mg de moxifloxacina. Por lo tanto, moxifloxacina presentó buena actividad antibacteriana in vitro contra periodontopatógenos, e incluso fue superior al metronidazol, clindamicina y penicilinas41.
A nivel de estudios in vivo, moxifloxacina fue comparada con doxiciclina en términos de reducción de los parámetros clínicos como microbiológicos. La moxifloxacina junto con la terapia mecánica fue superior a la doxiciclina en términos de reducción de la profundidad del sondaje, ganancia de inserción clínico, así como en una mayor reducción de la carga bacteriana, específicamente de A. actinomycetemcomitans, P. gingivalis, Treponema denticola, y T. forsythia. Por lo tanto, este antimicrobiano representa una nueva alternativa para el tratamiento de periodontitis crónicas tanto desde el punto de vista clínico como microbiológico45,46.
Recientemente, Ardila et al. (2010) compararon la eficacia a nivel clínico y microbiológico de la moxifloxacina con la ciprofloxacina, amoxicilina + ácido clavulánico, en pacientes colombianos con periodontitis crónica. Los resultados de su estudio revelaron a nivel microbiológico la presencia de BEGN junto a A. actinomycetecomitans, P. gingivalis y P. intermedia/nigrescens. Adicionalmente, todos los BEGN mostraron alta susceptibilidad a moxifloxacin y ciprofloxacin pero una variable susceptibilidad a amoxicilina + ácido clavulánico. Por lo tanto, el uso de quinolonas como coayudantes del RAR en pacientes colombianos con periodontitis, parece ser una buena moderna alternativa para el tratamiento de la enfermedad periodontal10.
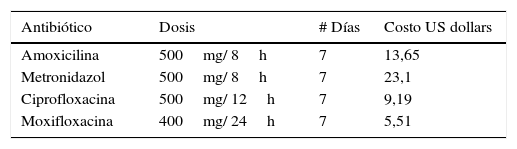
Centroamérica y Sudamérica comprenden más de 22 países donde habitan 600 millones de habitantes con alta prevalencia de enfermedad periodontal no tratada, resistencia bacteriana aumentada y presencia de periodontopatógenos como BEGN; los cuales, requieren el uso de antibióticos modernos coayudantes a la terapia mecánica, para tratar efectivamente la enfermedad periodontal. Sin embargo, dado el alto costo de algunos antibióticos en el mercado, muchos pacientes con limitaciones económicas abandonan la terapia antibiótica prescrita antes de finalizarla (tabla 3).
Costo y dosis de los antibióticos contra bacterias periodontopáticas y bacilos entéricos gramnegativos (BEGN)
| Antibiótico | Dosis | # Días | Costo US dollars |
|---|---|---|---|
| Amoxicilina | 500mg/ 8h | 7 | 13,65 |
| Metronidazol | 500mg/ 8h | 7 | 23,1 |
| Ciprofloxacina | 500mg/ 12h | 7 | 9,19 |
| Moxifloxacina | 400mg/ 24h | 7 | 5,51 |
GNER: Gram negative enteric rods; US: dólares americanos.
Adicionalmente, el continente latinoamericano presenta una alta tasa de emigración de individuos hacia a los países industrializados, como consecuencia de un incremento de la pobreza, falta de oportunidades y agitación social. Por lo tanto, el tratamiento de dichos pacientes fuera de sus lugares de origen se verá afectado47.
DiscusiónLa enfermedad periodontal es una infección causada por bacterias periodontopatógenas que conforman la biopelícula subgingival. La biopelícula, interviene en la destrucción de los tejidos periodontales al facilitar la permanencia de los periodontopatógenos en dichos tejidos, quienes estimulan la respuesta inmuno-inflamatoria del huésped caracterizada por un estado de inflamación crónico local y sistémico.
Dentro de la cavidad oral, existen condiciones apropiadas para la colonización y crecimiento de periodontopatógenos como los BEGN, quienes producen factores de virulencia que invaden los tejidos humanos, suprimen la proliferación de leucocitos, degradan la membrana basal e inactivan el complemento. Además, existe la posibilidad de que estos microorganismos incrementen la resistencia contra los antimicrobianos utilizados para tratar la enfermedad periodontal. Por ejemplo, el A. actinomycetecomitans y los BEGN han presentado resistencia bacteriana ante la prescripción de amoxicilina y metronidazol. Por consiguiente, el tratamiento de la enfermedad periodontal avanzada debe incluir la identificación de los periodontopatógenos así como su sensibilidad antimicrobiana, para elegir el antimicrobiano más eficaz como coayudante del raspado y alisado radicular.
Mediante la reducción de los periodontopatógenos de los diversos nichos de la cavidad bucal, el clínico puede controlar la infección local, retardar los procesos de recolonización microbiana, reducir o detener procesos de inflamación crónica (células y citoquinas como mediadores de destrucción periodontal), incrementar los niveles locales de los inhibidores de las metaloproteinasas, reducir la estimulación antigénica y promover procesos de cicatrización, reparación y regeneración de los tejidos periodontales. Estos conceptos contrastan con los enfoques tradicionales que tratan las secuelas de la enfermedad (profundidad de la bolsa periodontal, sangrado al sondaje, pérdida de inserción clínica, defectos óseos y movilidad dental)21,22,24,48.
Al parecer, el tratamiento periodontal ha revelado tener efectos a nivel sistémico según los hallazgos de Lafaurie et al. (2007)49 quienes encontraron bacteriemia transitoria causada por P. gingivalis, Actinomyces spp., Micromonas micros (M. micros), Campylobacter spp., Fusobacterium spp., Capnocytphaga spp., Eikenella corrodens, T. forsythia, y P. intermedia, inmediatamente después de realizar RAR (80,9%) y 30 minutos después (19%). Estos microorganismos han sido encontrados induciendo una respuesta inflamatoria sistémica, e incrementando los niveles séricos de proteínas de la fase aguda como proteína-C reactiva, fibrinógeno, ICAM, E-selectina y citoquinas proinflamatorias (IL -1β, IL-6, TNF-α). Este hallazgo es importante para el paciente ya que, la periodontitis no tratada, provoca un estado de inflamación crónica que parece aumentar el riesgo de enfermedad cardiovascular o generar alteración en la función endotelial durante las primeras 24 horas después de la terapia mecánica50–54. Por lo tanto, es razonable iniciar una terapia antibiótica para controlar la infección y reducir los efectos sistémicos de la bacteriemia o toxemia transitoria causada por el RAR, en pacientes con periodontitis severa e incluso moderada50.
En este orden de ideas, la terapia periodontal debería dirigirse en la disrupción de la biopelícula por medios mecánicos como el RAR y en la eliminación de los periodontopatógenos por medio de antimicrobianos; de esta forma se detiene la progresión de la enfermedad periodontal, se previenen los riesgos de la bacteriemia por la instrumentación mecánica y se retarda la recolonización bacteriana, controlando la inflamación crónica y promoviendo la cicatrización de los tejidos periodontales.
Las quinolonas han surgido recientemente como una opción dentro de la terapia antibiótica como coayudante de la terapia mecánica, gracias a su actividad antimicrobiana contra periodontopatógenos como BEGN27. Dentro de ellas, la moxifloxacina representa una opción moderna en el tratamiento de la enfermedad periodontal avanzada, ya que ha mostrado grandes ventajas a nivel clínico y microbiológico, así como pocos efectos adversos27,28,30. Adicionalmente, se ha demostrado mayor efectividad antimicrobiana cuando se comparó la moxifloxacina con la amoxicilina + ácido clavulánico, metronidazol y doxiciclina10. A su vez, ha presentado una mejor aceptación por los pacientes por su fácil dosificación, ya que requiere solo una dosis diaria por 7 días y se obtienen dosis plasmáticas inhibitorias suficientes5.
Por lo tanto, sería de gran contribución la utilización de la moxifloxacina como terapia antibiótica moderna y coayudante de la terapia mecánica, ya que de esta manera, se protegería al paciente a nivel local como sistémico y, adicionalmente, puede ser una oportunidad importante para el futuro tratamiento de pacientes con periodontitis a nivel de Centroamérica y Sudamérica.
FinanciaciónEsta revisión es parte del estudio financiado por los proyectos 1638 y 1106344319239 de Colciencias – Colombia.
También, es dedicada a la memoria de Edison Cruz padre de uno de los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a los proyectos #1638 de la Universidad del Valle factores de riesgo cardiovascular y disfunción endotelial en periodontitis, y al proyecto # 1106344319239 de Colciencias – Colombia.