La respiración afecta el rendimiento cardiaco, ciclo a ciclo, a través de los cambios en la presión y el volumen intratorácicos sobre las determinantes de la función cardiovascular. De esta manera, las interacciones corazón-pulmón afectan el funcionamiento cardiovascular y la capacidad del corazón para adaptarse. La interacción corazón-pulmón es un área de la fisiología aplicada ampliamente estudiada, pero en Colombia es el primer estudio que se realiza con un monitor de biorreactancia torácica. Se midieron los perfiles hemodinámicos de 38 pacientes programados para cirugía de revascularización miocárdica en la Fundación Clínica Abood Shaio utilizando un monitor de biorreactancia torácico, con el cual se obtuvieron medidas de volúmenes ventriculares y gasto cardiaco. Se registraron los volúmenes y presiones ventilatorias con las que se hicieron correlaciones para interpretar los efectos de la ventilación mecánica.
Breathing affects cardiac output on a cycle-by-cycle basis, through changes in pressure and intrathoracic volume of key components in cardiovascular function Hence, heart-lung inter-actions affect cardiovascular functioning and the heart's ability to adapt. The heart-lung interaction is an area of applied physiology broadly studied but in Colombia, this is the first trial ever done with a thoracic bioreactance monitor (NICOM). The hemodynamic profiles of 38 patients scheduled for myocardial revascularization were measured at the Fundación Clínica Abood Shaio using NICOM, which provided ventricular volume and cardiac output measurements. The ventilator volumes and pressures with which corrections were made to interpret the effects of mechanical ventilation were recorded.
La respiración espontánea, natural, que involucra la integridad del sistema respiratorio, se inicia con la inspiración por la acción muscular que aumenta el volumen del tórax, generando una presión negativa en el espacio interpleural que permite también el aumento del volumen pulmonar y el flujo de aire hacia la zona alveolar. Simultáneamente, la presión negativa facilita, mediante un gradiente de presión, la entrada de la sangre al tórax y al corazón; es la manera natural del retorno venoso. Durante esta fase el mejor llenado ventricular derecho promueve un mayor volumen sistólico (VS) derecho y un flujo sanguíneo por la arteria pulmonar que incrementa el llenado capilar para facilitar la hematosis. Durante la espiración la inversión mecánica de las fuerzas produce los efectos inversos, pero al ventrículo izquierdo llegará más sangre, fomentando también por el fenómeno de Frank Starling un mejor VS sistémico en esta etapa.
La enfermedad pulmonar o cardiaca que afecta la dinámica del flujo sanguíneo o del intercambio de gases requiere el uso de métodos y sistemas que soporten temporalmente la función comprometida. Estos generalmente funcionan a través de la insuflación pulmonar desde el exterior, utiliza entonces el principio de presión positiva. La ventilación mecánica (VM) es uno de los soportes comunes e importantes para el apoyo integral del paciente crítico. Las presiones positivas dentro del tórax tienen efectos benéficos sobre la función respiratoria relacionados directamente con el intercambio de gases; en oposición, se generan efectos adversos tanto en el pulmón como en el corazón, el cual tiene que adaptar sus funciones a las nuevas fuerzas y vectores de presión.
Las presiones positivas intrapulmonares durante la VM producen cambios en la interacción corazón-pulmón que pueden alterar directa o indirectamente la regulación del sistema cardiorrespiratorio. La intensidad de los efectos depende de varios factores: la severidad del compromiso parenquimatoso pulmonar, la integridad del espacio interpleural, la magnitud de las presiones positivas, el estado de la volemia y la suficiencia cardiaca. Sin embargo, los efectos de la VM sobre la composición de los gases sanguíneos dependerán de la enfermedad pulmonar de base y de la perfusión periférica.
En los últimos años las investigaciones clínicas se han enfocado en métodos no invasivos de monitorización debido a los efectos adversos generados por los dispositivos invasivos en las unidades de cuidado intensivo. Estos nuevos dispositivos permiten evaluar de forma continua las variables hemodinámicas, los cambios agudos derivados del ciclo respiratorio y las respuestas inmediatas a la terapia, proporcionando, así, un avance en los objetivos de manejo.
De esta manera, con el objetivo de analizar los cambios en la interacción corazón-pulmón, se diseñó un protocolo de investigación para realizar mediciones en pacientes con cardiopatía isquémica, programados para cirugía de revascularización miocárdica: 1) porque se iniciaría de forma programada la VM, y 2) porque los cambios hemodinámicos asociados a la VM aparentemente se podían evaluar tempranamente.
Materiales y métodosEste protocolo de investigación fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional de Colombia y el Comité de Ética de la Fundación Clínica Abood Shaio, y de acuerdo con la Declaración de Helsinki.
El estudio fue preexperimental con diseño de preprueba-posprueba con un solo grupo1. Se realizó durante el segundo y tercer trimestre de 2011, en la Fundación Clínica Abood Shaio. Se llevaron a cabo 3 momentos:
- 1.
Consentimiento informado y evaluación preanestésica. La medición se realizó en nivel basal.
- 2.
Inducción anestésica. Todos los pacientes se manejaron con el mismo protocolo de inducción anestésica: midazolam 0,1mg/kg, fentanilo 4mcg/kg, cisatracurio 0,1mg/kg y sevoflurano, dosis de inicio al 4% y mantenimiento al 2%.
- 3.
VM. Se instauró con los siguientes parámetros: ventilación controlada por volumen, FR 12-14rpm, PEEP de 5cmH2O, VC de 8ml/kg aproximadamente, FiO2 del 100%.
El estudio incluyó pacientes hombres y mujeres que cumplieron con las siguientes características:
- -
Enfermedad coronaria documentada.
- -
Pacientes programados para cirugía de revascularización miocárdica.
- -
Pacientes de la Fundación Clínica Abood Shaio.
Se excluyeron los pacientes con las siguientes afecciones:
- -
Enfermedad pulmonar crónica severa.
- -
Hipertensión pulmonar moderada a severa.
- -
Insuficiencia valvular aórtica y/o mitral.
- -
Aneurisma de aorta.
- -
Balón de contrapulsación.
- -
Fracción de eyección<30%.
Monitor de gasto cardiaco (GC) no invasivo; se basa en el análisis del cambio de frecuencia y la oscilación de la señal de corriente, que ocurre cuando esta atraviesa la cavidad torácica, a diferencia de la bioimpedancia, que mide solo el cambio de amplitud de la señal. Este dispositivo utiliza una frecuencia alta de 75kHz, que se aplica al tórax a través de electrodos tanto de disparo como de recepción de la señal. Estas señales son procesadas separadamente y combinadas antes del procesamiento digital.
Cambios en la frecuencia y en la fase son equivalentes y representan la reactancia del circuito, y de acuerdo con los algoritmos, cambios en la bioimpedancia y en la reactancia de la corriente que se inyecta y la corriente que se recibe reflejan cambios en el flujo sanguíneo de la aorta. Por lo tanto, existe una relación íntima entre la tasa de cambio del flujo sanguíneo y la tasa de cambio de la reactancia (ΔX/Δt máx), y puede ser expresada en la ecuación2 que se muestra en la figura 1.
Análisis estadísticoComparación de medias (prueba ANOVA, múltiples rangos). El programa estadístico utilizado fue: StatGraphics® Centurion XVI versión 16.1.11.
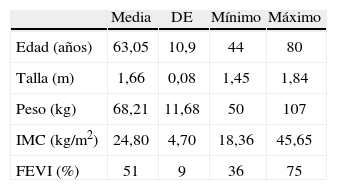
ResultadosSe obtuvieron, durante 4 meses de trabajo con pacientes de la Fundación Clínica Abood Shaio de Bogotá, 192 cirugías de corazón; 75 fueron revascularizaciones miocárdicas, de las cuales 38 cumplieron con los criterios de inclusión: 33 hombres y 5 mujeres, con una edad promedio de 63 años (ver tabla 1).
Distribución demográfica
| Media | DE | Mínimo | Máximo | |
| Edad (años) | 63,05 | 10,9 | 44 | 80 |
| Talla (m) | 1,66 | 0,08 | 1,45 | 1,84 |
| Peso (kg) | 68,21 | 11,68 | 50 | 107 |
| IMC (kg/m2) | 24,80 | 4,70 | 18,36 | 45,65 |
| FEVI (%) | 51 | 9 | 36 | 75 |
DE: desviación estándar; FEVI: fracción de eyección del ventrículo izquierdo; IMC: índice de masa corporal.
Características demográficas de la muestra según edad, talla, peso, índice de masa corporal y fracción de eyección del ventrículo izquierdo. Se indica la desviación estándar de cada variable.
Fuente: autores.
Se clasificaron las variables estudiadas en 3 grupos: función cardiaca, función vascular y contenido de líquidos(Ver tablas 2-4).
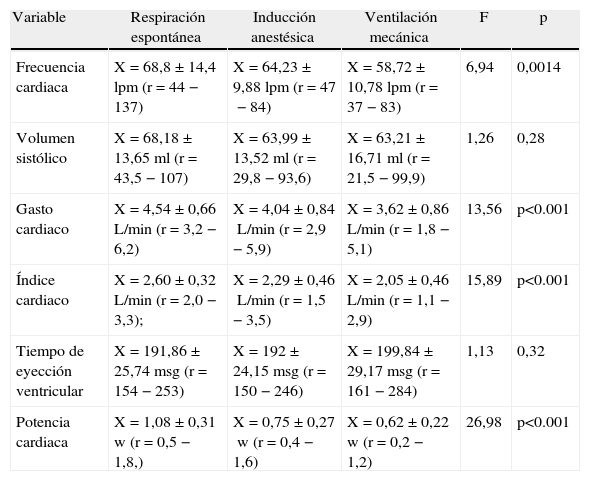
Resultados de la función cardiaca
| Variable | Respiración espontánea | Inducción anestésica | Ventilación mecánica | F | p |
| Frecuencia cardiaca | X=68,8±14,4lpm (r=44−137) | X=64,23±9,88lpm (r=47−84) | X=58,72±10,78lpm (r=37−83) | 6,94 | 0,0014 |
| Volumen sistólico | X=68,18±13,65ml (r=43,5−107) | X=63,99±13,52ml (r=29,8−93,6) | X=63,21±16,71ml (r=21,5−99,9) | 1,26 | 0,28 |
| Gasto cardiaco | X=4,54±0,66L/min (r=3,2−6,2) | X=4,04±0,84L/min (r=2,9−5,9) | X=3,62±0,86L/min (r=1,8−5,1) | 13,56 | p<0.001 |
| Índice cardiaco | X=2,60±0,32L/min (r=2,0−3,3); | X=2,29±0,46L/min (r=1,5−3,5) | X=2,05±0,46L/min (r=1,1−2,9) | 15,89 | p<0.001 |
| Tiempo de eyección ventricular | X=191,86±25,74msg (r=154−253) | X=192±24,15msg (r=150−246) | X=199,84±29,17msg (r=161−284) | 1,13 | 0,32 |
| Potencia cardiaca | X=1,08±0,31w (r=0,5−1,8,) | X=0,75±0,27w (r=0,4−1,6) | X=0,62±0,22w (r=0,2−1,2) | 26,98 | p<0.001 |
Se muestra el promedio, la desviación estándar y el rango (r) de la variable en cada momento de la medición, y los valores de F y P con la prueba ANOVA, con un nivel de confianza del 95%.
Fuente: autores.
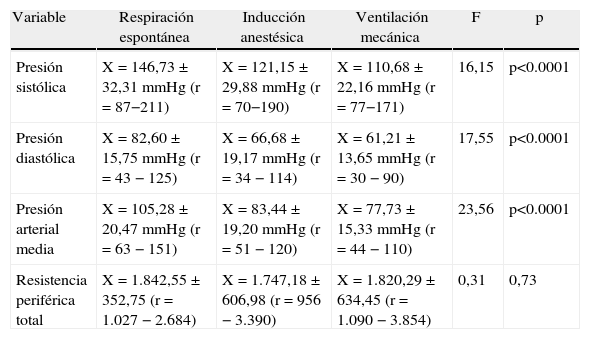
Resultados Función vascular
| Variable | Respiración espontánea | Inducción anestésica | Ventilación mecánica | F | p |
| Presión sistólica | X=146,73±32,31mmHg (r=87−211) | X=121,15±29,88mmHg (r=70−190) | X=110,68±22,16mmHg (r=77−171) | 16,15 | p<0.0001 |
| Presión diastólica | X=82,60±15,75mmHg (r=43−125) | X=66,68±19,17mmHg (r=34−114) | X=61,21±13,65mmHg (r=30−90) | 17,55 | p<0.0001 |
| Presión arterial media | X=105,28±20,47mmHg (r=63−151) | X=83,44±19,20mmHg (r=51−120) | X=77,73±15,33mmHg (r=44−110) | 23,56 | p<0.0001 |
| Resistencia periférica total | X=1.842,55±352,75 (r=1.027−2.684) | X=1.747,18±606,98 (r=956−3.390) | X=1.820,29±634,45 (r=1.090−3.854) | 0,31 | 0,73 |
Se muestra el promedio, la desviación estándar y el rango (r) de la variable en cada momento de la medición, y los valores de F y P con la prueba ANOVA, con un nivel de confianza del 95%.
Fuente: autores.
Resultados del contenido de líquidos dentro del tórax
| Variable | Respiración espontánea | Inducción anestésica | Ventilación mecánica | F | p |
| CLT | X=127,91±41,32 (r=43,1−237,2) | X=127,91±41,32 (r=42,9−236,5) | X=124,68±39,33 (r=41,5−234) | 0,09 | 0,91 |
CLT: contenido de líquidos dentro del tórax.
Se muestra el promedio, la desviación estándar y el rango (r) de la variable en cada momento de la medición, y los valores de F y P con la prueba ANOVA, con un nivel de confianza del 95%.
Fuente: autores.
En el corazón sano el VS y el GC están determinados en buena parte por el llenado de los ventrículos en diástole (precarga). Durante la VM con presión positiva, en la fase inspiratoria se incrementa la presión intratorácica, lo que puede conducir a una disminución en el retorno venoso, generando en un paciente sano la caída del GC y del aporte de oxígeno, por lo cual, la recomendación ha sido restablecer el VS con soporte farmacológico y mantenimiento de la volemia con líquidos3.
La transmisión de la presión desde la vía aérea hacia el parénquima pulmonar y al espacio interpleural depende de las distensibilidades de la vía aérea en sí misma, de las distensibilidades pulmonar y torácica. En un estudio realizado por Chapin et al. (1979), mediante anestesia inducida a 10 cerdos y asistencia con VM se realizaron mediciones sobre la transmisión de la presión de la vía aérea al espacio pleural en diferentes condiciones, y encontraron que: cuando las distensibilidades pulmonar y torácica eran normales la transmisión de la presión al espacio pleural era aproximadamente el 50% de la presión aplicada, mientras que si se disminuye la distensibilidad torácica la transmisión de la presión era un 75%. En contraposición, el aumento de la distensibilidad torácica disminuía la capacidad de transmitir la presión aplicada. En cuanto a la distensibilidad pulmonar, si disminuye también lo hace la transmisión de la presión al espacio pleural, lo contrario al aumentar4. Las conclusiones del estudio de Chapin et al. son argumentos importantes para estudiar la interacción corazón-pulmón y su dependencia con las presiones intratorácicas, puesto que de la transmisión de las presiones al lecho vascular dependen los efectos sobre el retorno venoso, el GC y las resistencias vasculares.
Por otro lado, los cambios en la presión intratorácica inciden directamente en la presión transmural de la aurícula derecha. Durante la respiración espontánea, en la inspiración la presión transmural de la aurícula derecha disminuye, aumentando el gradiente de presiones entre las venas cavas y la propia aurícula, facilitando el flujo sanguíneo o retorno venoso. En la respiración con presión positiva, la presión pleural aumenta, lo cual incrementa la presión dentro de la aurícula disminuyendo el gradiente para el flujo de retorno y, consecuentemente, el llenado ventricular derecho durante la inspiración en VM disminuye. Por otra parte, los cambios en el volumen pulmonar van a generar cambios sobre los vasos principalmente alveolares, haciendo que durante el inicio de la inspiración, al ir aumentando el volumen alveolar la sangre contenida en los capilares se vea obligada a fluir hacia delante y hacia el final de la inspiración con presión positiva; si esta presión es alta, la compresión sobre los capilares aumenta la resistencia al flujo con 2 consecuencias: 1) disminución retrógrada del vaciamiento ventricular y aumento de la presión auricular derecha, y 2) la mayor resistencia al flujo sanguíneo disminuye el llenado auricular izquierdo y, por lo tanto, el ventricular izquierdo. Dependiendo de la cantidad de volemia el mayor volumen ventricular derecho puede desplazar el septum hacia la izquierda restringiendo aún más el llenado ventricular izquierdo y condicionando así un efecto de menor GC, es la denominada interdependencia ventricular.
De esta manera, en pacientes que son sometidos a cirugías de alto riesgo, en este caso revascularización miocárdica, la monitorización hemodinámica cobra gran importancia y es una herramienta esencial para guiar la terapia. Los dispositivos de monitorización no invasiva se han desarrollado superando las limitaciones del catéter de arteria pulmonar y el método de Fick para medir el VS. La biorreactancia es un método no invasivo que provee información del perfil hemodinámico sin los riesgos, costos y experticia requerida con la termodilución y otros métodos mínimamente invasivos. La comprensión de los principios mediante los cuales funciona permite conocer sus ventajas y limitaciones5.
Para esta investigación se utilizó un monitor de GC no invasivo que se basa en la medición de la reactancia del tórax. Este equipo trabaja bajo los principios eléctricos de la bioimpedancia, pero con optimización de los filtros. El monitor de biorreactancia se basa en el análisis del cambio de frecuencia y la oscilación de la señal eléctrica que ocurre cuando la corriente atraviesa la cavidad torácica. Se han realizado estudios de validación comparando el monitor de biorreactancia con la termodilución y otras técnicas mínimamente invasivas en los que la biorreactancia ha mostrado un aceptable nivel de exactitud y tiene mayor precisión que otros dispositivos6,7. En la población de estudio, la monitorización de GC a partir de la medición de la resistencia eléctrica del tórax ha tenido buena correlación con la termodilución. Para otras poblaciones más heterogéneas, como pacientes sépticos y trauma, es necesario realizar más estudios8.
De acuerdo con la epidemiología y los factores de riesgo de enfermedad coronaria, el perfil demográfico de los 38 pacientes se asocia con los hallados en la literatura. El 87% fueron hombres y los factores de riesgo más comunes fueron: hipertensión arterial 71%, dislipidemia 60%, diabetes mellitus 36% y tabaquismo 31%. Los 38 pacientes venían recibiendo el tratamiento farmacológico recomendado para cada enfermedad. A continuación se discuten las variables hemodinámicas que se monitorizaron con la biorreactancia.
Función cardiacaLa frecuencia cardiaca disminuyó de forma lineal en los 3 momentos de medición. Esto se logra en el tratamiento de la enfermedad coronaria con betabloqueadores y durante la inducción anestésica por el efecto farmacológico cronotrópico e inotrópico negativo de los fármacos administrados. Por ejemplo, la combinación de fentanilo, midazolam y vecuronio genera bradicardia e hipotensión9.
En este estudio, la disminución de la frecuencia cardiaca durante la VM se puede asociar con los efectos pico de los medicamentos de inducción anestésica. La reducción de la frecuencia cardiaca en VM también se asocia con el reflejo de insuflación pulmonar con VC>15ml/kg10. En este estudio se utilizaron volúmenes corrientes promedio de 8,3ml/kg, y los sujetos estaban bajo efectos anestésicos, sin embargo, existió una disminución pequeña pero significativa (10lpm), de la frecuencia cardiaca durante la VM que puede estar asociada al fenómeno de acción parasimpática.
Se dice que el VS durante la VM se puede comprometer especialmente por la alteración en la precarga que se da por el incremento en la presión intratorácica. Esto genera una disminución del retorno venoso a consecuencia de un aumento de la presión en el entorno de la aurícula derecha. Esta disminución de la precarga inicialmente compromete el GC por compromiso del ventrículo derecho. Adicionalmente, la distensibilidad relativa del ventrículo izquierdo puede disminuir si existe desplazamiento del septum como consecuencia del aumento de la poscarga al ventrículo derecho (compresión vascular pulmonar). Sin embargo, la poscarga al ventrículo izquierdo puede disminuir si aumenta el gradiente de presión entre el ventrículo y la aorta torácica y entre esta y la aorta extratorácica derivado de los efectos de la PIT11. De esta manera, el efecto deletéreo sobre la precarga en un corazón enfermo se puede compensar con la disminución de la poscarga para el ventrículo izquierdo, con lo cual los cambios en el VS promedio pueden ser mínimos. Notablemente, el cambio significativo del VS ocurrió durante la inducción anestésica, no al instaurar la VM. Lo anterior se puede explicar por los efectos vasodilatadores de los medicamentos anestésicos y del relajante muscular.
La disminución del GC puede corresponder a la disminución de sus 2 determinantes (GC=FC×VS). Los determinantes del VS son: precarga, poscarga y contractilidad. Durante la VM la precarga del ventrículo izquierdo se ve afectada por la disminución del retorno venoso sistémico y por la caída del VS del ventrículo derecho, lo que puede llevar a la disminución del GC12. La función del ventrículo izquierdo también se evalúa como expresión de: 1) el VS; 2) el GC; 3) el trabajo ventricular, y 4) la potencia cardiaca (PC)13. En la práctica clínica es difícil realizar estas mediciones directamente mediante la relación de Frank-Starling (longitud-tensión), por lo tanto, se utilizan las curvas de función ventricular que relacionan el volumen de final de diástole o la presión de final de diástole como indicadores de precarga contra el producto de la descarga ventricular: el VS, el GC, el trabajo ventricular o la PC. Según este enfoque, es importante discriminar los factores que pueden disminuir el GC.
La disminución lineal del GC en los 3 momentos de medición no ocurrió como resultado de cambios en el VS, el cual se mantuvo constante, como ya se mencionó. Por otro lado, la frecuencia cardiaca disminuyó significativamente en los 3 momentos de medición. Con base en lo anterior, se puede proponer que la disminución del GC se asoció con el efecto deletéreo sobre la cronoterapia que ejercen los medicamentos durante la inducción anestésica.
El tiempo de eyección ventricular (TEV) es el periodo comprendido entre la apertura de la válvula aórtica y el cierre de la misma durante el ciclo cardiaco, y depende en gran medida de la contractilidad y de la poscarga. Weissler et al. (1968) evaluaron la función ventricular a partir de los intervalos sistólicos y encontraron que en pacientes con falla cardiaca el periodo preeyectivo era más largo; consecuentemente, el TEV era más corto de lo normal14. En el estudio no se encontraron diferencias significativas en el TEV en los 3 momentos de medición. Pese a lo anterior, el promedio de TEV en VM fue un poco mayor que en los demás momentos. El aumento en el TEV durante la VM puede ser ocasionado por una disminución en la poscarga del ventrículo izquierdo derivada de los efectos de la presión positiva sobre la aorta, aunque también influyen los efectos farmacológicos sobre la reactividad vascular que bajan la poscarga. Sin embargo, estas conclusiones requieren estudios específicos de contractilidad (dinámica del acople electromecánico) y se encuentran fuera del alcance de esta investigación.
La PC es la capacidad del corazón para entregar energía al sistema arterial y mantener la circulación sanguínea. La PC aparece con frecuencia como un indicador pronóstico de la función cardiaca15. Estudios realizados para medir la reserva funcional del corazón en pacientes con falla cardiaca mostraron que la PC se correlaciona bien con la capacidad de ejercicio y es un buen indicador pronóstico en estos pacientes16. En personas con enfermedad coronaria se podrían ver afectadas la PC y la reserva para responder a situaciones de estrés, como la VM. En los 38 pacientes estudiados, la PC disminuyó en cada momento de medición. Esto puede estar asociado a: 1) los efectos inotrópicos negativos de los fármacos utilizados; 2) la caída de la presión arterial, y 3) al aumento del TEV sin alteración significativa del VS, como se mostró anteriormente.
Función vascularLas presiones arteriales (sistólica, diastólica y media) tuvieron un comportamiento similar. Básicamente, la disminución en la presión se presentó durante la inducción anestésica, acontecimiento que se explica por el doble efecto farmacológico: 1) la afectación del inotropismo, y 2) la vasodilatación, con la consecuente disminución de la resistencia vascular9. Durante la VM no se disminuyó adicionalmente la presión arterial, demostrando que el descenso más importante ocurrió en el paso de la respiración espontánea al momento de la inducción anestésica con medicamentos.
En el monitor de biorreactancia, la medición de la resistencia periférica es la razón entre la presión arterial media, obtenida por el método no invasivo oscilométrico, y el GC derivado como el producto del VS por la frecuencia cardiaca. Como se observa en la tabla 3, no existen diferencias significativas entre los 3 momentos de medición. La poca variación de la presión arterial y de la resistencia periférica total al comparar la inducción anestésica y los efectos de la VM puede darse como resultado de: 1) el estímulo simpático resultante de las maniobras de intubación, y 2) el mantenimiento del estado anestésico con sevoflurano iniciado al terminar la intubación, medicamento que tiene menores efectos vasodilatadores que los agentes intravenosos administrados al inicio de la inducción y que podrían estar en fase de eliminación en el momento de la observación, dada su corta vida media alfa.
Contenido de líquidos dentro del tóraxLos líquidos intravasculares y extravasculares contienen una cantidad importante de electrolitos, como sodio, cloro, potasio, calcio y otros, que forman soluciones electrolíticas. Estas soluciones son muy buenas conductoras eléctricas, más electrolitos implican mayor conductabilidad, y menos electrolitos, menor conductabilidad. El monitor de biorreactancia mide simultáneamente los cambios en la corriente alterna de alta frecuencia aplicada y los cambios en los voltajes aplicados a través de los tejidos. Es decir, mide la bioimpedancia (Z), que es la resistencia instantánea al flujo de corriente (|Z|=|P|/|Q|).
La impedancia 0 (Z0) refleja la resistencia del tórax a la conductabilidad eléctrica. Esta es una medición dependiente del contenido de líquidos dentro del tórax (CLT), porque a mayor contenido de líquidos, menor impedancia, y viceversa. El inverso de la impedancia (resistencia) se denomina conductancia (1/Z0), la cual es directamente proporcional al CLT.
Es importante tener en cuenta que la relación específica entre las unidades de CLT (1/Ohm) y los litros de líquidos en términos absolutos es desconocida. Se dice que no existe un valor normal para CLT. Por lo tanto, el CLT es una medida más cualitativa que cuantitativa de la cantidad de solución con electrolitos en el tórax, o cualquier segmento corporal estudiado. Así, en el presente estudio la medición del CLT obtuvo valores que estuvieron entre 41,5 y 237,2, sin que se demostraran diferencias significativas entre los 3 momentos de medición. Este comportamiento estaría en relación con el procedimiento, ya que los pacientes durante el tiempo de medición no recibieron cantidades representativas de líquidos que pudieran modificar su volemia, ni se dieron cambios de posición ni de presiones intratorácicas suficientes para afectar la composición y distribución de los fluidos corporales.
Actualmente, varios estudios de investigación están evaluando la respuesta a volumen en los pacientes de unidades de cuidado intensivo; la medición del CLT aparece como una herramienta importante para evaluar la reanimación volumétrica. En contraste, estudios de modelos matemáticos que permiten entender la mecánica de fluidos y las respuestas hemodinámicas a los cambios de volemia17 pueden generar avances en los protocolos de reanimación volumétrica del paciente crítico.
En 1975 Qvist et al., utilizando como instrumento de medición el catéter de arteria pulmonar encontró que al instaurar la VM en perros normovolémicos las presiones de llenado y el GC disminuían y no había recuperación hemodinámica en las primeras horas. Concluyeron que los cambios en el índice cardíaco dependían de la integridad de la contractilidad ventricular derecha e izquierda18. En 2004 Reuters et al. compararon los efectos de la VM en pacientes sometidos a cirugía de corazón antes y después de la toracotomía, y encontraron, al igual que Chapin et al., que los efectos de la VM están directamente relacionados con la distensibilidad de la caja torácica. Este estudio se realizó con termodilución y ecocardiograma transesofágico19. Finalmente, en el estudio realizado por Kristensen et al. (2013) se encontró que durante la VM con presión positiva existe, aun a niveles bajos de presión positiva, disminución de la precarga y el GC. Este estudio se realizó con imágenes de resonancia magnética cardiaca20.
La termodilución, la resonancia magnética y el ecocardiograma son instrumentos con un alto nivel de precisión para evaluar los volúmenes cardiacos, de esta manera pueden determinar con mayor precisión los cambios resultantes de la interacción corazón-pulmón. En este contexto, es posible que la dificultad para diferenciar si los cambios en el perfil hemodinámico de los 38 pacientes son resultado de los efectos farmacológicos y/o de los efectos mecánicos esté directamente relacionada con el instrumento de medición. Sin embargo, es necesario continuar aplicando métodos fisiológicos en las situaciones clínicas reales para mejorar la comprensión de la interacción corazón-pulmón, ya que en los estudios17–19 no especifican los efectos directamente relacionados con los medicamentos utilizados durante la investigación. Además, la termodilución, el ecocardiograma y la resonancia magnética son instrumentos de alto costo, requieren experticia y los 2 primeros tienen las complicaciones asociadas a los métodos invasivos.
La biorreactancia genera mediciones en tiempo real y no es invasiva, de tal manera que es un elemento ideal para la investigación en clínica. Sin embargo, es necesario realizar más estudios.
El presente trabajo de investigación hace parte de la línea de fisiología aplicada y pretende hacer una descripción de la interacción corazón-pulmón en una situación real. En este contexto, aislar las variables que afectan dicha relación no es fácil, y diferenciar los efectos netamente producidos por los fármacos y/o la VM, dado que se siguen los protocolos de una práctica clínica convencional, es prácticamente imposible.
FinanciaciónDivisión de Fisiología, Maestría en Fisiología, Universidad Nacional de Colombia.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Agradecemos el apoyo de los departamentos de Anestesia, Cirugía Cardiovascular y salas de Cirugía de la Fundación Clínica Abood Shaio, que contribuyeron con su conocimiento y experiencia en la realización de la investigación.