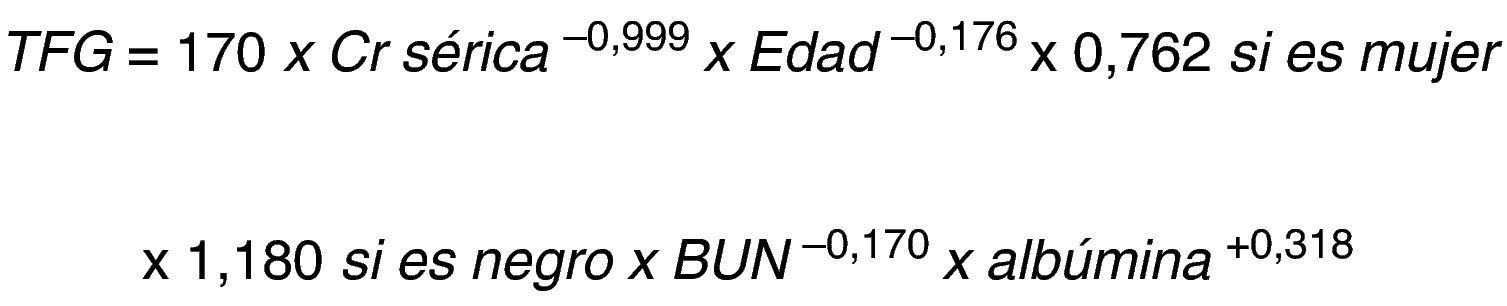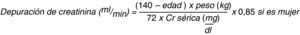La enfermedad renal crónica es un problema de salud pública mundial. En varias ocasiones los pacientes son llevados a cirugías relacionadas con su diálisis con operaciones propias de sus comorbilidades. El propósito de la valoración preanestésica es asesorar el riesgo de eventos cardiovasculares e iniciar las intervenciones que puedan influir en su morbimortalidad. El presente artículo describe datos epidemiológicos relevantes de la enfermedad renal crónica, así como su riesgo cardiovascular, y nos orienta en su valoración clínica, ayudas diagnósticas y estrategias para reducir el riesgo quirúrgico. La presente revisión narrativa de la literatura fue desarrollada con artículos escritos en inglés y español, limitados a los últimos 10años, información referenciada en textos guía y bases de datos primarias (como Pubmed-Embase-Lilacs), complementada con artículos referenciados de la anterior búsqueda.
Chronic renal disease is a public health problem worldwide. Several times these patients will undergo surgical procedures related to dialysis or surgeries related to their co-morbidities. The purpose of the pre-anesthesia evaluation is to assess the risk of cardiovascular events and initiate interventions that may influence morbidity and mortality. This article describes the relevant epidemiological data of chronic kidney disease and its cardiovascular risk and provides a guide on clinical assessment, diagnostic tools and strategies to reduce surgical risk. This narrative literature review is based on articles written in both English and Spanish limited to the last 10 years, information from basic textbooks and primary databases (i.e., PUBMED – EMBASE – LILACS), supported by articles referenced in the above-mentioned search.
En la valoración preanestésica se realiza una integra evaluación de la salud del paciente, lo cual incluye la medición de sus reservas orgánicas funcionales y la estimación de probables complicaciones durante el perioperatorio, que al final proporcionan un perfil de riesgo clínico que permita realizar intervenciones influyentes a corto y a largo plazo en la morbimortalidad1.
The National Kidney Foundation recomienda indagar durante la evaluación de los pacientes con enfermedad renal crónica: el diagnóstico etiológico, las comorbilidades, la severidad (nivel de función renal), las complicaciones, y estimar el riesgo de pérdida de la función renal y de complicación cardiovascular. En la valoración preanestésica estos parámetros deben sumarse a los riesgos inherentes del procedimiento quirúrgico con el fin de optimizar los factores de riesgo2.
MetodologíaRevisión narrativa no sistemática de la literatura desarrollada en idioma inglés y español, limitado a los últimos 10años, para información referenciada en textos guía, bases de datos primarias (como Pubmed-Embase-Lilacs) y complementada con artículos referenciados de la anterior búsqueda. Se utilizaron palabras en inglés, como: Kidney Diseases, Kidney Failure Chronic, Perioperative Care or Perioperative period, Mortality y Anesthesia. Para la búsqueda en español se emplearon las palabras: Enfermedad Renal, Falla Renal Crónica, Cuidado Perioperatorio y/o Perioperatorio. Tanto la búsqueda como la selección de los artículos se realizó de forma independiente por los diferentes autores, y cada grupo realizó lectura, análisis, asociación de nuevas referencias y construcción literaria para posteriormente ser analizada, validada (por el grupo de investigación) y corregida bajo el mejor estilo literario.
La investigación realizada en Pubmed se desarrolló con la siguiente fórmula y descriptores booleanos: ((((«kidney diseases»[MeSH Terms] OR («kidney»[All Fields] AND «diseases»[All Fields]) OR «kidney diseases»[All Fields]) AND («perioperative care»[MeSH Terms] OR («perioperative»[All Fields] AND «care»[All Fields]) OR «perioperative care»[All Fields])) AND («kidney failure, chronic»[MeSH Terms] OR («kidney»[All Fields] AND «failure»[All Fields] AND «chronic»[All Fields]) OR «chronic kidney failure»[All Fields] OR («kidney»[All Fields] AND «failure»[All Fields] AND «chronic»[All Fields]) OR «kidney failure, chronic»[All Fields])) AND («mortality»[Subheading] OR «mortality»[All Fields] OR «mortality»[MeSH Terms])) AND («anaesthesia»[All Fields] OR «anesthesia»[MeSH Terms] OR «anesthesia»[All Fields]).
Así se obtuvieron 8 artículos, de los cuales se incluyó uno. Con similar metodología se realizó búsqueda en Embase, no hallando diferentes artículos a los ya citados de Pubmed, y no se incluyeron duplicados. En Lilacs se hallaron 3 artículos empleando la búsqueda (Enfermedad Renal) AND (Cuidado Perioperatorio), ningún artículo con (Falla Renal Crónica) AND (Cuidado Perioperatorio) y uno con (Falla Renal Crónica) AND (Perioperatorio), y de los 4 hallados no se incluyó ninguno. Se realizó lectura de cada artículo y se seleccionaron los relacionados al tema en cuestión, se indagaron artículos referenciados tanto en lo publicado en libros de interés como en la referencias de los artículos, y bajo esta última metodología se incluyeron 54 referencias; en total se incluyeron 55 artículos con la metodología general. La minoría de los artículos incluidos en esta revisión es producto de la pesquisa primaria, lo cual pauta la escasa investigación y publicación en este tema, y por lo tanto nos acarrea la responsabilidad de argumentarnos con información vital pero no necesariamente hallada como eje básico de cada artículo, y mucho menos indexada con los presentes descriptores booleanos.
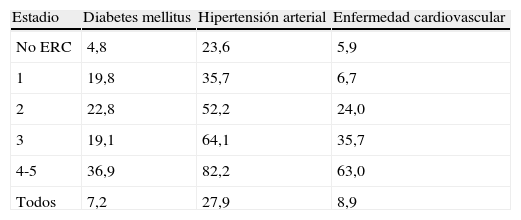
EpidemiologíaLa enfermedad renal crónica es un problema de salud pública; en Estados Unidos (para el año 2008) la enfermedad renal crónica presentó una incidencia del 4,3% en mayores de 65años (3,7 veces mayor que en 1995) y una prevalencia del 7,6% (4,6 más veces que en 1995); además se estableció que la prevalencia de diabetes mellitus, hipertensión arterial y enfermedad cardiovascular fue más alta en pacientes con enfermedad renal crónica y aumento a medida que la tasa de filtración glomerular (TFG) disminuía (tabla 1)3.
Prevalencia (%) de diabetes mellitus, hipertensión arterial y enfermedad cardiovascular en la enfermedad renal crónica (ERC) según la ecuación CKD-EPI
| Estadio | Diabetes mellitus | Hipertensión arterial | Enfermedad cardiovascular |
| No ERC | 4,8 | 23,6 | 5,9 |
| 1 | 19,8 | 35,7 | 6,7 |
| 2 | 22,8 | 52,2 | 24,0 |
| 3 | 19,1 | 64,1 | 35,7 |
| 4-5 | 36,9 | 82,2 | 63,0 |
| Todos | 7,2 | 27,9 | 8,9 |
Adaptado de: 2010 Annual Data Report: atlas of chronic kidney disease and end-stage renal disease in the United States, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, MD, 2010.
En Estados Unidos la mortalidad global fue 6,4 a 7,8 veces mayor que la población general, y cerca del 5 al 7% de todas las lesiones renales agudas ocurrieron durante la hospitalización4. Para Nash et al.5, el 7,2% de los pacientes durante la hospitalización experimentaron al menos un episodio de insuficiencia renal, y de ellos cerca del 20% requirieron tratamiento permanente con diálisis. Solo el 38,6% se recuperaron completamente, cerca del 20% fallecieron por causas relacionadas con su fallo renal, y en la unidad de cuidados intensivos este valor se elevó hasta el 60%5. En Colombia, la prevalencia de la enfermedad renal crónica en diálisis se incrementó de 44,7 pacientes por millón de habitantes en 1993 a 573 pacientes por millón en 2011; sus principales causas fueron diabetes mellitus (30%), hipertensión arterial (30%) y glomerulonefritis (7,85%)6.
Joseph y Cohn7 publicaron que la mortalidad de los pacientes con enfermedad renal crónica en diálisis programados a cirugía fue del 4% aproximadamente, y del 47% en procedimientos de urgencia.
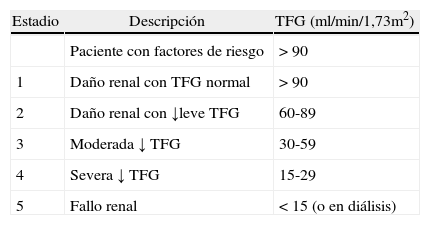
Evaluación de la función renalThe National Kidney Foundation y la Kidney Disease Outcomes Quality Initiative definen a la enfermedad renal crónica como el daño estructural o funcional del tejido renal que perdura durante más de 3meses, manifestado por anormalidades estructurales o funcionales, o la disminución de la TFG por debajo de 60ml/kg/1,73m28,9. Una reducción menor a este nivel representa una pérdida de más del 50% de la función renal en un adulto y está asociado a un aumento del riesgo de progresión de la enfermedad.
La TFG mide la capacidad del riñón para filtrar la sangre y se estandarizó para el esquema de clasificación de severidad de la enfermedad renal crónica (tabla 2)8.
Clasificación de la enfermedad renal crónica
| Estadio | Descripción | TFG (ml/min/1,73m2) |
| Paciente con factores de riesgo | >90 | |
| 1 | Daño renal con TFG normal | >90 |
| 2 | Daño renal con ↓leve TFG | 60-89 |
| 3 | Moderada ↓ TFG | 30-59 |
| 4 | Severa ↓ TFG | 15-29 |
| 5 | Fallo renal | <15 (o en diálisis) |
TFG: tasa de filtración glomerular.
Adaptado de: National Kidney Foundation and Kidney Disease Outcomes Quality Initiative - K/DOQI. Clinical practice guidelines for chronic kidney disease: evaluation, classification and stratification. American Journal Kidney Disease. 2002;39:S1-S266.
La creatinina sérica es el marcador más utilizado en la práctica clínica para evaluar la función renal. Sin embargo, la concentración de creatinina en plasma representa también la función metabólica muscular y es proporcional a su masa (generalmente más alta en hombres y en afro-descendientes). La formación de creatinina se reduce a medida que se incrementa la edad, en pacientes con desnutrición o atrofia muscular y en hipotermia; generalmente es excretada por secreción tubular y por vía gastrointestinal, la cual se aumenta en la disfunción renal y en edades avanzadas, encontrando en pacientes ancianos y/o con enfermedad crónica valores normales de creatinina y tasas de filtración glomerular disminuidas10.
La evaluación de la función renal se realiza con la estimación de la TFG a través de la depuración de creatinina, que representa el volumen de plasma que el riñón puede aclarar de creatinina en un minuto y se calcula mediante ecuaciones matemáticas; la ecuación de Cockroft-Gault ha sido la más utilizada (fig. 1)11.
Levey et al.12, a través del estudio de modificación de la dieta en la enfermedad renal (modification of diet in renal disease [MDRD]), desarrollaron otra ecuación que predice la TFG a partir de la concentración sérica de creatinina (fig. 2).
Este mismo autor luego modificó la ecuación MDRD y estableció la ecuación The Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) utilizando el registro de la creatinina sérica, la edad, el sexo y la raza según la escala natural (fig. 3)13.
Consideramos esta última ecuación como la más precisa para establecer el estadio de la enfermedad y orientar la evaluación del riesgo quirúrgico e intervenciones para evitar su progresión.
Riesgo cardiovascular y enfermedad renal crónicaLos pacientes con enfermedad renal crónica tienen un mayor riesgo de complicaciones cardiovasculares (infarto de miocardio, arritmia, disfunción ventricular o muerte de origen cardiaco). Según el estudio realizado por Manjunath et al.14, por cada 10ml/min/1,73m2 que desciende la TFG, se incrementa el riesgo de enfermedad coronaria en pacientes entre 45 a 64años (OR, 1,05; IC95%, 1,02-1,09)14. En el estudio Heart Outcomes and Prevention Evaluation (HOPE) se encontró un riesgo elevado de muerte cardiovascular en pacientes con niveles séricos de creatinina entre 1,4 y 2,3mg/dl, lo cual correspondió a una prevalencia del 11,4% vs. 6,6% hallado en los pacientes sanos, con un riesgo de 1,4 (IC95%, 1,16-1,69) independiente del tratamiento15. Resultados similares fueron encontrados por Tatsuhiko et al., con un OR de 13,1 para eventos cardiacos mayores en pacientes con TFG <60ml/kg/1,73m216.
En los pacientes sometidos a procedimientos quirúrgicos, una función renal disminuida se asoció con mayor morbimortalidad cardiaca, dependiendo de la clase funcional previa del paciente, del estadio de su enfermedad y del tipo de cirugía.
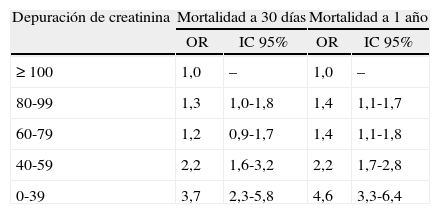
En un análisis prospectivo17, durante los primeros 30días postoperatorios de revascularización de miembros inferiores se incrementó el riesgo de morir (OR, 1,44; IC95%, 1,17-1,77), de paro cardiaco (OR, 1,43; IC95%, 1,09-1,88), de infarto de miocardio (OR, 1,68; IC95%, 1,39-2,16) o de intubación prolongada (OR, 1,57; IC95%, 1,28-1,94) en pacientes con TFG entre 30-59ml/kg/1,73m217. Otro análisis prospectivo a corto y a largo plazo posterior a cirugía cardiaca encontró un incremento de la mortalidad en pacientes con TFG entre 40 y 59ml/kg/1,73m2 y fue notorio en pacientes con menos de 39ml/kg/1,73m2 (tabla 3)18.
Resultados de mortalidad a 30 días y un año de pacientes sometidos a cirugía cardiaca según la depuración de creatinina (ml/min) por ecuación de Cockroft-Gault
| Depuración de creatinina | Mortalidad a 30 días | Mortalidad a 1 año | ||
| OR | IC 95% | OR | IC 95% | |
| ≥ 100 | 1,0 | – | 1,0 | – |
| 80-99 | 1,3 | 1,0-1,8 | 1,4 | 1,1-1,7 |
| 60-79 | 1,2 | 0,9-1,7 | 1,4 | 1,1-1,8 |
| 40-59 | 2,2 | 1,6-3,2 | 2,2 | 1,7-2,8 |
| 0-39 | 3,7 | 2,3-5,8 | 4,6 | 3,3-6,4 |
Adaptado de: Lok E et al. Impact of renal insufficiency on shortand long-term outcomes after cardiac surgery. Am Heart J. 2004;148:430-8.
Para la valoración preoperatoria del paciente cardiópata que va a ser llevado a cirugía no cardiaca, existen múltiples índices de predicción de complicaciones cardiovasculares19,20. Uno de los más utilizados es el índice de riesgo cardiaco revisado de Lee; sus datos, provenientes de un estudio prospectivo en 2.893 pacientes y validado en 1.492 pacientes, identificaron la enfermedad renal (creatinina >2mg/dl) como un factor de riesgo independiente para complicaciones cardiovasculares perioperatorias (infarto agudo de miocardio, eventos cerebrovasculares, insuficiencia cardiaca y muerte)21-23.
Evaluación clínica y ayudas diagnósticasLa cirugía urgente en pacientes con enfermedad renal crónica se asocia con mayor morbimortalidad, y no es diferible; en cambio, la cirugía programada se puede retrasar hasta optimizar la función renal al cursar con lesión aguda e inclusive se puede acelerar su resolución si se trata concomitantemente el evento precipitante24.
Para todo tipo de cirugía (urgente o programada) la historia clínica debe realizarse cuidadosamente; en la emergencia, la valoración clínica y paraclínica se limita a datos clínicos simples (como signos vitales, aspecto general, signos de hipervolemia) y paraclínicos sencillos como hemograma, electrolitos (sodio, potasio, calcio, cloro y fosforo), análisis de orina, creatinina sérica y electrocardiograma1.
La historia clínica se debe dirigir a condiciones cardiacas activas (infarto agudo de miocardio activo o reciente, insuficiencia cardiaca descompensada, enfermedad valvular severa y arritmias complicadas)1. Se debe establecer la capacidad funcional preferentemente expresada en equivalentes metabólicos (MET) según clasificación adoptada por la American Heart Association (AHA) (tabla 4)18,25; en ella, los pacientes con capacidad funcional <4MET habitualmente requieren estudios adicionales para evaluar el riesgo cardiovascular.
Estimación de requerimientos energéticos para varias actividades expresado en MET
| 1 MET a 4 MET | ¿Se puede cuidar por sí mismo? | > 4 MET | ¿Sube un tramo de escaleras? |
| ¿Come y se viste solo? | ¿Camina 100 cuadras? | ||
| ¿Camina plano en casa? | ¿Juega tenis dobles? | ||
| ¿Sube dos escalones? | ¿Hace trabajos pesados en casa: mover muebles pesados? | ||
| ¿Trabaja en casa: barre o lava platos? | > 10 MET | ¿Nada o corre rápidamente? | |
| 4 MET | ¿Juega un partido de baloncesto, corre a 10 km/h largas distancias, rema o realiza cualquier deporte de competencia? |
Adaptado de: American (Foundation/American Heart Association. 2009 Focused Update on Perioperative Beta Blockade Incorporated Into the ACC/AHA 2007 Guidelines on Perioperative Cardiovascular Evaluation and Care for Noncardiac Surgery. Journal of the American College of Cardiology. 2009;54(22):e13-118.
Basado en el principio de valoración de la severidad de la enfermedad renal y la intensidad quirúrgica programada9, se ha sugerido lo siguiente: los pacientes con enfermedad renal crónica en estadios 1-2 y capacidad funcional >4MET llevados a cirugía de riesgo bajo o intermedio no requieren estudio adicional. A los pacientes renales crónicos en estadio 3, 4, 5, o aquellos que van a cirugía de alto riesgo, se les debe asociar a su valoración inicial electrocardiograma, hemograma, radiografía de tórax, glucemia, nitrógeno ureico, creatinina, albúmina y electrolitos como sodio, potasio, cloro y calcio (si tienen algún impacto en el tratamiento). Igualmente, en pacientes con terapia de reemplazo renal que sean sometidos a cirugía de riesgo alto o intermedio se recomienda tener un control de electrolitos y tiempos de coagulación después de 2h de la última sesión de diálisis para optimizar sus requerimientos perioperatorios26.
En la enfermedad renal crónica terminal el electrocardiograma puede mostrar cambios inespecíficos como hipertrofia ventricular, trastornos electrolíticos y pericarditis urémica, dificultando la evaluación de enfermedad coronaria. Foley et al.27, en pacientes con enfermedad renal crónica terminal, encontraron por ecocardiografía que el 15% tenían disfunción sistólica, el 32% dilatación ventricular y el 74% hipertrofia ventricular, cada una de ellas con una clara correlación con enfermedad coronaria, hipocalcemia, hiperfosfatemia o hipoalbuminemia27.
Según las guías de evaluación perioperatoria de la AHA, es una recomendación II-B realizar prueba de estrés no invasivo a pacientes con uno o más factores de riesgo y una capacidad funcional <4MET. Para la gammagrafía con dipiridamol en pacientes con enfermedad renal crónica terminal se han reportado múltiples especificidades y sensibilidades, por lo que su valor diagnóstico es limitado; sin embargo, en combinación con gammagrafía con talio aumenta su rendimiento diagnóstico mostrando un valor predictivo negativo del 98%28. El ecocardiograma de estrés con dobutamina presenta mayor sensibilidad y especificidad y parece acercarse al diagnóstico de enfermedad coronaria en pacientes con enfermedad renal crónica; en estudios realizados en candidatos a trasplante renal se encontró una especificidad entre el 71 y el 95% y una sensibilidad entre el 37 y el 95%29–31. El rendimiento diagnóstico de la perfusión miocárdica en pacientes con enfermedad renal crónica terminal para enfermedad coronaria es variable, con especificidades entre el 37 y el 90% y sensibilidades entre el 40 y el 90%32.
Estrategias para reducir el riesgo quirúrgicoEl éxito de la prevención de complicaciones en el perioperatorio incluye la identificación y optimización de los pacientes en riesgo, un adecuado plan anestésico, la monitorización de la función renal e intervenciones oportunas.
La euvolemia, un adecuado estado de hidratación que asegure una adecuada perfusión renal y un adecuado gasto cardiaco siguen siendo las principales estrategias de protección renal para esta población33–35.
Es importante evitar el uso de nefrotóxicos durante el perioperatorio (p.ej., aminoglucósidos, anfotericina B, aciclovir, ciclosporina, tracrolimus, cisplatino, antinflamatorios no esteroideos y medios de contraste)36,37.
La nefropatía inducida por medio de contraste se produce en el 15% de pacientes con enfermedad renal crónica, y de ellos el 12% requieren hemodiálisis y hospitalizaciones prolongadas; por ello, intervenciones preventivas como hidratación controlada y alcalinización de la orina toman importancia38. Un estudio con 502 pacientes comparó la administración de bicarbonato de sodio en dextrosa versus infusión de solución salina al 0,9% antes de la exposición de contraste en pacientes con TFG<60ml/kg/1,73m2 y profilaxis oral con N-acetilcisteína; en ambos grupos no se encontraron diferencias significativas, y a pesar de las intervenciones, cerca del 10,8% presentaron nefropatía39.
El riesgo de hemorragia perioperatoria puede estar aumentado en pacientes con enfermedad renal crónica, debido a que la uremia conduce a disfunción plaquetaria; es recomendable que el paciente esté libre de uremia e idealmente la última sesión dialítica se realice el día previo40. Otras estrategias para prevenir el sangrado perioperatorio usan agentes hemostáticos; la desmopresina podría acortar el sangrado, sin embargo el empleo previo de eritropoyetina recombinante41 ha reducido su campo de acción. La terapia dual ácido acetilsalicílico (AAS) y clopidogrel aumenta hasta el 1% el riesgo de sangrado vs empleo único de AAS42; dependiendo del riesgo de compromiso hemostático durante el procedimiento quirúrgico, se recomienda suspender el clopidogrel 5días antes y evaluar la continuidad de AAS considerando su beneficio vs el riesgo de sangrado43.
Los efectos reno-vasculares modulados con fármacos inhibidores del sistema renina-angiotensina-aldosterona pueden estar potenciados bajo anestesia general, aumentando el riesgo de pérdida de control de la presión arterial sistémica y el tono vascular renal44. En un estudio prospectivo de 249 pacientes llevados a cirugía aórtica programada se encontró una disminución del 20% de la TFG al día 7posquirúrgico en pacientes en tratamiento crónico con inhibidores de la enzima convertidora de angiotensina45, por lo cual se recomienda su suspensión, incluidos los antagonistas de receptores de angiotensina, un mínimo de 10h antes del procedimiento y solo reiniciarse en el posoperatorio en estado euvolémico y sin evidencia de lesión renal aguda46.
La administración de fenoldopam, a diferencia de la dopamina, sí ha demostrado reducir la mortalidad y la incidencia de terapia de remplazo renal, aunque le faltan datos sólidos que lo confirmen de forma independiente47. La utilización de diuréticos y osmóticos como el manitol no tiene soporte preoperatorio, y es más importante su indicación durante la cirugía.
Múltiples estudios han demostrado el efecto de las estatinas para la morbimortalidad perioperatoria48 basado en su efecto pleiotrópico49,50. El estudio retrospectivo Statins for Risk Reduction in Surgery (StaRRS) encontró un efecto protector de complicaciones cardiovasculares en el subgrupo de cirugía vascular periférica (OR, 0,52)51.
Una de las complicaciones prevenibles del paciente con enfermedad renal crónica en el perioperatorio son las arritmias cardiacas y la depresión miocárdica secundarias a hipercaliemia; en caso de cirugía urgente se recomienda la administración de gluconato de calcio e infusión de dextrosa con insulina cristalina, además de bicarbonato de sodio, y micronebulizaciones con salbutamol asociado al manejo específico de la arritmia52–54.
Por último, en el paciente con enfermedad renal crónica en estadio terminal llevado a cirugía programada se recomienda realizar terapia de reemplazo renal el día previo al procedimiento y un estricto control dietario55.
ConclusionesLa enfermedad renal crónica es un factor de riesgo independiente para complicaciones cardiovasculares y muerte perioperatoria, convirtiéndose en un pilar de la valoración preanestésica; su correcto diagnóstico y la estadificación del riesgo de disfunción aguda posoperatoria nos permite delimitar con acierto las medidas de protección renal, así como hallar factores de riesgo asociados que nos conduzcan a la correcta prescripción de estudios y tratamientos adicionales.
FinanciaciónNinguna
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A nuestras familias (padres, esposas e hijos).