Describir la experiencia de 14 años del Instituto Nacional de Cancerología de Colombia en el tratamiento de los estados avanzados de cáncer epitelial de ovario.
MetodosEstudio observacional retrospectivo tipo serie de casos que incluyó pacientes con cáncer epitelial de ovario en estados III y IV, las cuales fueron llevadas a tratamiento primario en el Instituto Nacional de Cancerología entre el 1 de enero de 1997 y el 31 de diciembre de 2011.
ResultadosSe identificación 119 pacientes para el período de interés. Con una mediana de edad de 56 años, la mayoría de pacientes presentó compromiso en el estado funcional (63,9%) e hipoalbuminemia (82,4%). El tipo histológico más frecuente fue el adenocarcinoma seroso (62,2%), y el grado histológico mal diferenciado ocurrió en el 63,3% de los casos. Un 94,1% de los pacientes presentó compromiso de superficies peritoneales, con afectación de abdomen superior en un 38,7% y enfermedad extraabdominal un 29,4%. Se tuvo como intención de tratamiento la cirugía primaria más quimioterapia adyuvante en el 89,1% de las pacientes, logrando una citorreducción óptima en el 25,2% de los casos. El 29% presentó progresión durante el tratamiento y en un 57% se registró recaída. La mediana de supervivencia libre de enfermedad fue de 16,61 meses, y la de supervivencia global, de 28,93 meses.
ConclusionesLas pacientes con cáncer epitelial de ovario avanzado de nuestro medio se presentan con alta carga tumoral y con un comportamiento agresivo de la enfermedad reflejado en un pobre resultado oncológico.
To describe fourteen years of experience of in the treatment of advanced stages of epithelial ovarian cancer in the National Cancer Institute of Colombia
MethodsA retrospective observational case series including patients with epithelial ovarian cancer in stages III and IV, who received primary treatment in National Cancer Institute of Colombia between January 1st, 1997 and December 31th, 2011.
ResultsA total of 119 patients were identified durin the study period. With a median age of 56 years, most patients showed functional status compromise (63.9%) and hypolbuminemia (82.4%). The most common histological type was serous adenocarcinoma (62.2%) and there was poorly differentiated histological grade in 63.3% of cases. Almost all (94.1%) patients had peritoneal surfaces compromise with involvement of the upper abdomen in 38.7% and extra-abdominal disease in 29.4%. Treatment with primary surgery plus adjuvant chemotherapy was performed on 89.1%, achieving optimal cytoreduction in 25.2%; 29% of cases showed progression during treatment, and 57% of them relapsed. The median disease-free survival was 16.61 months, and the overall survival was 28.93 months.
ConclusionsIn our setting, patients with advanced epithelial ovarian cancer have a high tumor burden and aggressive behavior of the disease, reflected in a poor oncological outcome.
El cáncer epitelial de ovario es la quinta causa de cáncer y la primera de muerte por cáncer ginecológico en el ámbito mundial, con una incidencia de 6,3 casos por 100.000 mujeres, y una mortalidad de 3,8 casos por 100.000 mujeres1,2. En Colombia, la incidencia es de 8,7 por 10.000 mujeres, y la mortalidad es de 3,1 casos por 100.000 mujeres3.
Los tumores epiteliales en el mundo corresponden al 90% de los cánceres de ovario, con una edad promedio de aparición entre los 60 y 70 años4. El tipo histológico más frecuente es el seroso papilar, seguido por las variedades mucinoso, endometrioide, células claras, transicional, mixto e indife-renciado5.
La enfermedad se disemina generalmente por vía transcelómica, linfática y por continuidad a estructuras vecinas, siendo la mayoría de las veces asintomática o causando molestias abdominales menores, por lo que, generalmente, su diagnóstico se hace en estados avanzados (etapas III y IV), con diseminación fuera de la pelvis produciendo distención abdominal, ascitis, compromiso del epiplón, metástasis gan-glionares o hepáticas y disnea por efusión pleural, con una supervivencia a 5 años del 30% y períodos libres de enfermedad < 24 meses2,6.
En estados avanzados, el manejo estándar es la cirugía primaria seguida de quimioterapia adyuvante a base de platinos, siendo la citorreducción optima el factor pronóstico más importante para supervivencia7. La mortalidad postoperatoria se estima entre el 1 y 6% con morbilidad importante dada por sangrado, fenómenos tromboembólicos, infección, fistulas, isquemia miocárdica, obstrucción intestinal, lesiones viscerales y dehiscencia de heridas8.
En pacientes con condiciones médicas adversas o enfermedad tumoral muy extensa no susceptible de citorreducción óptima, se ha propuesto el manejo con quimioterapia neoadyuvante seguido por cirugía de intervalo y posterior quimioterapia, con resultados divergentes9. En algunas series, la quimioterapia neoadyuvante seguida por cirugía de intervalo ha mostrado resultados similares en supervivencia comparados con la cirugía primaria, requiriendo de menos procedimientos radicales y experimentando menor morbilidad4,10–13. Sin embargo, otros reportes han sugerido que la quimioterapia neoadyuvante está asociada con menor supervivencia global comparada con cirugía primaria14,15.
En los últimos años, en el ámbito mundial ha surgido controversia sobre el manejo ideal del cáncer epitelial avanzado de ovario. En Estados Unidos, se promueve el manejo quirúrgico primario incluso con procedimientos ultrarradicales9,16,17; en contraparte, en los grupos europeos se suele promulgar el uso de la quimioterapia neoadyuvante para disminuir morbilidad13. No conocemos estadísticas en nuestro medio que describan a los pacientes atendidos con esta patología y permitan informar sobre la elección entre opciones de tratamiento teniendo en cuenta las características de la enfermedad en nuestra población.
Por lo anteriormente expuesto, este estudio describe las características clínicas, epidemiológicas y los resultados oncológicos de un grupo de pacientes con cáncer epitelial avanzado de ovario tratadas en el Instituto Nacional de Cancerología de Colombia entre el 1 de enero de 1997 y el 31 de diciembre de 2011.
Materiales y métodosSe realizó un estudio observacional, retrospectivo, tipo serie de casos en pacientes con diagnóstico histopatológico de cáncer epitelial de ovario en estadios III y IV, las cuales habían recibido tratamiento primario en el Instituto Nacional de Cancerología de Colombia entre el 1 de enero de 1997 y el 31 de diciembre de 2011. Se excluyeron mujeres con otros cánceres primarios, excepto carcinoma basocelular de piel. A través del registro institucional de cáncer del Grupo de vigilancia epidemiológica, se listó a las pacientes con el diagnóstico de interés registrado mediante el código CIEO C56x. Este listado se contrastó con los registros de programación quirúrgica del servicio de ginecología oncológica, al igual que con las historias clínicas.
Una vez identificado el grupo de pacientes, se procedió a registrar la información de cada caso en un formato de recolección que incluía las variables demográficas, clínicas y de seguimiento relevantes. Se consolidó la información empleando un sistema de captura semiautomatizado con el software Teleform® (Cardiff Teleform, San Diego, California, Estados Unidos).
El análisis descriptivo de la información se realizó mediante medidas de frecuencia absoluta y relativa en el caso de las variables cualitativas. Para las variables cuantitativas, se resumió la información con medidas de tendencia central (promedios o medianas) y medidas de dispersión (desviaciones estándares o rangos), acorde con la normalidad de la distribución. Se validó el supuesto de normalidad mediante la prueba de Shapiro-Wilks. Se describió de forma gráfica la supervivencia global (tiempo entre la cirugía y el último seguimiento) y la supervivencia libre de progresión (tiempo entre el final del tratamiento y la presencia de recaída) con funciones de tiempo a evento estimadas por el método de Kaplan-Meier. Todos los análisis fueron realizados en Stata versión 11.2® (StataCorp LP, College Station, Texas, Estados Unidos).
Este proyecto de investigación fue evaluado y avalado por el Comité de Ética e Investigación del Instituto Nacional de Cancerología.
ResultadosSe identificaron 119 pacientes con cáncer epitelial avanzado de ovario con tratamiento primario realizado en el Instituto Nacional de Cancerología de Colombia entre el 1 de enero de 1997 y el 31 de diciembre de 2011, con estadios clínicos distribuidos de la siguiente manera: 78 (65,6%) en estado IIIC, 31 (26%) en estado IV, 7(5,9%) en estado IIIB y 3 (2,5%) en estado IIIA.
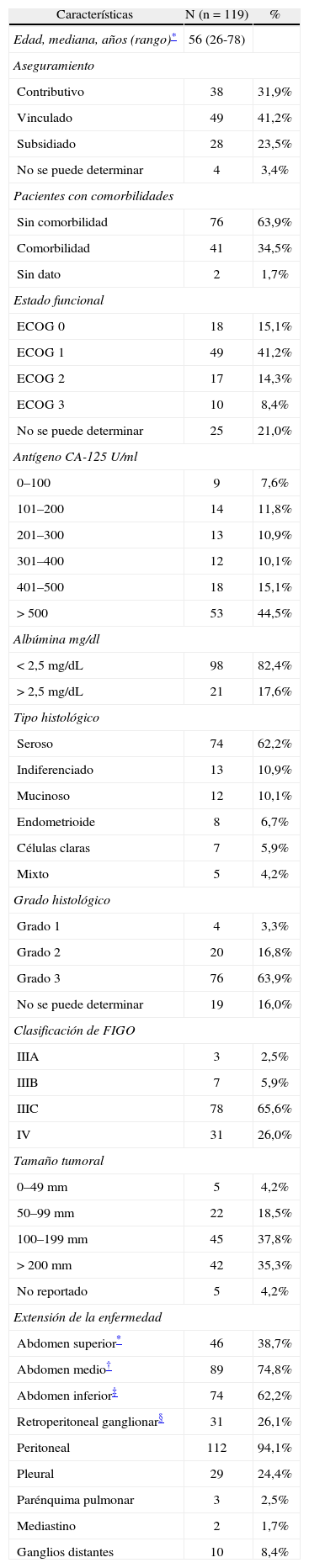
La mediana de edad de las pacientes fue 56 años, con un rango entre los 26 y los 78 años. Entre los factores sociode-mográficos de interés, se encontró que la mayoría correspondieron a población de bajos recursos económicos que no pertenecía al régimen contributivo de salud (64,7%). Entre las características clínicas más importantes se destacan la presencia de al menos una comorbilidad severa en 41 pacientes (34,5%), consistente principalmente en patología cardiovascular (27,7%) y restricción de leve a severa en su estatus funcional (63,9%) e hipoalbuminemia (82,4%).
Con relación al tipo histológico, en nuestra población el adenocarcinoma seroso fue el más frecuente (62,2%), y el grado histológico mal diferenciado ocurrió en 63,9% de los casos. La mediana de niveles de CA125 previo al inicio del tratamiento primario fue de 500 UI, la mediana de volumen de ascitis fue de 2,0 litros y la mediana de la masa tumoral dominante fue de 150mm, presentándose en el 73,1% de los casos con masas > 100mm.
En la mayoría de pacientes de esta serie, la enfermedad abdominal estuvo representada por compromiso peritoneal (94,1), abdomen medio (74,8%), seguido por enfermedad en estructuras de abdomen superior (38,7%) y ganglionar retro-peritoneal (26,1). El 29,4% presentaron metástasis en tórax, siendo el compromiso pleural el más frecuente a este nivel; en el 8,4% de los pacientes se registraron metástasis gan-glionares distantes (tabla 1).
Características clínicas e histopatológicas de las pacientes con cáncer epitelial avanzado de ovario tratadas en Instituto Nacional de Cancerología de Colombia (1997–2011)
| Características | N (n=119) | % |
| Edad, mediana, años (rango)* | 56 (26-78) | |
| Aseguramiento | ||
| Contributivo | 38 | 31,9% |
| Vinculado | 49 | 41,2% |
| Subsidiado | 28 | 23,5% |
| No se puede determinar | 4 | 3,4% |
| Pacientes con comorbilidades | ||
| Sin comorbilidad | 76 | 63,9% |
| Comorbilidad | 41 | 34,5% |
| Sin dato | 2 | 1,7% |
| Estado funcional | ||
| ECOG 0 | 18 | 15,1% |
| ECOG 1 | 49 | 41,2% |
| ECOG 2 | 17 | 14,3% |
| ECOG 3 | 10 | 8,4% |
| No se puede determinar | 25 | 21,0% |
| Antígeno CA-125 U/ml | ||
| 0–100 | 9 | 7,6% |
| 101–200 | 14 | 11,8% |
| 201–300 | 13 | 10,9% |
| 301–400 | 12 | 10,1% |
| 401–500 | 18 | 15,1% |
| > 500 | 53 | 44,5% |
| Albúmina mg/dl | ||
| < 2,5mg/dL | 98 | 82,4% |
| > 2,5mg/dL | 21 | 17,6% |
| Tipo histológico | ||
| Seroso | 74 | 62,2% |
| Indiferenciado | 13 | 10,9% |
| Mucinoso | 12 | 10,1% |
| Endometrioide | 8 | 6,7% |
| Células claras | 7 | 5,9% |
| Mixto | 5 | 4,2% |
| Grado histológico | ||
| Grado 1 | 4 | 3,3% |
| Grado 2 | 20 | 16,8% |
| Grado 3 | 76 | 63,9% |
| No se puede determinar | 19 | 16,0% |
| Clasificación de FIGO | ||
| IIIA | 3 | 2,5% |
| IIIB | 7 | 5,9% |
| IIIC | 78 | 65,6% |
| IV | 31 | 26,0% |
| Tamaño tumoral | ||
| 0–49mm | 5 | 4,2% |
| 50–99mm | 22 | 18,5% |
| 100–199mm | 45 | 37,8% |
| > 200mm | 42 | 35,3% |
| No reportado | 5 | 4,2% |
| Extensión de la enfermedad | ||
| Abdomen superior* | 46 | 38,7% |
| Abdomen medio† | 89 | 74,8% |
| Abdomen inferior‡ | 74 | 62,2% |
| Retroperitoneal ganglionar§ | 31 | 26,1% |
| Peritoneal | 112 | 94,1% |
| Pleural | 29 | 24,4% |
| Parénquima pulmonar | 3 | 2,5% |
| Mediastino | 2 | 1,7% |
| Ganglios distantes | 10 | 8,4% |
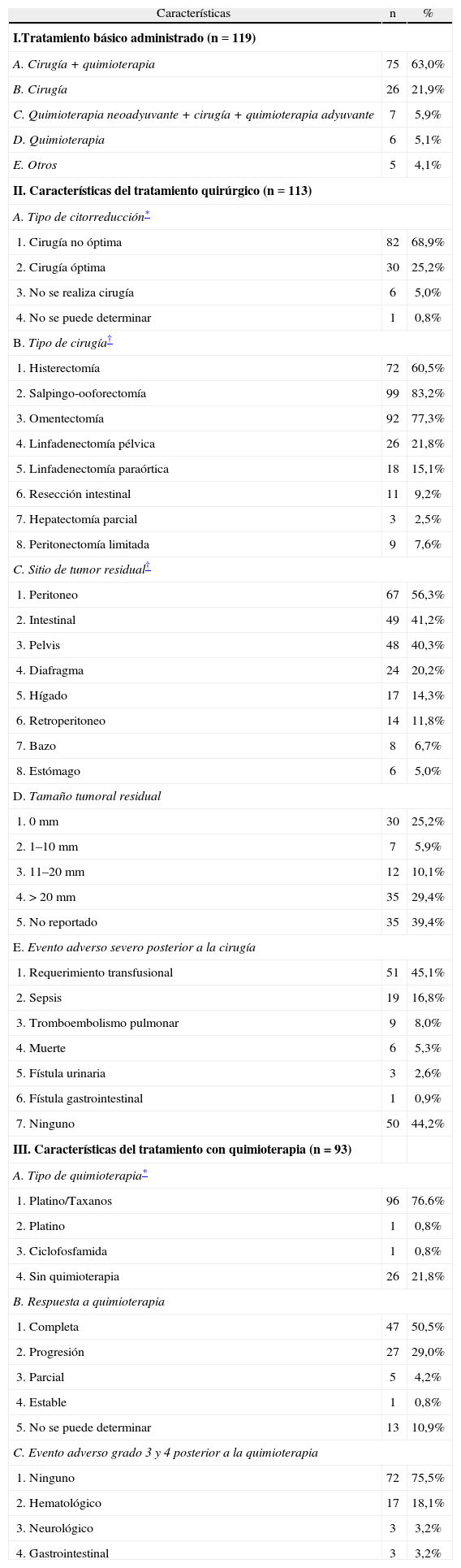
De las 119 pacientes incluidas en el estudio, en 106 (89,1%) el tratamiento prescrito originalmente fue quirúrgico, y en 13 (10,9%) con quimioterapia neoadyuvante. La citorreduc-ción óptima definida para el estudio como ausencia de enfermedad residual macroscópica se logró en el 25,2% de los casos, siendo las superficies peritoneales, las asas intestinales, las estructuras pélvicas y de hemiabdomen superior los sitios más frecuentes de tumor residual (tabla 2). Los procedimientos de citorreducción ultrarradical incluyeron resecciones intestinales (n=11, 9,2%), peritonectomías limitadas (n=9, 7,6%) y hepatectomías parciales (n=3, 2,5%). Las complicaciones mayores derivadas de los procedimientos quirúrgicos se presentaron en un 55,8% de los pacientes llevados a cirugía, entre las más relevantes, se encontraron el requerimiento transfusional (n=51, 45,1%), la sepsis de origen abdominal (n=19, 16.8%), la presencia de tromboem-bolismo pulmonar (n=9, 8%) y la muerte atribuible a la cirugía (n=6, 5,3%).
Características del tratamiento de las pacientes con cáncer epitelial avanzado de ovario manejadas en el Instituto Nacional de Cancerología de Colombia (1997–2011)
| Características | n | % |
| I.Tratamiento básico administrado (n=119) | ||
| A. Cirugía + quimioterapia | 75 | 63,0% |
| B. Cirugía | 26 | 21,9% |
| C. Quimioterapia neoadyuvante + cirugía + quimioterapia adyuvante | 7 | 5,9% |
| D. Quimioterapia | 6 | 5,1% |
| E. Otros | 5 | 4,1% |
| II. Características del tratamiento quirúrgico (n=113) | ||
| A. Tipo de citorreducción* | ||
| 1. Cirugía no óptima | 82 | 68,9% |
| 2. Cirugía óptima | 30 | 25,2% |
| 3. No se realiza cirugía | 6 | 5,0% |
| 4. No se puede determinar | 1 | 0,8% |
| B. Tipo de cirugía† | ||
| 1. Histerectomía | 72 | 60,5% |
| 2. Salpingo-ooforectomía | 99 | 83,2% |
| 3. Omentectomía | 92 | 77,3% |
| 4. Linfadenectomía pélvica | 26 | 21,8% |
| 5. Linfadenectomía paraórtica | 18 | 15,1% |
| 6. Resección intestinal | 11 | 9,2% |
| 7. Hepatectomía parcial | 3 | 2,5% |
| 8. Peritonectomía limitada | 9 | 7,6% |
| C. Sitio de tumor residual† | ||
| 1. Peritoneo | 67 | 56,3% |
| 2. Intestinal | 49 | 41,2% |
| 3. Pelvis | 48 | 40,3% |
| 4. Diafragma | 24 | 20,2% |
| 5. Hígado | 17 | 14,3% |
| 6. Retroperitoneo | 14 | 11,8% |
| 7. Bazo | 8 | 6,7% |
| 8. Estómago | 6 | 5,0% |
| D. Tamaño tumoral residual | ||
| 1. 0mm | 30 | 25,2% |
| 2. 1–10mm | 7 | 5,9% |
| 3. 11–20mm | 12 | 10,1% |
| 4. > 20mm | 35 | 29,4% |
| 5. No reportado | 35 | 39,4% |
| E. Evento adverso severo posterior a la cirugía | ||
| 1. Requerimiento transfusional | 51 | 45,1% |
| 2. Sepsis | 19 | 16,8% |
| 3. Tromboembolismo pulmonar | 9 | 8,0% |
| 4. Muerte | 6 | 5,3% |
| 5. Fístula urinaria | 3 | 2,6% |
| 6. Fístula gastrointestinal | 1 | 0,9% |
| 7. Ninguno | 50 | 44,2% |
| III. Características del tratamiento con quimioterapia (n=93) | ||
| A. Tipo de quimioterapia* | ||
| 1. Platino/Taxanos | 96 | 76.6% |
| 2. Platino | 1 | 0,8% |
| 3. Ciclofosfamida | 1 | 0,8% |
| 4. Sin quimioterapia | 26 | 21,8% |
| B. Respuesta a quimioterapia | ||
| 1. Completa | 47 | 50,5% |
| 2. Progresión | 27 | 29,0% |
| 3. Parcial | 5 | 4,2% |
| 4. Estable | 1 | 0,8% |
| 5. No se puede determinar | 13 | 10,9% |
| C. Evento adverso grado 3 y 4 posterior a la quimioterapia | ||
| 1. Ninguno | 72 | 75,5% |
| 2. Hematológico | 17 | 18,1% |
| 3. Neurológico | 3 | 3,2% |
| 4. Gastrointestinal | 3 | 3,2% |
Con respecto al subgrupo de pacientes tratadas con cirugía (n=26), el manejo se realizó sin adyuvancia por severo compromiso en estado funcional en 8 casos, no aceptación del tratamiento con quimioterapia en 6 casos, en 5 se registró muerte perioperatoria, y no se pudo establecer el motivo en 7 pacientes. Por otra parte, en 5 pacientes llevadas a manejo quirúrgico, se realizaron procedimientos mínimos de citorreducción en primera instancia debido al compromiso extenso de la enfermedad, requiriendo posterior quimioterapia neoadyuvante, con lo cual se logró ausencia de enfermedad residual en 4 de los casos durante la cirugía de intervalo.
De las 93 pacientes que recibieron quimioterapia, el 97,8% lo hicieron con esquemas que incluían combinación de platinos y taxanos, con una mediana de 5 ciclos. La mayoría de las pacientes tuvo respuesta completa (n=47, 50,5%), sin embargo, un 29% de los casos se constituyeron en refractarias al tratamiento por presentar progresión de la enfermedad durante el manejo. Se presentaron efectos adversos severos derivados de la quimioterapia en el 23% de los casos, siendo el más frecuente la toxicidad hematológica, grados 3 y 4 (n=17, 18,1%). No se registraron muertes asociadas con la quimioterapia.
Un total de 6 mujeres (5,1%) recibieron tratamiento con quimioterapia exclusiva; en 5 de ellas, la enfermedad progresó durante el tratamiento, con un empeoramiento del estado funcional, lo cual contraindicó la cirugía de intervalo; la paciente restante no aceptó el manejo quirúrgico.
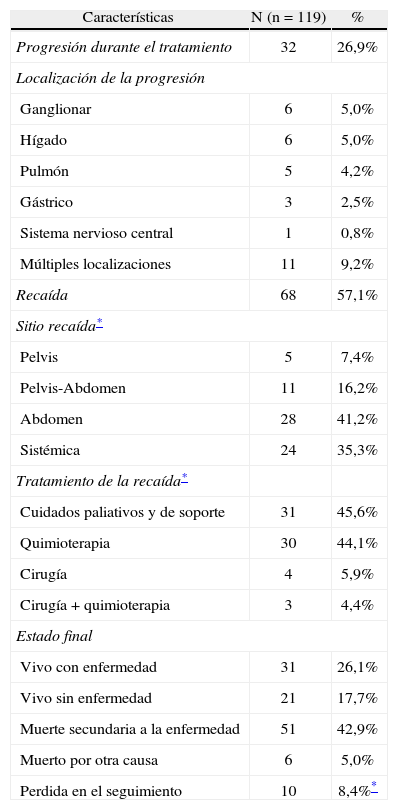
Del total de pacientes del estudio, 32 mostraron progresión de la enfermedad durante el tratamiento. En cuanto a los sitios de progresión, la mayoría la presentó simultáneamente en más de un sitio (11 casos), seguidos por compromiso ganglionar y hepático (6 casos cada uno), estomago (3 casos) y sistema nervioso central (1 caso) (tabla 3).
Resultado oncológico de las pacientes con cáncer epitelial avanzado de ovario manejadas en el Instituto Nacional de Cancerología de Colombia (1997–2011)
| Características | N (n=119) | % |
| Progresión durante el tratamiento | 32 | 26,9% |
| Localización de la progresión | ||
| Ganglionar | 6 | 5,0% |
| Hígado | 6 | 5,0% |
| Pulmón | 5 | 4,2% |
| Gástrico | 3 | 2,5% |
| Sistema nervioso central | 1 | 0,8% |
| Múltiples localizaciones | 11 | 9,2% |
| Recaída | 68 | 57,1% |
| Sitio recaída* | ||
| Pelvis | 5 | 7,4% |
| Pelvis-Abdomen | 11 | 16,2% |
| Abdomen | 28 | 41,2% |
| Sistémica | 24 | 35,3% |
| Tratamiento de la recaída* | ||
| Cuidados paliativos y de soporte | 31 | 45,6% |
| Quimioterapia | 30 | 44,1% |
| Cirugía | 4 | 5,9% |
| Cirugía + quimioterapia | 3 | 4,4% |
| Estado final | ||
| Vivo con enfermedad | 31 | 26,1% |
| Vivo sin enfermedad | 21 | 17,7% |
| Muerte secundaria a la enfermedad | 51 | 42,9% |
| Muerto por otra causa | 6 | 5,0% |
| Perdida en el seguimiento | 10 | 8,4%* |
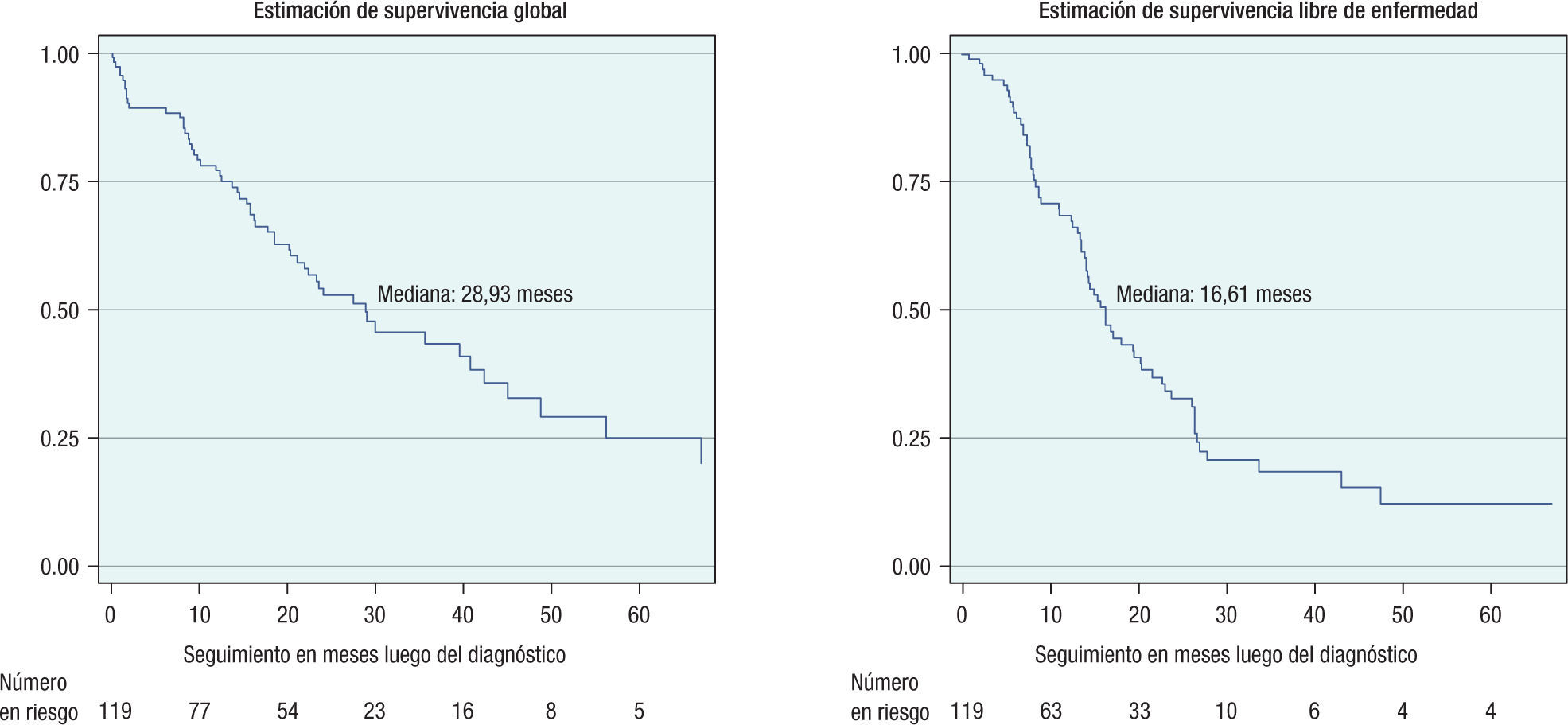
Con respecto a la condición final de las pacientes, se pudieron seguir 109 mujeres (91,6%) con una mediana de seguimiento de 20,52 meses (rango 0 a 117 meses). Al cierre del estudio, el 42,9% habían fallecido a causa de la enfermedad, el 26,1% estaban vivas con enfermedad, el 17,7% se encontraban libres de enfermedad y el 5% habían fallecido por otras causas. La mediana de supervivencia global para esta muestra de pacientes fue de 28,93 meses.
La mediana de supervivencia libre de enfermedad para el total de la población del estudio fue de 16,61 meses (fig. 1). Del total de mujeres con tratamiento primario para cáncer epitelial avanzado de ovario, 68 pacientes (57,1%) presentaron recaída en las siguientes localizaciones: 28 pacientes, en abdomen (23,3%), 24 pacientes, en el ámbito sistémico (20,2%), 11 pacientes, recaída simultánea en abdomen y pelvis (9,2%) y 5 pacientes, limitado solo a la pelvis (4,2%). El tratamiento de las recaídas consistió fundamentalmente en quimioterapia para 31 mujeres (45,6%) y cuidado paliativo y de soporte en 31 casos (45.6%). En 7 casos se intentó cirugía de rescate, 2 de ellos con peritonectomía y quimioterapia hipertérmica intraperitoneal, falleciendo un caso en el perioperatorio por sepsis abdominal y el otro presentando progresión de la enfermedad 4 meses después del procedimiento. Del subgrupo de pacientes que recibieron quimioterapia y presentaron recaída de la enfermedad (n=63), un 47,6% lo hicieron antes de 6 meses de finalizado el tratamiento (platino-resistentes), un 20,6% tuvo sensibilidad intermedia al recaer entre 6 y 12 meses y un 31,7% recayeron luego de 12 meses (población platino-sensible).
DiscusiónLas pacientes con cáncer epitelial avanzado de ovario tratadas en el Instituto Nacional de Cancerología de Colombia presentan en su mayoría una alta carga tumoral y un comportamiento agresivo. La mediana de edad en el momento del diagnóstico es menor en nuestra población cuando se compara con lo reportado para la población norteamericana y europea (56 vs. 63 años). La histología serosa e indiferenciada se registra en la mayoría de los casos, similar a la distribución reportada en la literatura; sin embargo, el grado nuclear mal diferenciado predomina en un 63,9% de los casos, contrario a estudios de referencia en los cuales el grado bien y moderadamente diferenciado corresponde a las 2/3 partes de los casos7–9.
En el presente estudio, la población de los regímenes subsidiado y vinculado constituía el 64,7% de la muestra, esto podría estar relacionado con un acceso menos oportuno y regular a los servicios de salud de alta complejidad, contribuyendo a la severidad de la enfermedad en el momento del diagnóstico, demora en la realización de los tratamientos y una limitación en la adherencia al seguimiento.
El 26% de las pacientes de este estudio se presentaron en estado IV, dato similar al 28% reportado en la revisión Cochrane del manejo quirúrgico del cáncer avanzado de ovario6. Sin embargo, la enfermedad abdominal en nuestra población fue extensa, con tamaños tumorales > 20cm en el 35,2%, y entre 10–20cm en el 37,8% de los casos, hallazgos que en conjunto con la presencia de enfermedad masiva en abdomen superior, el compromiso intestinal y el compromiso de superficies peritoneales contribuyeron a la baja frecuencia de citorreducción registradas y al pobre desenlace oncológico en supervivencia global y supervivencia libre de progresión, frente a los reportados por otras experiencias institucionales18–20.
La tendencia en el tratamiento en este estudio es realizar cirugía de citorreducción primaria y posterior adyuvancia con quimioterapia en el 89,1% de los casos. Chi et al. han liderado la propuesta de esfuerzo citorreductor máximo con objetivo de eliminar toda la enfermedad macroscópica a expensas de procedimientos ultrarradicales que incluyeron peritonectomía diafragmática (73%), esplenectomía (62%), hepatectomía parcial (29%), colecistectomía y pancreatectomía (11%), logrando porcentajes de citorreducción óptima hasta del 78%, con medianas de supervivencia global de 57 meses y medianas de supervivencia libre de enfermedad de 34 meses8,16,17,20. En la experiencia institucional, se logró una menor citorreducción óptima (25,2%), con medianas de supervivencia global y libre de progresión inferiores para toda la población. Los procedimientos de citorreducción ultrarradical se limitan a unos pocos casos de hepatectomía parcial, resecciones intestinales y peritonectomías limitadas como manejo primario, y en 2 casos, protocolos de Sugar Baker en el escenario de enfermedad recurrente con un resultado oncológico discreto.
El grupo European Organisation for Research and Treatment of Cancer-Gynaecological Cancer Group reporta que el tratamiento con quimioterapia neoadyuvante más cirugía de intervalo no es inferior a la propuesta de tratamiento con cirugía primaria convencional. Los porcentajes de citorreducción óptima de los pacientes de nuestro estudio son similares a los registrados en el brazo de manejo primario con cirugía de un ensayo aleatorizado publicado por el grupo europeo (20,4%)9 e inferiores al brazo de tratamiento con cirugía de intervalo, el cual puede alcanzar una citorreducción de hasta el 50%. El resultado oncológico de nuestras pacientes fue similar al obtenido por el grupo europeo cuando se evalúa la mediana de supervivencia global (30 meses) y la supervivencia libre de enfermedad (12 meses)7. Es importante resaltar que existe un riesgo de sesgo de información importante, derivado de la baja continuidad en la atención de nuestro sistema de salud, esto puede generar una subestimación del tiempo a recaída o muerte por la enfermedad. En el estudio solo un 8,4% de las pacientes no pudieron ser seguidas, y los casos restantes variaron en la regularidad y alcance del seguimiento.
Este estudio refleja el comportamiento epidemiológico de las pacientes tratadas por cáncer epitelial avanzado de ovario en el Instituto Nacional de Cancerología de Colombia. Entre las fortalezas del estudio se encuentran la estandarización del registro para las características histológicas, el comportamiento clínico de las pacientes, los eventos adversos asociados al tratamiento, el curso de la enfermedad y el resultado oncológico alcanzado. Existen limitaciones asociadas con el diseño del estudio y el tamaño de la muestra, tal es el caso de algunos subregistros de información y la dificultad para garantizar un seguimiento a largo plazo. No obstante, esta investigación constituye un punto de partida para el desarrollo de estudios prospectivos que permitan dilucidar el comportamiento biológico del cancer de ovario en la población colombiana, evaluar el efecto de las modalidades de tratamiento existentes e incorporar nuevas terapias con el fin de mejorar los desenlaces.
El resultado oncológico pobre identificado en la población a estudio podría corresponder a causas multifactoriales: se identifican características biológicas que marcan un comportamiento agresivo de la enfermedad dado por una edad más temprana de presentación de la enfermedad, predominio de cáncer de ovario tipo 2, y extenso compromiso tumoral en el momento de diagnóstico. De igual manera, la complejidad del cuadro en el momento del inicio del tratamiento,¡ condiciona bajas tasas de citorreducción óptima, el factor pronóstico conocido más importante, sumado a tasas altas de complicaciones quirúrgicas y perdidas de seguimiento. Con los resultados obtenidos, se puede sustentar el desarrollo de un protocolo institucional de manejo, que permita seleccionar el tratamiento primario más conveniente para cada paciente, en busca de mejorar las tasas de citorreducción, hacer más oportuno el inicio de tratamientos adyuvantes y disminuir la morbilidad asociada al manejo. Se puede considerar la necesidad de un papel más relevante para el tratamiento con neoadyuvancia.
Dada la complejidad de las pacientes atendidas en nuestro medio y el curso clínico desfavorable en una proporción importante de los casos, se hace necesario aumentar la investigación en nuevas estrategias de detección temprana, modelos de atención oportuna e integral, el uso de nuevas terapias antineoplásicas y hormonoterapia, así como consolidar el aprendizaje de abordajes quirúrgicos radicales, el uso de terapias biológicas y de quimioterapia intraperito-neal para la atención de estas pacientes.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.