Los tumores anficrinos de la glándula mamaria son lesiones duales muy poco frecuentes con diferenciación epitelial y neuroendocrina de una misma célula. Nosotros presentamos el caso de una mujer con masa en el seno derecho. El estudio histopatológico mostró un tumor maligno constituido por células pequeñas entremezcladas con algunas células con aspecto en anillo de sello. El uso de anticuerpos monoclonales mostró inmunoreactividad para marcadores epiteliales y neuroendocrinos en las células malignas. Estas características permitieron hacer el diagnóstico de un tumor anficrino basado en la expresión en la misma célula de marcadores epiteliales y neuroendocrinos. El diagnóstico diferencial debe realizarse con los tumores de colisión o con metástasis. La interpretación rigurosa de la inmunohistoquímica en las células neoplásicas en un tumor anficrino es útil para distinguir esta entidad de otras patológicas con características morfológicas similares.
Amphicrine tumours of the mammary gland are very rare dual lesions with epithelial and neuroendocrine differentiation in the same cell. We report the case of a woman with a mass in the right breast. The histopathology study showed a malignant tumour formed by small cells inter-mixed with some cells with a signet ring appearance. The use of antibodies showed immunoreactivity for epithelial and neuroendocrine markers in the malignant cells. These characteristics enable the diagnosis of an amphicrine tumour, based on the expression of epithelial and neuroendocrine markers in the same cell. The differential diagnosis must be made with collision tumours or with metastasis. The rigorous interpretation of the immunohistochemistry in the malignant cells in an amphicrine tumour is useful in order to distinguish this tumour from other diseases with similar morphological characteristics.
Los carcinomas anficrinos primarios de glándula mamaria son lesiones poco frecuentes que se presentan en adultos mayores entre la sexta y séptima década de la vida y afectan predominantemente a las mujeres. Si se le compara con el carcinoma de mama de tipo no especial (anteriormente llamado carcinoma ductal de mama o tipo NOS) tienen un comportamiento biológico en apariencia más agresivo y un pronóstico menos favorable con una mayor tasa de metástasis y recurrencia local 1. Reportamos un caso de un carcinoma anficrino infiltrante primario de glándula mamaria haciendo énfasis en sus características morfológicas e inmunohistoquímicas y las consideraciones en relación con su graduación histopatológica, comportamiento biológico y pronóstico.
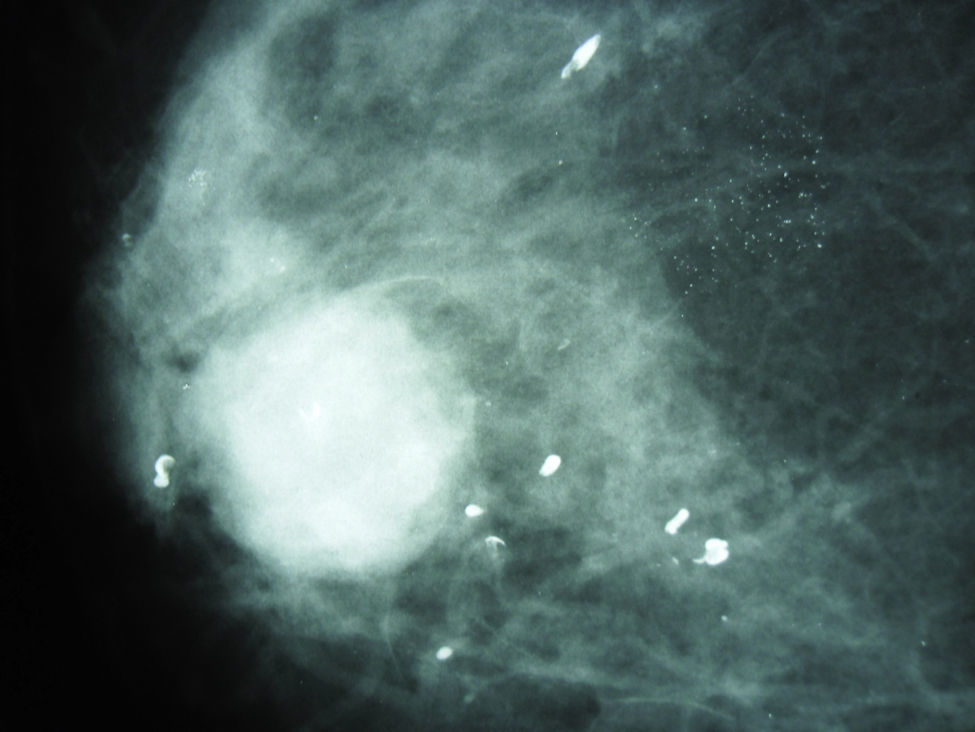
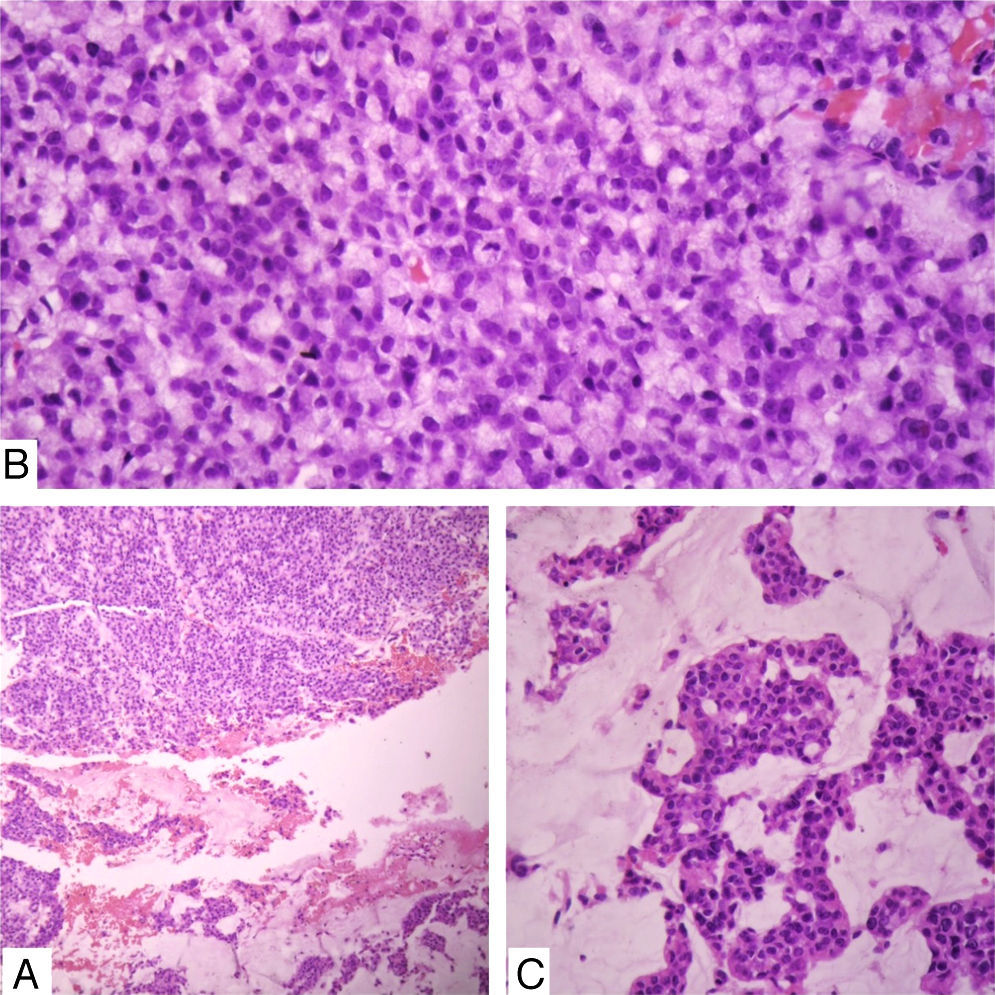
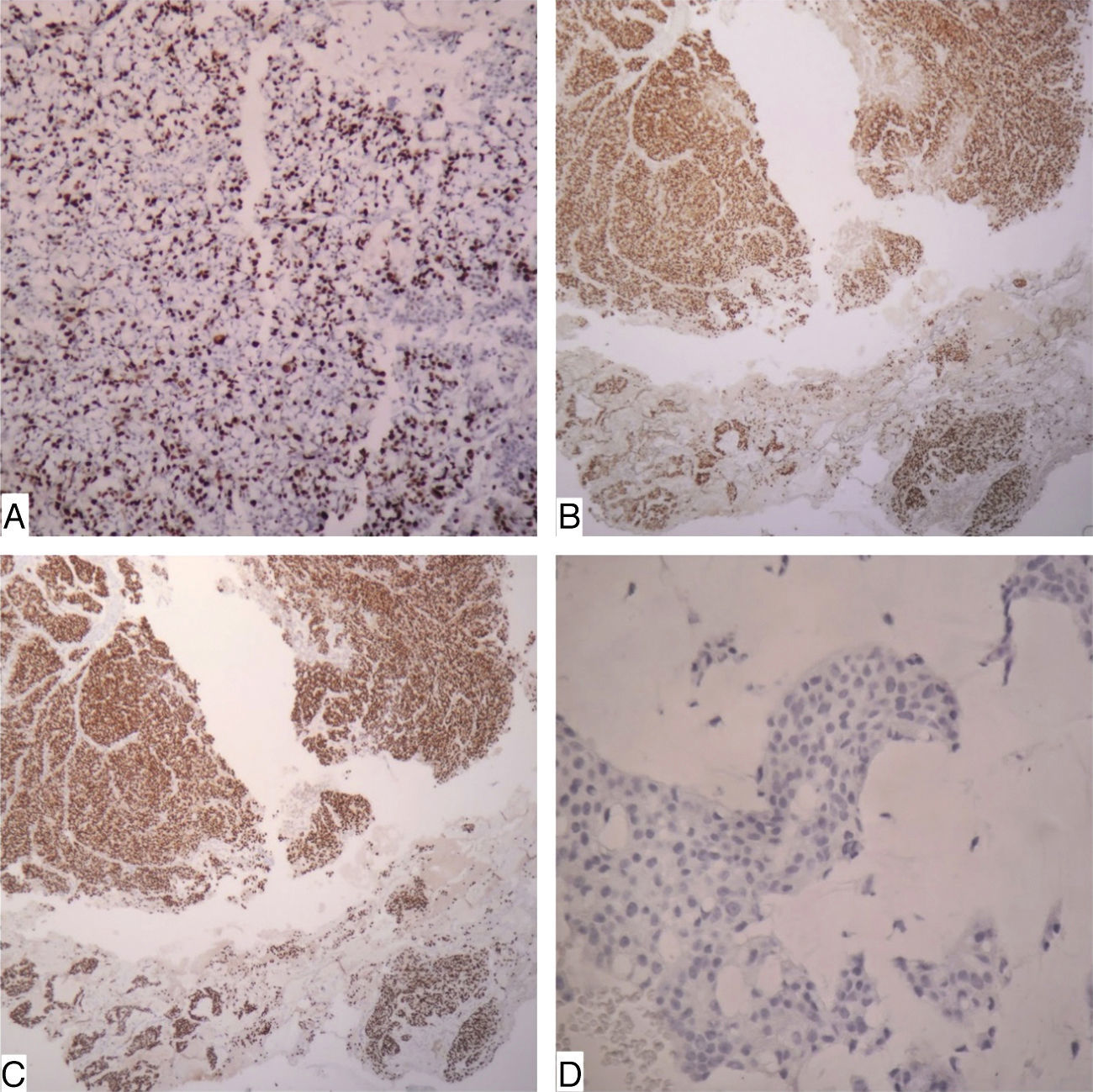
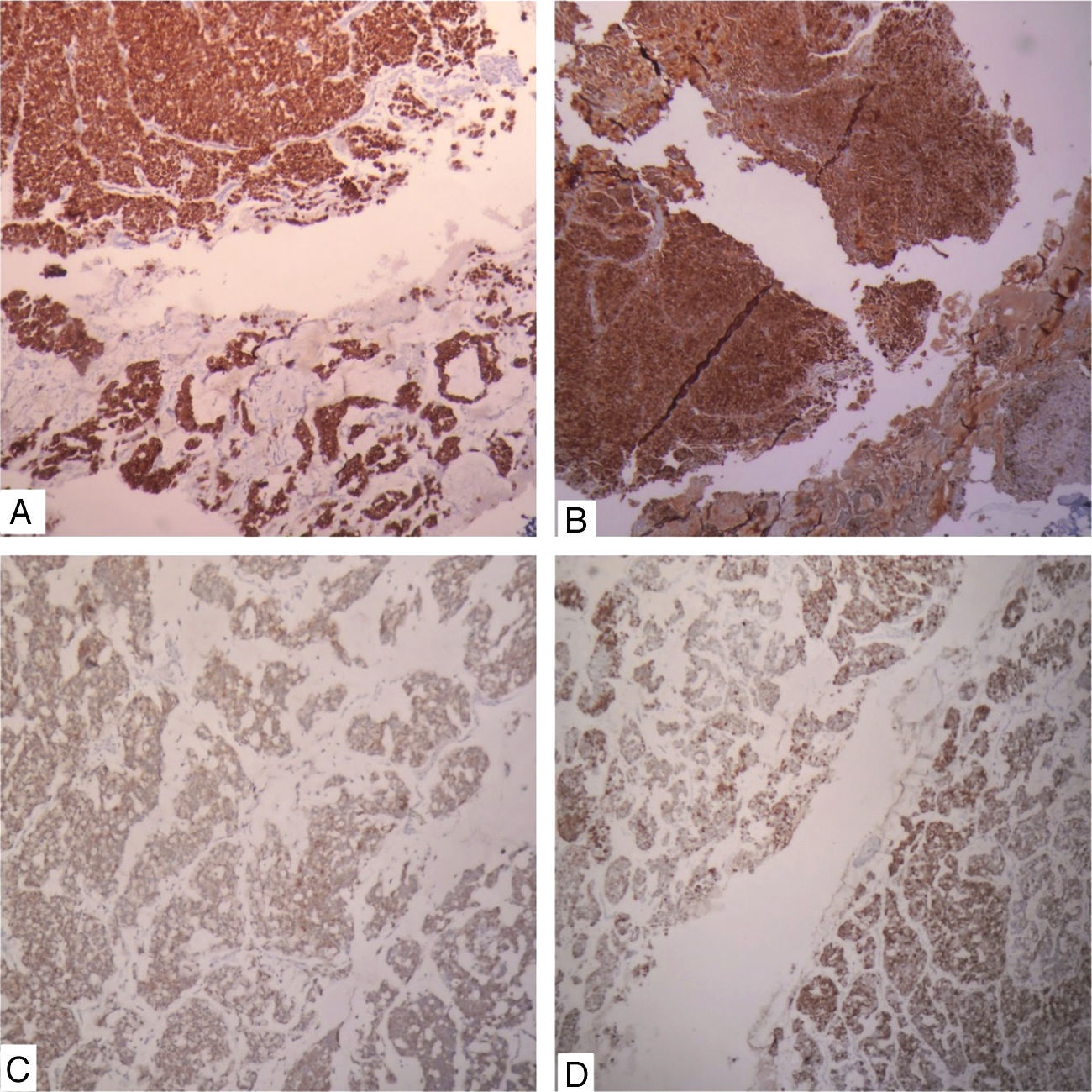
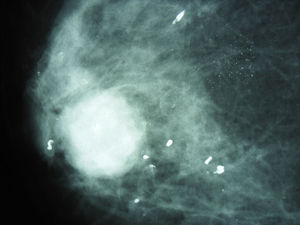
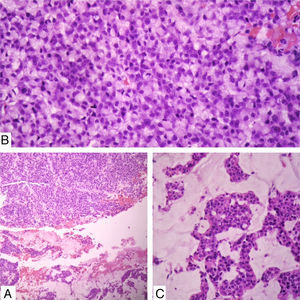
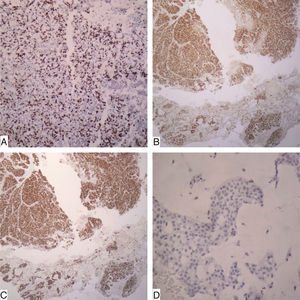
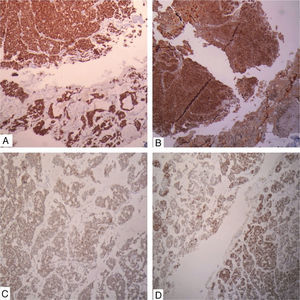
Caso clínicoSe trata de un paciente de sexo femenino de 90 años quien consultó por un cuadro clínico de un año de evolución consistente en sensación de masa en la mama derecha sin dolor ni telorrea. Clínicamente se palpaba una masa de 1,8cm de diámetro a nivel del cuadrante supero-externo. No se palpaban adenomegalias axilares. Traía reporte extrainstitucional de mamografía que reporta masa retroareolar en seno derecho con calcificaciones pleomórficas bilaterales, BIRADS: 0 (cero), esto debido a que no era posible definir si la lesión era sólida o quística (fig. 1). Se realizó un estudio citológico de punción guiada por ecografía, que fue reportado como sospechoso de malignidad dado la presencia de abundantes células ductales sueltas, discohesivas con hipercromatismo nuclear. Se realizó biopsia trucut de la masa que evidenció un carcinoma anficrino infiltrante de glándula mamaria con componente exocrino de carcinoma mucinoso tipo coloide de variante hipercelular, con células en anillo de sello y componente endocrino de tipo carcinoma neuroendocrino grado 3 de célula pequeña, con más de 20 mitosis por 10 campos de alto poder y un Ki-67 del 40% (fig. 2). El estudio de inmunohistoquímica mostró en la misma célula tumoral expresión de citoqueratina 7, receptores de estrógenos en el 100% de los núcleos de las células tumorales, receptor de progestágenos positivos en el 100%, oncogén HER-2 negativo (0), cromogranina (+) y sinaptofisina (+), así como la proteína del fluido quístico mamario 15 (GCPDF-15) (figs. 3 y 4).
Los estudios de extensión mostraban una gammagrafía ósea sin evidencia de lesiones metabólicamente activas, una ecografía abdominal total con hígado de forma, tamaño y ecogenicidad normal y sin imágenes que sugieran metástasis. La radiografía de tórax no mostró lesiones de ocupación alveolar ni masas. Como antecedentes de importancia, la paciente refirió un melanoma facial (se desconoce las clasificaciones de Clark y Breslow), el cual fue manejado con resección local amplia, hipertensión arterial y un accidente cerebrovascular con demencia y ansiedad generalizada como secuelas.
Con estos resultados se clasificó como paciente con carcinoma de mama anficrino luminal A, estadio IIA (T1N0M0). La paciente y sus familiares no aceptaron manejo quirúrgico ni con radioterapia. Dados los antecedentes de la paciente se deja manejo únicamente con Letrozol 2,5mg al día. El seguimiento actual a 6 meses desde el ingreso no muestra lesiones a distancia. La masa a la valoración clínica persiste del mismo tamaño. No se detectaron adenomegalias axilares.
DiscusiónLos carcinomas anficrinos de la glándula mamaria son muy poco frecuentes, constituyen menos del 0,1% de los carcinomas de glándula mamaria y tan solo su categorización como un tumor anficrino crea desconcierto al médico en relación con su naturaleza como su clasificación, pronóstico y tratamiento. Tan solo 6 series de casos han sido descritas en la literatura y en conjunto conforman solo 74 casos 2–7.
Se define como tumor anficrino a una neoplasia en que las células epiteliales muestran diferenciación dual: exocrina y endocrina confirmada por estudios de inmunohistoquímica o ultraestructurales 8. Esta definición es la más conocida y manejada por los clínicos y patólogos en referencia a las neoplasias gastroenteropancreáticas y de glándula salival, pero que poco se relaciona con los tumores mamarios. Para el caso de los carcinomas primarios de glándula mamaria se considera que un tumor es anficrino cuando la misma célula tumoral epitelial, que expresa citoqueratinas, también presenta diferenciación exocrina dada por la producción de mucinas o secreciones de tipo apocrino y diferenciación endocrina dada por la positividad para marcadores neuroendocrinos como la cromogranina (CHR) y sinaptofisina (SYN). También puede haber positividad para receptores hormonales de estrógenos (ER) y progestágenos (PR). En nuestro caso particular el carcinoma mostraba expresión de citoqueratina 7, GCPDF-15, ER, PR, CHR y SYN.
Las queratinas son dos grupos de filamentos intermedios (tipo I y tipo II) que constituyen parte de la ultraestructura celular. Se clasifican de acuerdo a su peso molecular (bajo y alto) y a su punto isoeléctrico (ácidas o básicas). Los tumores neuroendocrinos epiteliales expresan las queratinas en un patrón específico de distribución paranuclear o “dot-like” 9. Las cromograninas constituyen una familia de proteínas solubles localizadas en la matriz de los gránulos secretores de las células neuroendocrinas. La más importante debido a su alta utilidad clínica es la cromogranina A, un precursor de la pancreastatina y en general se expresa en la mayoría de neoplasias neuroendocrinas; sin embargo, su expresión es directamente proporcional a la cantidad de gránulos secretores presentes en la célula, de ahí que carcinomas neuroendocrinos de alto grado pueden no expresarla así como los originados en el recto 10. La sinaptofisina es una glicoproteína integral de membrana localizada en las vesículas presinápticas de las neuronas y en las vesículas pequeñas de las células neuroendocrinas tanto normales como tumorales y es expresada independientemente de otros marcadores neuroendocrinos, por lo cual su utilidad resulta complementaria con la cromogranina, en especial cuando esta última es negativa 11.
La Organización Mundial de la Salud (OMS) sugiere clasificar los tumores anficrinos primarios mamarios como carcinomas con diferenciación neuroendocrina, extendiéndose en su definición como carcinomas que exhiben características morfológicas similares a las observadas en los tumores neuroendocrinos de origen gastrointestinal y pulmonar 12. Se presentan generalmente en mujeres entre los 60 a 70 años sin alguna característica clínica o radiológica especial a los carcinomas convencionales de glándula mamaria, sino es su aspecto morfológico el que hace al patólogo considerar la posibilidad de componente o diferenciación neuroendocrina, dado que el tumor en el estudio microscópico muestra características similares a los de cualquier neoplasia neuroendocrina independientemente del sitio anatómico donde se produzca. En el estudio microscópico, el tumor está constituido por células monomórficas de bordes citoplasmáticos indistinguibles con patrones morfológicos variables que incluyen morfología plasmocitoide, fusocelular, irregular, etc.; y que crecen en patrones arquitecturales múltiples que incluyen formas organoide, nidos, trabéculas, acinos o sólidas. Las células muestran un citoplasma eosinófilo finamente granular. Los núcleos son ovoides con cromatina fina o granular que clásicamente ha sido definida a partir de su aspecto como de “sal y pimienta”, los nucléolos son en general no visibles y con un conteo mitótico variable que tiende a correlacionarse con el grado del tumor.
La OMS clasifica los tumores primarios mamarios con diferenciación neuroendocrina en tres grupos: tumores neuroendocrinos bien diferenciados (NET-WD), carcinoma neuroendocrinos pobremente diferenciados o carcinoma de células pequeñas (NEC-PD/SCC), y carcinoma de seno invasivo con diferenciación neuroendocrina (ICB-ND).
Los NET-WD están definidos como neoplasias constituidas por células de morfología elongado (fusiforme) o plasmocitoide, en ocasiones con cambio claro citoplasmático dispuestas en nidos y trabéculas con baja actividad mitótica (menos de 2 mitosis en 10 campos de alto poder) y que en general dependiendo de la expresión del índice de proliferación celular cuantificado por inmunohistoquímica con el anticuerpo para Ki–67 son categorizados como de bajo grado o grado intermedio (1 o 2), homologando a la clasificación de los tumores neuroendocrinos gastroenteropancreáticos. El antígeno Ki–67 es una proteína nuclear que se asocia estrechamente a la proliferación celular y está presente durante todas las fases activas del ciclo celular (G1, S, G2 y mitosis), pero está ausente de las células en reposo (G0). Durante la interfase, el antígeno Ki–67 es detectado exclusivamente en el núcleo de la célula, mientras que en la mitosis la mayor parte de la proteína se traslada a la superficie de los cromosomas 13.
Los NEC-PD/SCC son aquellos en que las células tumorales crecen en patrón infiltrativo con hipercromatismo nuclear, acompañado de necrosis y frecuentes figuras mitóticas (en general más de 20 en 10 campos de alto poder), en un aspecto histológico similar a lo observado en los carcinomas de células pequeñas del pulmón (los popularmente conocidos como células en avena o carcinomas out cell). El Ki–67 es mayor del 20%, lo que en conjunto categoriza los tumores como de alto grado. En nuestro caso particular, el tumor mostraba morfología de célula pequeña con hipercromatismo nuclear, más de 20 mitosis en 10 CAP, focos de necrosis y un Ki–67 del 40%, lo cual lo categorizaría en este grupo de lesiones.
Los ICB-DN son definidos como carcinomas invasivos que en el estudio de inmunohistoquímica muestra expresión de marcadores neuroendocrinos (definida como la expresión en más del 30% de las células tumorales pero menor al 50%) y que generalmente es observada en los carcinomas mucinosos de variante hipercelular o en las variantes sólidas de los carcinomas papilares. Una mención aparte merecen los tumores con componente endocrino y exocrino.
Se define un tumor mixto exocrino-endocrino cuando la neoplasia presenta de forma claramente diferenciable tanto elementos endocrinos y exocrinos (confirmados por inmunohistoquímica) mayores del 30%, pero menores del 50% del volumen total tumoral. Este grupo es denominado actualmente por la OMS como carcinoma mixto adenoneuroendocrino (MANEC) similares a los NET gástricos. Si el componente es mayor del 50% (sea del exocrino o del endocrino), ya no se utiliza el término de carcinoma mixto, sino que se referencia el componente predominante de acuerdo con su clasificación convencional en primera instancia (p.ej. carcinoma ductal infiltrante bien diferenciado) y los elementos minoritarios a continuación (p.ej. con componente neuroendocrino grado 2).
Quizá el problema más frecuente en que se ve el patólogo al afrontar este tipo de lesiones es asignarle el grado histológico al tumor que en definitiva va a constituir uno de los factores determinantes, no solo en el pronóstico sino en la terapéutica del paciente. Dado lo poco frecuente de este tipo de tumores, se ha considerado que los grados histológicos sean homologados a lo observado en los NET gastroenteropancreáticos basados en la clasificación de la OMS del 2010 en asociación con la Sociedad Europea de Tumores Neuroendocrinos (ENETS), modificando de alguna forma la sugerencia de la misma OMS en 2003, en la cual un carcinoma neuroendocrino mamario se definía como aquel en que más del 50% de las células tumorales expresaban marcadores neuroendocrinos pero sin profundizar en criterios para la graduación 14.
La clasificación del 2010 y de ENETS se basa en criterios morfológicos en relación con el conteo de mitosis en 10 campos de gran aumento microscópico (CAP) y la cuantificación del índice de proliferación celular de Ki–67 realizada por inmunohistoquímica. La evidencia de la fracción de proliferación ha sido demostrada como factor de significancia pronóstica en tumores de intestino anterior así como del estómago y el páncreas 15–18. La clasificación permite establecer tres grados histológicos así:
Grado 1: menos de 2 mitosis en 10 CAP y/o Ki–67 menor o igual a 2.
Grado 2: conteo mitótico entre 2 a 20 mitosis en 10 CAP y/o Ki–67 entre el 3 al 20%.
Grado 3: conteo mitótico superior a 20 mitosis en 10 CAP y/o Ki–67 mayor del 20%.
El grado histológico 1 y 2 son denominados tumores neuroendocrinos, siendo el grado 1 homologable al tumor neuroendocrino bien diferenciado o de bajo grado (OMS 2000 – ENETS), el grado 2 sería el antiguamente denominado como carcinoma neuroendocrino bien diferenciado o de bajo grado (OMS 2000 – ENETS), mientras el grado histológico 3 se denominan carcinomas neuroendocrinos (NEC) y se subclasifica de acuerdo al tamaño celular en célula grande o de célula pequeña. Sin embargo, aunque la clasificación aparentemente permite “clasificar” la gran mayoría de las neoplasias en algún grupo, si hay discordancia entre la actividad mitótica (p.ej. 1 mitosis en 10 CAP) y el Ki–67 (p.ej. del 4%) para la graduación, se sugiere tomar la variable más alta para establecer el grado histológico para clasificación (en este caso a pesar de la actividad mitótica, el tumor se clasificaría como grado 2 por el Ki–67 mayor del 3%). Un esquema de comparación de las clasificaciones está representado en la tabla 1.
Esquema de comparación de clasificaciones de tumores neuroendocrinos digestivos
| OMS 1980 | OMS 2000 | OMS 2010 |
|---|---|---|
| I. Carcinoide | 1. Tumor neuroendocrino bien diferenciado (bajo grado)2. Carcinoma neuroen-docrino bien diferenciado (bajo grado)3. Carcinoma neuroendo-crino pobremente diferenciado (célula grande o pequeña) | 1. Tumor neuroendocrino Grado 12. Tumor neuroendocrino Grado 23. Carcinoma neuroendo-crino Grado 3 (célula grande o célula pequeña) |
| II. MucocarcinoideII. Mixto carcinoide-adenocarcinoma | 4. Carcinoma mixto exo-crino-endocrino (MEEC) | 4. Carcinoma mixto adeno-neuroendocrino (MANEC) |
El principal diagnóstico diferencial está en relación con metástasis de neoplasias neuroendocrinas, por lo cual una historia clínica adecuada constituye la mejor herramienta en este tipo de casos. Aunque poco frecuente, la presencia de carcinoma ductal in situ (DCIS) de características histológicas similares ayuda a soportar el origen primario de la lesión.
El tratamiento de este tipo de tumores presenta un reto para el oncólogo debido a lo infrecuente del tumor que hace imposible definir un protocolo convencional de tratamiento como si es posible en un carcinoma invasivo convencional o sin otra especificación (NOS). Surgiría la pregunta si manejarlo como un tumor mixto con agentes quimioterapéuticos a lo exocrino y lo endocrino, o utilizar otras formas terapéuticas como análogos de somatostatina, lutecio, etc. Este caso en particular fue llevado a la junta intrainstitucional, la paciente no aceptó manejo quirúrgico ni otras intervenciones como radioterapia; se decidió entonces iniciar manejo con Letrozol 2,5mg diarios. Se prescribió Letrozol por ser una paciente postmenopáusica con antecedente de evento vascular en sistema nervioso y por los resultados de la densitometría ósea no se realizó manejo complementario para aminorar el mayor impacto en hueso del inhibidor de aromatasa.
Los pocos estudios de genética coinciden en que son tumores con fenotipo luminal A en similar expresión a lo encontrado en carcinoma papilares sólidos como en los mucinosos con diferenciación neuroendocrina, lo que explica la positividad para receptor de estrógenos y progestágenos 19. Algunos estudios han demostrado por medio de hibridación in situ e inmunohistoquímica que los tumores neuroendocrinos de mama, como en este caso, también pueden coexpresar marcadores apocrinos tales como la proteína del fluido quístico mamario (GCDFP-15) y plantean la hipótesis de que la lesión tumoral se origina en una célula madre capaz de diferenciarse hacia ambos linajes, tanto neuroendocrino como apocrino (exocrino) 1.
Las lesiones con diferenciación neuroendocrina también muestran una expresión diferente del oncogén HER-2 y de la proteína P53 comparado con los carcinomas de tipo no especial (NOS) y los de tipo lobulillar; por lo que se plantea de que podría tratarse de una entidad distinta con un comportamiento aparentemente menos agresivo en casos de tumores de bajo grado (bien diferenciados), en los que no se ve alterado el pronóstico global del paciente 4,20; sin embargo, cabe resaltar que estos estudios tomaron como positivo la marcación en cualquier célula o grupo tumoral sin que necesariamente fuera mayor del 50% de la población tumoral y por esto lo definieron como tumores con diferenciación neuroendocrina. Asimismo, se ha encontrado que cuando el tumor morfológicamente presenta componente de anillo de sello se asocian con un peor pronóstico clínico4.
Los estudios de cariotipo de los NEC mamario han mostrado alteraciones recurrentes tales como la trisomía del cromosoma 7 y 12 predominantemente en los tumores de bajo grado y deleción del cromosoma 15. Esta última se ve con mayor frecuencia en los carcinomas de mama y ha sido pocas veces vista en los tumores neuroendocrinos de otros órganos. Los cariotipos complejos, definidos como aquellos que presentan más de 3 alteraciones, fueron asociados a tumores de alto grado, más agresivos y con peor pronóstico 21.
Más complejo aún es intentar determinar el pronóstico y el comportamiento biológico de este tipo específico de tumor. Los estudios son variables y algunos refieren que el comportamiento biológico es similar o ligeramente menos “agresivo” comparados con los carcinomas invasivos NOS 1,3,4,19; no obstante, otras series más grandes sugieren que los NEC de glándula mamaria son tumores infiltrantes agresivos, ya que se presentan con masas tumorales mayores de 2cm. La mayoría son de alto grado histológico (OMS 3) con estadios clínicos avanzados con sobrevidas globales más cortas, así como de las supervivencias específicas de la enfermedad comparados como los carcinomas invasivos NOS. Asimismo otros autores sugieren que cuando se agrupan todos los NEC mamarios con los NOS, la diferenciación neuroendocrina perse constituye un efecto adverso pronóstico factor independiente de otros factores pronósticos conocidos, incluyendo la edad, el tamaño del tumor, estado ganglionar, el grado histológico, el estado del receptor de estrógeno/progesterona, y la terapia utilizada 20.
ConclusiónLos carcinomas primarios con diferenciación neuroendocrina, en especial los denominados anficrinos, son tumores extremadamente infrecuentes, lo que limita su conocimiento en relación con su comportamiento biológico y terapéutico, pero que indiscutiblemente si presentan un aspecto morfológico “sui generis”. Es necesario que el patólogo sepa identificarlo con el fin de realizar una adecuada clasificación y graduación del tumor haciendo énfasis en descartar lesión metástasica.