Determinar la distribución de los genotipos de VPH en mujeres de Bogotá con citología cervicouterina anormal.
MétodosSe colectaron muestras cervicales de 191 mujeres con ASCUS, 236 con lesiones intraepiteliales escamosas de bajo grado (LIEBG) y 116 de alto grado (LIEAG). La tipificación de VPH se realizó usando PCR con iniciadores consenso GP5+/GP6+ y reverse line blot.
ResultadosLa prevalencia de VPH fue 76,1%. Se observaron infecciones únicas en el 41,4% de las participantes, y coinfecciones en el 34,6%. La frecuencia de VPH según diagnóstico fue: 60,2%, 84,7% y 84,5% en ASCUS, LIEBG y LIEAG. Los VPH-16 y 58 fueron los tipos más frecuentes en los tres grupos, con frecuencias para VPH-16 de 20,4%, 33,9% y 38,8%, y para VPH-58 de 7,3%, 13,6%, 18,1% para ASCUS, LIEBG y LIEAG. En ASCUS y LSIL el tercer tipo en frecuencia fue VPH-56 (6,8% y 11,0%), mientras que en LIEAG fue VPH-18 (10,3%). Las infecciones con tipos virales probablemente oncogénicos y con tipos de bajo riesgo fueron mucho menos frecuentes y en general se presentaron como coinfecciones con tipos de alto riesgo.
ConclusionesLas infecciones con tipos de VPH de alto riesgo fueron las más frecuentes en todas las lesiones estudiadas, el VPH-58 ocupo el segundo lugar en frecuencia, como ha sido reportado en México y en general en Suramérica. El cambio hacia nuevas vacunas profilácticas que incluyan más tipos virales como el VPH-58 puede tener un mayor impacto en la disminución de la incidencia de lesiones preneoplásicas en nuestra región.
To determine the distribution of HPV genotypes in women from Bogotá with abnormal cervical smear.
MethodsCervical samples were collected from 191 women with ASCUS, 236 with low-grade (LSIL) and 116 with high-grade squamous intraepithelial lesions (HSIL). HPV typing was performed using consensus PCR primers GP5+/GP6 + and reverse line blot.
ResultsThe prevalence of HPV was 76.1%. Unique infections were observed in 41.4% of the participants and co-infections in 34.6%. The frequency of HPV according to diagnosis was: 60.2%, 84.7% and 84.5% in ASCUS, LSIL and HSIL respectively. HPV16 and 58 were the more frequent types in the three groups, HPV16 frequencies were 20.4%, 33.9% and 38.8%, and HPV58 frequencies were 7.3%, 13.6%, and 18,1% for ASCUS, LSIL and HSIL respectively. The third type in frequency in ASCUS and LSIL was HPV56 (6.8% and 11.0%), while in HSIL was HPV18 (10.3%). Infections with probably oncogenic types or with low risk types were much less frequent and generally were observed as co-infections with high-risk types.
ConclusionsInfections with high risk HPV types were the most frequent in all studied lesions, VPH-58 ranked second in frequency as has been reported in Mexico and in general in South America. The change to new prophylactic vaccines including more viral types as HPV58 could have a higher impact in reducing the incidence of pre-neoplastic lesions in our region.
El cáncer de cuello uterino (CCU) es el cuarto cáncer más frecuente en mujeres en el mundo, con una incidencia de 528.000 casos nuevos en el 2012 y una mortalidad de alrededor del 50%, en especial en países en desarrollo donde ocurre aproximadamente el 85% de las muertes (IARC- Globocan, 2012. http://globocan.iarc.fr/Default.aspx). La infección persistente con tipos oncogénicos del virus del papiloma humano (VPH) está establecida como factor causal para el desarrollo del CCU y sus lesiones precursoras: LIEBG y LIEAG1,2. A la fecha hay más de 130 tipos de VPH descritos de los cuales aproximadamente 50 causan infecciones en el epitelio genital, la agencia internacional contra el cáncer ha clasificado los tipos virales asociados a la mucosa anogenital en 4 grupos: grupo 1 o grupo de alto riesgo conformado por los virus VPH 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59 que son los 12 tipos virales más frecuentemente encontrados en cáncer; grupo 2A o grupo probablemente carcinogénico contiene el VPH-68; grupo 2B o grupo posiblemente carcinogénico que incluye los VPH 26, 30, 34, 53, 66, 67, 69, 70, 73, 82, 85, 97 son tipos virales relacionados filogenéticamente al grupo 1 o 2, o con potencial carcinogénico en estudios de mecanismos moleculares y grupo 3 o grupo de bajo riesgo conformado por los tipos 6, 113.
La coinfección con más de un tipo de VPH es común, especialmente en mujeres jóvenes y se asocia con mayor riesgo de anomalías en la citología y con mayor riesgo de LEIAG4. Los efectos de estas infecciones concomitantes no son claros, algunos estudios de cohorte sugieren que la infección con múltiples tipos virales tiene efectos sinérgicos en la carcinogénesis cervical5, mientras que en otros se reporta que el riesgo es similar a la suma del riesgo estimado para cada tipo individual, sin evidencia de interacciones sinérgicas6. En un estudio reciente, con el mayor número de datos de genotipificación reportado hasta la fecha, no se encuentra evidencia de sinergia entre genotipos durante infecciones múltiples, se observa incluso que el riesgo es menor que el que se esperaría asumiendo un riesgo aditivo de LEIAG para mujeres infectadas con más de dos tipos virales4.
Las vacunas actuales para VPH están diseñadas para prevenir las infecciones por VPH-16 y VPH-18 que causan aproximadamente el 70% del CCU en el mundo7. Dado que no existen mayores variaciones en las prevalencias de VPH-16 y 18 en CCU entre diferentes regiones, el impacto de las vacunas en la incidencia del CCU se espera sea similar entre los continentes con una reducción aproximada del 70%8, si bien se ha reportado que estas vacunas inducen una protección cruzada parcial hacia tipos virales filogenéticamente relacionados con VPH-16 y VPH-18 que podría incrementar en algún grado el nivel de protección, aun no es claro ni el grado ni la durabilidad de esta protección cruzada9. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA por su sigla en inglés) aprobó en diciembre de 2014 una nueva vacuna para VPH de la compañía Merck que incluye además de los VPH 6, 11, 16 y 18, los tipos virales de alto riesgo 31, 33, 45, 52 y 5810 cuyo impacto podría variar entre regiones. Si bien el registro de esta vacuna ante el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) en Colombia aún no está aprobado, es importante conocer la prevalencia de los diferentes tipos de VPH en las lesiones cervicales a nivel local. El objetivo de este estudio fue investigar la distribución de los tipos de VPH en lesiones intraepiteliales cervicales en mujeres de Bogotá, Colombia.
Materiales y métodosReclutamiento de sujetos de estudio y recolección de muestrasEn total 547 mujeres, que asistieron a la Liga Contra el Cáncer en Bogotá a practicarse una colposcopia luego de un resultado anormal en la citología: células escamosas atípicas de significado indeterminado (ASCUS), lesión escamosa intraepitelial de bajo grado (LIEBG) o lesión escamosa intraepitelial de alto grado (LIEAG), fueron enroladas de manera consecutiva entre octubre de 2010 y diciembre de 2012. Las citologías fueron convencionales y se realizaron en la Liga de Contra el Cáncer en el 83% de las mujeres o en la institución prestadora de salud Famimédica en el 16,7%. Todas las mujeres consintieron su participación por escrito, el protocolo de investigación fue aprobado por el Comité de Ética del Instituto Nacional de Cancerología. Se excluyeron cuatro mujeres a las que se les diagnosticó cáncer infiltrante luego de la colposcopia. Antes de realizar la colposcopia se obtuvieron muestras cervicales con un cytobrush que fueron resuspendidas en 5mL de solución amortiguada fosfato salino (PBS) con 0,05% de timerosal y posteriormente centrifugadas a 3.000g por 10min, el botón celular se resuspendió en 1mL de tampón TRIS-HCl 10mM, pH 8,0, y se almacenó a −20°C hasta su uso.
Genotipificación de VPHEl análisis de VPH se realizó según la metodología descrita por Van der Brule et al11. Brevemente, se realizó una PCR empleando los iniciadores generales GP5+ biotinado/GP6+ seguida de la genotipificación de los productos de PCR mediante un ensayo de hibridación tipo reverse line blot (RLB) con sondas específicas para 37 tipos virales, clasificados según la IARC en el Grupo de riesgo 1, carcinogénicos: tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, en el Grupo de riesgo 2, con evidencia limitada de carcinogenicidad en humanos: 68, 26, 53, 66, 70, 73, 82, 34 y 17 tipos virales de bajo riesgo o de potencial carcinogénico no conocido: 6, 11, 40, 42, 43, 44, 54, 55, 57, 61, 71, 72, 83, 84, Iso 39, 71, 81 y 89/CP6108. Como control de calidad del ADN se realizó adicionalmente una PCR para el gen beta globina con los iniciadores PCO3 y PCO5.
Análisis estadísticoLos análisis estadísticos se hicieron con el programa SPSS 18.0 para Windows. Se empleó la prueba de χ2 para evaluar el significado de las diferencias entre los grupos. Se consideró significativa una P<0,05.
ResultadosEn total se analizaron 543 muestras provenientes de mujeres con una edad promedio de 37 años, en un rango entre 19 y 75 años, con diagnóstico de citología anómala, su distribución según el resultado de la citología fue: 35,2% (191/543) ASCUS, 43,5% (236/543) LIEBG, y 21,4% (116/543) LIEAG.
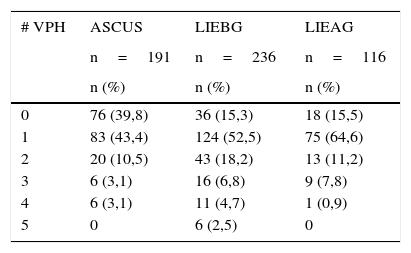
Se evaluó la presencia de 37 tipos de VPH en todas las participantes, que incluían: los 12 tipos virales que componen el grupo 1 que agrupa los tipos de VPH causantes de cáncer de cuello uterino, 8 de los 13 tipos virales del grupo 2, que agrupa los tipos virales con evidencia limitada de carcinogenicidad en humanos o clasificados así por analogía filogenética a tipos virales con evidencia suficiente o limitada de carcinogenicidad y del grupo 3 se evaluaron los tipos 6 y 11, y 15 tipos virales que se consideran de bajo riesgo o no se les conoce potencial carcinogénico. Un 76,1% (413/543) de las mujeres incluidas fue positivo para uno o más tipos virales, mientras que el 23,9% (130/543) fue negativo. Se observaron infecciones con un solo tipo viral en el 41,4% (225/543) de las participantes, e infecciones por varios tipos virales en el 34,6% (188/543), en la tabla 1 se presenta la distribución de las infecciones por uno, dos, tres, cuatro o cinco tipos virales según el diagnóstico citológico. Las infecciones por un solo tipo viral fueron significativamente más frecuentes en LIEAG en comparación con las LIEBG (76% vs 62%, p=0,017 χ2).
Distribución de las infecciones por uno, dos, tres, cuatro o cinco tipos virales según el diagnóstico citológico
| # VPH | ASCUS | LIEBG | LIEAG |
|---|---|---|---|
| n=191 | n=236 | n=116 | |
| n (%) | n (%) | n (%) | |
| 0 | 76 (39,8) | 36 (15,3) | 18 (15,5) |
| 1 | 83 (43,4) | 124 (52,5) | 75 (64,6) |
| 2 | 20 (10,5) | 43 (18,2) | 13 (11,2) |
| 3 | 6 (3,1) | 16 (6,8) | 9 (7,8) |
| 4 | 6 (3,1) | 11 (4,7) | 1 (0,9) |
| 5 | 0 | 6 (2,5) | 0 |
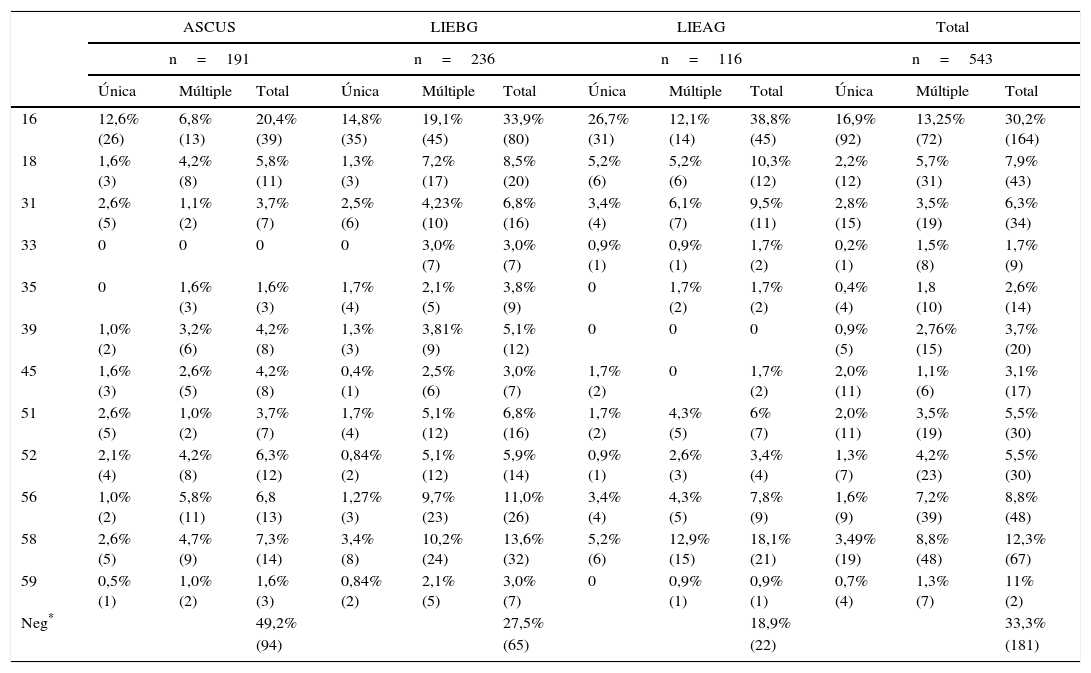
Los diez tipos virales más prevalentes fueron VPH-16 30,2% (164/543), VPH-58 12,3% (67/543), VPH-56 8,8% (48/543), VPH-18 7,9% (43/543), VPH-31 6,3% (34/543), VPH-66 5,9% (32/543), VPH-51 (30/543) 5,5%, VPH-52 (30/543) 5,5%, VPH-42 (28/543) 5,0%, VPH-39 (20/543) 3,7% (tabla 2). De estos ocho pertenecen al grupo 1, causantes de cáncer de cuello uterino, uno pertenece al grupo 2, evidencia limitada de causalidad y dos son de bajo riesgo.
En el total de mujeres participantes la frecuencia de infecciones con uno o más de los 12 tipos virales que conforman el grupo 1 fue 66,7% (362/543); para uno o más de los 8 tipos virales analizados pertenecientes al grupo 2 fue menor: 17,1% (93/543). Para uno o más de los tipos virales de bajo riesgo o de carcinogenicidad no conocida fue del 18,6% (101/543).
Un 44% (241/543) de las mujeres participantes presentó infección exclusivamente con tipos virales del grupo 1, en el 75,9% (183/241) de estas infecciones se detectó un único tipo viral, en contraste las infecciones exclusivas con tipos del grupo 2 o con tipos de bajo riesgo fueron menos frecuentes: 3,1% (17/543) y 5,3% (29/543) respectivamente. Todas las infecciones con tipos virales del grupo 2 fueron de más de un tipo viral y la mayoría de las de tipos de bajo riesgo, 82,8% (24/29). Se presentaron infecciones mixtas con tipos del grupo 1 y del grupo 2 en un 9,8% (53/543) de las participantes, del grupo 1 con tipos de bajo riesgo en el 9,6% (52/543) de los casos y de los tres grupos en el 2,9% de los casos (16/543).
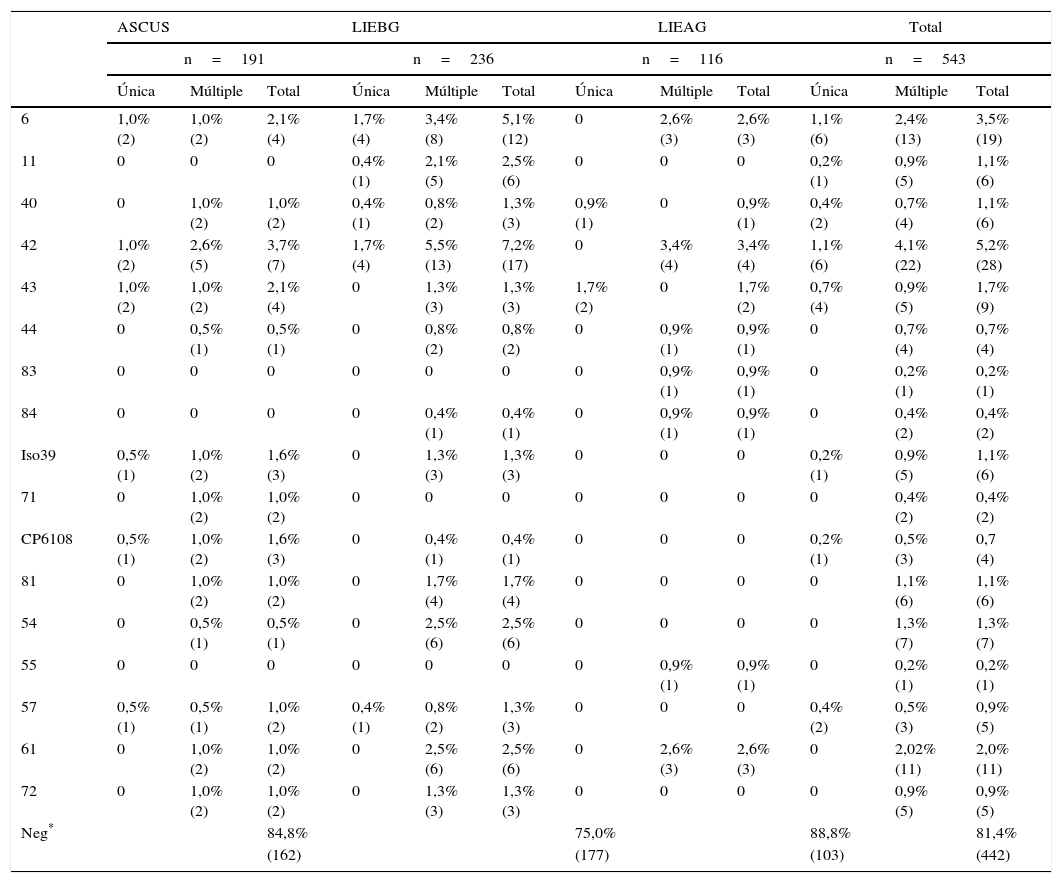
En las tablas 2 y 3 se presentan las frecuencias de detección de los diferentes tipos virales según el resultado de la citología. Los tipos de VPH se agruparon de acuerdo a los grupos de riesgo definidos por la IARC, y se discriminaron las infecciones únicas y múltiples (tabla 4).
Frecuencia de los tipos virales de VPH pertenecientes al grupo de riesgo 1 según la IARC en mujeres con anomalías en la citología cervical
| ASCUS | LIEBG | LIEAG | Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n=191 | n=236 | n=116 | n=543 | |||||||||
| Única | Múltiple | Total | Única | Múltiple | Total | Única | Múltiple | Total | Única | Múltiple | Total | |
| 16 | 12,6% (26) | 6,8% (13) | 20,4% (39) | 14,8% (35) | 19,1% (45) | 33,9% (80) | 26,7% (31) | 12,1% (14) | 38,8% (45) | 16,9% (92) | 13,25% (72) | 30,2% (164) |
| 18 | 1,6% (3) | 4,2% (8) | 5,8% (11) | 1,3% (3) | 7,2% (17) | 8,5% (20) | 5,2% (6) | 5,2% (6) | 10,3% (12) | 2,2% (12) | 5,7% (31) | 7,9% (43) |
| 31 | 2,6% (5) | 1,1% (2) | 3,7% (7) | 2,5% (6) | 4,23% (10) | 6,8% (16) | 3,4% (4) | 6,1% (7) | 9,5% (11) | 2,8% (15) | 3,5% (19) | 6,3% (34) |
| 33 | 0 | 0 | 0 | 0 | 3,0% (7) | 3,0% (7) | 0,9% (1) | 0,9% (1) | 1,7% (2) | 0,2% (1) | 1,5% (8) | 1,7% (9) |
| 35 | 0 | 1,6% (3) | 1,6% (3) | 1,7% (4) | 2,1% (5) | 3,8% (9) | 0 | 1,7% (2) | 1,7% (2) | 0,4% (4) | 1,8 (10) | 2,6% (14) |
| 39 | 1,0% (2) | 3,2% (6) | 4,2% (8) | 1,3% (3) | 3,81% (9) | 5,1% (12) | 0 | 0 | 0 | 0,9% (5) | 2,76% (15) | 3,7% (20) |
| 45 | 1,6% (3) | 2,6% (5) | 4,2% (8) | 0,4% (1) | 2,5% (6) | 3,0% (7) | 1,7% (2) | 0 | 1,7% (2) | 2,0% (11) | 1,1% (6) | 3,1% (17) |
| 51 | 2,6% (5) | 1,0% (2) | 3,7% (7) | 1,7% (4) | 5,1% (12) | 6,8% (16) | 1,7% (2) | 4,3% (5) | 6% (7) | 2,0% (11) | 3,5% (19) | 5,5% (30) |
| 52 | 2,1% (4) | 4,2% (8) | 6,3% (12) | 0,84% (2) | 5,1% (12) | 5,9% (14) | 0,9% (1) | 2,6% (3) | 3,4% (4) | 1,3% (7) | 4,2% (23) | 5,5% (30) |
| 56 | 1,0% (2) | 5,8% (11) | 6,8 (13) | 1,27% (3) | 9,7% (23) | 11,0% (26) | 3,4% (4) | 4,3% (5) | 7,8% (9) | 1,6% (9) | 7,2% (39) | 8,8% (48) |
| 58 | 2,6% (5) | 4,7% (9) | 7,3% (14) | 3,4% (8) | 10,2% (24) | 13,6% (32) | 5,2% (6) | 12,9% (15) | 18,1% (21) | 3,49% (19) | 8,8% (48) | 12,3% (67) |
| 59 | 0,5% (1) | 1,0% (2) | 1,6% (3) | 0,84% (2) | 2,1% (5) | 3,0% (7) | 0 | 0,9% (1) | 0,9% (1) | 0,7% (4) | 1,3% (7) | 11% (2) |
| Neg* | 49,2% | 27,5% | 18,9% | 33,3% | ||||||||
| (94) | (65) | (22) | (181) | |||||||||
Dado que se presentan infecciones por más de un tipo viral, la suma de casos positivos para cada tipo de VPH excede el número total de muestras.
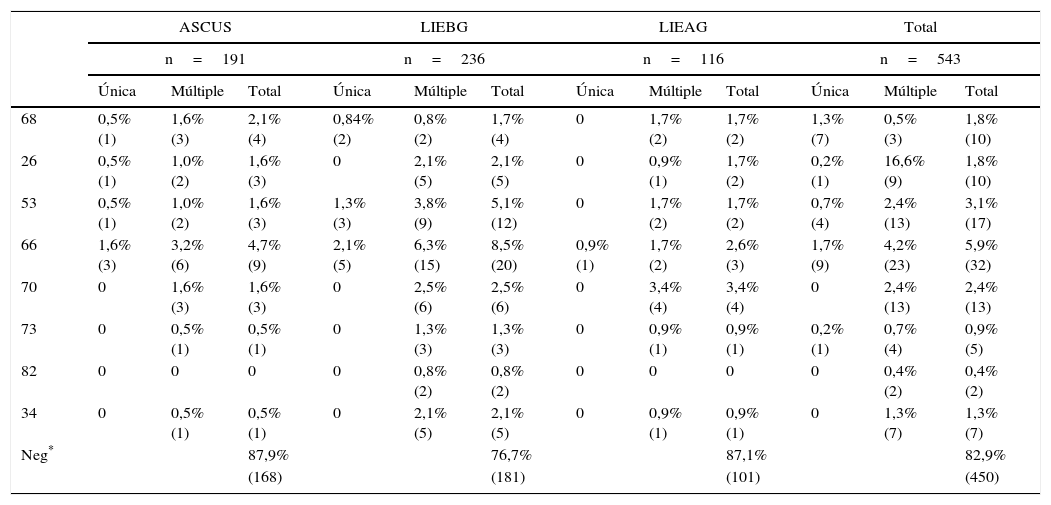
Frecuencia de tipos virales de VPH pertenecientes al grupo de riesgo 2 según la IARC en mujeres con anomalías en la citología cervical
| ASCUS | LIEBG | LIEAG | Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n=191 | n=236 | n=116 | n=543 | |||||||||
| Única | Múltiple | Total | Única | Múltiple | Total | Única | Múltiple | Total | Única | Múltiple | Total | |
| 68 | 0,5% (1) | 1,6% (3) | 2,1% (4) | 0,84% (2) | 0,8% (2) | 1,7% (4) | 0 | 1,7% (2) | 1,7% (2) | 1,3% (7) | 0,5% (3) | 1,8% (10) |
| 26 | 0,5% (1) | 1,0% (2) | 1,6% (3) | 0 | 2,1% (5) | 2,1% (5) | 0 | 0,9% (1) | 1,7% (2) | 0,2% (1) | 16,6% (9) | 1,8% (10) |
| 53 | 0,5% (1) | 1,0% (2) | 1,6% (3) | 1,3% (3) | 3,8% (9) | 5,1% (12) | 0 | 1,7% (2) | 1,7% (2) | 0,7% (4) | 2,4% (13) | 3,1% (17) |
| 66 | 1,6% (3) | 3,2% (6) | 4,7% (9) | 2,1% (5) | 6,3% (15) | 8,5% (20) | 0,9% (1) | 1,7% (2) | 2,6% (3) | 1,7% (9) | 4,2% (23) | 5,9% (32) |
| 70 | 0 | 1,6% (3) | 1,6% (3) | 0 | 2,5% (6) | 2,5% (6) | 0 | 3,4% (4) | 3,4% (4) | 0 | 2,4% (13) | 2,4% (13) |
| 73 | 0 | 0,5% (1) | 0,5% (1) | 0 | 1,3% (3) | 1,3% (3) | 0 | 0,9% (1) | 0,9% (1) | 0,2% (1) | 0,7% (4) | 0,9% (5) |
| 82 | 0 | 0 | 0 | 0 | 0,8% (2) | 0,8% (2) | 0 | 0 | 0 | 0 | 0,4% (2) | 0,4% (2) |
| 34 | 0 | 0,5% (1) | 0,5% (1) | 0 | 2,1% (5) | 2,1% (5) | 0 | 0,9% (1) | 0,9% (1) | 0 | 1,3% (7) | 1,3% (7) |
| Neg* | 87,9% | 76,7% | 87,1% | 82,9% | ||||||||
| (168) | (181) | (101) | (450) | |||||||||
Dado que se presentan infecciones por más de un tipo viral, la suma de casos positivos para cada tipo de VPH excede el número total de muestras.
Frecuencia de tipos virales de VPH pertenecientes al grupo de riesgo 3 según la IARC y de otros tipos de bajo riesgo o de carcinogenicidad no conocida
| ASCUS | LIEBG | LIEAG | Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n=191 | n=236 | n=116 | n=543 | |||||||||
| Única | Múltiple | Total | Única | Múltiple | Total | Única | Múltiple | Total | Única | Múltiple | Total | |
| 6 | 1,0% (2) | 1,0% (2) | 2,1% (4) | 1,7% (4) | 3,4% (8) | 5,1% (12) | 0 | 2,6% (3) | 2,6% (3) | 1,1% (6) | 2,4% (13) | 3,5% (19) |
| 11 | 0 | 0 | 0 | 0,4% (1) | 2,1% (5) | 2,5% (6) | 0 | 0 | 0 | 0,2% (1) | 0,9% (5) | 1,1% (6) |
| 40 | 0 | 1,0% (2) | 1,0% (2) | 0,4% (1) | 0,8% (2) | 1,3% (3) | 0,9% (1) | 0 | 0,9% (1) | 0,4% (2) | 0,7% (4) | 1,1% (6) |
| 42 | 1,0% (2) | 2,6% (5) | 3,7% (7) | 1,7% (4) | 5,5% (13) | 7,2% (17) | 0 | 3,4% (4) | 3,4% (4) | 1,1% (6) | 4,1% (22) | 5,2% (28) |
| 43 | 1,0% (2) | 1,0% (2) | 2,1% (4) | 0 | 1,3% (3) | 1,3% (3) | 1,7% (2) | 0 | 1,7% (2) | 0,7% (4) | 0,9% (5) | 1,7% (9) |
| 44 | 0 | 0,5% (1) | 0,5% (1) | 0 | 0,8% (2) | 0,8% (2) | 0 | 0,9% (1) | 0,9% (1) | 0 | 0,7% (4) | 0,7% (4) |
| 83 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,9% (1) | 0,9% (1) | 0 | 0,2% (1) | 0,2% (1) |
| 84 | 0 | 0 | 0 | 0 | 0,4% (1) | 0,4% (1) | 0 | 0,9% (1) | 0,9% (1) | 0 | 0,4% (2) | 0,4% (2) |
| Iso39 | 0,5% (1) | 1,0% (2) | 1,6% (3) | 0 | 1,3% (3) | 1,3% (3) | 0 | 0 | 0 | 0,2% (1) | 0,9% (5) | 1,1% (6) |
| 71 | 0 | 1,0% (2) | 1,0% (2) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,4% (2) | 0,4% (2) |
| CP6108 | 0,5% (1) | 1,0% (2) | 1,6% (3) | 0 | 0,4% (1) | 0,4% (1) | 0 | 0 | 0 | 0,2% (1) | 0,5% (3) | 0,7 (4) |
| 81 | 0 | 1,0% (2) | 1,0% (2) | 0 | 1,7% (4) | 1,7% (4) | 0 | 0 | 0 | 0 | 1,1% (6) | 1,1% (6) |
| 54 | 0 | 0,5% (1) | 0,5% (1) | 0 | 2,5% (6) | 2,5% (6) | 0 | 0 | 0 | 0 | 1,3% (7) | 1,3% (7) |
| 55 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,9% (1) | 0,9% (1) | 0 | 0,2% (1) | 0,2% (1) |
| 57 | 0,5% (1) | 0,5% (1) | 1,0% (2) | 0,4% (1) | 0,8% (2) | 1,3% (3) | 0 | 0 | 0 | 0,4% (2) | 0,5% (3) | 0,9% (5) |
| 61 | 0 | 1,0% (2) | 1,0% (2) | 0 | 2,5% (6) | 2,5% (6) | 0 | 2,6% (3) | 2,6% (3) | 0 | 2,02% (11) | 2,0% (11) |
| 72 | 0 | 1,0% (2) | 1,0% (2) | 0 | 1,3% (3) | 1,3% (3) | 0 | 0 | 0 | 0 | 0,9% (5) | 0,9% (5) |
| Neg* | 84,8% | 75,0% | 88,8% | 81,4% | ||||||||
| (162) | (177) | (103) | (442) | |||||||||
Dado que se presentan infecciones por más de un tipo viral, la suma de casos positivos para cada tipo de VPH excede el número total de muestras.
El porcentaje de casos positivos según diagnóstico citológico fue: 60,2% (115/191) en ASCUS, 84,7% (200/413) en LIEBG y 84,5% (98/116) en LIEAG. Los tipos virales más comunes en ASCUS fueron: VPH-16 20,42% (39/191), VPH-58 7,33% (14/191), VPH-56 6,81% (13/191), VPH-52 6,28% (12/191), VPH-18 5,72% (11/191), todos del grupo 1; en LIEBG los tipos virales más frecuentes fueron: VPH-16 33,9% (80/236), VPH-58 13,56% (32/236), VPH-56 11,02% (26/236), VPH-18 8,47% (20/236), VPH-66 8,47% (20/236) cuatro del grupo 1 y uno del grupo 2; en LIEAG los tipos más frecuentes fueron: VPH-16 38,9% (45/116), VPH-58 18,1% (21/116), VPH-18 10,34% (12/116), VPH-31 9,48% (11/116), VPH-56 7,76% (9/116), todos del grupo 1. Los tipos virales VPH-16 y VPH-58 fueron los más prevalentes en los tres grupos diagnóstico.
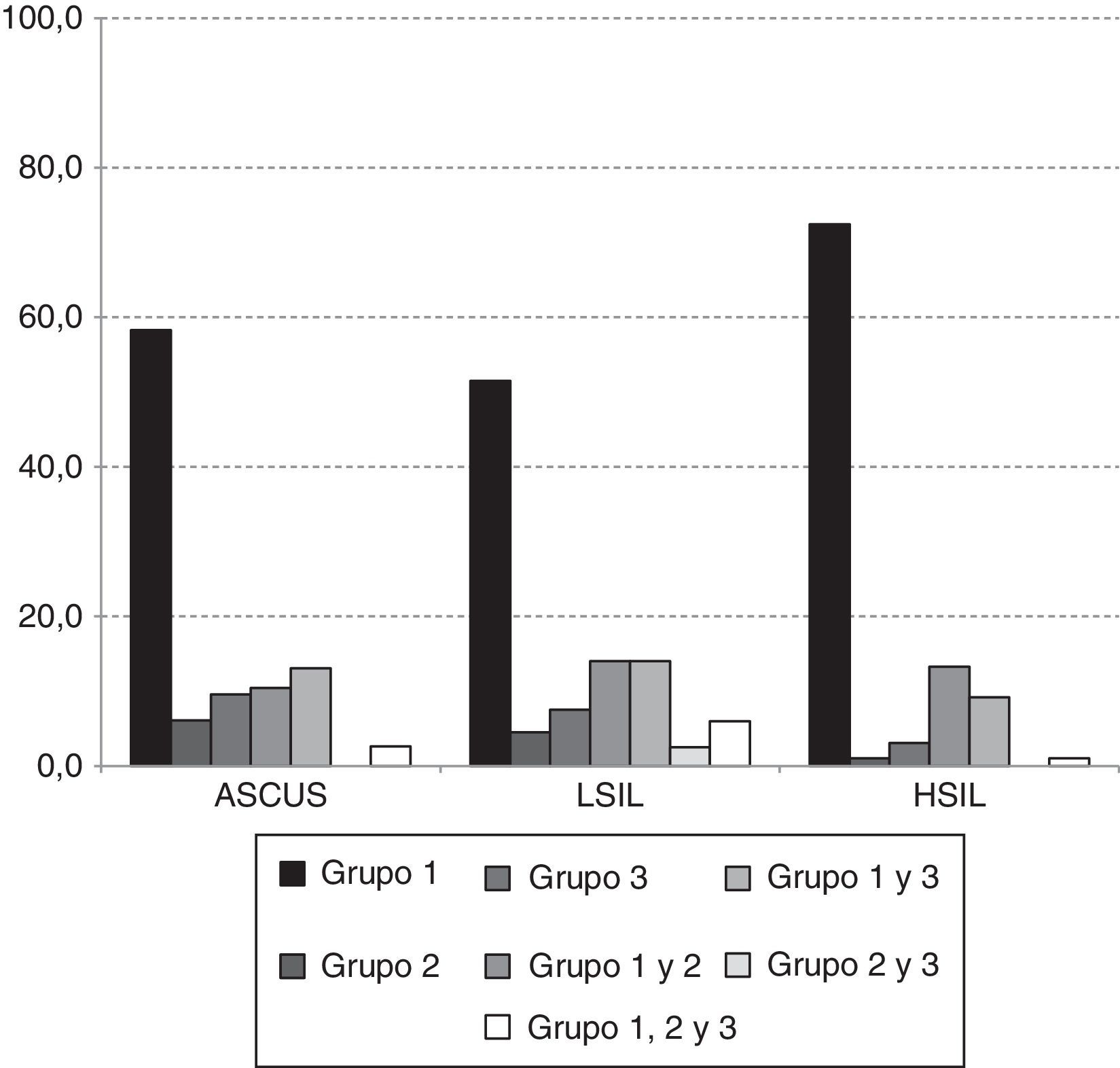
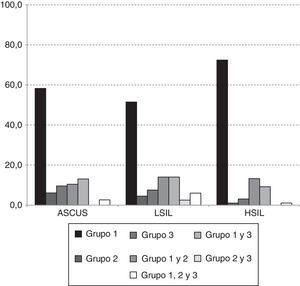
En la figura 1 se presenta la distribución de las infecciones únicas y mixtas según los grupos de riesgo en cada categoría diagnóstica. Las infecciones con tipos virales exclusivamente del grupo 1 fueron las más detectadas en las tres categorías diagnósticas, con frecuencias del 58,3% (67/115), 51,5% (103/200) y 72,4% (71/98) en ASCUS, LIEBG y LIEAG respectivamente. Las infecciones mixtas del grupo 1 y 2 o del grupo 1 y 3 se presentaron en el 23,5% (27/103), 28,0% (56/200) y 22,4 (22/115). Las infecciones con los grupos 2 y 3, solos o en combinación fueron poco frecuentes en LIEAG.
DiscusiónEl propósito de este estudio fue evaluar la distribución de los genotipos de VPH en un grupo de mujeres con resultado anómalo en la citología en Bogotá. Encontramos muy pocos datos acerca de la distribución de los tipos de VPH en LSIL, HSIL y ASCUS en mujeres colombianas y en particular de la ciudad de Bogotá.
Las infecciones con uno o más tipos virales de alto riesgo fueron cuatro veces más frecuentes que las asociadas a tipos virales probablemente carcinogénicos y que las asociadas a tipos de bajo riesgo o de carcinogenicidad no conocida (66,7% vs. 17,1% y 18,6%, respectivamente). La frecuencia mucho mayor de infecciones únicas con virus de alto riesgo contrastó con la frecuencia diez veces menor de las infecciones con tipos probablemente carcinogénicos (44% vs. 3,1%). Recientemente se ha descrito que los tipos virales considerados probablemente carcinogénicos, aunque son detectados en infecciones por un solo tipo viral en un bajo número de casos de cáncer de cuello uterino, causan a la célula infectada las mismas alteraciones en las vías de señalización que conducen a cáncer reportadas para los tipos de VPH considerados carcinogénicos o del grupo 112. En este estudio no encontramos infecciones únicas con tipos de VPH probablemente oncogénicos, aunque sí observamos infecciones exclusivamente con tipos de este grupo de VPH pero con más de un tipo viral en un 1,7% de las LIEAG, porcentaje similar al observado en cáncer de cuello uterino que es del 2,2% para infecciones únicas con tipos de este grupo12. Dada esa baja frecuencia, el impacto de estrategias de prevención primaria dirigidas a evitar estas infecciones probablemente no sería costo-efectivo. Por el contrario, prevenir las infecciones virales de tipos virales del grupo 1 además del VPH-16 y 18, tendría un impacto mayor en la disminución de infecciones asociadas a cáncer y lesiones preneoplásicas.
En LSIL los cinco tipos virales más frecuentes fueron VPH-16 33,9% (80/236), VPH-58 13,56% (32/236), VPH-56 11,02% (26/236), VPH-18 8,47% (20/236), VPH-66 8,47%, resultado que difiere del reportado por Clifford et al13, en un metaanálisis que evalúa la distribución de los tipos de VPH según lesión y región del mundo. En este, los tipos más frecuentes en LSIL para Suramérica y Centroamérica fueron VPH-16, VPH-33, VPH-6, VPH-58 y VPH-31. Si bien se coincide en que el VPH-16 es el más prevalente, en el metaanálisis su prevalencia fue bastante menor (24%), es de resaltar que solo se coincide en dos tipos virales entre los cinco primeros, lo que señala las variaciones geográficas en la distribución de los tipos de VPH en lesiones de bajo grado.
En contraste, para las lesiones de alto grado encontramos una mayor concordancia entre los cinco primeros tipos virales encontrados en nuestro estudio: VPH-16 38,9% (45/116), VPH-58 18,1% (21/116), VPH-18 10,34% (12/116), VPH-31 9,48% (11/116), VPH-56 7,76% (9/116), y los reportados para Latinoamérica por Bosch et al7: VPH-16 39,6%, VPH-58 13,4%, VPH-18 7,2%, VPH-31 6,5% y VPH-33 5,4%, es de resaltar que en nuestro estudio se observaron prevalencias mayores en los cuatro primeros tipos virales. Es interesante ver, como ha sido previamente descrito, que a medida que las lesiones avanzan las diferencias en distribución de tipos entre las regiones se hacen menos pronunciadas, en parte porque el VPH-16 se vuelve más predominante.
Este estudio presenta algunas limitaciones, la primera es que no se tuvo una lectura citológica centralizada, lo que restringe su comparabilidad con otros estudios. En segundo lugar, todas las pacientes fueron captadas en la Liga Contra el Cáncer en Bogotá, a la que si bien acuden pacientes de muchas áreas de la ciudad, en su mayoría pertenecen a estratos socioeconómicos medios y bajos, con una representación menor de los estratos altos.
La vacuna nonavalente contra VPH preparada por Merck que incluye los cuatro tipos de la vacuna cuadrivalente VPH-16, VPH-18, VPH-11 y VPH-6 y cinco tipos adicionales de alto riesgo: VPH-31, VPH-33, VPH-45, VPH-52 y VPH-58, previene de manera eficaz las infecciones y enfermedades relacionadas con los tipos virales presentes en la vacuna10. En nuestro estudio detectamos en total 629 infecciones por VPH, 165 en ASCUS, 332 en LIEBG y 132 en LIEAG, de estas los tipos virales 6, 11, 16 y 18, presentes en la vacuna tetravalente causaron el 32,7% de las infecciones en ASCUS, el 35,5% de las infecciones en LIEBG y el 45,5% de las infecciones en LIEAG. Los cinco tipos adicionales 31, 33, 45, 52 y 58 incluidos en la vacuna nonavalente causaron el 24,8% de las infecciones en ASCUS, el 22,9% de las infecciones en LIEBG y el 30,3% de las infecciones en LIEAG. La introducción de esta nueva vacuna tendrá un importante impacto en la reducción de lesiones precancerosas, particularmente en Bogotá, Colombia donde el VPH-58 ocupa el segundo lugar en frecuencia de detección en lesiones preneoplásicas. Dada la complejidad de los datos debido al alto número de infecciones múltiples no fue posible presentar la reducción potencial en el número de colposcopias, dato relevante en salud pública. Es importante aclarar que en este estudio el impacto de la vacuna estaría subestimado puesto que no incluimos casos de cáncer y la vacuna está dirigida contra los VPH asociados a cáncer que no necesariamente coinciden con los tipos virales predominantes en ASCUS y LEIBG.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónInstituto Nacional de Cancerología. Recursos de Inversión Nación C41030310-036.
AgradecimientosA los ginecólogos, patólogos, enfermeras y personal administrativo de la Liga Contra el Cáncer-Bogotá.