Se describe el caso de un paciente de 75 años sin antecedentes de relevancia, que fue diagnosticado con insulinoma maligno en estado avanzado, con metástasis hepáticas, con síntomas por hipoglucemia hiperinsulinémica refractaria al tratamiento, y con diazóxido y octreotide de acción corta. El paciente presentó una respuesta clínica poco esperada a la embolización transarterial de metástasis hepáticas, pues a pesar de que persisten las lesiones tumorales, desarrolló hiperglucemia persistente y requirió manejo con insulina. Adicionalmente, se hace una breve revisión de la literatura sobre las opciones terapéuticas disponibles para el tratamiento sintomático de la hipoglucemia hiperinsulinémica.
The case is presented of a 75 year-old man who was diagnosed with malignant insulinoma in an advanced stage with diffuse liver metastases and symptoms due to hyperinsulinaemic hypoglycaemia refractory to treatment with diazoxide and short-acting octreotide. The patient had an unexpected clinical response to trans-arterial embolisation of liver metastases, since, despite still having the tumour, he developed persistent hyperglycaemia that required insulin treatment. A brief review of the literature is also presented on the treatment options for hyperinsulinaemic hypoglycaemia.
Las intervenciones terapéuticas en los insulinomas malignos tienen como objetivo el control tumoral y el de la hipoglucemia por exceso de insulina. Se han descrito medidas nutricionales y farmacológicas para el control glucémico, pero cuando estas fallan o no están disponibles se deben buscar alternativas adicionales. Presentamos el caso de un paciente tratado con embolización transarterial de metástasis hepáticas y una breve revisión en la literatura de las opciones terapéuticas para el manejo sintomático en este tipo de neoplasias.
Caso clínicoPaciente de 75 años, sin antecedentes de importancia, con cuadro clínico de 8 meses de evolución caracterizado por episodios de mareo, adinamia y diaforesis de predominio nocturno. Consultó a su hospital local donde documentaron hipoglicemia y posteriormente le practicaron una ecografía abdominal en la que se evidenciaron lesiones en el hígado compatibles con metástasis, por lo cual fue enviado al Instituto Nacional de Cancerología (INC) bajo sospecha diagnóstica de insulinoma metastásico.
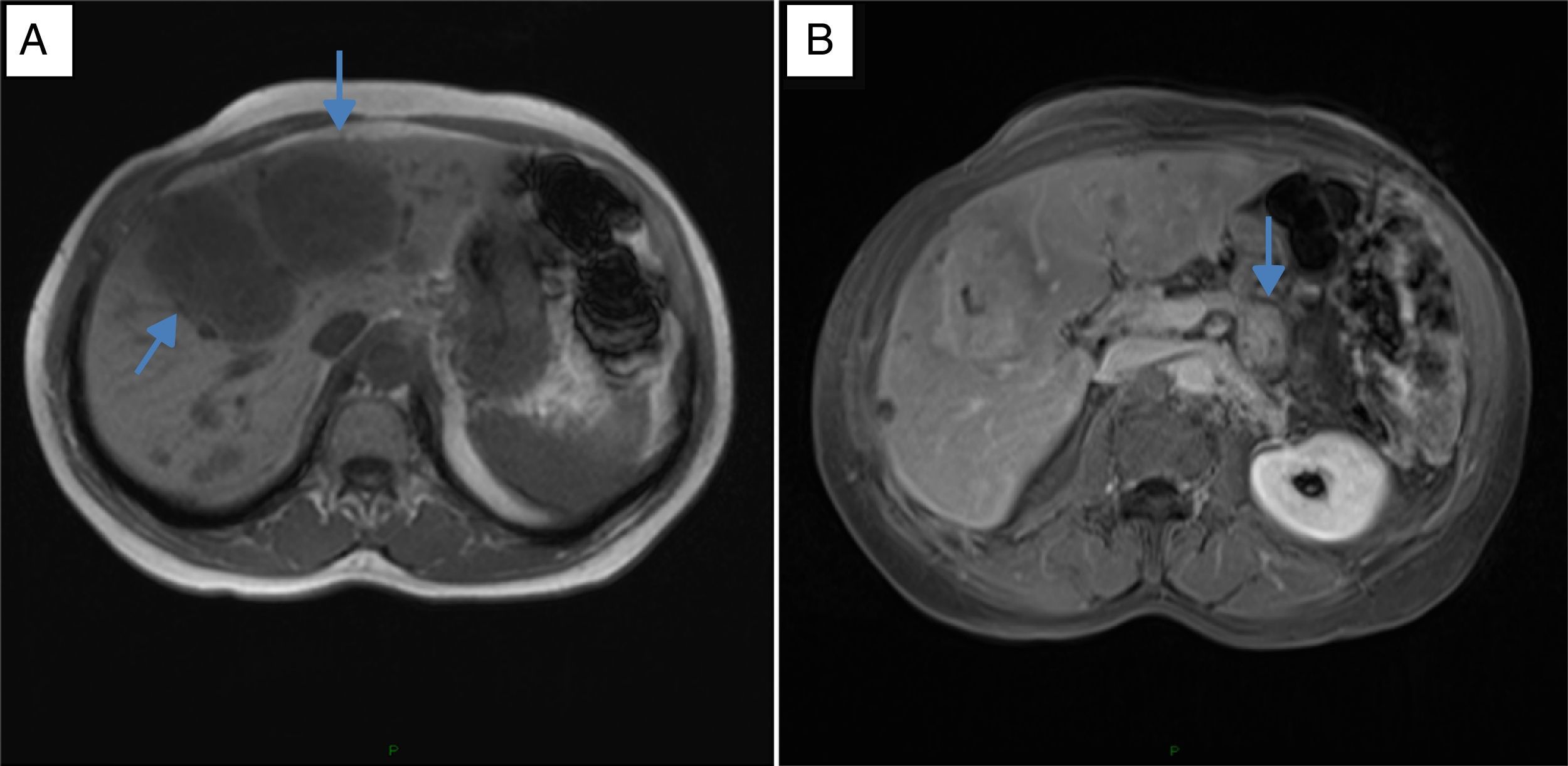
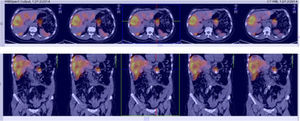
En el INC se realizó un test de ayuno documentándose hipoglucemia hiperinsulinémica (tabla 1) aunque no se realizó determinación de anticuerpos antiinsulina, ni niveles de beta-hidroxibutirato ni de sulfunilureas debido a la no disponibilidad de estas pruebas en la institución. Posteriormente, una imagen por resonancia magnética (IRM) (fig. 1) mostró una masa heterogénea irregular de 20 mm de diámetro en el cuerpo del páncreas y múltiples metástasis en hígado, las mayores en segmentos IV y V con un tamaño de 60x50mm. La lesión de mayor tamaño fue estudiada mediante biopsia percutánea que confirmó el compromiso por neoplasia neuroendocrina grado histológico 1 (OMS, 2010) con inmunohistoquímica positiva para cromogranina y sinaptofisina y negativa para insulina. El índice de proliferación Ki-67 fue del 1% y el índice mitótico de cero en diez campos de alto poder.
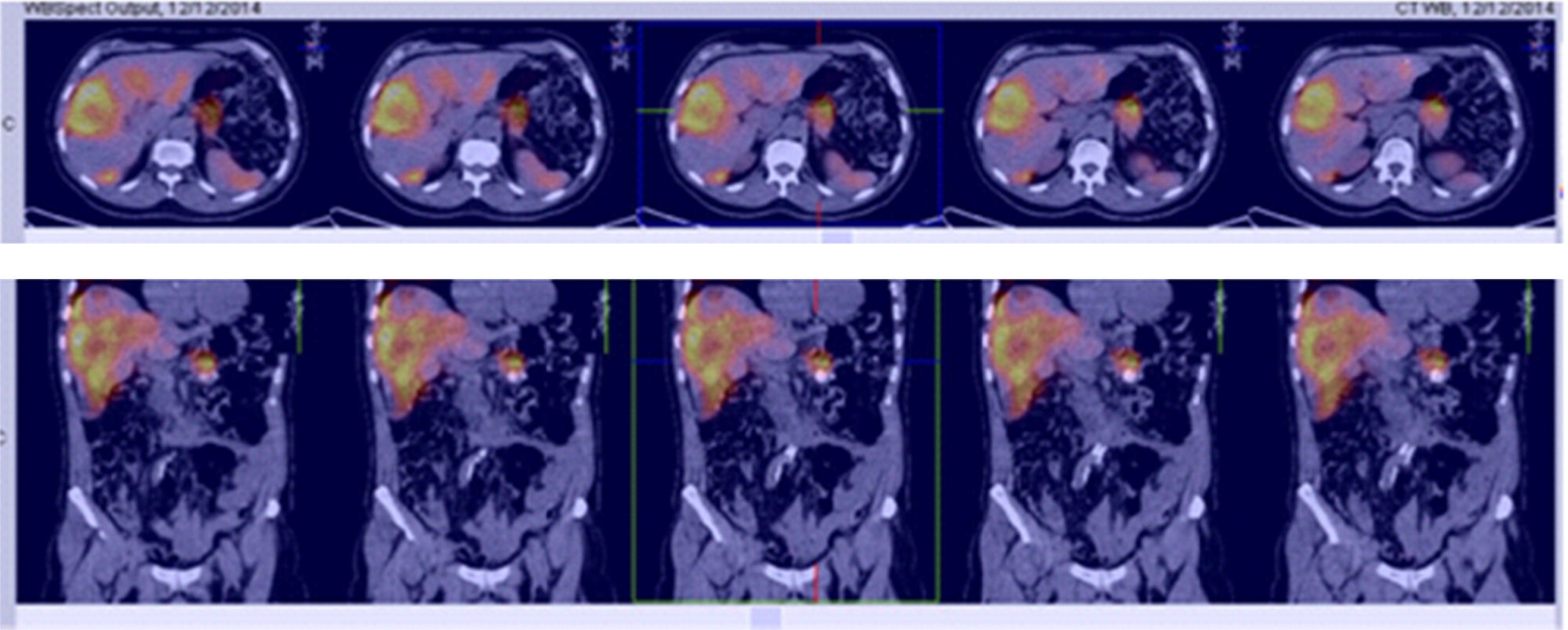
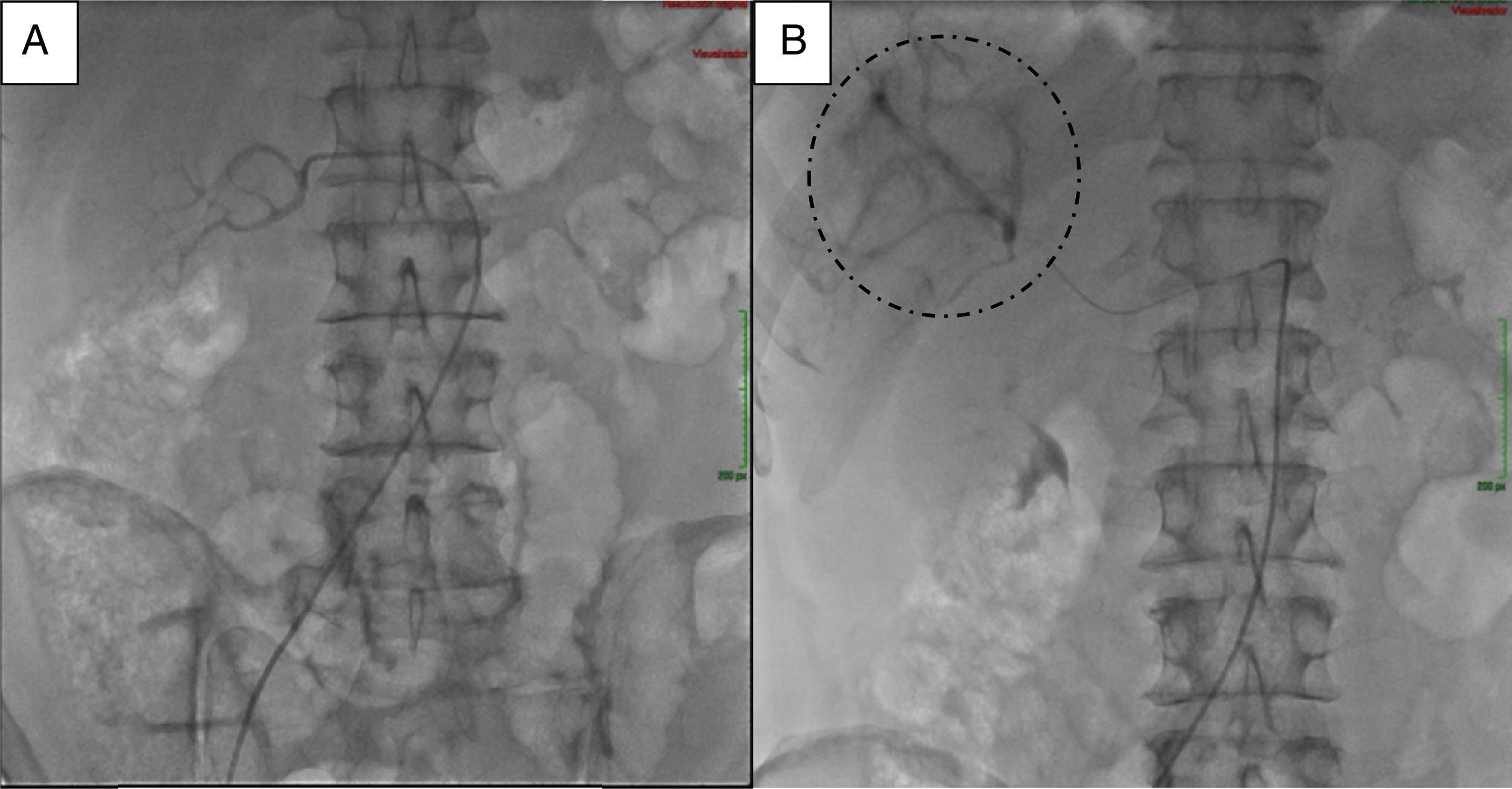
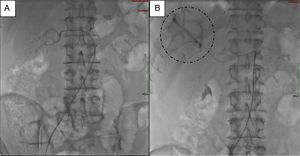
Para el manejo sintomático el paciente fue hospitalizado y se le administró diazoxido 50 mg vía oral cada 8 horas sin lograr un adecuado control al cabo de dos días, con una mala tolerancia al aumento de la dosis. Requirió la infusión continua de dextrosa al 10% en agua destilada (DAD10%) y se le practicó una prueba de respuesta a octreotide subcutáneo1 con monitoreo glucométrico durante 6 horas (tabla 2) sin lograr una repuesta adecuada, presentando incluso hipoglucemia pese a que la gammagrafía con HYNIC-TOC (octreotide-tecnecio-99) encontrara sobreexpresión de receptores de somatostatina en las lesiones hepáticas y en la lesión del cuerpo del páncreas (fig. 2). Se discutió el caso en una junta multidisciplinaria y se decidió realizar embolización arterial hepática (EAH) de las lesiones de mayor tamaño localizadas en los segmentos IV y V, procedimiento que fue realizado intrahospitalariamente (fig. 3) sin complicaciones, y alcanzando un control sintomático a las 24 horas del mismo. De manera inesperada posterior al procedimiento desarrolló hiperglucemias persistentes, lo que requirió el uso de insulina para su manejo.
Test corto de Octreotide SC
| Tiempo | Glucometría | |
|---|---|---|
| Basal | 54 mg/dl | ←Octreotide 100 ug. |
| 1 hora | 33 mg/dl | ←DAD 10%. |
| 2 horas | 120 mg/dl | |
| 3 horas | 81 mg/dl | |
| 4 horas | 73 mg/dl | |
| 5 horas | 87 mg/dl |
Se considera respuesta favorable si la glucemia es mayor a 100mg/dl en cualquier momento dentro de las 6 horas después de la administración de 100 ug de octreotide SC. Se considera falla si el paciente presenta hipoglucemia durante el test.
El paciente fue dado de alta con un esquema basal bolo con insulina glargina 10 unidades al día e insulina glulisina 2 unidades preprandiales, con dosis ajustadas según glucometrías. La respuesta tumoral a la embolización fue valorada mediante IMR (imagen por resonancia nuclear magnética) a los 3 meses; los 6 posteriores al procedimiento se observó estabilidad en los diámetros de las lesiones tratadas, pero con cambios en la densidad, lo que sugirió necrosis en el centro de la lesión (datos no mostrados). En una nueva junta multidisciplinaria se decidió dar terapia adicional con péptidos radiomarcados [lutecio 177 marcado con octreotide modificado – (177Lu – DOTA – Tyr3 – octreotate)] con la intención de lograr citorreducción para una eventual intervención quirúrgica posterior. El paciente recibió tres dosis de 200mCi (5,7 GBq) cada una con intervalos de 2 meses, logrando enfermedad estable al final de la tercera dosis. En cuanto al control glucémico, el paciente requirió manejo con insulina hasta 2 meses después de la primera dosis de la terapia con lutecio 177 – DOTATATE y 6 meses después de la EAH y al momento de la última evaluación no requería ningún manejo antihiperglucemiante y tampoco ha presentado nuevos episodios de hipoglucemia.
DiscusiónEl caso que presentamos corresponde a un insulinoma maligno con una extensa enfermedad hepática e hipoglucemia hiperinsulinémica de difícil control con las medidas convencionales de tratamiento, por lo cual se llevó a embolización transarterial de metástasis hepáticas con intención de reducir la carga tumoral funcional logrando que se resolviera la hipoglicemia.
Los insulinomas son tumores neuroendocrinos secretores con una frecuencia de presentación de 4 casos por millón al año; de estos entre el 4 y el 14% corresponden a insulinomas malignos cuyo diagnóstico se basa en la identificación de metástasis que en la mayoría de los casos son ganglionares o hepáticas2. Las manifestaciones clínicas son similares a las del insulinoma no maligno pero pueden ser más severas y prolongadas, como consecuencia de la mayor carga tumoral3.
Los objetivos del tratamiento son el control de la secreción hormonal y el control tumoral. La primera medida para el control sintomático debe ser nutricional, indicando ingestas pequeñas y frecuentes y la administración de glucosa intravenosa para los casos en que se requiera. El diazóxido, en dosis de 50 a 600mg/día, actúa inhibiendo la liberación de insulina por acción directa sobre las células beta, pero solo es eficaz en aproximadamente el 50% de los casos3–6.
En los casos refractarios pueden usarse glucocorticoides como la dexametasona, prednisolona o hidrocortisona, con un efecto hiperglicemiante temporal y con los efectos adversos conocidos de los esteroides5,6. Los análogos de la somatostatina (octreotide o lanreotide) pueden ser útiles en pacientes con tumores que expresen receptores tipo 2 de la somatostatina por su efecto antisecretor de insulina, pero existe el riesgo potencial de empeorar la hipoglucemia por un efecto de inhibición de la secreción del glucagón5,6, como posiblemente ocurrió en nuestro paciente, por ello, como una manera de predecir la respuesta clínica a las formulaciones de acción prolongada, se ha descrito el empleo del test corto de octreotide1.
Recientemente, se ha usado el everolimus (un inhibidor de mTOR) en algunos pacientes con insulinomas malignos, logrando un control aceptable de la hipoglucemia, efecto que podría ser explicado por la inducción de insulino-resistencia4.
La embolización hepática transarterial es una herramienta terapéutica para el tratamiento de las metástasis hepáticas de más de 5cm de diámetro y la ablación con radiofrecuencia en metástasis pequeñas menores a 3cm3, en los TNE funcionantes y no funcionantes, generalmente como una medida temporal para aliviar los síntomas por secreción hormonal en los primeros o por efecto de masa en los segundos. En la literatura se han reportado menos de 20 casos de insulinomas malignos tratados con EAH7–11, pero se contempla como una alternativa terapéutica en las guías internacionales5,6.
En el caso presentado en este artículo, se logró resolver la hipoglicemia luego de la EAH de las metástasis de mayor tamaño, pero de manera inesperada el procedimiento resultó en hiperglicemia prolongada después del procedimiento, a pesar de que no se dio tratamiento simultáneo para el tumor primario ni para las demás lesiones hepáticas. Una explicación para este fenómeno podría ser la secreción conjunta de glucagón que ha sido descrita en series de casos de tumores neuroendocrinos pancreáticos multisecretores12. De esta manera, al destruir las células que producían insulina, predominaron las productoras de glucagón causando hiperglucemia, que no fue permanente debido a que el paciente recibió luego terapia sistémica con Lu 177 DOTATATE. Infortunadamente no se pudo demostrar por inmunohistoquímica la presencia de glucagón en las células tumorales debido al escaso material de tejido obtenido por biopsia percutánea que se valoró en el laboratorio de patología.
Otra explicación sería que el paciente tuviese una diabetes mellitus no diagnosticada previamente, que hubiera sido enmascarada por la hipoglucemia, y que afloró clínicamente al reducirse el exceso de insulina proveniente de las lesiones metastásicas hepáticas. Esto sucedió de manera similar en el caso reportado por Sherriff y Drake13, en el cual una paciente previamente diabética y en insulinoterapia, desarrolló hipoglucemia por un insulinoma metastásico que fue tratado con terapia con péptidos radiomarcados (lutecio 177 –DOTATATE) con buena respuesta tumoral, volviendo a su estado de hiperglucemia. Esta situación es menos probable en nuestro caso por cuanto el paciente dejó de requerir tratamiento antihiperglucemiante y no volvió a presentar hipoglucemias después de la terapia adicional con Lu177-DOTATE, que es una terapia sistémica, con el potencial de destruir las células tumorales, independiente de la hormona que secreten (glucagón, insulina, etc).
Si bien la inmunohistoquímica para insulina en la biopsia de una de las lesiones hepáticas fue negativa, debe tenerse en cuenta que la sensibilidad de los anticuerpos antiinsulina empleados en esta técnica no es del 100% dejando abierta la opción de falsos negativos12,14. Adicionalmente, se ha descrito una reducción de la capacidad de almacenamiento de las hormonas dentro de las células tumorales, cuando se compara la tinción para insulina dentro de las células tumorales con las células beta normales14 y, en este mismo sentido, un estudio con microscopía electrónica demostró un menor número de gránulos secretores dentro de las células tumorales frente a las células beta normales15. Esto quiere decir que la ausencia de tinción en inmunihistoquímica para una hormona determinada en una muestra de tejido tumoral no excluye la posibilidad de secreción de la misma.
En conclusión, este es hasta ahora el primer caso reportado en Colombia de un insulinoma maligno con extensa enfermedad metastásica hepática en el que se logró un control de la hipoglucemia tras la embolización transarterial de las metástasis hepáticas de mayor tamaño, lo que destaca el papel de esta modalidad mínimamente invasiva en el rápido control de la secreción hormonal en TNE. Un aspecto importante a destacar en este caso es el hallazgo de hiperglucemia hasta por 6 meses luego de la embolización, que podría ser explicado por la co-secreción de glucagón, lo cual nos debe alertar ante la posibilidad de tumores pancreáticos de secreciones mixtas o plurihormonales.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna declarada por los demás.
Conflicto de interesesNinguno declarado por los autores.
Al Dr. J. L. Quintana. Radiólogo intervencionista INC.