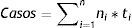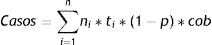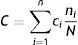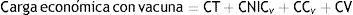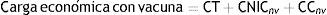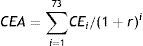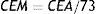Calcular la carga económica de las enfermedades neoplásicas del cuello uterino en Colombia y el efecto de su prevención.
MétodosSe calculó la incidencia a partir de un modelo de Markov sobre historia natural de la infección por VPH. Se estimaron costos directos en pesos colombianos (COP) a partir de eventos generadores de costos identificados en guías nacionales e internacionales. El valor monetario de los procedimientos se basó en manuales tarifarios vigentes (ISS 2001 con ajuste del 30% y SOAT). Las frecuencias de uso se definieron por consenso de expertos. Se incluyeron costos programáticos en tamización (citología) y vacunación (VPH).
ResultadosLos casos esperados por año para NIC I, NIC II-III y cáncer fueron 177.317, 46.911 y 5.110. El valor de la citología fue de COP$19.070 (US$10,8) y cada dosis de vacuna costó COP$23.700. La tamización representa el mayor costo en el control de la enfermedad (COP$126.933 millones). La vacuna genera un costo adicional de COP$11.977 millones y un ahorro de COP$15.969 millones; este último inició luego de 20 años de introducir la estrategia. Reducir el costo de la vacuna contribuye al ahorro y disminuir el costo de la tamización acorta su tiempo de inicio.
ConclusionesLa vacunación contra VPH reduce los costos del control del cáncer de cuello uterino pero requiere una inversión sostenida por un periodo largo de tiempo. La reducción del costo de la vacunación y la tamización traería beneficios económicos importantes, donde las nuevas alternativas tecnológicas pueden jugar un papel relevante.
To estimate the economic burden cervical neoplastic disease in Colombia and the effects of its prevention.
MethodsThe incidence was calculated from a Markov model on the natural history of human papillomavirus (HPV) infection. Direct costs were estimated, in Colombian Pesos (COP), from cost-generating events identified in national and international guides. The monetary value of the procedures was based on current tariff manuals (ISS 2001 with a 30% adjustment and mandatory insurance (SOAT). The frequencies of use were defined by expert consensus. Screening program (cytology) and vaccination (HPV) costs were included.
ResultsThe expected cases per year for IFRS (NIC) 1 (International Financial Reporting Standards), IFRS 2-3 and cancer were 177,317, 46,911, and 5,110, respectively. The cost of cytology was COP$19,070 (€9.80) and each vaccine dose cost COP$23,700 (€10.00). Screening represented the highest cost in the control of the disease (COP$126.933 million; €38.5 million). The vaccine generated an additional cost of COP$11.977 million (€3.5 million) and a saving of COP$15.969 million (€4.8 million). This latter started 20 years after introducing the strategy. To reduce the cost of the vaccination contributes to a saving and to decrease the cost of screening shortens its start-up time.
ConclusionsVaccination against HPV reduces the costs of controlling uterine cervical cancer, but it requires a sustained investment for a long period of time. The reduction in the vaccine and screening costs would bring significant economic benefits, where the new, alternative technologies could play an important role.
El cáncer de cuello uterino es la segunda causa de incidencia y la tercera de mortalidad por cáncer en mujeres a nivel mundial. Se estima que cada año 528.000 mujeres son afectadas por esta patología y alrededor de 266.000 mueren por esta causa1. En Colombia el cáncer de cuello uterino representa la principal causa de muerte y la segunda causa de incidencia por cáncer en mujeres. Para el periodo 2000-2006 se reportaron 13.670 muertes por esta enfermedad, para una tasa ajustada por edad de 10,1 por 100.0002. Además se estima que habrá un incremento neto en el número de casos nuevos de cáncer de cuello uterino como efecto del envejecimiento poblacional, pasando en el caso de Latinoamérica de 72.000 casos en el 2002 a 126.000 casos en el 20253. El incremento en el número de casos representa un desafío para los sistemas de salud de la región, debido la carga que implica para los servicios de salud y el impacto económico de dicha situación.
Como se puede observar, a pesar de los esfuerzos realizados con la implementación de programas de tamización basados en citología, esta enfermedad continúa siendo un problema de salud pública en los países en desarrollo incluyendo a Colombia y las demás naciones latinoamericanas.
Algunas características propias de los programas basados en citología, como la necesidad de múltiples visitas para la tamización, la confirmación diagnóstica y el tratamiento definitivo, se mencionan como posibles causas del poco efecto observado con estos programas, a diferencia de lo evidenciado en los países desarrollados donde las mejores condiciones de acceso de los sistemas de salud han permitido un mejor desempeño de la estrategia4.
Recientemente, el establecimiento de la relación entre el virus del papiloma humano (VPH) y el cáncer de cuello uterino posibilitó un gran auge investigativo que dio como resultado nuevas alternativas para el control de la enfermedad incluyendo el desarrollo de vacunas y nuevas tecnologías para la detección temprana5,6.
En el contexto descrito, existen pocos estudios que estimen la carga económica del cáncer de cuello uterino en Latinoamérica y, particularmente en Colombia; dicha información resulta indispensable para una adecuada valoración del impacto potencial de la introducción de las nuevas alternativas para la prevención y la detección temprana del cáncer de cuello uterino. Este estudio tiene por objetivo estimar la carga económica que las lesiones preneoplásicas y neoplásicas del cuello uterino en el sistema de salud colombiano.
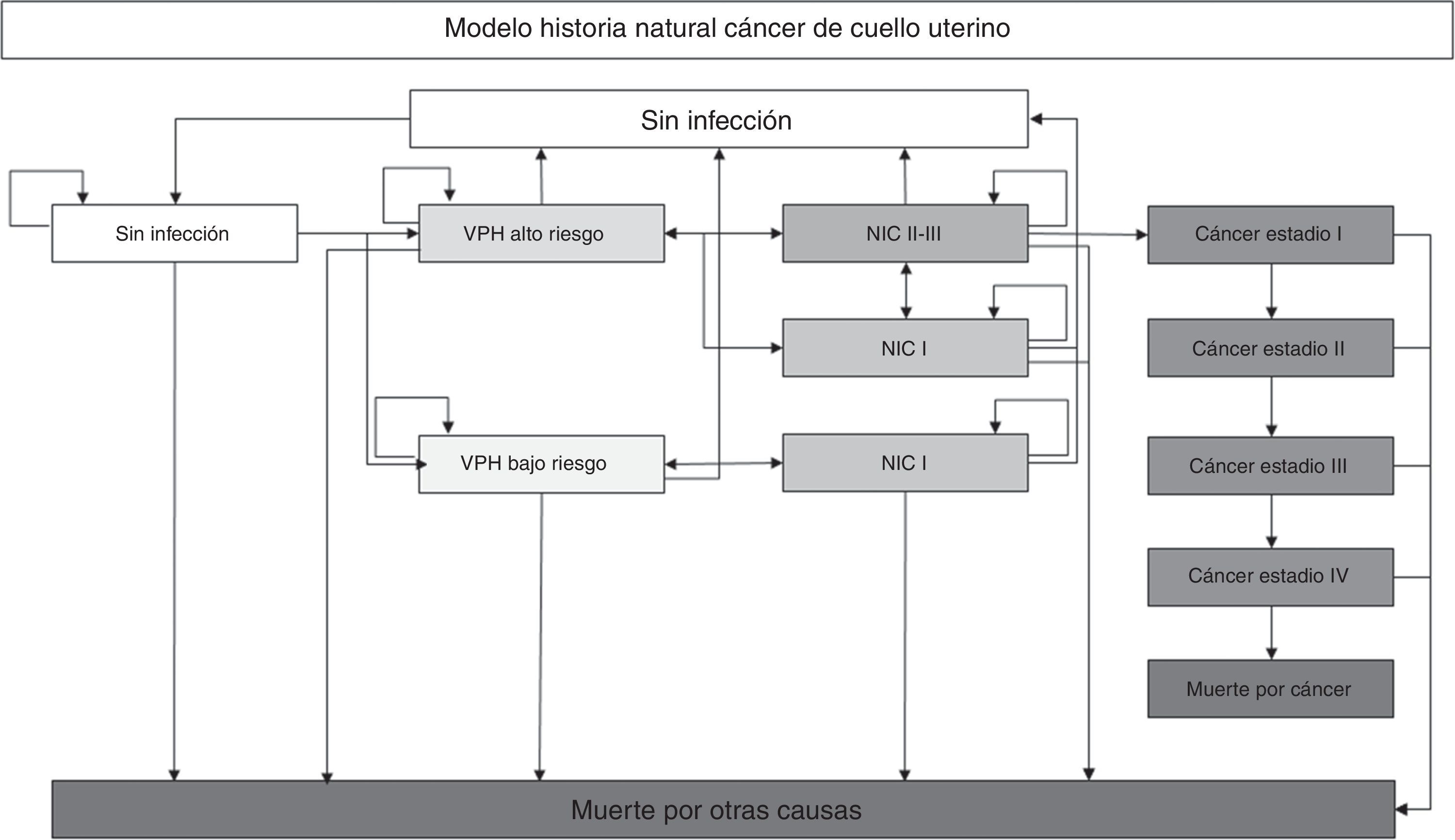
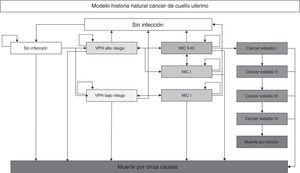
Materiales y métodosEstimación de la incidenciaSe adaptó el modelo desarrollado por Gamboa et al.7, que corresponde a un modelo de Markov que simula la historia natural de la infección por el VPH. Se realizó simulación a nivel individual para lo cual se crearon 1.000.000 de mujeres que ingresaron al modelo a la edad de 12 años. Las mujeres transitaron por los diferentes estados del modelo en ciclos anuales hasta la muerte por cáncer u otras causas o hasta que se alcanzara la edad de 85 años. El modelo permitió que las mujeres realizaran hasta 9 episodios de infección por el VPH, lesiones de alto grado y lesiones de bajo grado. El modelo fue validado con los datos de incidencia y mortalidad por cáncer de cuello uterino reportados por el Registro Poblacional de Cáncer de Cali. En la fig. 1 se muestra la estructura del modelo.
Modelo de historia natural del cáncer de cuello uterino.
VPH: virus del papiloma humano.
NIC: neoplasia intraepitelial cervical.
Las mujeres ingresan al modelo a la edad de 12 años en el estado sin infección y pueden transitar a los diferentes estados del modelo de acuerdo a las probabilidades anules de transición (las flechas indican las transiciones de un estado a otro). Solo las infecciones por VPH de alto riesgo tiene la probabilidad de generar lesiones de alto riesgo (NIC II-III) las cuales pueden progresar hasta cáncer. En los estados de infección y lesión es posible regresar al estado sin infección. Una vez en el estado cáncer no es posible volver a los estados previos progresando la enfermedad hasta el estado IV desde el cual es posible morir por cáncer. En todos los estados se está en riesgo de morir por otras causas.
Supuestos del modelo
- •
Las mujeres ingresan a la edad de 12 años sin antecedente de infección por VPH.
- •
Todos los casos de cáncer ocurren en presencia de infección por VPH de alto riesgo.
- •
Las infecciones por VPH de bajo riesgo no progresan a cáncer.
- •
La infección por el VPH depende de la edad.
- •
Las probabilidades de progresión/regresión de las infecciones por VPH y de las lesiones (LSIL y HSIL) son dependientes de la edad y del tipo de virus (alto o bajo riesgo).
- •
Una vez en el estado invasor no es posible regresar a los estados previos. La mujer queda en los estados de cáncer hasta la muerte por cáncer u otras causas.
- •
Después de 5 años del tratamiento del cáncer invasor sin presentar recaída de la enfermedad, la probabilidad de morir es la misma de la población general.
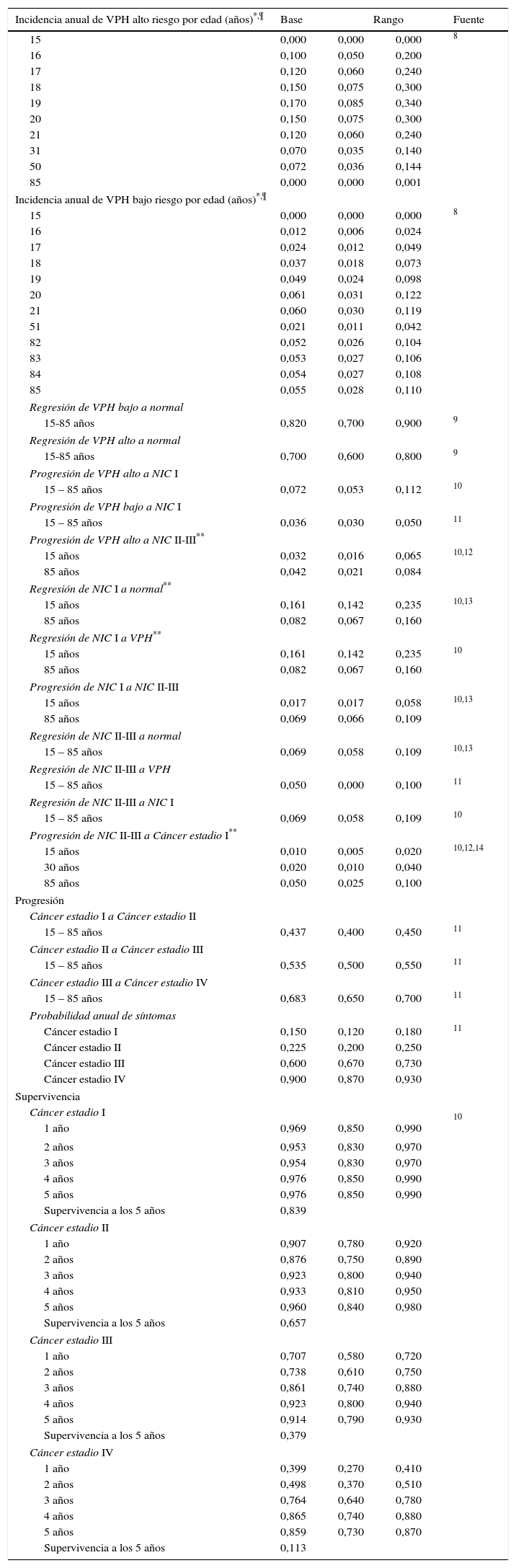
Los datos usados en el modelo, con sus referencias 8-14, son mostrados en la tabla 1. A partir del modelo se estimaron las tasas de incidencia de lesiones preneoplásicas y cáncer y fueron calculadas como el número de casos nuevos que se observan en periodos de seguimiento de cinco años (el primer periodo fue de tres años, 12 a 14 años, luego cada cinco años) sobre la suma de los tiempos que las mujeres estuvieron en riesgo de desarrollar los eventos durante estos periodos.
Datos usados en el modelo de historia natural
| Incidencia anual de VPH alto riesgo por edad (años)*,¶ | Base | Rango | Fuente | |
|---|---|---|---|---|
| 15 | 0,000 | 0,000 | 0,000 | 8 |
| 16 | 0,100 | 0,050 | 0,200 | |
| 17 | 0,120 | 0,060 | 0,240 | |
| 18 | 0,150 | 0,075 | 0,300 | |
| 19 | 0,170 | 0,085 | 0,340 | |
| 20 | 0,150 | 0,075 | 0,300 | |
| 21 | 0,120 | 0,060 | 0,240 | |
| 31 | 0,070 | 0,035 | 0,140 | |
| 50 | 0,072 | 0,036 | 0,144 | |
| 85 | 0,000 | 0,000 | 0,001 | |
| Incidencia anual de VPH bajo riesgo por edad (años)*,¶ | ||||
| 15 | 0,000 | 0,000 | 0,000 | 8 |
| 16 | 0,012 | 0,006 | 0,024 | |
| 17 | 0,024 | 0,012 | 0,049 | |
| 18 | 0,037 | 0,018 | 0,073 | |
| 19 | 0,049 | 0,024 | 0,098 | |
| 20 | 0,061 | 0,031 | 0,122 | |
| 21 | 0,060 | 0,030 | 0,119 | |
| 51 | 0,021 | 0,011 | 0,042 | |
| 82 | 0,052 | 0,026 | 0,104 | |
| 83 | 0,053 | 0,027 | 0,106 | |
| 84 | 0,054 | 0,027 | 0,108 | |
| 85 | 0,055 | 0,028 | 0,110 | |
| Regresión de VPH bajo a normal | ||||
| 15-85 años | 0,820 | 0,700 | 0,900 | 9 |
| Regresión de VPH alto a normal | ||||
| 15-85 años | 0,700 | 0,600 | 0,800 | 9 |
| Progresión de VPH alto a NIC I | ||||
| 15 – 85 años | 0,072 | 0,053 | 0,112 | 10 |
| Progresión de VPH bajo a NIC I | ||||
| 15 – 85 años | 0,036 | 0,030 | 0,050 | 11 |
| Progresión de VPH alto a NIC II-III** | ||||
| 15 años | 0,032 | 0,016 | 0,065 | 10,12 |
| 85 años | 0,042 | 0,021 | 0,084 | |
| Regresión de NIC I a normal** | ||||
| 15 años | 0,161 | 0,142 | 0,235 | 10,13 |
| 85 años | 0,082 | 0,067 | 0,160 | |
| Regresión de NIC I a VPH** | ||||
| 15 años | 0,161 | 0,142 | 0,235 | 10 |
| 85 años | 0,082 | 0,067 | 0,160 | |
| Progresión de NIC I a NIC II-III | ||||
| 15 años | 0,017 | 0,017 | 0,058 | 10,13 |
| 85 años | 0,069 | 0,066 | 0,109 | |
| Regresión de NIC II-III a normal | ||||
| 15 – 85 años | 0,069 | 0,058 | 0,109 | 10,13 |
| Regresión de NIC II-III a VPH | ||||
| 15 – 85 años | 0,050 | 0,000 | 0,100 | 11 |
| Regresión de NIC II-III a NIC I | ||||
| 15 – 85 años | 0,069 | 0,058 | 0,109 | 10 |
| Progresión de NIC II-III a Cáncer estadio I** | ||||
| 15 años | 0,010 | 0,005 | 0,020 | 10,12,14 |
| 30 años | 0,020 | 0,010 | 0,040 | |
| 85 años | 0,050 | 0,025 | 0,100 | |
| Progresión | ||||
| Cáncer estadio I a Cáncer estadio II | ||||
| 15 – 85 años | 0,437 | 0,400 | 0,450 | 11 |
| Cáncer estadio II a Cáncer estadio III | ||||
| 15 – 85 años | 0,535 | 0,500 | 0,550 | 11 |
| Cáncer estadio III a Cáncer estadio IV | ||||
| 15 – 85 años | 0,683 | 0,650 | 0,700 | 11 |
| Probabilidad anual de síntomas | ||||
| Cáncer estadio I | 0,150 | 0,120 | 0,180 | 11 |
| Cáncer estadio II | 0,225 | 0,200 | 0,250 | |
| Cáncer estadio III | 0,600 | 0,670 | 0,730 | |
| Cáncer estadio IV | 0,900 | 0,870 | 0,930 | |
| Supervivencia | ||||
| Cáncer estadio I | ||||
| 1 año | 0,969 | 0,850 | 0,990 | 10 |
| 2 años | 0,953 | 0,830 | 0,970 | |
| 3 años | 0,954 | 0,830 | 0,970 | |
| 4 años | 0,976 | 0,850 | 0,990 | |
| 5 años | 0,976 | 0,850 | 0,990 | |
| Supervivencia a los 5 años | 0,839 | |||
| Cáncer estadio II | ||||
| 1 año | 0,907 | 0,780 | 0,920 | |
| 2 años | 0,876 | 0,750 | 0,890 | |
| 3 años | 0,923 | 0,800 | 0,940 | |
| 4 años | 0,933 | 0,810 | 0,950 | |
| 5 años | 0,960 | 0,840 | 0,980 | |
| Supervivencia a los 5 años | 0,657 | |||
| Cáncer estadio III | ||||
| 1 año | 0,707 | 0,580 | 0,720 | |
| 2 años | 0,738 | 0,610 | 0,750 | |
| 3 años | 0,861 | 0,740 | 0,880 | |
| 4 años | 0,923 | 0,800 | 0,940 | |
| 5 años | 0,914 | 0,790 | 0,930 | |
| Supervivencia a los 5 años | 0,379 | |||
| Cáncer estadio IV | ||||
| 1 año | 0,399 | 0,270 | 0,410 | |
| 2 años | 0,498 | 0,370 | 0,510 | |
| 3 años | 0,764 | 0,640 | 0,780 | |
| 4 años | 0,865 | 0,740 | 0,880 | |
| 5 años | 0,859 | 0,730 | 0,870 | |
| Supervivencia a los 5 años | 0,113 | |||
Se calcularon tasas de incidencia por grupos etarios quinquenales, que fueron usadas para calcular el número de casos anuales esperados en la población de mujeres colombianas, de acuerdo a la siguiente fórmula:
Donde: ni = número de mujeres de grupo de edad i; ti= tasa de incidencia de lesiones o cáncer para el grupo de edad i; i= grupo de edad; con i = 1,2,…,n; Los casos anuales esperados en la población vacunada se estimaron como:
Donde: ni = número de mujeres de grupo de edad i; ti= tasa de incidencia de lesiones o cáncer para el grupo de edad i; p= el porcentaje de NIC I, NIC II-III o cáncer atribuibles a infecciones por VPH de alto riesgo incluidas en la vacuna; cob= cobertura de la vacunación; i= grupo de edad; con i = 1,2,…,n.
El porcentaje de NIC I, NIC II-III y cáncer atribuible a infecciones por VPH de alto riesgo incluidas en la vacuna, usado en la estimación fue respectivamente de 47%, 63,6% y 76,8%15–18, bajo el supuesto que existe protección cruzada para los virus 45 y 33 como lo muestra la literatura19. Es importante mencionar que el valor de p solo aplicaba a las mujeres que han recibido vacunación, por lo que la reducción en los costos debidos al tratamiento del cáncer invasor comienza a los diez años de iniciado el programa de vacunación. Para las otras lesiones la reducción en los costos empieza en un tiempo menor debido a que estas ocurren a menor edad.
Se utilizó el modelo de Markov en la estimación de las tasas de incidencia, debido a que no se identificó información sobre incidencia de NIC II y NIC II-III, para Colombia. Ante la ausencia de información se estimaron tasas de incidencia de lesiones precancerosas, cáncer y mortalidad por esta causa, validando el modelo al comparar las dos últimas con las reportadas por el Registro Poblacional de Cáncer de Cali.
Estimación de los costosLa perspectiva usada fue la del tercero pagador y únicamente se incluyeron costos directos expresados en pesos colombianos (COP). Se estimaron los costos de las lesiones preneoplásicas y del cáncer de cuello uterino para cada uno de los estadios de la enfermedad. Los costos asociados al tratamiento incluyeron: el personal asistencial, los tratamientos médicos y el tratamiento de las complicaciones. Para dicho cálculo se utilizó la metodología de casos tipo en la que se identificaron, cuantificaron y valoraron los eventos generadores de costos como se explicará a continuación.
En la identificación de los eventos generadores de costos se revisaron protocolos de manejo del Instituto Nacional de Cancerología20 y las guías del National Comprehensive Cancer Network NCCN21. Con los eventos generadores de costos identificados, se construyeron formatos de recolección de información que fueron validados por expertos clínicos (ginecología oncológica, oncología clínica y radioterapia). En los formatos se incluyó información sobre: diagnóstico inicial, diagnóstico de extensión, tratamiento quirúrgico, tratamiento oncológico, tratamiento de radioterapia y seguimiento.
Para la estimación de la cantidad y la frecuencia de uso de cada recurso identificado, se utilizó la opinión de expertos. El panel de expertos estuvo conformado por: cuatro ginecólogos oncólogos, dos oncólogos clínicos y tres radioterapeutas.
La valoración monetaria se realizó usando manuales tarifarios colombianos (ISS 2001 y SOAT). La información reportada por el Sistema de Información de Precios de Medicamentos del país (SISMED 2010) y la reglamentación sobre precios de medicamentos vigente; particularmente la Resolución 4316 de 2011 fue usada para determinar los precios de los medicamentos con precio techo. La información reportada por el SISMED fue actualizada a 2012 usando el índice de precios al consumidor informado por el Departamento Administrativo Nacional de Estadísticas (DANE). En caso de no encontrarse información para algún procedimiento o medicamento en las fuentes anteriormente mencionadas, se usó la información del Instituto Nacional de Cancerología de Colombia (INC).
Los procedimientos identificados fueron expresados en unidades de valor relativo (UVR) para el manual tarifario ISS 2001 con un incremento del 30%, de acuerdo con lo vigente al momento del análisis en el mercado de servicios del Instituto Nacional de Cancerología. El manual tarifario SOAT se expresa en salarios mínimos legales diarios, para lo cual se utilizó el valor vigente para Colombia en 2012 (COP$ 18.890). El número de UVR por procedimiento fue el determinado en el manual ISS, teniendo en cuenta las variaciones de este de acuerdo a las características de los procedimientos.
En la estimación de los costos de los medicamentos, se realizaron los siguientes procedimientos: se extrajo la información de los medicamentos que no tenían regulación de precios; se codificaron los medicamentos usando la clasificación Anatómica, Terapéutica, Química (ATC); dado que un mismo principio activo puede tener varias presentaciones y ser producido por diferentes compañías farmacéuticas, se estimó un costo ponderado por dosis del medicamento usando como ponderador las cantidades reportadas y finalmente se estimó el costo por miligramo del medicamento.
El costo ponderado por dosis se calculó de acuerdo a la siguiente fórmula:
Donde: C= costo por dosis ponderado; n = número de presentaciones del medicamento (la presentación quedo definida por los miligramos por tableta, vial, etc. y la marca, por lo tanto, una misma marca podía tener más de una presentación); ci= es el costo por dosis de la i-ésima presentación del medicamento, con i = 1, 2,…,n; ni= número de unidades reportadas para i-ésima presentación del medicamento, con i = 1, 2,…,n; N= total de unidades reportadas para el medicamento.
Se estimaron los costos totales para las lesiones preneoplásicas y para cada estadio del cáncer de cuello uterino como se muestra a continuación:
Donde: n = número de procedimientos (diagnóstico o terapéuticos) o medicamentos; ci= es el costo del i-ésimo procedimiento o medicamento, con i = 1, 2,…,n; qi= es la cantidad del i-ésimo procedimiento o medicamento, con i = 1, 2,…,n; fi= es la frecuencia del i-ésimo procedimiento o medicamento, con i = 1, 2,…,n.
Adicionalmente, se estimaron los costos de operación de un programa de tamización y de un programa de vacunación, considerando la información suministrada por la Secretaría Distrital de Salud de Bogotá referente a las actividades de coordinación, capacitación a proveedores, comunicación y educación a la población objetivo, control de calidad, monitoreo y evaluación. Los costos observados se asumieron para una población media de 100.000 mujeres y fueron finalmente promediados para cada mujer por cada año en el programa para el caso de la tamización y para la aplicación de tres dosis de vacuna en el caso de la vacunación.
Estimación de la carga económicaSe estimó la carga económica (CE) anual para Colombia considerando los casos anuales esperados de NIC I, NIC II-III y cáncer invasor, y sumando el número de mujeres tamizadas y vacunadas. La estimación se realizó para un horizonte temporal de 73 años, incluyendo cohortes sucesivas de mujeres de 12 años, hasta que la primera cohorte alcanzó los 80 o más años. En la estimación se realizaron dos supuestos: que la estructura por edades de las mujeres colombianas observada actualmente se mantiene en el tiempo y que las tasas de incidencia de lesiones estimadas son constantes para el caso del programa de tamización sin vacuna y disminuyen en el tiempo, en la medida que se van vacunado nuevas cohortes de mujeres, para el programa con vacuna.
La CE anual para un programa de tamización con y sin vacuna se estimó como:
Donde: CT = costos de tamización. Se calculó multiplicando el número de mujeres tamizadas por el costo de la prueba más el costo anual del programa de tamización; CNIC= costo del tratamiento del NIC I y NIC II-III. Se calculó multiplicado los casos anuales estimados, para el programa con y sin vacuna respectivamente, por el costo del tratamiento; CC= costo del cáncer. Se calculó multiplicando el número de casos anuales estimados de cáncer de cuello uterino, para el programa con y sin vacuna respectivamente, por el costo del tratamiento; CV= costo vacunación. Se calculó multiplicando el número de mujeres vacunadas por el costo de las tres dosis de la vacuna más el costo anual del programa de vacunación.
Se estimó la carga económica acumulada (CEA) y media (CEM) como:
Donde r corresponde a la tasa de descuento anual del 3% e i al año de iniciado el programa de vacunación. Se realizaron análisis de sensibilidad sobre: los costos de la vacuna, la cobertura de la vacunación, el costo del programa de tamización y la existencia o no de protección cruzada.
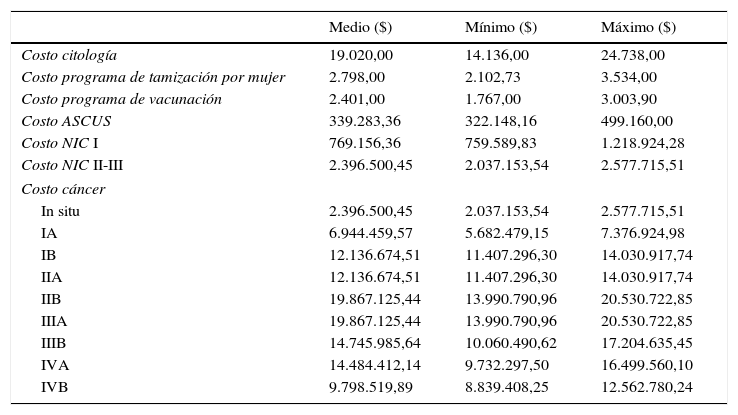
ResultadosEl costo estimado de la citología fue de COP$ 19.020, a lo que se suma un costo por año del programa de COP$ 2.798 pesos; a estos costos se suman COP$ 2.401 por mujer en el programa de tamización más vacunación. Los costos de manejo de NIC II-III y del cáncer in situ se estimaron igual y el costo del tratamiento de cáncer invasor es incremental hasta el estadio IIIA para luego descender con los estadios más avanzados (tabla 2).
Costos usados en el análisis
| Medio ($) | Mínimo ($) | Máximo ($) | |
|---|---|---|---|
| Costo citología | 19.020,00 | 14.136,00 | 24.738,00 |
| Costo programa de tamización por mujer | 2.798,00 | 2.102,73 | 3.534,00 |
| Costo programa de vacunación | 2.401,00 | 1.767,00 | 3.003,90 |
| Costo ASCUS | 339.283,36 | 322.148,16 | 499.160,00 |
| Costo NIC I | 769.156,36 | 759.589,83 | 1.218.924,28 |
| Costo NIC II-III | 2.396.500,45 | 2.037.153,54 | 2.577.715,51 |
| Costo cáncer | |||
| In situ | 2.396.500,45 | 2.037.153,54 | 2.577.715,51 |
| IA | 6.944.459,57 | 5.682.479,15 | 7.376.924,98 |
| IB | 12.136.674,51 | 11.407.296,30 | 14.030.917,74 |
| IIA | 12.136.674,51 | 11.407.296,30 | 14.030.917,74 |
| IIB | 19.867.125,44 | 13.990.790,96 | 20.530.722,85 |
| IIIA | 19.867.125,44 | 13.990.790,96 | 20.530.722,85 |
| IIIB | 14.745.985,64 | 10.060.490,62 | 17.204.635,45 |
| IVA | 14.484.412,14 | 9.732.297,50 | 16.499.560,10 |
| IVB | 9.798.519,89 | 8.839.408,25 | 12.562.780,24 |
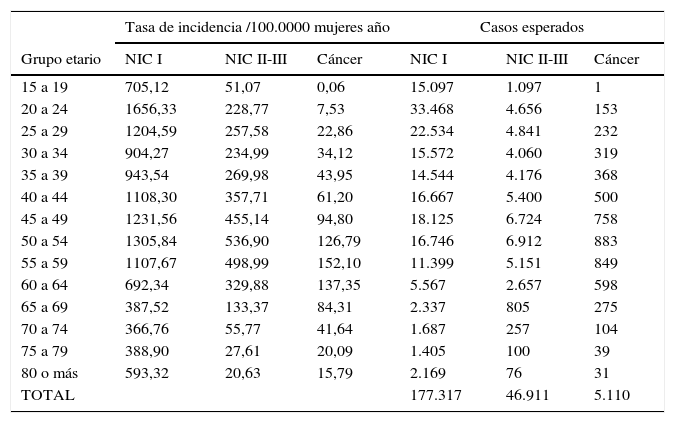
En la tabla 3 se muestran los casos anuales de NIC y cáncer invasor estimados. Se esperarían 177.317 casos de NIC I, 46.911 de NIC II-III y 5.110 de cáncer invasor. El número de casos de cáncer invasor estimado es similar al reportado por GLOBOCAN 2012 para Colombia (4.661)1.
Tasas de incidencias estimadas y casos esperados anuales de NIC I, NIC II-III y cáncer
| Tasa de incidencia /100.0000 mujeres año | Casos esperados | |||||
|---|---|---|---|---|---|---|
| Grupo etario | NIC I | NIC II-III | Cáncer | NIC I | NIC II-III | Cáncer |
| 15 a 19 | 705,12 | 51,07 | 0,06 | 15.097 | 1.097 | 1 |
| 20 a 24 | 1656,33 | 228,77 | 7,53 | 33.468 | 4.656 | 153 |
| 25 a 29 | 1204,59 | 257,58 | 22,86 | 22.534 | 4.841 | 232 |
| 30 a 34 | 904,27 | 234,99 | 34,12 | 15.572 | 4.060 | 319 |
| 35 a 39 | 943,54 | 269,98 | 43,95 | 14.544 | 4.176 | 368 |
| 40 a 44 | 1108,30 | 357,71 | 61,20 | 16.667 | 5.400 | 500 |
| 45 a 49 | 1231,56 | 455,14 | 94,80 | 18.125 | 6.724 | 758 |
| 50 a 54 | 1305,84 | 536,90 | 126,79 | 16.746 | 6.912 | 883 |
| 55 a 59 | 1107,67 | 498,99 | 152,10 | 11.399 | 5.151 | 849 |
| 60 a 64 | 692,34 | 329,88 | 137,35 | 5.567 | 2.657 | 598 |
| 65 a 69 | 387,52 | 133,37 | 84,31 | 2.337 | 805 | 275 |
| 70 a 74 | 366,76 | 55,77 | 41,64 | 1.687 | 257 | 104 |
| 75 a 79 | 388,90 | 27,61 | 20,09 | 1.405 | 100 | 39 |
| 80 o más | 593,32 | 20,63 | 15,79 | 2.169 | 76 | 31 |
| TOTAL | 177.317 | 46.911 | 5.110 | |||
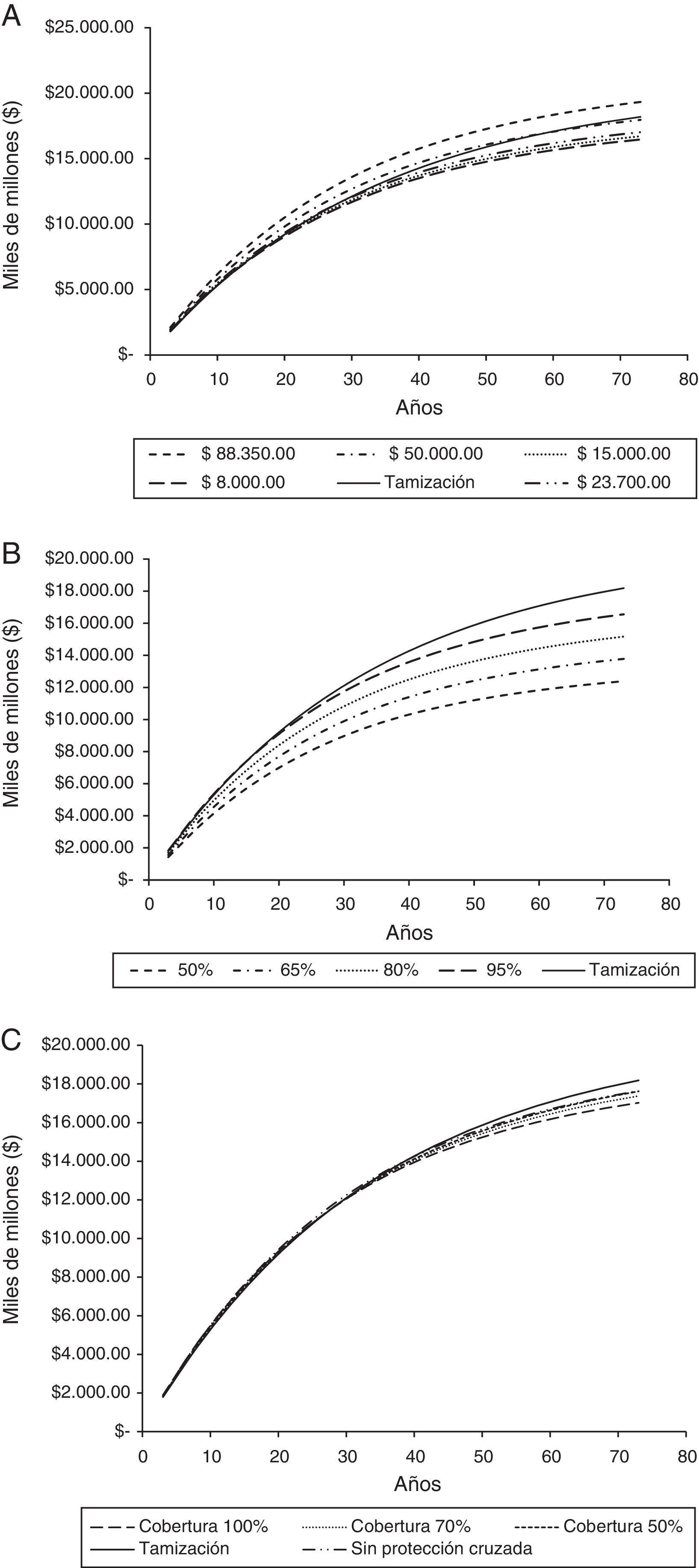
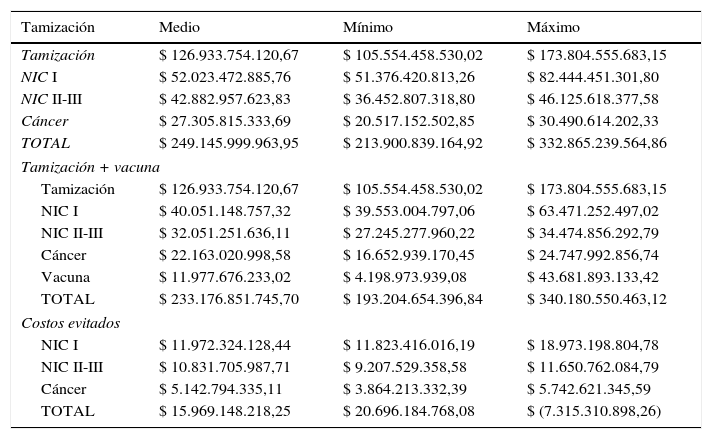
Para el horizonte temporal del estudio la adición de la vacunación a la tamización generaría un ahorro promedio anual de COP$ 15.969.148.218,25, que puede ser hasta COP$ 20.696.184.768,08 si el costo por dosis de vacuna es de COP$ 8.000 o incrementar el gasto en COP$ 7.315.310.898,26 si el costo por dosis de vacuna es de COP$ 88.350. Este ahorro comenzaría después de 25 años de implementado el programa, en un escenario con cobertura de vacunación del 100%, con protección cruzada y un costo por dosis de COP$ 23.700 (tabla 4, fig. 2).
Costo promedio anual evitado de lesiones preneoplásicas y neoplásicas del cuello uterino con la vacunación
| Tamización | Medio | Mínimo | Máximo |
|---|---|---|---|
| Tamización | $ 126.933.754.120,67 | $ 105.554.458.530,02 | $ 173.804.555.683,15 |
| NIC I | $ 52.023.472.885,76 | $ 51.376.420.813,26 | $ 82.444.451.301,80 |
| NIC II-III | $ 42.882.957.623,83 | $ 36.452.807.318,80 | $ 46.125.618.377,58 |
| Cáncer | $ 27.305.815.333,69 | $ 20.517.152.502,85 | $ 30.490.614.202,33 |
| TOTAL | $ 249.145.999.963,95 | $ 213.900.839.164,92 | $ 332.865.239.564,86 |
| Tamización + vacuna | |||
| Tamización | $ 126.933.754.120,67 | $ 105.554.458.530,02 | $ 173.804.555.683,15 |
| NIC I | $ 40.051.148.757,32 | $ 39.553.004.797,06 | $ 63.471.252.497,02 |
| NIC II-III | $ 32.051.251.636,11 | $ 27.245.277.960,22 | $ 34.474.856.292,79 |
| Cáncer | $ 22.163.020.998,58 | $ 16.652.939.170,45 | $ 24.747.992.856,74 |
| Vacuna | $ 11.977.676.233,02 | $ 4.198.973.939,08 | $ 43.681.893.133,42 |
| TOTAL | $ 233.176.851.745,70 | $ 193.204.654.396,84 | $ 340.180.550.463,12 |
| Costos evitados | |||
| NIC I | $ 11.972.324.128,44 | $ 11.823.416.016,19 | $ 18.973.198.804,78 |
| NIC II-III | $ 10.831.705.987,71 | $ 9.207.529.358,58 | $ 11.650.762.084,79 |
| Cáncer | $ 5.142.794.335,11 | $ 3.864.213.332,39 | $ 5.742.621.345,59 |
| TOTAL | $ 15.969.148.218,25 | $ 20.696.184.768,08 | $ (7.315.310.898,26) |
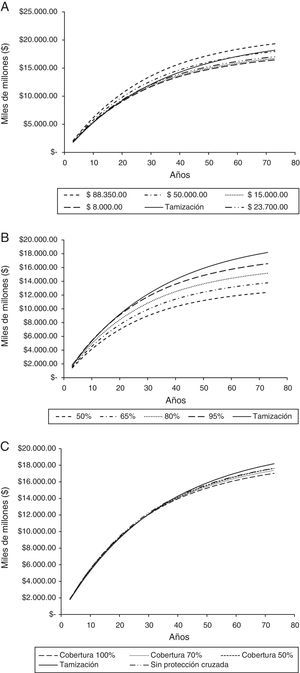
Costos acumulados de la tamización y la tamización más vacunación de acuerdo con el costo de la vacuna, cobertura y ausencia de protección cruzada.
A: Costo de la dosis de vacuna; B: Porcentaje de reducción en los costos del programa de tamización; C: Cobertura de la vacunación y protección cruzada.
El tiempo al cual ocurre el ahorro de recursos es sensible al costo de la vacuna y al costo del programa de tamización. Si el costo por dosis fuera de COP$ 8.000 los ahorros iniciarían a los 13 años de implementado el programa, si es de COP$ 50.000 el ahorro empieza a los 58 años y si es de COP$ 88.350 no se genera ahorro de recursos. En relación al costo del programa de tamización, una reducción de su costo en 20% o más, ahorraría recursos al año siguiente de implementada la vacunación (fig. 2).
La ausencia de protección cruzada también afecta el tiempo al cual se inicia el ahorro y la magnitud de este, donde se observa que el ahorro empezaría a los 38 años de implementado el programa y sería de COP$ 7.380.243.078,27 en promedio cada año. La cobertura no modifica en mayor medida el tiempo al cual inician los ahorros, pero si la magnitud de este, de forma que para una cobertura del 70% el ahorro promedio anual sería de COP$ 11.061.024.122,69 y para una cobertura del 50% el ahorro sería de COP$ 7.788.941.392,32 (fig. 2).
DiscusiónSe han adelantado una gran cantidad de análisis económicos en torno a la introducción de la vacunación contra VPH en diferentes países tanto desarrollados como en desarrollo. En términos generales, han mostrado que dicha estrategia tiene una relación favorable entre el costo y el tiempo de vida que se gana con ella, con o sin ajuste por calidad o discapacidad22,23. De manera similar, existen diversas publicaciones que analizan los costos asociados a enfermedades causadas por el VPH en diversos entornos24–32; no obstante, existen pocos análisis sobre el impacto económico de la tamización y la vacunación y al momento de esta publicación no encontramos ninguno referido a Colombia o a otro país latinoamericano.
Si bien los estudios de costo-efectividad son fundamentales para la toma de decisiones en la introducción de nuevas tecnologías sanitarias, sus resultados se expresan en indicadores que tienen sentido en el marco de la sociedad como el costo por año de vida ganado, pero usualmente estos no brindan información directa sobre la carga económica (costo y gasto asociado) y el impacto que sobre ella tienen las intervenciones en salud; dicha información resulta indispensable para una adecuada planificación y toma de decisiones.
Este análisis hace parte de los estudios realizados frente a la introducción de alternativas para el control del cáncer de cuello uterino. Se utilizó un modelo basado en datos epidemiológicos y sistemas de costeo apropiados, a fin de estimar el gasto en salud asociado al manejo de lesiones del cuello uterino (preneoplásicas y neoplásicas) y a las alternativas de control disponibles al momento, las cuales son la tamización y la vacunación.
De manera similar a lo reportado en estudios de otros países, el mayor costo en el control de la enfermedad lo tiene la tamización, valor que resulta similar a la suma del tratamiento de todo el espectro de enfermedad (alrededor de COP$ 127.000 millones y COP$ 122.000 millones respectivamente). Francia estima un costo cercano a los EU$ 532 millones para el programa de tamización, frente a EU$ 50 millones para el manejo de la neoplasia intraepitelial cervical (grados 1 a 3)26 y EU$ 84.1 millones para el cáncer invasor del cuello uterino, estos últimos datos provenientes de un reporte independiente27. En el Reino Unido se estima un costo de £$ 104 millones para la tamización, £$ 34 millones para el manejo de anormalidades citológicas y £$ 33 millones para el tratamiento de cáncer invasor (incidente)28. Un estudio realizado en los Estados Unidos estima el costo total del cáncer de cuello uterino en US$ 7021 millones, de los cuales 5356 corresponden a la tamización y 1224 al manejo de lesiones precancerosas (seguimiento de anormalidades citológicas)29. Para este último país, una revisión sistemática encuentra que: los costos de la tamización están entre US$ 2644 y US$ 4070 millones según el reporte (incluyendo el costo de falsos positivos); los costos de las lesiones preneoplásicas oscilan entre US$ 700 y US$ 2300 millones, y los costos del cáncer invasor muestran resultados más consistentes entre publicaciones alrededor de US$ 300 millones31.
A pesar de la coherencia frente a un costo mayor de la tamización, el valor de esta intervención en relación con el costo global de la enfermedad se ve menor en este estudio, lo que quizás se debe a que los datos referenciados corresponden a países desarrollados en donde la incidencia de cáncer invasor se ha reducido sustancialmente tras varias décadas de la implementación exitosa de programas de detección temprana, a lo que se suma un estado más temprano al momento del diagnóstico y una menor prevalencia de lesiones preneoplásicas como producto de la misma intervención. A la fecha no encontramos información similar proveniente de países en desarrollo.
En términos generales, la información sobre costos de lesiones precancerosas muestra gran variación no solo entre países sino también entre reportes para un mismo país. Para los estudios citados, los costos del NIC representan entre el 51% y el 88% del total de costos por manejo de enfermedad cervical (NIC y cáncer) para Reino Unido y Estados Unidos, respectivamente. En el caso de Francia no es estimable el porcentaje ya que los datos de cáncer y precáncer vienen de reportes diferentes26-29,31.
Los datos de este estudio muestran que en Colombia el NIC representa el 77% de este costo e información adicional de Italia, Singapur y Malasia muestra dichos costos en 50%, 26% y 4% respectivamente24,25,32. Es posible que las variaciones se deban parcialmente al estado de desarrollo de los programas de tamización, donde a menor nivel de desarrollo del tamizaje mayor el costo derivado del cáncer invasor y menor el costo relacionado con el manejo de lesiones preneoplásicas.
Datos disponibles de Malasia y Singapur reportan antecedente de tamización en el tiempo de vida en 47,3% y 62,4% de las mujeres respectivamente (años 2009 y 2002)33,34, mientras que el antecedente de citología en los últimos 3 años para Colombia en 2005 fue mayor al 70% y el antecedente en el tiempo de vida superior a 90%35.
A pesar de lo descrito, las variaciones anotadas dependen mayoritariamente de diferencias en las aproximaciones metodológicas como el uso de casos prevalentes o incidentes, los métodos y fuentes de información para la estimación de incidencia o prevalencia (reportes de citología anormal o modelos de historia natural) y los métodos de estimación de costos31. Al margen de las diferencias, resulta relevante que todos los estudios estiman un costo significativo en el manejo de lesiones preneoplásicas y particularmente en el manejo de NIC I, que es, como se sabe, la expresión de infección sin manifestación real de daño celular.
Este estudio muestra que la vacunación sumada a la tamización ahorraría recursos a largo plazo, debido a la disminución en el gasto de tratar lesiones preneoplásicas y neoplásicas del cuello uterino y donde el mayor ahorro se daría en torno a las primeras. Sin embargo, el ahorro inicia después de 20 años de implementado el programa, indicando que se debe disponer de recursos adicionales que garanticen la sostenibilidad de la implementación por un periodo prolongado de tiempo. Los resultados también revelan que sería posible acortar el tiempo en el que se empieza a producir el ahorro si se reducen los costos de la tamización, lo que de hecho ocurriría de forma inmediata si dicha reducción es igual o superior al 20%.
Este análisis no consideró alternativas de tamización diferentes de la citología, pero sería esperable que la introducción de pruebas de VPH como base de la tamización trajera un ahorro significativo por la ampliación de los intervalos de tamización, la reducción en la prevalencia de lesiones preneoplásicas y la reducción en las remisiones a colposcopia en el mediano plazo entre otras características6.
A diferencia de lo observado con el efecto temporal del costo de la tamización, el costo de la vacuna tendría mayor impacto en la magnitud del ahorro que en el tiempo del mismo; sin embargo, una reducción equivalente al 66% del costo para el periodo de análisis (COP$ 23.700) generaría un adelanto importante en la aparición del ahorro a la vez que incrementaría sustancialmente la magnitud del mismo, efecto que podría obtenerse parcialmente con la reducción en el número de dosis.
Esta vacuna se aplica en población adolecente que se puede negar a participar en un programa de este tipo, generando un desperdicio de recursos si no se alcanzan las coberturas adecuadas.
En los análisis de sensibilidad se observó que la cobertura no modificaba en gran medida el tiempo de inicio del ahorro, pero sí, la magnitud de este. Por lo tanto, para la vacuna contra el VPH debido a su potencial efecto de rebaño, se deberían realizar estudios para determinar la cobertura efectiva ya que no se requiere alcanzar una cobertura del 100% para obtener los efectos deseados en disminución de la carga de las lesiones preneoplásicas y neoplásicas del cuello uterino.
Los cambios demográficos y sociales experimentados por Colombia han modificado la estructura por edades de la población, lo cual muestra un aumento en el grupo mayor de 60 años, que sumado al crecimiento de la población, explicaría en dos terceras partes el aumento de la carga por cáncer en el país36. Sin embargo, para el caso de cáncer de cuello uterino se tiene la particularidad que el riesgo se asocia a los comportamientos sexuales, que son impredecibles pues dependen del contexto de la época donde estos se observen37. Debido a la incertidumbre, se decidió realizar una estimación conservadora de la carga, asumiendo que no había cambios en la estructura por edades de las mujeres y que las tasas de incidencia de lesiones solo se modificarán por la vacunación de cohortes sucesivas de mujeres de 12 años. La direccionalidad en la estimación es impredecible, puede que la carga baje, por la disminución en el número de mujeres, sin embargo, puede aumentar a pesar de esta disminución por el cambio a comportamientos sexuales de mayor riesgo.
Este estudio tiene varias limitaciones y una de ellas corresponde al uso de modelos para estimar la carga de enfermedad. Desafortunadamente en Colombia no existen registros de la carga debida a lesiones preneoplásicas del cuello uterino así como tampoco información sobre la positividad de la citología, por lo que resultó necesario usar modelos de simulación para estimar dicha carga. A pesar de dicha limitación, el modelo fue validado con datos de mortalidad e incidencia de cáncer de cuello uterino publicados para Colombia, mostrando un ajuste adecuado frente al riesgo de enfermar y morir por esta causa.
Otra limitación corresponde al hecho de no incluir enfermedades no cervicales relacionadas con el VPH como el cáncer de pene y orofaringe y las verrugas genitales, entre otras. No obstante, la principal enfermedad relacionada al VPH y, en consecuencia, la que genera mayor carga corresponde a las lesiones preneoplásicas y neoplásicas del cuello uterino. Por este motivo, se considera que la inclusión de las otras enfermedades no cambiaría el sentido de los resultados, debido a que el ahorro sería mayor y ocurría en menor tiempo al estimado.
Los resultados tienen implicaciones para la práctica, ya que muestran que a pesar de las claras ventajas en términos de costo-efectividad por año de vida ganado, la implementación de este tipo de programas requiere de recursos adicionales que garanticen su sostenibilidad y la obtención de resultados en el largo plazo. Es importante resaltar que el análisis se realizó con las alternativas de vacunación existentes a la fecha que implican una cobertura de tipos virales restringida y tres dosis de vacuna; la existencia de nuevas alternativas que reducen el número de dosis o la aparición de vacunas con mayor cobertura de tipos virales podrían modificar de manera importante los resultados en el sentido en que ha sido descrito para los costos de vacunación y el efecto de la protección cruzada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.