Se presentan dos casos clínicos de pacientes con leucemia mieloide crónica en fase acelerada, hospitalizados para inicio de terapia dirigida con inhibidores de tirosina cinasa (dasatinib). Posteriormente se determina la presencia de sangrado intraparenquimatoso a sistema nervioso central. Para finalizar, se revisa la literatura disponible a cerca de eventos adversos tipo sangrado asociados a dasatinib y los posibles condicionantes de este desenlace.
Two clinical cases are presented on patients with chronic myeloid leukaemia in accelerated phase, who were admitted to hospital for initiation of targeted therapy with tyrosine kinase inhibitors (Dasatinib). Intraparenchymal bleeding in the central nervous system was subsequently observed. A review was also made on the available literature on bleeding-related adverse events associated with Dasatinib and the possible determining factors of this outcome.
La leucemia mieloide crónica (LMC) es un desorden neoplásico de origen clonal que deriva de la presencia del oncogén BCR-ABL1 (Breakpoint cluster region-Abelson murine leukemia). La alteración molecular reconocida obedece a una translocación recíproca t(9;22) (q34, q11) que se logra determinar en más del 95% de los casos de LMC1. De acuerdo al sitio de ruptura en el gen BCR se pueden formar tres tipos de proteínas de mayor a menor frecuencia p210, p190 y p230. Esta proteína resultante posee actividad tirosina cinasa y favorece la proliferación y mecanismos antiapotóticos de la línea mieloide2.
En la LMC se reconocen tres fases: crónica, acelerada y blástica. Al inicio, una fase crónica donde se diagnostica más del 90% de los pacientes, siendo hasta el 40% de ellos asintomáticos, detectados a través de pruebas de chequeo médico, como rasgo característico se evidencia una preservación en la maduración del componente granulocítico, leucocitosis, trombocitosis, basofilia menor al 20% en sangre periférica y conteo de blastos menor a 10% en sangre periférica o medula ósea3.
Acorde al curso natural de la enfermedad, se ha precisado una fase acelerada que se caracteriza por la manifestaciones clínicas y paraclínicas de progresión de la enfermedad; así, es posible reconocer aumento de la esplenomegalia, compromiso de otras líneas celulares, trombocitosis mayor a 1.000 Cel x 109/L, trombocitopenia menor a 100 Cel x 109/L e incremento del conteo de blastos (10% a 19%) en medula ósea y sangre periférica, pudiendo generarse esta fase con o sin tratamiento activo3.
Por otra parte, se ha establecido una fase blástica que corresponde a la pérdida de la capacidad de diferenciación de las células afectadas, con presencia de más del 20% de blastos en sangre periférica o medula ósea, así como a la proliferación blástica extramedular. En el 70% de los casos se identifican blastos de inmunofenotipo mieloide contra un 30% aproximadamente de origen linfoide3.
El reconocimiento de las alteraciones moleculares puntuales ha favorecido la generación de medicamentos con capacidad para bloquear de forma específica la función de la proteína derivada de la mutación BCR-ABL1. De manera que, medicamentos como imatinib favorecen la inactivación de la tirosina cinasa, impidiendo su unión con el ATP (adenosin trifosfato), alterando la cascada de señalización intracelular y por tal razón estimulando a la baja la proliferación y los mecanismos antiapoptóticos4.
Otros medicamentos denominados de segunda generación como nilotinib y dasatinib tienen mecanismos de acción que le confieren a estas moléculas una mayor actividad biológica y se propusieron en primera instancia para pacientes con resistencia o intolerancia a imatinib. En la actualidad, se cuenta evidencia clínica suficiente que ha permitido que los inhibidores de tirosina cinasa o TKI's (Tirosine-Kinase Inhibitors, por sus siglas del inglés) puedan ser ofrecidos en primera línea de tratamiento5.
La terapia con TKI's mejora los resultados de tratamiento en LMC, al punto que se han descrito tasas de supervivencia global similares a la población general6. Sin embargo, múltiples efectos adversos a corto plazo han sido objetivados en los diferentes ensayos clínicos realizados, que van desde alteraciones cardiovasculares y neuromusculares, así como retención de líquidos, citopenias hematológicas y alteraciones hemorrágicas principalmente del tracto gastrointestinal7–9. Por otro lado, efectos adversos a largo plazo como complicaciones cardiopulmonares impactan en la elección del tratamiento10.
En el presente trabajo se analizan dos casos clínicos asociados al inicio de dasatinib en evidencia de enfermedad no controlada y desenlace de sangrado intraparenquimatoso a sistema nervioso central, siendo esta una complicación fatal por el riesgo potencial de mortalidad que genera y la morbilidad asociada.
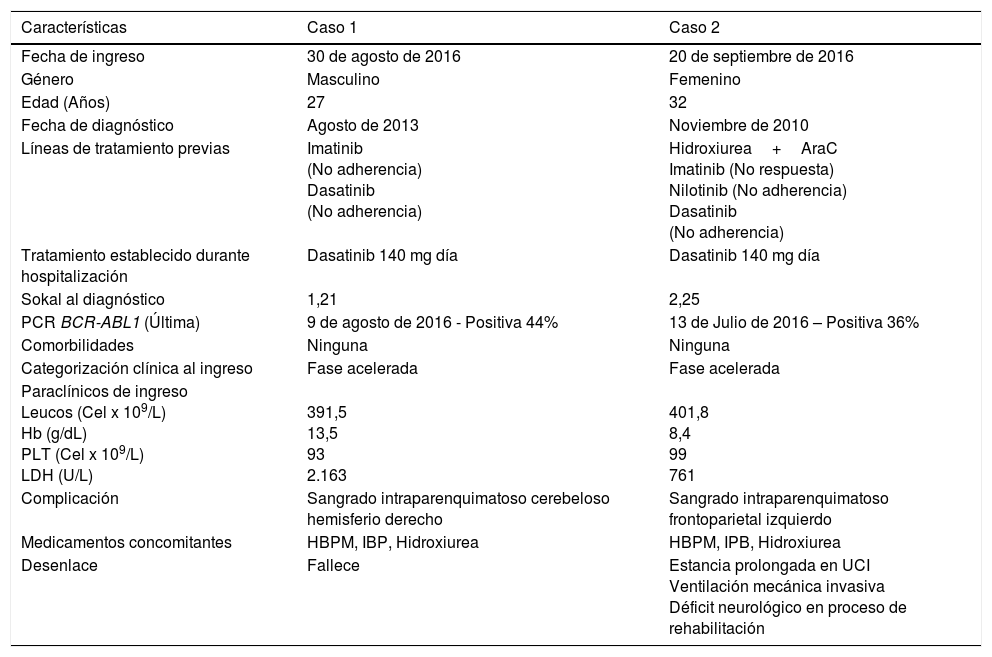
Presentación de casos clínicosLas características demográficas, clínicas y paraclínicas para cada uno de los pacientes se presentan en la tabla 1.
Características clínicas y paraclínicas de los pacientes presentados
| Características | Caso 1 | Caso 2 |
|---|---|---|
| Fecha de ingreso | 30 de agosto de 2016 | 20 de septiembre de 2016 |
| Género | Masculino | Femenino |
| Edad (Años) | 27 | 32 |
| Fecha de diagnóstico | Agosto de 2013 | Noviembre de 2010 |
| Líneas de tratamiento previas | Imatinib (No adherencia) Dasatinib (No adherencia) | Hidroxiurea+AraC Imatinib (No respuesta) Nilotinib (No adherencia) Dasatinib (No adherencia) |
| Tratamiento establecido durante hospitalización | Dasatinib 140 mg día | Dasatinib 140 mg día |
| Sokal al diagnóstico | 1,21 | 2,25 |
| PCR BCR-ABL1 (Última) | 9 de agosto de 2016 - Positiva 44% | 13 de Julio de 2016 – Positiva 36% |
| Comorbilidades | Ninguna | Ninguna |
| Categorización clínica al ingreso | Fase acelerada | Fase acelerada |
| Paraclínicos de ingreso Leucos (Cel x 109/L) Hb (g/dL) PLT (Cel x 109/L) LDH (U/L) | 391,5 13,5 93 2.163 | 401,8 8,4 99 761 |
| Complicación | Sangrado intraparenquimatoso cerebeloso hemisferio derecho | Sangrado intraparenquimatoso frontoparietal izquierdo |
| Medicamentos concomitantes | HBPM, IBP, Hidroxiurea | HBPM, IPB, Hidroxiurea |
| Desenlace | Fallece | Estancia prolongada en UCI Ventilación mecánica invasiva Déficit neurológico en proceso de rehabilitación |
AraC: citarabina, PCR: reacción en cadena de la polimerasa, HBPM: heparinas de bajo peso molecular, IBP: inhibidores de la bomba de protones, UCI: Unidad de Cuidados Intensivos.
Como características comunes, ambos pacientes ingresaron al servicio de urgencias de un centro de referencia para pacientes oncológicos por deterioro sintomático refiriendo nula adherencia al tratamiento con TKI's, se determinó por valoración clínica y paraclínica fase acelerada de su enfermedad y se decidió establecer terapia citorreductora con hidroxiurea con plan de dosificación a titular acorde a respuesta, asociada a dasatinib, a dosis de 140mg cada día.
Dentro del tratamiento concomitante se ordenó gastroprofilaxis con omeprazol a dosis de 20mg cada día, así como tromboprofilaxis con heparinas de bajo peso molecular (HBPM), específicamente dalteparina a dosis de 5.000 UI subcutánea cada día.
Una vez establecido el manejo farmacológico previamente anotado, se precisó para el Caso 1: las 72 horas posteriores al inicio de tratamiento integral sintomatología consistente con cefalea con signos de alarma. Igualmente, en el Caso 2: las 48 horas posteriores al inicio del tratamiento establecido se anotan cambios en la sintomatología de ingreso con asocio de cefalea con signos de alarma con imágenes por tomografía axial computarizada con hallazgos anotados en la tabla 1 y detallados en figuras 1 y 2.
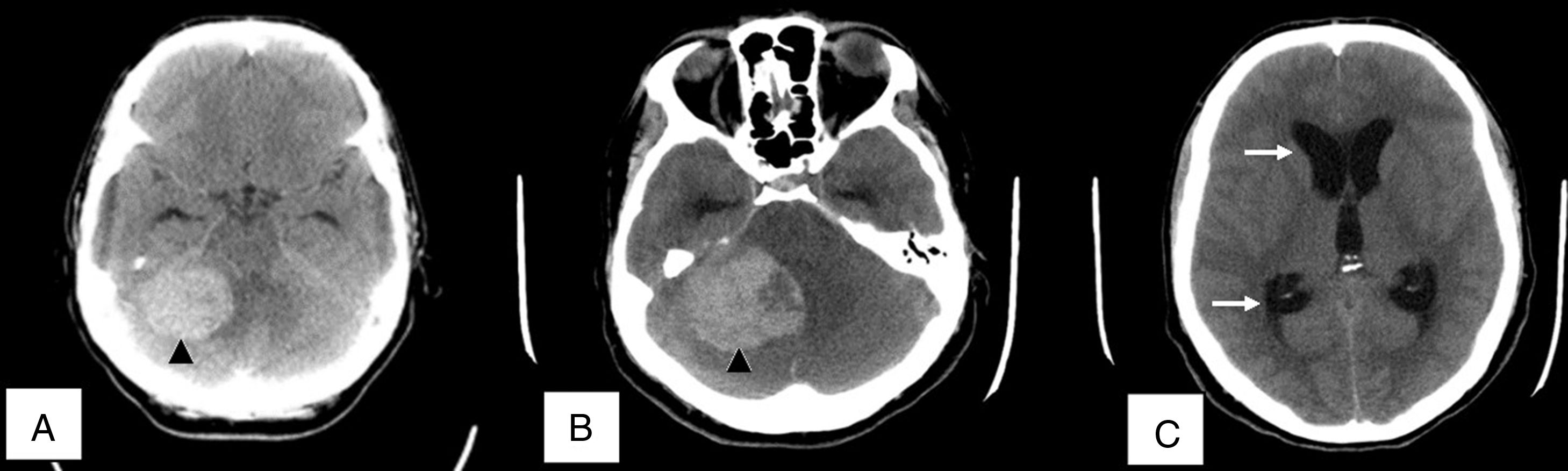
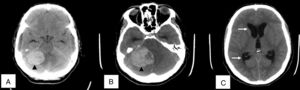
A. B. Imágenes de tomografía axial computarizada que demuestran sangrado a sistema nervioso central de localización cerebelosa (cabezas de flecha en color negro), apreciándose efecto de masa y obliteración parcial del IV ventrículo. C. Imagen de control 24 horas posteriores de ingreso a UCI que presentan progresión de sangrado, con imágenes de hidrocefalia aguda no comunicante (flechas de color blanco) además de edema cerebral difuso.
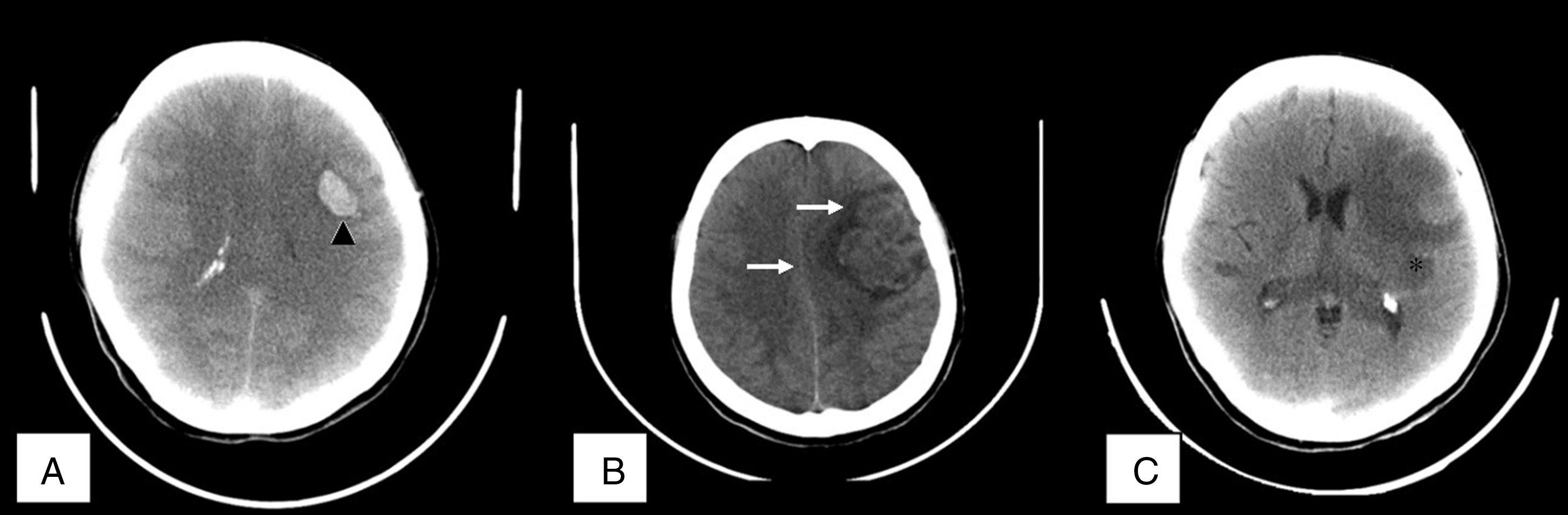
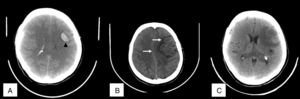
A. Tomografía axial computarizada que evidencia sangrado intraparenquimatoso frontoparietal izquierdo (cabezas de flecha en color negro), asociado a edema cerebral difuso. B. Cortes que demuestran adecuada reabsorción del sangrado con persistencia moderada de edema cerebral y leve desplazamiento de línea media (flechas de color blanco). C. Cortes tomados de control demostrando disminución marcada del edema cerebral (asterisco en color negro).
Dentro de las conductas tomadas una vez se determinan los hallazgos en el sistema nervioso central se destacan, el traslado inmediato a la Unidad de Cuidados Intensivos, el establecimiento de las estrategias de neuroprotección, aseguramiento de la vía aérea por deterioro respiratorio y suspensión de la medicación con riesgo de incrementar el sangrado; incluyendo dasatinib.
Otras pruebas de valoración de la hemostasia como tiempo de protrombina y tromboplastina no aportaron resultados para justificar cambios en el tratamiento. No se realizaron pruebas de agregabilidad plaquetaria.
No se consideró el uso de soporte transfusional dentro del tratamiento de los pacientes.
La evolución clínica de los pacientes acá presentados evidencia muerte encefálica a las 24 horas para el paciente del Caso 1, así como intubación prolongada (10 días) para el Caso 2, donde presenta neumonía asociada a la ventilación mecánica, terapia antimicrobiana de amplio espectro, adicionalmente, se configura cuadro de celulitis del antebrazo derecho que recibió manejo médico. Posteriormente, en la continuidad de la hospitalización se pudo corroborar para el paciente del Caso 2 secuelas neurológicas, actualmente en neurorrehabilitación y con restablecimiento del tratamiento establecido de forma ambulatoria con dasatinib a dosis de 140mg cada día, presentando respuesta hematológica favorable a las 4 semanas de tratamiento continuo.
DiscusiónEl modelo de estudio de la LMC ha permitido un avance significativo en términos de la concepción de terapia dirigida. De hecho, se ha cambiado el paradigma de manejo del cáncer al considerar la manipulación específica de la alteración genética responsable de la patología neoplásica en cuestión. Sin embargo, estas estrategias de manejo no están 100% libres de presentar efectos adversos. Tan así, que un bajo porcentaje de estos efectos adversos llegan a limitar la terapia con inhibidores de tirosina cinasa10.
Conocer los perfiles de seguridad de cada uno de los inhibidores de tirosina cinasa es la propuesta de diferentes autores, con el ánimo de garantizar mejores desenlaces, una vez se realice un balance riesgo-beneficio de acuerdo al contexto clínico del paciente.
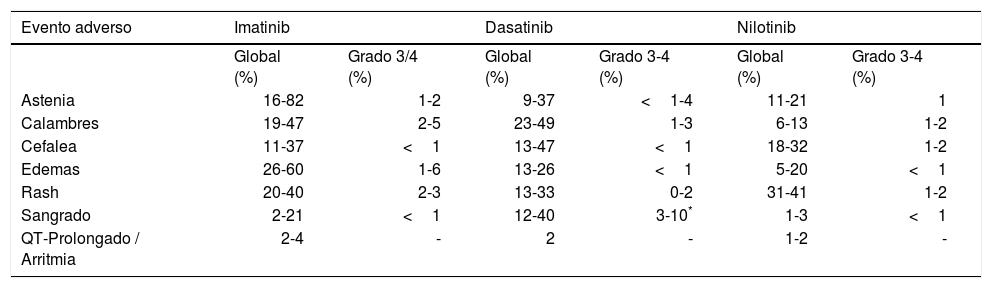
Dentro de los eventos adversos de presentación temprana se encuentran los datos colectados en la tabla 2, los grados de severidad de reacciones adversas a medicamentos se presentan con base a las recomendaciones del National Cancer Institute (NCI)11.
Compilado de reacciones adversas tempranas en diferentes estudios con TKI's
| Evento adverso | Imatinib | Dasatinib | Nilotinib | |||
|---|---|---|---|---|---|---|
| Global (%) | Grado 3/4 (%) | Global (%) | Grado 3-4 (%) | Global (%) | Grado 3-4 (%) | |
| Astenia | 16-82 | 1-2 | 9-37 | <1-4 | 11-21 | 1 |
| Calambres | 19-47 | 2-5 | 23-49 | 1-3 | 6-13 | 1-2 |
| Cefalea | 11-37 | <1 | 13-47 | <1 | 18-32 | 1-2 |
| Edemas | 26-60 | 1-6 | 13-26 | <1 | 5-20 | <1 |
| Rash | 20-40 | 2-3 | 13-33 | 0-2 | 31-41 | 1-2 |
| Sangrado | 2-21 | <1 | 12-40 | 3-10* | 1-3 | <1 |
| QT-Prolongado / Arritmia | 2-4 | - | 2 | - | 1-2 | - |
En las casillas se especifica para cada medicamento el total de eventos adversos reportados, y se amplía la información con respecto a las calificadas como grado 3-4.
Mayor prevalencia de sangrados grados 3-4. Modificada y adaptada de referencia 10. Los grados de presentación clínica hacen referencia a los criterios comunes de toxicidad del NCI11.
Al analizar conjuntamente los casos expuestos se puede observar que cumplen algunas características desde el punto de vista del comportamiento clínico y de tratamiento. Así, se debe resaltar que son pacientes jóvenes, que se encuentran en la tercera y cuarta década de la vida respectivamente, en quienes a pesar de tener más de dos años de diagnóstico, no han llegado a recibir de forma continua el tratamiento con inhibidores de tirosina cinasa, de acuerdo con registros clínicos, por la existencia de barreras en la entrega de la medicación por parte de su aseguradora. Además, en el seguimiento hematológico por pruebas moleculares no se alcanza la respuesta hematológica, ni respuesta molecular propuestas como meta terapéutica en pacientes con LMC12.
Con lo anterior, estos pacientes presentan un riesgo elevado de progresión en su enfermedad, corroborado por ingresar en condición clínica de fase acelerada, donde se establecen medidas de citorreducción, en particular la combinación de dasatinib e hidroxiurea llamando la atención el deterioro clínico, con evidencia de sangrado a sistema nervioso central que se presenta de forma tan temprana en tan solo 72 y 48 horas respectivamente del inicio de tratamiento.
La suspensión de los medicamentos asociados al sangrado, en conjunto con la estabilización clínica en el Caso 2, permitió el reinicio de dasatinib, donde la vigilancia clínica posterior descartó nuevos episodios de sangrado.
De forma interesante se debe determinar que dentro de los efectos adversos comentados en la tabla 2, hay una mayor proporción para los eventos de sangrado con dasatinib, incluyendo hasta un 10% de pacientes con sangrado grado 3-4 del NCI. De igual forma, se ha precisado mediantes estudios in vitro, la capacidad antiagregante que tiene dasatinib (independiente de los conteos plaquetarios) frente a otros TKI's para pruebas de función plaquetaria como PFA-100® y agregometría plaquetaria (con las pruebas de agonistas: ácido araquidónico y epinefrina)13.
Estas alteraciones en la función plaquetaria se han observado en otros TKI's, reportando prolongación en el tiempo de cierre medido mediante PFA-100® en pacientes que iniciaron ponatinib al ser considerados refractarios a terapias con TKI's previas14.
No se conoce con exactitud el mecanismo que favorece la alteración en la agregabilidad plaquetaria con el uso de medicamentos como dasatinib o ponatinib. Sin embargo, bien se conoce que dentro del mecanismo de acción del dasatinib, más allá de la inhibición del ABL, se compromete la función de otras cinasas, dentro de ellas, la familia SRC (SRC, LCK, HCK, YES, FYN, FGR, BLK, LYN, FRK), C-KIT y PDGFR-a y b, que impactan indirectamente en la función de agregación plaquetaria15. De igual forma, se ha sugerido que la inhibición de ciertas cinasas como SFK, LYN y FYN (importantes en la activación plaquetaria), se inhiben en los pacientes con ponatinib16.
El sangrado a sistema nervioso central se comporta como una complicación mayor. En los pacientes presentados esta condición derivó en uso de ventilación mecánica invasiva, predisposición a infecciones asociadas al cuidado de la salud, estancia en UCI y hospitalización prolongada, secuelas neurológicas que impactan negativamente en la calidad de vida. Por otro lado, la complicación con mayor fatalidad, evidenciada en el desenlace del Caso 1, quien fallece por hipertensión endocraneana en las primeras 14 horas de ingreso a UCI.
Dentro de las condiciones clínicas que se han llegado a asociar a manifestaciones hemorrágicas asociadas al uso de dasatinib, se ha encontrado el estado evolutivo de la LMC, donde se ha reportado que la prevalencia de sangrado oscila desde 12% para la fase crónica, incrementándose a 32% y 35% para la fase acelerada y blástica respectivamente8. Con lo anterior, los análisis multivariados han llegado a proponer a las fases avanzadas de la enfermedad y la trombocitopenia como los factores de mayor riesgo para presentar manifestaciones de sangrado grados 3-413.
Se ha reportado que los eventos de sangrado más frecuentes son los localizados en tracto gastrointestinal, la severidad de los mismos se localiza en grados 2-3, donde se ha visto beneficio del retiro transitorio del medicamento con una medias de hasta 17 días, adicional a soporte transfusional13. No es clara la directriz de tratamiento a establecer en los pacientes comentados, sin embargo, se debe considerar la suspensión transitoria del medicamento, evitar la exposición a otros medicamentos con capacidad de alterar la hemostasia (por ejemplo, heparinas, antiinflamatorios no esteroideos, otros anticoagulantes), medidas de neuroprotección en cuidado crítico, así como el soporte transfusional de plaquetas considerando la disfunción en la agregación favorecida por el medicamento.
Con los casos aquí presentados se confirma que la adherencia subóptima en el tratamiento de la LMC en fase crónica favorece la progresión a estados más avanzados de la enfermedad y con ello un efecto global deletéreo sobre los costos del sistema de salud y morbimortalidad. Se deben conocer las condiciones que alteran la adherencia para incidir positivamente en ellas y así prevenir desenlaces adversos17. El impacto clínico negativo de las interrupciones en la terapia con ITK's ha sido analizado en población colombiana, reafirmando la necesidad de documentar detalladamente el perfil de adherencia de cada paciente, así como la importancia del papel de las aseguradoras de salud, en aras de lograr un adecuado suministro de los medicamentos18.
En conclusión, la LMC obedece a la presencia de una alteración citogenética puntual, donde el tratamiento con terapias diana como los ITK's han modificado su comportamiento clínico. Se deben conocer los potenciales efectos adversos de estas terapias, así como las condiciones clínicas en las que se pueden llegar a presentar efectos adversos que amenacen la vida de los pacientes. Con dasatinib se han evidenciado mayores tasas de sangrado grados 3-4, especialmente en fase acelerada y blástica, máxime con la presencia de trombocitopenia. El tratamiento comprende el retiro del medicamento, evitar ofrecer otros medicamentos que alteren la hemostasia y el soporte transfusional. Para pacientes en tratamiento ambulatorio se destaca la importancia del seguimiento continuo para identificar y tratar problemas de la adherencia a los ITK's en aras de evitar deterioro de la calidad de vida e incremento en la morbimortalidad.
Fuente de financiaciónNinguna.
Conflicto de interesesLos autores del presente trabajo declaran que no tienen ningún conflicto de intereses.
Infinitos agradecimientos a los pacientes, personal Médico y de Enfermería del servicio de Hematología del Instituto Nacional de Cancerología.