La hipercalcemia maligna mediada por péptido relacionado con hormona paratiroidea (PR-PTH) es una manifestación poco común en tumores neuroendocrinos. Presentamos dos pacientes con tumores neuroendocrinos de páncreas con metástasis a hígado pero sin compromiso óseo en quienes se evidenció hipercalcemia maligna asociada a elevación de PR-PTH, con PTH suprimida. En ambos casos se logró normalizar temporalmente la calcemia con el uso de análogos de somatostatina, pero durante la evolución se requirió adición de bisfosfonatos en uno de ellos.
Con la discusión de estos casos, la revisión de la literatura y de los casos similares publicados esperamos contribuir al mejor conocimiento de esta enfermedad.
Parathyroid hormone-related peptide-mediated hypercalcaemia (PTH-rp) is rare in patients with neuroendocrine tumours. The clinical cases are thus presented on two patients with pancreatic neuroendocrine tumours with liver metastases, but without bone involvement and with hypercalcaemia associated with elevated PTH-rp and with PTH suppressed. In both cases, it was possible to temporarily bring the calcium levels back to normal with the use of somatostatin analogues, but during the course of the disease, the addition of bisphosphonates was required in one of them.
With the discussion of these cases and the review of the literature and similar published cases, it is hoped to contribute to provide better knowledge of this disease.
La hipercalcemia es un problema frecuente en las neoplasias malignas, se puede encontrar hasta en un 10% de los pacientes con cáncer en estado avanzado1–3, pero es un fenómeno raro en los pacientes con tumores neuroendocrinos (TNE), en los cuales la hipercalcemia puede presentarse como resultado de tres procesos: por secreción de factores humorales por parte del tumor, de los cuales el más común es el péptido relacionado con la hormona paratiroidea (PR-PTH); por factores locales secretados por el tumor en el hueso y, de manera indirecta, como consecuencia del hiperparatiroidismo primario asociado al síndrome de neoplasia endocrina múltiple tipo 11.
El síndrome de hipercalcemia maligna fue descrito por primera vez en 1940 por Albright con el caso de un paciente con carcinoma renal4 pero el PR-PTH pudo ser identificado solamente hasta el año 1987. Este péptido comparte homología significativa en los primeros 13 residuos de aminoácidos del extremo amino-terminal, que se une al mismo receptor de la PTH en el hueso y el riñón y cumple un papel importante en el desarrollo óseo embrionario, siendo responsable de la formación normal de hueso endocondral y de la proliferación controlada del cartílago en la placa de crecimiento4. El PR-PTH es secretado en el cerebro, hipófisis, tiroides, paratiroides, corteza y médula adrenales, mucosa gástrica, islotes pancreáticos, tejido mamario estimulado por la prolactina y la piel con funciones inciertas o hasta el momento desconocidas en dichos órganos4,5.
Debido a su similitud con la PTH, presenta un efecto similar con respecto a sus acciones hipercalcemiantes con estimulación del transporte transepitelial del calcio en el túbulo proximal, también puede llevar a hipofosfatemia por la reducción de la reabsorción de fósforo en el túbulo distal. A diferencia de la PTH, no induce la hidroxilación renal de la vitamina D lo cual se explica por la carencia del extremo carboxilo terminal de la PTH3,4.
La producción de PR-PTH ha sido documentada en diferentes neoplasias tales como adenocarcinoma del páncreas exocrino; carcinomas de células escamosas de pulmón, cabeza y cuello, esófago, cérvix, vulva, piel; carcinoma de mama; carcinoma de células renales; carcinoma de vejiga, y en el linfoma de células T asociado a HTLV13–7.
A continuación presentamos dos casos clínicos de pacientes con tumor neuroendocrino que durante la evolución de la enfermedad presentaron hipercalcemia mediada por PR-PTH.
Caso 1Paciente de sexo masculino de 48 años de edad al momento del diagnóstico, a quien durante el estudio de la etiología de molestias abdominales de tipo distención y llenura fácil le realizaron una ultrasonografía de abdomen encontrando una masa sólida pancreática de 80mm de diámetro con dilatación del colédoco y varias lesiones hepáticas sospechosas de compromiso metastásico. Dichos hallazgos fueron corroborados por medio de imágenes por resonancia magnética con contraste. La biopsia percutánea de una de las lesiones hepáticas informó compromiso por una neoplasia neuroendocrina de grado histológico 2 (de la clasificación OMS 20108), con 2 mitosis por 10 campos de alto poder, con marcadores de inmunohistoquímica positivos para cromogranina, sinaptofisina, PAX8, receptor de progestágenos y negatividad para TTF1 y CDX2; el índice de proliferación por Ki67 fue calculado en 10%. La gammagrafía con análogo de somatostatina (Hynic-TOC) mostró captación del radiofármaco en la masa del páncreas y en las lesiones metastásicas hepáticas.
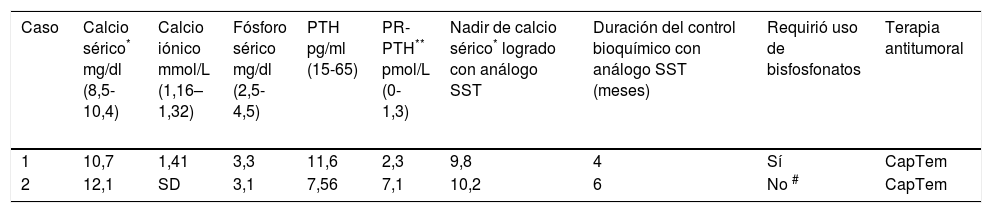
El paciente recibió tratamiento inicial con Octreotide LAR 20mg cada 28 días por vía intramuscular. El paciente consultó a nuestra institución transcurridos 3 meses de terapia y la revaloración del caso confirmó los hallazgos mencionados, y una respuesta tumoral de enfermedad estable en la evaluación por imágenes de resonancia magnética; sin embargo, en ese momento se documentó hipercalcemia con valores suprimidos de PTH intacta confirmando la presencia de hipercalcemia no mediada por PTH. Los niveles plasmáticos de PR-PTH estuvieron por encima del rango de referencia confirmando así hipercalcemia mediada por PR-PTH. Los resultados de los paraclínicos se muestran en la tabla 1. Se decidió aumentar la dosis de Octreotide LAR a 30mg cada 28 días con el propósito de controlar la secreción de PR-PTH con una buena respuesta inicial, como se muestra en la tabla 1. No obstante, la duración de esta respuesta duró únicamente 4 meses, al cabo de los cuales se documentó nueva elevación del calcio sérico, a pesar de no documentar progresión tumoral en las imágenes de resonancia magnética. Se discutió el caso en una junta multidisciplinaria y se decidió dar tratamiento con quimioterapia (capecitabina + temozolomida) con el objetivo de lograr citorreducción tumoral para luego brindar manejo quirúrgico posterior. Además, se adicionó ácido ibandrónico 6mg intravenosos cada 3 meses con el propósito de controlar la hipercalcemia. La evaluación al tercer ciclo de quimioterapia mostró enfermedad tumoral estable y adecuado control bioquímico con calcemia dentro de rangos normales.
Características bioquímicas al diagnóstico y evolución con los tratamientos
| Caso | Calcio sérico* mg/dl (8,5-10,4) | Calcio iónico mmol/L (1,16– 1,32) | Fósforo sérico mg/dl (2,5- 4,5) | PTH pg/ml (15-65) | PR-PTH** pmol/L (0-1,3) | Nadir de calcio sérico* logrado con análogo SST | Duración del control bioquímico con análogo SST (meses) | Requirió uso de bisfosfonatos | Terapia antitumoral |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 10,7 | 1,41 | 3,3 | 11,6 | 2,3 | 9,8 | 4 | Sí | CapTem |
| 2 | 12,1 | SD | 3,1 | 7,56 | 7,1 | 10,2 | 6 | No # | CapTem |
SD: Sin datos; Pr-PTH: Péptido relacionado con la PTH; ASS: Análogo de somatostatina; CapTem: Quimioterapia con capecitabina y temozolomida. # Se usó una dosis de bsfosfonatos sin respuesta.
Paciente de 77 años con historia de dolor abdominal y distensión abdominal de 2 meses de evolución, quien presentó un episodio de hemorragia de vías digestivas altas documentándose por gastroscopia una lesión ulcerada duodenal clasificada como Forrest Ib. Se le practicó una tomografía computarizada de abdomen con contraste que mostró una masa en la cabeza del páncreas con extensión al hilio hepático de 130mm de diámetro mayor y múltiples lesiones nodulares en el hígado sospechosas de compromiso metastásico, con lesiones dominantes en los segmentos IV y III, de 83 y 72mm de diámetro mayor, respectivamente. La biopsia percutánea de una de las lesiones hepáticas fue reportada como positiva para compromiso por carcinoma neuroendocrino de grado histológico 3 (Clasificación OMS 2010) con inmunohistoquímica positiva para sinaptofisina y cromogranina y negativa para TTF-1 y CDX2. El índice de proliferación por Ki67 fue estimado en 25%. Se le realizó una tomografía por emisión de positrones (PET) con Galio 68 – Octreotide-DotaToc que fue positiva para sobreexpresión de receptores de somatostatina en la masa pancreática, en las lesiones de ambos lóbulos hepáticos y en retroperitoneo (adenomegalias). También se realizó una PET con 18-F-FluorDesoxi Glucosa que mostró hipermetabolismo en la lesión pancreática y en las lesiones metastásicas hepáticas.
La junta multidisciplinaria decidió iniciar tratamiento con quimioterapia (capecitabina- temozolomida). Al tercer ciclo de quimioterapia se documentó hipercalcemia moderada con PTH suprimida, como se resume en la tabla 1. La respuesta tumoral valorada por tomografías hasta ese momento fue clasificada como enfermedad estable (reducción del tamaño de las lesiones principales en aproximadamente el 22%, que no cumple criterios para considerar una respuesta parcial) razón por la cual se continuó con el esquema de quimioterapia, pero se indicó tratamiento adicional con ácido zoledrónico 4mg intravenosos con el objetivo controlar hipercalcemia, sin adecuada respuesta, con persistencia de calcio sérico por encima del límite superior luego de 15 días de la aplicación. La determinación de niveles plasmáticos de PR-PTH confirmó un origen humoral de la hipercalcemia, y se adicionó octreotide 30mg vía intramuscular cada 28 días y con ello se logró mantener los valores de calcio dentro de límites normales. La respuesta tumoral al sexto ciclo de quimioterapia fue catalogada como de enfermedad estable, con adecuado control bioquímico.
DiscusiónLa presentación de hipercalcemia maligna humoral es poco frecuente en los pacientes con tumores neuroendocrinos describiéndose una asociación del 1% o menos1,7,9. El momento de la presentación es muy variable, encontrándose desde los 4 meses hasta 12 años luego del diagnóstico1,7,10. En nuestros 2 casos la hipercalcemia se documentó aproximadamente a los 6 meses luego del diagnóstico histopatológico, pero no hay determinaciones previas de calcio sérico que permitan concluir el tiempo exacto del desarrollo de la hipercalcemia.
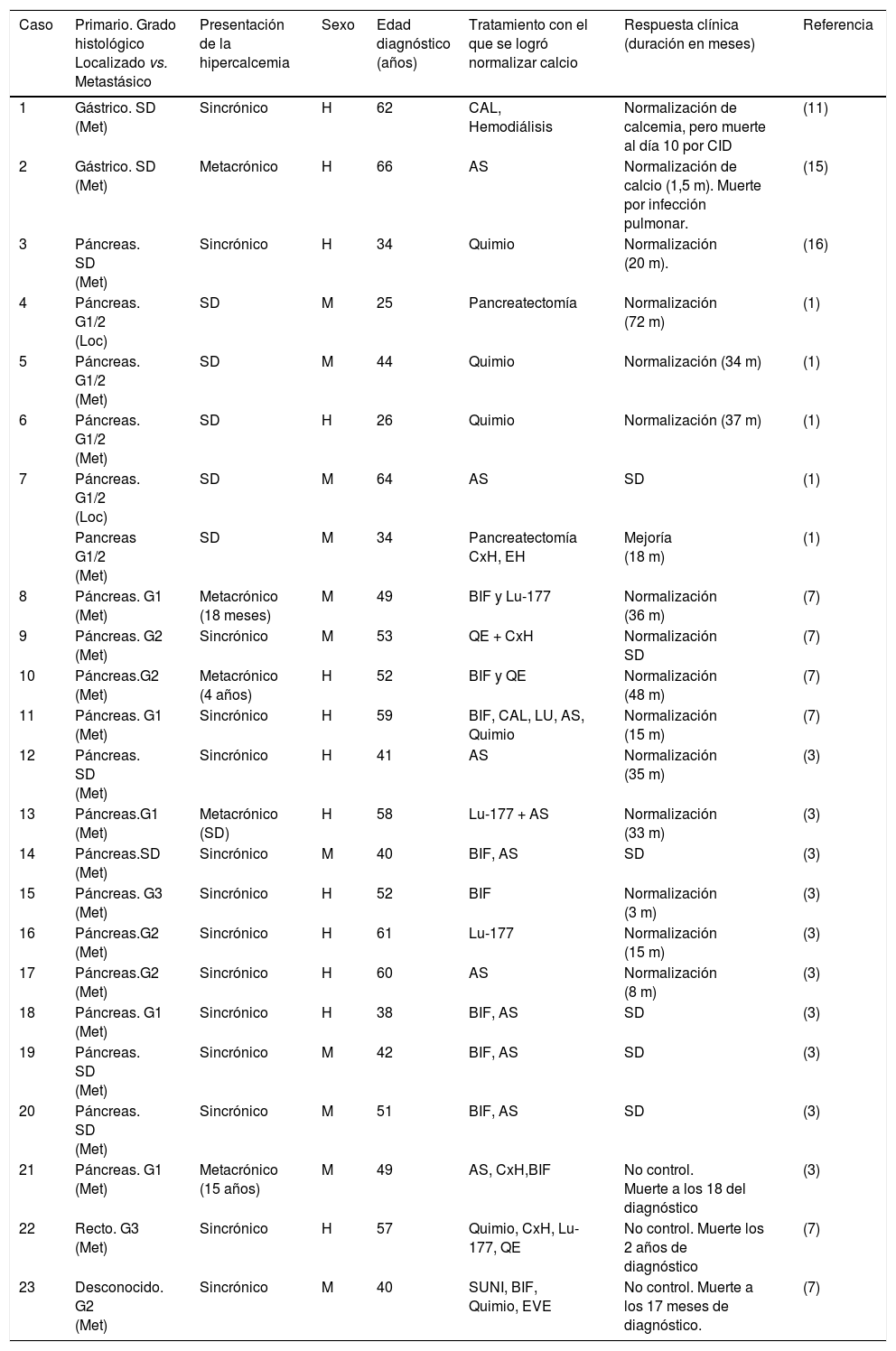
Los sitios primarios más frecuentes descritos en TNE en la literatura son páncreas, estómago y recto en orden descendente (ver tabla 2) y la mayoría de los casos han sido tumores de bajo grado histológico, aunque también se han descrito casos de alto grado histológico como uno de los 2 casos presentados en nuestro reporte7,11.
Resumen de las características de algunos de los casos de pacientes con TNE productores de PR-PTH reportados
| Caso | Primario. Grado histológico Localizado vs. Metastásico | Presentación de la hipercalcemia | Sexo | Edad diagnóstico (años) | Tratamiento con el que se logró normalizar calcio | Respuesta clínica (duración en meses) | Referencia |
|---|---|---|---|---|---|---|---|
| 1 | Gástrico. SD (Met) | Sincrónico | H | 62 | CAL, Hemodiálisis | Normalización de calcemia, pero muerte al día 10 por CID | (11) |
| 2 | Gástrico. SD (Met) | Metacrónico | H | 66 | AS | Normalización de calcio (1,5 m). Muerte por infección pulmonar. | (15) |
| 3 | Páncreas. SD (Met) | Sincrónico | H | 34 | Quimio | Normalización (20 m). | (16) |
| 4 | Páncreas. G1/2 (Loc) | SD | M | 25 | Pancreatectomía | Normalización (72 m) | (1) |
| 5 | Páncreas. G1/2 (Met) | SD | M | 44 | Quimio | Normalización (34 m) | (1) |
| 6 | Páncreas. G1/2 (Met) | SD | H | 26 | Quimio | Normalización (37 m) | (1) |
| 7 | Páncreas. G1/2 (Loc) | SD | M | 64 | AS | SD | (1) |
| Pancreas G1/2 (Met) | SD | M | 34 | Pancreatectomía CxH, EH | Mejoría (18 m) | (1) | |
| 8 | Páncreas. G1 (Met) | Metacrónico (18 meses) | M | 49 | BIF y Lu-177 | Normalización (36 m) | (7) |
| 9 | Páncreas. G2 (Met) | Sincrónico | M | 53 | QE + CxH | Normalización SD | (7) |
| 10 | Páncreas.G2 (Met) | Metacrónico (4 años) | H | 52 | BIF y QE | Normalización (48 m) | (7) |
| 11 | Páncreas. G1 (Met) | Sincrónico | H | 59 | BIF, CAL, LU, AS, Quimio | Normalización (15 m) | (7) |
| 12 | Páncreas. SD (Met) | Sincrónico | H | 41 | AS | Normalización (35 m) | (3) |
| 13 | Páncreas.G1 (Met) | Metacrónico (SD) | H | 58 | Lu-177 + AS | Normalización (33 m) | (3) |
| 14 | Páncreas.SD (Met) | Sincrónico | M | 40 | BIF, AS | SD | (3) |
| 15 | Páncreas. G3 (Met) | Sincrónico | H | 52 | BIF | Normalización (3 m) | (3) |
| 16 | Páncreas.G2 (Met) | Sincrónico | H | 61 | Lu-177 | Normalización (15 m) | (3) |
| 17 | Páncreas.G2 (Met) | Sincrónico | H | 60 | AS | Normalización (8 m) | (3) |
| 18 | Páncreas. G1 (Met) | Sincrónico | H | 38 | BIF, AS | SD | (3) |
| 19 | Páncreas. SD (Met) | Sincrónico | M | 42 | BIF, AS | SD | (3) |
| 20 | Páncreas. SD (Met) | Sincrónico | M | 51 | BIF, AS | SD | (3) |
| 21 | Páncreas. G1 (Met) | Metacrónico (15 años) | M | 49 | AS, CxH,BIF | No control. Muerte a los 18 del diagnóstico | (3) |
| 22 | Recto. G3 (Met) | Sincrónico | H | 57 | Quimio, CxH, Lu-177, QE | No control. Muerte los 2 años de diagnóstico | (7) |
| 23 | Desconocido. G2 (Met) | Sincrónico | M | 40 | SUNI, BIF, Quimio, EVE | No control. Muerte a los 17 meses de diagnóstico. | (7) |
G1-3: Grado histológico (1, 2, 3) según clasificación OMS 2010; G1/2: Los datos proporcionados no se ajustan a clasificación OMS 2010, pero el índice de proliferación Ki67 fue menor 10%; Met: Metastásico; Loc: Localizado; H: Hombre; M: Mujer; CAL: Calcitonina; BIF: Bisfosfonatos; AS: Análogo de somatostatina; Quimio: Quimioterapia; QE: Quimioembolización; EH: Embolización hepática; RA: Radioablación; CxH: Cirugía de hepatectomia; Lu-177: Lutecio 177; SUNI: Sunitinib; EVE: Everolimus; CID: Coagulopatía intravascular diseminada.
La presencia de hipercalcemia se ha asociado a mal pronóstico en otros tipos de tumores y los niveles plasmáticos elevados de PR-PTH se correlacionaron con un mayor riesgo de desarrollo de metástasis óseas y una menor supervivencia5,12.
Las terapias para el control agudo de la hipercalcemia se basan en la hidratación con líquidos endovenosos isotónicos y en los casos de hipercalcemia moderada a severa (calcio colorimétrico > 12mg/dl), se requiere la adición de una terapia antirresortiva para proporcionar un control más duradero. Los bisfosfonatos son análogos del pirofosfato natural que forma el componente mineral del hueso, y su mecanismo de acción lo ejercen inhibiendo la enzima farnesildifosfato sintasa y de manera indirecta al proceso de geranil-geranilación de proteínas inhibiendo la resorción ósea mediada por el osteoclastos. El ácido zoledrónico a dosis de 4 mg intravenosos ha demostrado que es superior al pamidronato en el control de la hipercalcemia maligna13; sin embargo, la mayoría de los casos descritos en el presente artículo utilizaron pamidronato, posiblemente por la fecha de publicación. Se debe tener en cuenta la función renal del paciente, por cuanto el ácido zoledrónico requiere reducción de la dosis cuando la filtración glomerular es menor de 60ml/min y no debe usarse cuando es menor de 30ml/min. El ibandronato también es eficaz en el control de la hipercalcemia maligna y es una alternativa cuando la tasa de filtración glomerular es menor de 60ml/min, pero tampoco debe usarse cuando la tasa de filtración es menor de 30mg/ml y no tiene aprobación en Colombia para este propósito. En pacientes con deterioro de la función renal con tasa de filtración menor a 30ml/min o en casos de hipercalcemia refractaria a bisfosfonatos se ha descrito el uso de denosumab, un anticuerpo monoclonal dirigido contra el ligando RANK con eficacia antirresortiva, también ha demostrado ser una opción exitosa para el control de la hipercalcemia maligna a dosis de 120 mg por vía subcutánea6.
Los análogos de somatostatina empleados en el control de la secreción hormonal en la mayoría de los TNE secretores, han sido también empleados en la disminución de la producción de PR-PTH logrando control de la hipercalcemia3,7. Los tratamientos dirigidos a la reducción del volumen tumoral como la cirugía, la quimioterapia, la embolización arterial de las metástasis hepáticas o la terapia con radionúclidos, deben ser tenidas en cuenta en aquellos casos en los que hay progresión tumoral o mal control bioquímico con el uso de las medidas previamente mencionadas.
En la tabla 2 se presentan de manera resumida las características de los pacientes con TNE e hipercalcemia por PR-PTH y la respuesta bioquímica lograda con las diferentes terapias recibidas. Solamente en 4 casos se describió un control bioquímico con análogos de somatostatina, sin embargo, únicamente en uno de ellos el control fue duradero, sin requerir otras terapias. En los casos que nosotros reportamos, la respuesta a análogos fue transitoria en el primero y duradera en el segundo, no obstante ambos estuvieron con quimioterapia concomitante y en el caso 2 se registró una reducción del volumen tumoral del 22% que por criterios radiológicos RECIST 1.014 no permite ser catalogada como respuesta parcial, esa disminución de la carga tumoral funcional pudo haber contribuido a una respuesta mayor en cuanto al control bioquímico.
Finalmente, en cuanto al impacto pronóstico que tiene la secreción de PR-PTH es difícil establecer una relación, pues la gran mayoría de los casos revisados, incluyendo los 2 casos que presentamos, se diagnosticaron en estado avanzado y solamente en 3 casos no se logró controlar la hipercalcemia a pesar de múltiples intervenciones.
Teniendo en cuenta lo anterior, la hipercalcemia es un evento poco frecuente en pacientes con TNE. Cuando se presenta en pacientes con TNE pancreáticos se debe considerar la posibilidad de hiperparatiroidismo primario asociado a neoplasia endocrina múltiple tipo 1. No obstante, ante el hallazgo de hipercalcemia asociada a niveles bajos de PTH (menores de 20 pg/ml), se debe sospechar la secreción tumoral de PR-PTH y en la evaluación se debe incluir la determinación de los niveles plasmáticos de PR-PTH. El tratamiento dirigido al control de la calcemia se realiza de manera similar a otros casos de hipercalcemia maligna, aunque en los TNE existe la opción de intentar disminuir la secreción de PR-PTH con el uso de análogos de somatostatina. Se debe tener en cuenta el objetivo terapéutico de controlar la secreción hormonal mediante la reducción de la carga tumoral funcional, con estrategias como: la cirugía, la embolización transarterial, la ablación por radiofrecuencia, la quimioterapia o la terapia con radionúclidos. La mejor estrategia terapéutica para cada paciente debe ser concertada en una junta multidisciplinaria.
Conflicto de interesesNinguno.
FinanciaciónNinguna.