Evaluar la asociación de los polimorfismos de alguna de las citocinas más estudiadas en relación con el cáncer gástrico (IL-1B-511, IL-1RN intron-2-VNTR, TNF-α-308, IL-10-819 e IL-10-1082) y la presencia de anticuerpos hacia la proteína cagA de Helicobacter pylori con las lesiones preneoplásicas gástricas en pacientes colombianos.
Materiales y métodosSe estudiaron 185 pacientes con lesiones preneoplásicas (gastritis atrófica, metaplasia intestinal y displasia), y 154 controles (gastritis no atrófica), provenientes de hospitales de una zona de riesgo alto y otra de riesgo bajo para cáncer gástrico. Se obtuvieron biopsias gástricas y muestras de sangre; la genotipificación de los polimorfismos se hizo por discriminación alélica usando PCR en tiempo real y por PCR convencional y electroforesis en agarosa (VNTR del intron 2 de IL-1RN); la serología de Helicobacter pylori y Helicobacter pylori cagA se determinó por ELISA. Se utilizó regresión logística multinomial en el análisis estadístico.
ResultadosEl genotipo IL-1B-511TT (odds ratio=4,05; intervalo de confianza 95% 1,35-12,10) se asoció a metaplasia intestinal; no se observaron otras asociaciones entre los diferentes polimorfismos y las lesiones preneoplásicas. La infección por Helicobacter pylori cagA positivo se asoció a gastritis atrófica, metaplasia intestinal y displasia (OR=2,66; 13,70; 40,29, respectivamente).
ConclusiónLos resultados sugieren que entre los genotipos proinflamatorios el genotipo IL-1B-511TT estaría asociado a la metaplasia intestinal, y la serología de Helicobacter pylori cagA positivo sería un biomarcador útil para intervenir y prevenir la presencia de lesiones preneoplásicas. Se necesitan otros estudios con población colombiana que evalúen la asociación hallada de IL1B-511 con la metaplasia intestinal.
To evaluate the relationship of some of the most studied cytokines (IL-1B-511, IL-1RN intron-2-VNTR, TNF-α-308, IL-10-819, and IL-10-1082) with gastric cancer, as well as the presence of anti-Helicobacter pylori cagA IgG antibodies with pre-cancerous lesions in Colombian patients.
Materials and methodsA study was conducted on 185 patients with pre-cancerous lesions (atrophic gastritis, intestinal metaplasia and dysplasia), and 154 controls (non-atrophic gastritis), seen in hospitals in a high risk area, and another in a low risk area, for gastric cancer. Gastric biopsy specimens and blood samples were obtained. The genotyping of the polymorphisms was performed by allelic discrimination using real-time PCR, conventional PCR, and agarose electrophoresis (VNTR of IL-1RN intron 2). The serology of Helicobacter pylori and Helicobacter pylori cagA was determined by ELISA. A multinomial logistic regression was used in the statistical analysis.
ResultsThe IL-1B-511TT genotype was associated with intestinal metaplasia (OR=4.05; 95% CI; 1.35-12.10). No other relationships were observed between the different polymorphisms and pre-cancerous lesions. Infection due to a positive Helicobacter pylori cagA was associated with atrophic gastritis, intestinal metaplasia and dysplasia (OR=2.66; 13.70; 40.29, respectively).
ConclusionThe results suggest that, among the pro-inflammatory genotypes, the IL-1B-511TT would be associated with intestinal metaplasia, and that a positive Helicobacter pylori cagA serology could be a useful biomarker for the intervention and prevention of pre-cancerous lesions. Further studies are required in the Colombian population in order to evaluate the relationship found between IL1B-511 and intestinal metaplasia.
La infección por Helicobacter pylori (H. pylori) es el principal factor de riesgo para cáncer gástrico1. Menos del 3% de los sujetos infectados y con inflamación crónica de la mucosa gástrica progresa2 de forma consecutiva hacia gastritis crónica atrófica (GCA), metaplasia intestinal (MI), displasia gástrica (DG) y finalmente cáncer3. Las cepas de H. pylori que contienen la proteína cagA producen una gastritis más severa e incrementan el riesgo de lesiones preneoplásicas4 y cáncer gástrico5.
Varios polimorfismos de citocinas, con características pro y antiinflamatorias, se han asociado al riesgo de cáncer gástrico; sin embargo, los resultados varían dependiendo de las poblaciones donde son estudiados, sin que haya un consenso claro sobre su rol en la patogenia del cáncer gástrico6; resultados que se explicarían por variaciones en la frecuencia de los “alelos de riesgo” en las diferentes poblaciones7, y por una nueva evidencia que soporta una respuesta inmune multifactorial donde otros genes polimórficos podrían proporcionar novedosas perspectivas en la inmunidad innata de la carcinogénesis gástrica asociada a la infección por H. pylori8.
Adicionalmente, hay poca evidencia, y no conclusiva, de la asociación de estos polimorfismos a las lesiones preneoplásicas gástricas. Sujetos infectados por H. pylori y portadores de los genotipos interleucina (IL)-1B-511TT, IL-1RNA2/A2, u otros polimorfismos en población asiática9, presentan un aumento en el riesgo de desarrollar atrofia gástrica hasta cáncer gástrico tipo intestinal y difuso de localización no cardial10; sin embargo, los resultados varían entre las poblaciones caucásicas, asiáticas y latinoamericanas11–15.
Los resultados asociados al aumento de riesgo de cáncer gástrico11,13,15–17 y lesiones preneoplásicas14 en portadores del alelo factor de necrosis tumoral (TNF)-α-308A e infectados por H. pylori son controversiales. Igualmente, portadores de los alelos de riesgo de los polimorfismos del gen IL-10 que producen niveles reducidos de citocina IL-10 muestran asociaciones contrastantes con las lesiones neoplásicas gástricas según poblaciones occidentales y orientales13,18,19.
En Colombia, el cáncer gástrico continúa como la primera causa de mortalidad por cáncer. La distribución geográfica de esta enfermedad es contrastante en relación con la altitud20: la zona ubicada en la cordillera de los Andes presenta tasas de mortalidad altas, entre 13 y 20/100.000 habitantes, y la zona ubicada en la Costa Atlántica presenta tasas < 5/100.000 habitantes21. Este contraste también se relaciona con otras características reportadas en diferentes estudios: el origen étnico principal de las poblaciones de la zona montañosa andina es mestizo o amerindio, y el de las poblaciones costeras es africano22, condición ligada a diferencias culturales (dieta y estilos de vida); la infección por H. pylori cagA positivo es mayor en la zona montañosa en comparación con la zona costera, aunque esta diferencia no es significativa23, y el origen filogeográfico principal de las cepas de H. pylori de las regiones montañosas es europeo, y el de la región costera del pacífico es africano24.
Este estudio tiene como objetivo evaluar la asociación de los polimorfismos de alguna de las citocinas más estudiadas en relación con el cáncer gástrico (IL-1B-511, IL-1RN intron-2-VNTR, TNF-α-308, IL-10-819 e IL-10-1082), y la presencia de anticuerpos hacia la proteína cagA de H. pylori con las lesiones preneoplásicas gástricas en pacientes colombianos.
Materiales y métodosPacientesEn el estudio participaron pacientes mayores de 29 años que consultaron por molestias gastrointestinales, a quienes se les realizó una endoscopia de vías digestivas altas para un diagnóstico inicial de enfermedad gastroduodenal en hospitales e instituciones de salud de las ciudades de Tunja (zona de riesgo alto), y Barranquilla, Cartagena y Santa Marta (zona de riesgo bajo). Los criterios de exclusión fueron: tener úlcera péptica, varices esofágicas u otras condiciones que dificultaran el procedimiento de endoscopia; haber tomado antibióticos (compuestos de bismuto), inhibidores de bomba de protones y drogas, antiinflamatorios tipo antiinflamatorios no esteroideos (con y sin esteroides) 2 semanas previas al examen de endoscopia, y enfermedades crónicas severas incluyendo otros tipos de cáncer diferentes al adenocarcinoma gástrico. De los 351 pacientes que firmaron el consentimiento informado, se excluyeron 12 (3,41%) por: procedencia de otra zona de riesgo, 1; úlcera gástrica, 6, y no haber contestado la encuesta, 5. Se aplicó una encuesta que indagó sobre factores sociodemográficos y estilos de vida. El ingreso de los pacientes se hizo de forma consecutiva entre febrero de 2000 y julio de 2008. Este estudio fue aprobado por el Comité de Ética e Investigaciones del Instituto Nacional de Cancerología ESE.
El grupo control lo conformaron pacientes con diagnóstico histológico de gastritis no atrófica o normal; se definieron como casos los pacientes con diagnóstico histológico de GCA, GCA con MI y DG.
Diagnóstico histopatológicoSe tomaron 6 biopsias gástricas: 3 en antro, 1 en la cisura angular y 2 en el cuerpo. Estas fueron colocadas en una solución al 10% de formalina neutral para su inclusión en parafina, y se realizaron cortes histológicos de 5 micras. Las biopsias fueron teñidas con PAS-Azul Alciano para los casos de MI. La clasificación de la gastritis se hizo con base en la escala visual análoga propuesta en el sistema actualizado de Sidney25; los tipos de MI se clasificaron de acuerdo con Filipe et al.26, y el diagnóstico de displasia se realizó siguiendo los criterios de Padova27. A cada biopsia se le hizo un diagnóstico histológico, y el diagnóstico definitivo global fue el más avanzado entre las múltiples biopsias por paciente.
Determinación de los polimorfismos interleucinas 1B-511, 1-RN, factor de necrosis tumoral-α-308, interleucinas 10-819 y 10-1082La genotipificación de los polimorfismos IL-1B-511 C/T (RS16944), TNF-α-308 G/A (RS 1800629), IL-10-819 C/T (RS3021097) e IL-10-1082 G/A (RS 1800896) se realizó a partir de ADN genómico extraído de las biopsias obtenidas del antro gástrico. Para la genotipificación, se utilizó la técnica de reacción en cadena de la polimerasa (PCR) en tiempo real empleando las combinaciones de iniciadores directo (F) y reverso (R), y sondas marcadas con los fluorocromos TET y FAM como la describe Johnson et al.28; los iniciadores utilizados se publicaron previamente29. Cada reacción se realizó en un volumen final de 20μl con 40ng de ADN genómico, 300nM de cada iniciador, 250nM de cada sonda, 10μL de PCR máster mix 2X del kit DyNamo Probe qPCR que contiene buffer de PCR, MgCl2, mezcla de dNTPs, incluyendo dUTP y Thermus brockianus DNA Polymerasa (Finnzymes). La amplificación se realizó en un termociclador Chromo 4™ System for Real-Time PCR Detection (MJ Research). Se utilizaron como controles muestras de individuos homocigotos y heterocigotos para cada polimorfismo que fueron caracterizados previamente mediante RFLPs. Todos los ensayos se hicieron por duplicado, el investigador que los realizó no conocía el diagnóstico histopatológico de los pacientes.
Para la genotipificación del gen IL-1RN intron-2-VNTR (RS22344663), se utilizó ADN genómico extraído de biopsias gástricas del antro. Los polimorfismos en el gen IL-1RN se evaluaron mediante amplificación por PCR y visualización del tamaño de los fragmentos amplificados en geles de agarosa según la metodología descrita por Perri et al.30. Cada reacción de PCR tenía un volumen final de reacción de 25μL: 5μL de solución de ADN obtenida a partir de cada biopsia, 5μL de buffer 10 × fase de la Taq polimerasa (Tris-HCl 10mM pH 8KCl 50mM), 1,25mM de MgCl2, 0,2mM de la mezcla de dNTPs, 1U de GoTaq® Flexi DNA Polimerasa marca Promega, y 0,5μM de cada oligonucleótido. Los productos de amplificación se separaron en geles de agarosa al 2,5%, se tiñeron con bromuro de etidio (0,5μg/mL) y se visualizaron con luz ultravioleta en un analizador de imágenes Gel Doc EQ (bio Rad); la imagen del gel se analizó con el programa Quanty One 1-D versión 4,4 (bio Rad). Los alelos se identificaron según el tamaño del fragmento amplificado: alelo 1 (4 repeticiones) 490bp; alelo 2 (2 repeticiones) 240pb; alelo 3 (5 repeticiones) 500pb; alelo 4 (3 repeticiones) 325pb, y el alelo 5 (6 repeticiones) 595pb30,31. En el polimorfismo penta-alélico de IL1RN (número variable de repeticiones VNTR en el intrón 2), el alelo L (largo) combina los alelos largos del IL1RN con 3 (A4), 4 (A1), 5 (A3) y 6 (A5) repeticiones VNTR, y el alelo 2 (A2) es el alelo corto que porta 2 repeticiones VNTR, y es el alelo de riesgo en este polimorfismo.
La genotipificación de los diferentes polimorfismos se hizo en todos los pacientes, a excepción del polimorfismo IL-1RN, que no se pudo determinar en el 8,8% (30 pacientes) de la muestra.
ELISA para inmunoglobulina G anti-Helicobacter pylori y ELISA para inmunoglobulina G anti-cagA de Helicobacter pyloriLa presencia de anticuerpos inmunoglobulina G (IgG) contra H. pylori y la determinación de anticuerpos IgG contra cagA se evaluó en suero, mediante un ensayo inmunoenzimático previamente validado en población mexicana32. Como antígeno se utilizó un sonicado de una mezcla de 3 cepas de H. pylori aisladas de pacientes mexicanos. Las muestras de suero fueron probadas en una dilución 1:1.000. En seguida, fue aplicada una dilución 1:1.000 de anticuerpos monoclonales anti-IgG humana conjugados a fosfatasa alcalina. El sustrato fue una solución de p-nitrofenilfosfato en concentración de 1mg/mL, y la lectura se realizó en un lector de ELISA a una absorbancia de 405nm32,33. El valor final se dio por el promedio de 2 mediciones. Un resultado ≥ 1 unidades/ELISA se consideró seropositivo para H. pylori.
Como antígeno para los anticuerpos IgG anti-cagA se utilizó proteína cagA recombinante a una concentración de 0,1ug/pozo, el suero se usó a una dilución 1:200. En seguida, fue aplicada una dilución 1:1.000 de anticuerpos monoclonales anti-IgG humana conjugados a fosfatasa alcalina. El sustrato fue una solución de p-nitrofenilfosfato en concentración de 1mg/ml, y la lectura se realizó en un lector de ELISA a una absorbancia de 405nm32,33. El valor final se dio por el promedio de 2 mediciones. El valor de corte para considerar a un individuo seropositivo para cagA fue definido como un valor de ≥ 1,5 unidades/ELISA.
Se definió no infección por H. pylori cuando los 2 resultados de serología para extracto total de H. pylori y cagA fueron negativos. Los análisis serológicos no se realizaron en 5,3% (18 pacientes).
Análisis estadísticoSe evaluó el equilibrio de Hardy-Weinberg de los polimorfismos en el grupo control con la prueba exacta de Fisher; el análisis se hizo separadamente en los pacientes control de la Costa Atlántica (zona de riesgo bajo, de origen étnico africano, principalmente) y los de Tunja (zona de riesgo alto, de origen principalmente mestizo y caucásico), al igual que para el grupo control total. Se utilizó la prueba Ji2 de diferencia para establecer aquellas en la distribución de las variables. Los anticuerpos IgG anti-H. pylori y anti-cagA, y la presencia de infección por H. pylori se describen de forma independiente; con base en los resultados del análisis univariado de la serología de H. pylori con las lesiones preneoplásicas se incluyó en el análisis multivariado la presencia de anticuerpos IgG anti-cagA de H. pylori. En este estudio se consideraron como alelos de riesgo los siguientes: IL1B-511T, TNF-α-308A, IL10-819T e IL10-1082a e IL1RN intron-2-VNTR alelo 2 (corto). La asociación entre los polimorfismos y el riesgo de presentar lesiones preneoplásicas, expresada como odds ratio (OR) y su intervalo de confianza del 95% (IC 95%), se estimó a través de la regresión logística multinomial ajustada por sexo, edad, zona de riesgo de procedencia, nivel de educación, fumar, anticuerpos IgG anti-cagA, y por todos los polimorfismos de manera simultánea para controlar posibles efectos de unos sobre otros. El análisis de los polimorfismos se valoró con el modelo dominante. También, se construyeron variables que combinaban la presencia simultánea de los diferentes genotipos de los polimorfismos IL1B-511 y TNF-α-308, y de los polimorfismos IL10-819 e IL10-1082. Los resultados se presentan de forma conjunta por las 2 zonas de riesgo, dado el número bajo de casos de las lesiones preneoplásicas en la zona de riesgo bajo.
Se consideró una asociación significativa aquella con un valor de p≤0,05. Los análisis estadísticos se realizaron con el programa SPSS, versión 18.0.
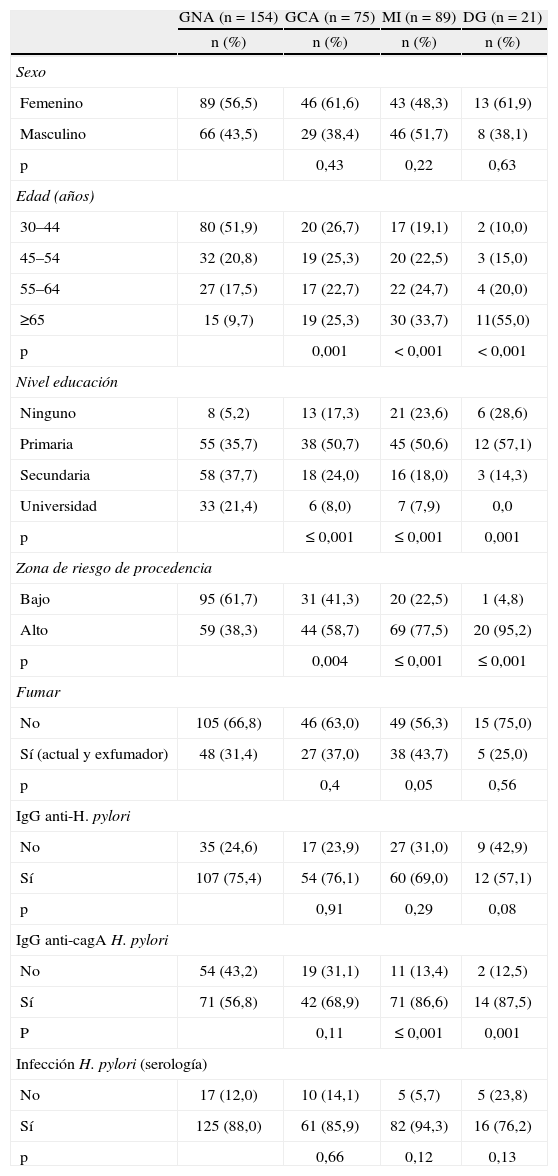
ResultadosSe analizaron 185 pacientes con lesiones preneoplásicas: 75 con GCA, 89 con MI, 21 con DG, y 154 pacientes con gastritis no atrófica. Las características sociodemográficas de los pacientes se presentan en la tabla 1. Se halló una diferencia entre casos y controles en la distribución de la edad, el nivel de educación, la zona de procedencia y tener anticuerpos IgG anti-cagA.
Características de los pacientes con lesiones preneoplásicas gástricas
| GNA (n=154) | GCA (n=75) | MI (n=89) | DG (n=21) | |
| n (%) | n (%) | n (%) | n (%) | |
| Sexo | ||||
| Femenino | 89 (56,5) | 46 (61,6) | 43 (48,3) | 13 (61,9) |
| Masculino | 66 (43,5) | 29 (38,4) | 46 (51,7) | 8 (38,1) |
| p | 0,43 | 0,22 | 0,63 | |
| Edad (años) | ||||
| 30–44 | 80 (51,9) | 20 (26,7) | 17 (19,1) | 2 (10,0) |
| 45–54 | 32 (20,8) | 19 (25,3) | 20 (22,5) | 3 (15,0) |
| 55–64 | 27 (17,5) | 17 (22,7) | 22 (24,7) | 4 (20,0) |
| ≥65 | 15 (9,7) | 19 (25,3) | 30 (33,7) | 11(55,0) |
| p | 0,001 | < 0,001 | < 0,001 | |
| Nivel educación | ||||
| Ninguno | 8 (5,2) | 13 (17,3) | 21 (23,6) | 6 (28,6) |
| Primaria | 55 (35,7) | 38 (50,7) | 45 (50,6) | 12 (57,1) |
| Secundaria | 58 (37,7) | 18 (24,0) | 16 (18,0) | 3 (14,3) |
| Universidad | 33 (21,4) | 6 (8,0) | 7 (7,9) | 0,0 |
| p | ≤ 0,001 | ≤ 0,001 | 0,001 | |
| Zona de riesgo de procedencia | ||||
| Bajo | 95 (61,7) | 31 (41,3) | 20 (22,5) | 1 (4,8) |
| Alto | 59 (38,3) | 44 (58,7) | 69 (77,5) | 20 (95,2) |
| p | 0,004 | ≤ 0,001 | ≤ 0,001 | |
| Fumar | ||||
| No | 105 (66,8) | 46 (63,0) | 49 (56,3) | 15 (75,0) |
| Sí (actual y exfumador) | 48 (31,4) | 27 (37,0) | 38 (43,7) | 5 (25,0) |
| p | 0,4 | 0,05 | 0,56 | |
| IgG anti-H. pylori | ||||
| No | 35 (24,6) | 17 (23,9) | 27 (31,0) | 9 (42,9) |
| Sí | 107 (75,4) | 54 (76,1) | 60 (69,0) | 12 (57,1) |
| p | 0,91 | 0,29 | 0,08 | |
| IgG anti-cagA H. pylori | ||||
| No | 54 (43,2) | 19 (31,1) | 11 (13,4) | 2 (12,5) |
| Sí | 71 (56,8) | 42 (68,9) | 71 (86,6) | 14 (87,5) |
| P | 0,11 | ≤ 0,001 | 0,001 | |
| Infección H. pylori (serología) | ||||
| No | 17 (12,0) | 10 (14,1) | 5 (5,7) | 5 (23,8) |
| Sí | 125 (88,0) | 61 (85,9) | 82 (94,3) | 16 (76,2) |
| p | 0,66 | 0,12 | 0,13 | |
DG: displasia gástrica; GCA: gastritis crónica atrófica; GNA: gastritis no atrófica; MI: metaplasia intestinal; p: Ji cuadrado de diferencia
Se observó que el tipo de MI completa fue la más frecuente, y no presentó diferencias significativas en las 2 zonas de riesgo (56,5% en la de riesgo alto y 75% en la de riesgo bajo [p=0,21]), seguida de la MI incompleta (11,6 y 20% [p=0,55]), y la MI mixta fue la menos frecuente en la zona de riesgo bajo (31,9 y 5% [p=0,03]). El grado de displasia fue leve en todos los pacientes que la presentaron.
Polimorfismos interleucinas 1B-511, 1RN, factor de necrosis tumoral-α-308, interleucinas 10-819 y 10-1082Los alelos de los diferentes polimorfismos se encontraron en equilibrio de Hardy-Weinberg, excepto el polimorfismo IL-1RN (p=0,001); la ausencia de equilibrio se explica por la frecuencia observada menor de los genotipos IL-1RNA1-A1 (50,4%) e IL-1RNA1-A2 (32,6%), y la frecuencia mayor del genotipo IL-1RNA2-A2 (17%) en el grupo control en comparación con las frecuencias esperadas (60,0, 60,0, 15%, respectivamente); resultados similares en la evaluación por zona de riesgo, por lo tanto no se evaluó este polimorfismo.
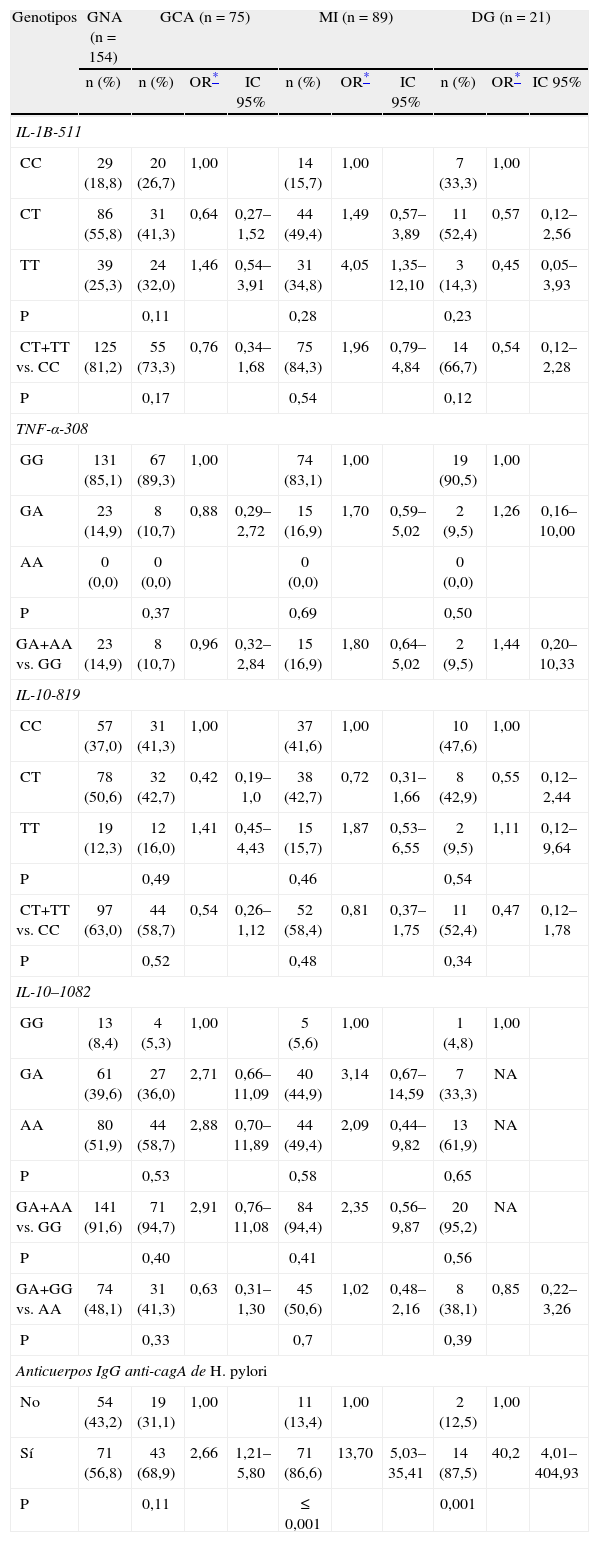
La distribución del polimorfismo TNF-α-308 se caracterizó por la ausencia del genotipo TNF-α-308AA en los pacientes de los diferentes grupos; y el genotipo IL-10-1082AA presentó una frecuencia > 50% en todos los grupos estudiados. No se hallaron diferencias significativas en la distribución de los genotipos de los polimorfismos analizados entre el grupo control y los grupos de lesiones preneoplásicas (tabla 2). El genotipo IL-1B511TT se asoció a un aumento de 4 veces el riesgo de presentar MI (p Wald=0,012) (tabla 2), e igualmente, el alelo T (CT+TT) presenta un aumento de riesgo sin ser significativo (p Wald=0,14); no se identificó otra asociación significativa entre los diferentes genotipos y los alelos de los polimorfismos con las lesiones preneoplásicas (tabla 2).
Distribución y riesgo (odds ratio e intervalo de confianza 95%) de los genotipos de polimorfismos y de los anticuerpos IgG anti-cagA de Helicobacter pylori en pacientes con lesiones preneoplásicas gástricas.
| Genotipos | GNA (n=154) | GCA (n=75) | MI (n=89) | DG (n=21) | ||||||
| n (%) | n (%) | OR* | IC 95% | n (%) | OR* | IC 95% | n (%) | OR* | IC 95% | |
| IL-1B-511 | ||||||||||
| CC | 29 (18,8) | 20 (26,7) | 1,00 | 14 (15,7) | 1,00 | 7 (33,3) | 1,00 | |||
| CT | 86 (55,8) | 31 (41,3) | 0,64 | 0,27–1,52 | 44 (49,4) | 1,49 | 0,57–3,89 | 11 (52,4) | 0,57 | 0,12–2,56 |
| TT | 39 (25,3) | 24 (32,0) | 1,46 | 0,54–3,91 | 31 (34,8) | 4,05 | 1,35–12,10 | 3 (14,3) | 0,45 | 0,05–3,93 |
| P | 0,11 | 0,28 | 0,23 | |||||||
| CT+TT vs. CC | 125 (81,2) | 55 (73,3) | 0,76 | 0,34–1,68 | 75 (84,3) | 1,96 | 0,79–4,84 | 14 (66,7) | 0,54 | 0,12–2,28 |
| P | 0,17 | 0,54 | 0,12 | |||||||
| TNF-α-308 | ||||||||||
| GG | 131 (85,1) | 67 (89,3) | 1,00 | 74 (83,1) | 1,00 | 19 (90,5) | 1,00 | |||
| GA | 23 (14,9) | 8 (10,7) | 0,88 | 0,29–2,72 | 15 (16,9) | 1,70 | 0,59–5,02 | 2 (9,5) | 1,26 | 0,16–10,00 |
| AA | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | ||||||
| P | 0,37 | 0,69 | 0,50 | |||||||
| GA+AA vs. GG | 23 (14,9) | 8 (10,7) | 0,96 | 0,32–2,84 | 15 (16,9) | 1,80 | 0,64–5,02 | 2 (9,5) | 1,44 | 0,20–10,33 |
| IL-10-819 | ||||||||||
| CC | 57 (37,0) | 31 (41,3) | 1,00 | 37 (41,6) | 1,00 | 10 (47,6) | 1,00 | |||
| CT | 78 (50,6) | 32 (42,7) | 0,42 | 0,19–1,0 | 38 (42,7) | 0,72 | 0,31–1,66 | 8 (42,9) | 0,55 | 0,12–2,44 |
| TT | 19 (12,3) | 12 (16,0) | 1,41 | 0,45–4,43 | 15 (15,7) | 1,87 | 0,53–6,55 | 2 (9,5) | 1,11 | 0,12–9,64 |
| P | 0,49 | 0,46 | 0,54 | |||||||
| CT+TT vs. CC | 97 (63,0) | 44 (58,7) | 0,54 | 0,26–1,12 | 52 (58,4) | 0,81 | 0,37–1,75 | 11 (52,4) | 0,47 | 0,12–1,78 |
| P | 0,52 | 0,48 | 0,34 | |||||||
| IL-10–1082 | ||||||||||
| GG | 13 (8,4) | 4 (5,3) | 1,00 | 5 (5,6) | 1,00 | 1 (4,8) | 1,00 | |||
| GA | 61 (39,6) | 27 (36,0) | 2,71 | 0,66–11,09 | 40 (44,9) | 3,14 | 0,67–14,59 | 7 (33,3) | NA | |
| AA | 80 (51,9) | 44 (58,7) | 2,88 | 0,70–11,89 | 44 (49,4) | 2,09 | 0,44–9,82 | 13 (61,9) | NA | |
| P | 0,53 | 0,58 | 0,65 | |||||||
| GA+AA vs. GG | 141 (91,6) | 71 (94,7) | 2,91 | 0,76–11,08 | 84 (94,4) | 2,35 | 0,56–9,87 | 20 (95,2) | NA | |
| P | 0,40 | 0,41 | 0,56 | |||||||
| GA+GG vs. AA | 74 (48,1) | 31 (41,3) | 0,63 | 0,31–1,30 | 45 (50,6) | 1,02 | 0,48–2,16 | 8 (38,1) | 0,85 | 0,22–3,26 |
| P | 0,33 | 0,7 | 0,39 | |||||||
| Anticuerpos IgG anti-cagA de H. pylori | ||||||||||
| No | 54 (43,2) | 19 (31,1) | 1,00 | 11 (13,4) | 1,00 | 2 (12,5) | 1,00 | |||
| Sí | 71 (56,8) | 43 (68,9) | 2,66 | 1,21–5,80 | 71 (86,6) | 13,70 | 5,03–35,41 | 14 (87,5) | 40,2 | 4,01–404,93 |
| P | 0,11 | ≤ 0,001 | 0,001 | |||||||
DG: displasia gástrica; GCA: gastritis crónica atrófica; GNA: gastritis no atrófica; IC: intervalo de confianza; MI: metaplasia intestinal; OR: odds ratio; p: Ji cuadrado de diferencia de porciones; TNF: factor de necrosis tumoral.
Los pacientes portadores simultáneos de las diferentes combinaciones de los genotipos de IL-1B-511 y TNF-α-308, e IL-10-819 e IL-10-1082 no mostraron asociaciones significativas con las lesiones preneoplásicas (datos no mostrados).
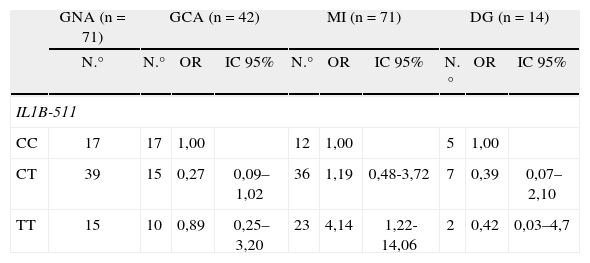
Anticuerpos inmunoglobulina G anti-cagA de Helicobacter pyloriNo se presentó infección por H. pylori en el 11,5% (37) de los pacientes analizados. De los 198 pacientes con anticuerpos anti-cagA, 25,8% (51) fueron negativos para el antígeno total de H. pylori. Entre los pacientes que presentaron infección por H. pylori, se observó una frecuencia mayor de anticuerpos IgG de H. pylori anti-cagA positivo en los pacientes con MI y DG en comparación con el grupo control (tabla 1); se encontró una asociación significativa entre la seropositividad para cagA y las lesiones prenenoplásicas (OR=2,66 (p Wald=0,014); 13,7 (p Wald≤0,001); 40,29 (p Wald=0,002) para GCA, MI y DG, respectivamente) (tabla 2). En los pacientes seropositivos para cagA, se mantuvo la magnitud de la asociación entre el genotipo IL-1B-511TT y la MI (OR=4,14; IC 95% 1,22-14,06) (p Wald=0,03) (tabla 3); no se identificaron otras asociaciones entre los genotipos de los polimorfismos y las lesiones preneoplásicas en los pacientes seropositivos para cagA (datos no mostrados).
Distribución y riesgo (odds ratio e intervalo de confianza 95%) de los genotipos del polimorfismo IL1B-511 en pacientes con anticuerpos IgG anti-cagA positivo con las lesiones preneoplásicas gástricas.
| GNA (n=71) | GCA (n=42) | MI (n=71) | DG (n=14) | |||||||
| N.° | N.° | OR | IC 95% | N.° | OR | IC 95% | N.° | OR | IC 95% | |
| IL1B-511 | ||||||||||
| CC | 17 | 17 | 1,00 | 12 | 1,00 | 5 | 1,00 | |||
| CT | 39 | 15 | 0,27 | 0,09–1,02 | 36 | 1,19 | 0,48-3,72 | 7 | 0,39 | 0,07–2,10 |
| TT | 15 | 10 | 0,89 | 0,25–3,20 | 23 | 4,14 | 1,22-14,06 | 2 | 0,42 | 0,03–4,7 |
DG: displasia gástrica; GCA: gastritis crónica atrófica; GNA: gastritis no atrófica; IC: intervalo de confianza; MI: metaplasia intestinal; OR: odds ratio; p: Ji cuadrado de diferencia de porciones.
OR* ajustado: sexo, edad en decenios, zona de riesgo, fumador (binomial), nivel de educación y por todos los polimorfismos simultáneamente.
En este estudio se halló que el genotipo IL-1B-511TT se asoció a un aumento de riesgo de presentar MI, y tener anticuerpos IgG anti-cagA incrementa el riesgo de presentar gastritis atrófica, MI y DG. No se encontraron asociaciones significativas entre los genotipos de los polimorfismos TNF-α-308, IL-10-819 e IL-10-1082 y las lesiones preneoplásicas gástricas.
Los resultados presentes corroboran el efecto del genotipo IL-1B-511TT en algunas de las etapas del proceso de carcinogénesis gástrica en la muestra de pacientes colombianos analizada con diagnósticos de lesiones neoplásicas gástricas; previamente, se reportó un aumento similar de riesgo de cáncer gástrico en los pacientes portadores de este genotipo29,34.
El resultado de la asociación del genotipo IL-1B-511TT en este estudio está acorde con el metanálisis de Peleteiro et al., quienes hallaron una asociación entre los genotipos IL-1B-511CT e IL-1B-511TT con la MI y en poblaciones con alta prevalencia de infección por H. pylori14; además, los autores hallaron una relación entre el genotipo IL-1RNA2*A2 con todas las lesiones preneoplásicas14, información que no se pudo verificar en la presente investigación. Por otra parte, el estudio de Kupcinskas et al.35 reporta la pérdida de asociación de los polimorfismos IL-1B-511 e IL-1RN a las lesiones preneoplásicas; el estudio incluyó a pacientes de la Región Báltica y Taiwán, información que se agrega a los resultados controversiales del polimorfismo IL-1 en relación con las poblaciones estudiadas. Por otra parte, consideramos que los resultados de asociación observados en la DG, opuestos a los de la MI, están afectados por el tamaño pequeño de la muestra y no daría lugar a una explicación biológica plausible.
La asociación significativa del genotipo IL1B-511TT se sustenta en que la citocina IL-1β inducida por la infección por H. pylori es una citocina proinflamatoria potente que inicia y amplifica la respuesta inflamatoria e inhibe la secreción de ácido gástrico que conduce a hipoclorhidria y atrofia gástrica36,37; se encuentra aumentada en portadores de los genotipos IL-1B-511TT, IL-1B31CC e IL-1RNA2*A2, y por con siguiente, aumenta el riesgo de lesiones preneoplásicas y cáncer gástrico no cardial38–40. Igualmente, la combinación de genotipos de riesgo alto de la bacteria con los genotipos de riesgo alto de los polimorfismos genéticos de IL-1B aumenta significativamente el riesgo de carcinoma gástrico38,41.
El efecto biológico de la IL-1 en el riesgo de la carcinogénesis gástrica es variante como lo evidencian varios metanálisis. Un aumento en el riesgo de cáncer gástrico tipo intestinal asociado a los polimorfismos IL-1B-511T e IL-1RA2 en poblaciones caucásicas12,13,15, un incremento de riesgo asociado al polimorfismo IL-1RN*2 en población latinoamericana11, y no asociación de estos polimorfismos en ninguna población como lo reportaron otros autores42.
La distribución del polimorfismo TNF-α-308 en los pacientes estudiados es similar a la población asiática17 y acorde con resultados previos en una población colombiana43. El metanálisis de Peleitero et al.14 y el estudio de Kato et al.44, en Venezuela, no hallaron asociación entre el genotipo TNF-α-308AA con las lesiones preneoplásicas, resultados acordes con los del presente estudio. En cáncer gástrico, los metanálisis muestran asociaciones débiles y varían según las poblaciones, asociaciones leves en poblaciones caucásicas13,16,17 y no asociaciones15.
Los genotipos IL-10-819TT e IL-10-1082AA se han asociado a una baja expresión de la citocina mRNA IL-10 en la mucosa gástrica37. Los hallazgos presentes muestran una distribución del genotipo IL-10-1082AA similar a la población asiática13, la del genotipo IL-10-819TT difiere de las poblaciones caucásicas y asiáticas18, y la ausencia de asociación de los polimorfismos IL-10-1082 e IL-10-919 es acorde con reportes en poblaciones asiáticas, europeas y latinoamericanas 45–47; otras investigaciones reportan un aumento en el riesgo de MI y DG con el genotipo IL-10-1082AA (Venezuela)48, un incremento en el riesgo de MI con el alelo IL-10-819C (China)49 y un aumento en el riesgo de GCA con el genotipo IL-10-819TT (Alemania)50. Los diferentes metanálisis en cáncer gástrico, igualmente muestran el mismo efecto contrastante y con genotipos diferentes: aumento de riesgo con el polimorfismo IL-10-1082G en población asiática y con el polimorfismo IL-10-1082A en población caucásica13,15,19, y disminución de riesgo con el alelo IL-10-1082A o el genotipo IL-10-819TT18,19,51.
El incremento en la frecuencia de los anticuerpos IgG anticagA de H. pylori positivos en la medida en que avanzan las lesiones preneoplásicas, al igual que en el valor del riesgo asociado, han sido reconocidos en estudios previos4,33; resultados que corroboran el efecto deletéreo de la inflamación crónica por la infección con H. pylori cagA positivos debido a reacciones bioquímicas oxidativas sobre el ADN, la activación de oncogenes en las células epiteliales de la mucosa gástrica52. Observamos que algunos sueros fueron seropositivos a cagA y negativos a H. pylori (25,8%); este resultado es semejante a lo publicado por otros trabajos53, y se puede deber a que los anticuerpos anti-cagA persisten durante más tiempo que los anticuerpos a otros antígenos de H. pylori. También, estos resultados están en relación directa con los resultados de Flores-Luna et al.54 que muestran el valor de los anticuerpos IgG anti-cagA como un potencial biomarcador de las lesiones preneoplásicas en países latinoameri canos con diferentes tasas de mortalidad por cáncer gástrico.
Por otra parte, la magnitud de la asociación de la combinación del genotipo cagA de H. pylori con el genotipo IL-1B-511TT en la MI permaneció sin modificaciones, resultado no acorde con lo reportado por otros autores, que demuestran un aumento significativo de riesgo con el carcinoma gástrico en pacientes portadores de la combinación de los genotipos de riesgo de la bacteria y los genotipos proinflamatorios38; posiblemente, este resultado esté afectado por el tamaño de la muestra, teniendo en cuenta el número de factores por los que se ajustó en el análisis multivariado.
Los resultados presentes deben evaluarse teniendo en cuenta sus limitaciones. El tamaño de muestra pequeño que afecta al poder de los resultados. El análisis de la asociación de los polimorfismos genéticos puede estar sesgado por la mezcla ancestral en las poblaciones latinas. No obstante estas limitaciones, el análisis de los polimorfismos genéticos tuvo en cuenta controlar por los posibles efectos de unos sobre otros, y el estudio aporta información nueva acerca de la caracterización de polimorfismos pro y antiinflamatorios conjuntamente en pacientes colombianos no presentada de manera previa. Adicional a la identificación de los factores genéticos, no se desconoce la influencia de los factores ambientales, dieta y estilos de vida en el desarrollo de las lesiones preneoplásicas gástricas.
En conclusión, mostramos que la asociación de la infección por H. pylori cagA positiva en las lesiones preneoplásicas corrobora la magnitud y el rol fundamental en la patogénesis del cáncer gástrico en la población colombiana, y sustenta su uso potencial para la discriminación del riesgo en este cáncer en la población. Por el contrario, los resultados del análisis de los polimorfismos estudiados no permite rechazar la hipótesis nula de no asociación con las lesiones preneoplásicas gástricas, ya que son necesarios estudios futuros que incluyan la ancestría genética para un mejor análisis de estos polimorfismos que presentan gran variabilidad de las frecuencias alélicas de acuerdo con las poblaciones ancestrales, al igual que se necesitan investigaciones que evalúen la asociación hallada de IL1B-511 con la MI.
FinanciaciónInternational Agency Research in Cancer y el Instituto Nacional de Cancerología ESE: Inversión Nación, C401 C41030310-108.
Conflicto de interesesLos autores declaramos que no tenemos ningún conflicto de intereses.
Los autores agradecemos al grupo de médicos y paramédicos que captaron los pacientes: Carlos Rizo, Andrés Vecino, Carlos Pinzón y Rosaura Galvis, y Adrey González (citohistotecnóloga) en el Instituto Nacional de Cancerología ESE. Juan Carlos Espinel, Cristina Millán y Gloria Páez en el Hospital San Rafael Tunja. Agradecemos a todos los gastroenterólogos involucrados en el proyecto: Ricardo Oliveros y Rosario Albis (Grupo de Gastroenterología del Instituto Nacional de Cancerología ESE), Fernando Peñalosa (Hospital Universitario de Kennedy, Bogotá, D.C.), Jorge Salek (Hospital Militar), Albis Jani (Hospital Universitario San Ignacio, Bogotá, D.C.), Cesar Redondo (Cartagena), César Suárez (Santa Marta), Oscar Páez Rodríguez (Barranquilla) y José Jaramillo (Santa Marta). También, agradecemos a los patólogos, Jesús Pérez-García (Facultad de Medicina, Universidad Libre, Barranquilla), Juan Carlos Bravo (Fundación Valle de Lili, Cali) y Germán Barbosa (Instituto Nacional de Cancerología). Finalmente, agradecemos de manera especial a la Dra. Nubia Muñoz, exdirectora de Unit of Field and Intervention Studies, International Agency for Research on Cancer (Lión, Francia), por su empeño para que fuera posible la realización del estudio “Helicobacter pylori: international prevalence, peptic ulcer disease and gastric neoplasia” en nuestro país.