Caracterizar los niveles de pepsinógeno y evaluar la capacidad de discriminación del PGI y la relación PGI/PGII para el diagnóstico serológico de atrofia gástrica en diferentes poblaciones colombianas.
Materiales y métodosParticiparon 600 sujetos sin sintomatología gástrica y se analizaron 544 muestras de pacientes con sintomatología gástrica provenientes de diferentes poblaciones con riesgos opuestos para cáncer gástrico. A todos los participantes se les tomó muestra de sangre. En los pacientes se obtuvieron biopsias de antro y cuerpo para su diagnóstico inicial de lesiones gastroduodenales. Los niveles de pepsinógeno y la serología de Helicobacter pylori se estimaron con pruebas de ELISA. Los análisis estadísticos incluyeron pruebas de Kruskal-Wallis y Mann-Whitney, curva ROC y valores diagnósticos.
ResultadosLos niveles de pepsinógeno en pacientes y sujetos asintomáticos difieren según la zona de riesgo de procedencia. Los niveles de PGI, PGII y PGI/PGII disminuyeron a medida que aumenta la severidad del diagnóstico histológico (p<0,005), al igual que con el grado de severidad de la atrofia y la localización multifocal (p≤0,001). El PGI ≤86,68 y PGI/PGII ≤3,19 con un área bajo la curva de 0,76 identificó pacientes con atrofia severa multifocal, serología positiva para H. pylori y procedentes de la zona de riesgo alto, con sensibilidad de 77,5% y especificidad de 71,74%.
ConclusiónLos resultados sugieren que los niveles de PGI, PGI/PGII conjuntamente con serología H. pylori positiva podrían ser considerados para la detección de atrofia severa en pacientes de la zona de riesgo alto. Se necesita otros estudios en poblaciones de riesgo alto.
To characterize levels of pepsinogen and evaluate the discrimination ability of pepsinogen I (PGI) and the PGI/ pepsinogen II (PGII) ratio for the serological diagnosis of gastric atrophy in different Colombian populations.
MethodsA total 600 subjects without gastric symptoms participated and 544 samples from patients with gastric symptomatology were analyzed from different populations with opposing risks to gastric cancer. A blood sample was taken from all participants; a gastric antrum and body biopsy for the initial diagnosis of gastroduodenal lesions was obtained from the patients. The levels of pepsinogen and Helicobacter pylori serology were estimated with ELISA. Statistical analyses included Kruskal -Wallis and Mann -Whitney test, ROC curve and diagnostic values.
ResultsThe levels of PGI and PGI / PGII differ by risk area of origin. Levels of PGI, PGII and PGI / PGII decreased with increasing severity of histological diagnosis (P<.005), as with the severity of atrophy and multifocal localization (P ≤.001). The PGI ≤ 86.68 and PGI / PGII ≤ 3.19 with an area under the curve of 0.76 identified patients with severe multifocal atrophy, positive serology for H. pylori, and from the high risk area, with a sensitivity of 77.5% and specificity of 71.74%.
ConclusionThe results suggest that PGI levels together with PGI / PGII ratios and positive serology for H. pylori could be considered for the detection of severe atrophy in high-risk areas. Further studies are needed in high-risk populations
En el mundo el cáncer gástrico es la segunda causa de muerte por cáncer en ambos sexos en con 736.000 muertes anuales (9,7% del total)1, mientras que en Colombia es la primera causa2. Las zonas geográficas del país con el mayor riesgo para cáncer gástrico se localizan en las regiones montañosas. Los departamentos ubicados en esas regiones con las tasas de mortalidad ajustadas por edad (TAE por 100.000) más altas, en hombres y mujeres, se registran en: Cauca (21,5 y 13,0), Huila (22,7 y 10,0), Nariño (19,2 y 11,7), Norte de Santander (18,5 y 11,3) y Boyacá (18,8 y 9,7), respectivamente. De otra parte, las zonas geográficas con el menor riesgo son las regiones costeras; los departamentos ubicados en estas regiones con las tasas anuales equivalentes de mortalidad más bajas, en hombres y mujeres, son: Guajira (3,2 y 1,5), Bolívar (5,0 y 2,9), Chocó (5,2 y 4,1), Magdalena (5,4 y 3,7) y Atlántico (6,1 y 3,3) respectivamente2.
La infección por Helicobacter pylori (H. pylori) y la gastritis crónica atrófica se consideran los principales factores etiológicos independientes del cáncer gástrico no cardial (distal)3,4, estos factores se han evaluado en población colombiana.
La infección por H. pylori cagA positivo se asoció a un riesgo mayor de lesiones preneoplásicas y cáncer gástrico5,6 y el diagnóstico de gastritis crónica atrófica es el más frecuente, 36,4%, con una prevalencia mayor en la zona de riesgo alto (34,1%) en comparación con la zona de riesgo bajo para cáncer gástrico (6,4%) (p≤0,05)7.
Los niveles séricos de pepsinógeno (PG) se han utilizado como un método diagnóstico serológico no invasivo de detección temprana para estimar el riesgo de atrofia severa y cáncer gástrico en varias poblaciones8–12, en otras no ha mostrado ser un método útil13,14. Estos niveles reflejan la morfología y el estatus funcional de la mucosa gástrica, de ahí su utilidad como marcador biológico de la mucosa gástrica15.
Bioquímicamente se producen dos tipos de pepsinógeno: el pepsinógeno I (PGI) que se produce en la mucosa gástrica fúndica y el pepsinógeno II (PGII) que se produce en la mucosa gástrica fúndica y antral y en la mucosa duodenal. El avance de la inflamación crónica a gastritis atrófica en gran parte de la mucosa gástrica, se asocia a: hiposecreción de ácido gástrico, disminución de los niveles de pepsinógeno e hipergastrina16. Es así que los bajos niveles séricos de PGI y PGI/PGII se han asociado con atrofia gástrica severa, metaplasia intestinal y cáncer gástrico, localizados en el cuerpo gástrico y multifocal15,17,18.
El presente estudio tiene como objetivos caracterizar los niveles de PGI y PGII en población sin sintomatología gástrica y en pacientes con sintomatología gástrica, y evaluar la capacidad de discriminación del pepsinógeno I y la relación PGI/PGII para el diagnóstico serológico de atrofia gástrica en pacientes con sintomatología gástrica en dos poblaciones de riesgo opuesto para cáncer gástrico en Colombia.
Materiales y métodosPacientesParticiparon en este estudio 600 sujetos voluntarios sin sintomatología gástrica y se analizaron 544 muestras de suero de pacientes con sintomatología gástrica que formaron parte del estudio de casos y controles «Genotipos de Helicobacter pylori, polimorfismos de las citocinas inflamatorias y factores ambientales asociados a cáncer gástrico y lesiones preneoplásicas en Colombia».
Los sujetos participantes se reclutaron en los laboratorios clínicos de varios hospitales públicos y entidades de salud públicas y privadas en las ciudades de Tunja y Bogotá (zona de riesgo alto para cáncer gástrico), y en la ciudad de Barranquilla (zona de riesgo bajo para cáncer gástrico).
Ingresaron hombres y mujeres mayores de 29 años de edad, sin diagnóstico de gastritis en los últimos cinco años por endoscopia de vías digestivas altas, y residentes de las ciudades enunciadas. Se excluyeron sujetos: con cualquier tipo de cáncer, o que hubieran consultado por sintomatología gástrica o por una enfermedad crónica severa, como motivo de la última consulta médica; que hubieran tomado drogas anti-inflamatorias no esteroideas (AINES) en las dos semanas previas a la invitación a formar parte del estudio, y sujetos con dificultades para comprender y responder el cuestionario.
Las muestras de suero provenían de pacientes cuyos criterios de inclusión y exclusión fueron descritos previamente6. Brevemente, se incluyeron sueros de pacientes procedentes de las ciudades de Tunja, Bogotá y, Barranquilla, Santa Marta y Cartagena (estas últimas ubicadas en la zona de riesgo bajo) con sintomatología gástrica que consultaron a instituciones de salud del Estado y particulares localizadas en las ciudades enunciadas para un diagnóstico inicial de enfermedad gastroduodenal, y que no hubieran tomado antibióticos compuestos de bismuto, inhibidores de bomba de protones o drogas anti-inflamatorias no esteroideas (AINES) en las dos semanas previas a la invitación a formar parte del estudio.
A todos los 544 pacientes que contribuyeron con la muestra de suero se les realizó endoscopia de vías digestivas con toma de biopsias gástricas: 2 en antro, 1 en la incisura angularis,1 en curvatura mayor y 2 en cuerpo. El diagnóstico histopatológico se realizó con base en la clasificación actualizada de Sídney19, los criterios de Padova20 y Lauren21. Los parámetros histopatológicos de atrofia se describieron según la escala nominal planteada por el Sistema Actualizado de Sídney; el diagnóstico final fue el más avanzado de todas las biopsias de cada paciente, posterior a la segunda lectura de un patólogo de reconocimiento internacional. Se clasificaron como casos a todos los pacientes con lesiones preneoplásicas gástricas y cáncer gástrico, y los controles fueron pacientes con diagnóstico de gastritis no atrófica y normal. El ingreso de los pacientes se hizo de forma consecutiva. Para este estudio se excluyeron las muestras de pacientes con diagnóstico de úlcera duodenal.
A todos los participantes se les tomó una muestra de sangre de 15cm3, a los pacientes antes del examen de endoscopia y a los sujetos asintomáticos antes de la encuesta, y se les aplicó una encuesta que incluyó datos sociodemográficos y estilos de vida.
Los sujetos voluntarios asintomáticos y los pacientes voluntarios firmaron el consentimiento informado. El estudio fue aprobado por el Comité de Ética e Investigaciones del Instituto Nacional de Cancerología.
Determinación de los niveles séricos de PGI y PGII y anticuerpos IgG anti-H. pylori e IgG anti-CagALas concentraciones de PGI y PGII fueron determinadas por ELISA. Se empleó el estuche comercial Biohit Co., Ltda., Helsinky, Filandia. La determinación de los niveles séricos de PGI y PGII se realizó en suero. Se siguieron las indicaciones del fabricante; en cada placa de ELISA se incluyó un control positivo suministrado por el fabricante, se aceptaron los resultados si se obtenía el valor esperado de concentración de este control. Todas las pruebas se analizaron por duplicado y se calculó el promedio de las dos mediciones. El total de las muestras se analizaron.
La presencia de anticuerpos IgG contra H. pylori y de anticuerpos IgG contra CagA se evaluaron en suero, mediante un ensayo inmunoenzimático previamente validado en población mexicana22,23. En los ensayos (ELISAS) se utilizó como controles positivos un pool de 20 sueros de individuos positivos para H. pylori por prueba de aliento con C13 y serología, y como control negativo, sueros de individuos negativos por serología y prueba de aliento. El valor final para la determinación de los dos anticuerpos se dio por el promedio de dos mediciones. Un resultado igual o mayor a 1 Unidades/ELISA se consideró seropositivo para H. pylori y, el valor de corte para considerar un individuo seropositivo para CagA fue definido como un valor igual o mayor a 1,5 Unidades/ELISA. Los análisis serológicos no se realizaron en 5,3% (18 pacientes) por no contar con las muestras de suero.
Análisis estadísticoLa presencia de los anticuerpos IgG anti-H. pylori y anti-CagA se recodificó en una variable con cuatro categorías:
- a
IgG anti-H. pylori negativo y IgG anti-CagA– negativo.
- b
IgG anti-H. pylori positivo y anticuerpos IgG anti-CagA negativo.
- c
IgG anti-H. pylori negativos y anticuerpos anti-CagA positivos.
- d
anticuerpos IgG anti-H. pylori positivos y anticuerpos anti-CagA positivos.
Se calculó la mediana (Md) y el rango inter-cuartil (RI) de los niveles de PGI, PGII y la relación PGI/PGII; para establecer las diferencias en la distribución de los niveles de los PGI, PGII y PGI/PGII según las diferentes variables se utilizaron las pruebas de Mann-Whitney y Kruskal-Wallis.
Los análisis de los niveles de pepsinógeno, para el diagnóstico serológico de atrofia gástrica, se realizaron en 536 pacientes (193 con gastritis no atrófica y 343 con lesiones preneoplásicas y cáncer gástrico, en 8 pacientes con cáncer gástrico no se documentó la presencia de atrofia gástrica) que tuvieron muestra de suero y estudio histológico de biopsias gástricas.
El punto óptimo de corte para los niveles de PGI, PGII, PGI/PGII se identificó a través de la curva ROC, y la fórmula: √((1-sensibilidad)2+((0-(1-especificidad)2)). Este se definió como el mejor punto de los niveles de pepsinógeno para discriminar los diferentes grados histológicos de severidad de la atrofia gástrica en comparación con la gastritis no atrófica, según género, edad (≥50 años), localización de la atrofia gástrica, tener o no anticuerpos H. pylori positivos (anticuerpos IgG anti–H. pylori y anti-CagA positivos o uno de los dos positivos vs. IgG anti-H. pylori negativo y anti-CagA negativo) y la zona de riesgo de procedencia. Se calcularon los valores diagnósticos de sensibilidad, especificidad, valores predictivos, el índice de Youden y el área bajo la curva con sus IC 95% para cada uno de los puntos de corte establecidos.
Se consideró un valor significativo aquel con una p≤0,05. Los análisis se realizaron con el programa estadístico SPSS versión 18,0.
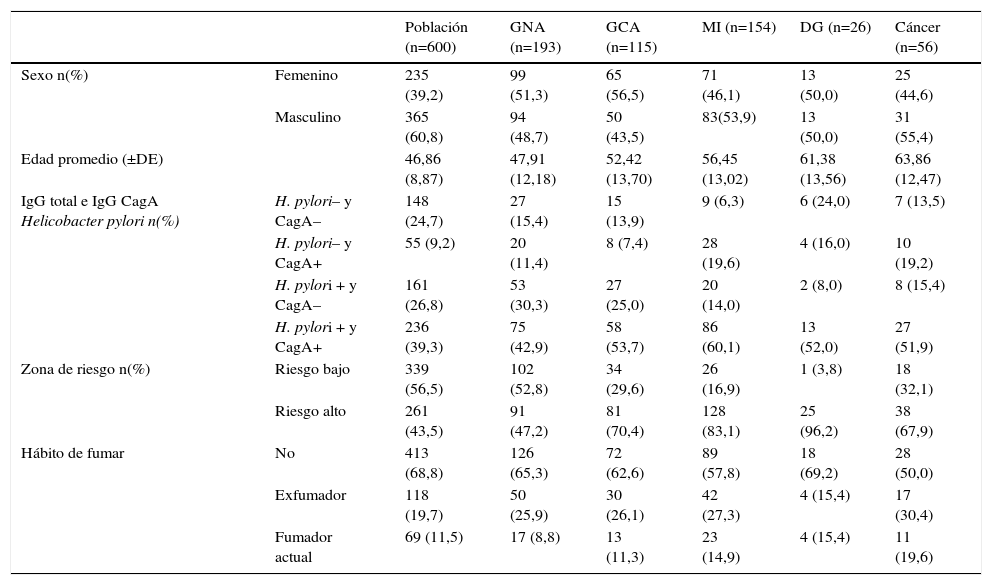
ResultadosLas características sociodemográficas, serológicas de H. pylori y de estilos de vida se presentan en la tabla 1. Del total de la muestra, el 19,0% (211) no presentó anticuerpos IgG anti-H. pylori ni anticuerpos IgG anti-CagA, en la población sin sintomatología gástrica correspondió al 24,7% (148) y en los pacientes al 12,6% (64) (p≤0,001). Los sujetos asintomáticos de la zona de riesgo alto presentaron mayor porcentaje de anticuerpos IgG anti-H. pylori positivos, 86,6% (226), en comparación con los sujetos de la zona de riesgo bajo, 67,0% (227) (p≤0,001); y no hubo diferencia en la proporción de sujetos con serología CagA positiva entre las dos zonas, 49,9% (169) en la zona de riesgo bajo y 46,7% (122) en la zona de riesgo alto (p=0,45).
Descripción de las características de la población de estudio
| Población (n=600) | GNA (n=193) | GCA (n=115) | MI (n=154) | DG (n=26) | Cáncer (n=56) | ||
|---|---|---|---|---|---|---|---|
| Sexo n(%) | Femenino | 235 (39,2) | 99 (51,3) | 65 (56,5) | 71 (46,1) | 13 (50,0) | 25 (44,6) |
| Masculino | 365 (60,8) | 94 (48,7) | 50 (43,5) | 83(53,9) | 13 (50,0) | 31 (55,4) | |
| Edad promedio (±DE) | 46,86 (8,87) | 47,91 (12,18) | 52,42 (13,70) | 56,45 (13,02) | 61,38 (13,56) | 63,86 (12,47) | |
| IgG total e IgG CagA Helicobacter pylori n(%) | H. pylori– y CagA– | 148 (24,7) | 27 (15,4) | 15 (13,9) | 9 (6,3) | 6 (24,0) | 7 (13,5) |
| H. pylori– y CagA+ | 55 (9,2) | 20 (11,4) | 8 (7,4) | 28 (19,6) | 4 (16,0) | 10 (19,2) | |
| H. pylori + y CagA– | 161 (26,8) | 53 (30,3) | 27 (25,0) | 20 (14,0) | 2 (8,0) | 8 (15,4) | |
| H. pylori + y CagA+ | 236 (39,3) | 75 (42,9) | 58 (53,7) | 86 (60,1) | 13 (52,0) | 27 (51,9) | |
| Zona de riesgo n(%) | Riesgo bajo | 339 (56,5) | 102 (52,8) | 34 (29,6) | 26 (16,9) | 1 (3,8) | 18 (32,1) |
| Riesgo alto | 261 (43,5) | 91 (47,2) | 81 (70,4) | 128 (83,1) | 25 (96,2) | 38 (67,9) | |
| Hábito de fumar | No | 413 (68,8) | 126 (65,3) | 72 (62,6) | 89 (57,8) | 18 (69,2) | 28 (50,0) |
| Exfumador | 118 (19,7) | 50 (25,9) | 30 (26,1) | 42 (27,3) | 4 (15,4) | 17 (30,4) | |
| Fumador actual | 69 (11,5) | 17 (8,8) | 13 (11,3) | 23 (14,9) | 4 (15,4) | 11 (19,6) |
SD: desviación estándar.
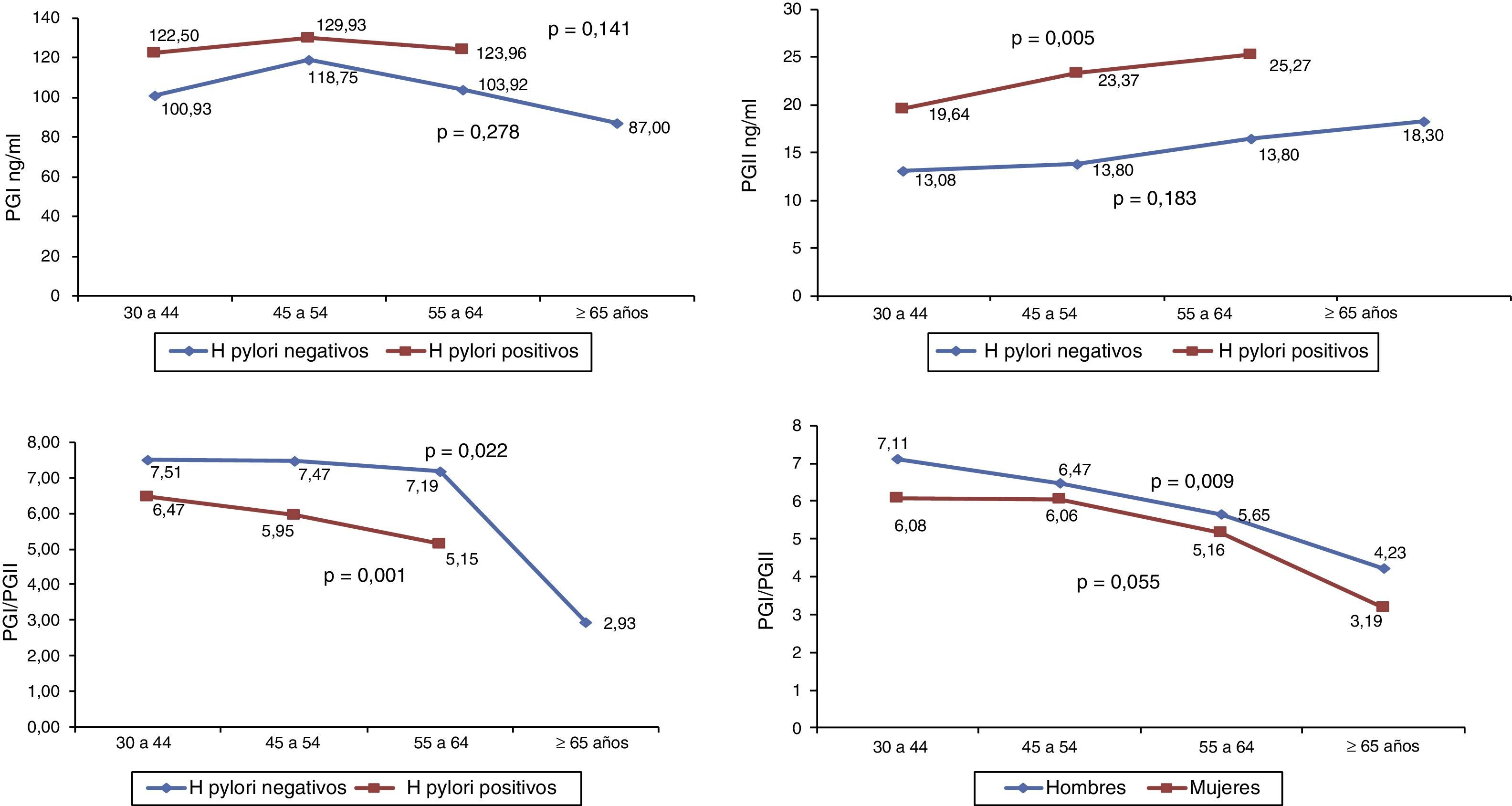
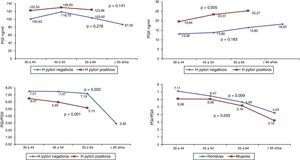
En la población sin sintomatología gástrica se observó que a medida que aumenta la edad el PGI permanece estable, el PGII aumenta y la relación PGI/PGII disminuye. Los niveles de PGI y PGII son mayores en los sujetos con anticuerpos IgG anti-H. pylori positivos, con un aumento significativo en los niveles PGII con el envejecimiento (p=0,005); y la relación PGI/PGII disminuye con el avance de la edad en los sujetos con anticuerpos positivos y negativos para H. pylori (p≤0,05), con valores mayores para los sujetos H. pylori positivos. No se reporta la mediana de pepsinógeno en el grupo de 65 y más años de edad en los sujetos con H. pylori positivo por el número bajo de casos, cinco (fig. 1). La relación entre PGI/PGII y la edad según genero mostró valores mayores en hombres en comparación con las mujeres y, disminución en ambos géneros a medida que aumenta la edad (p<0,05) (fig. 1).
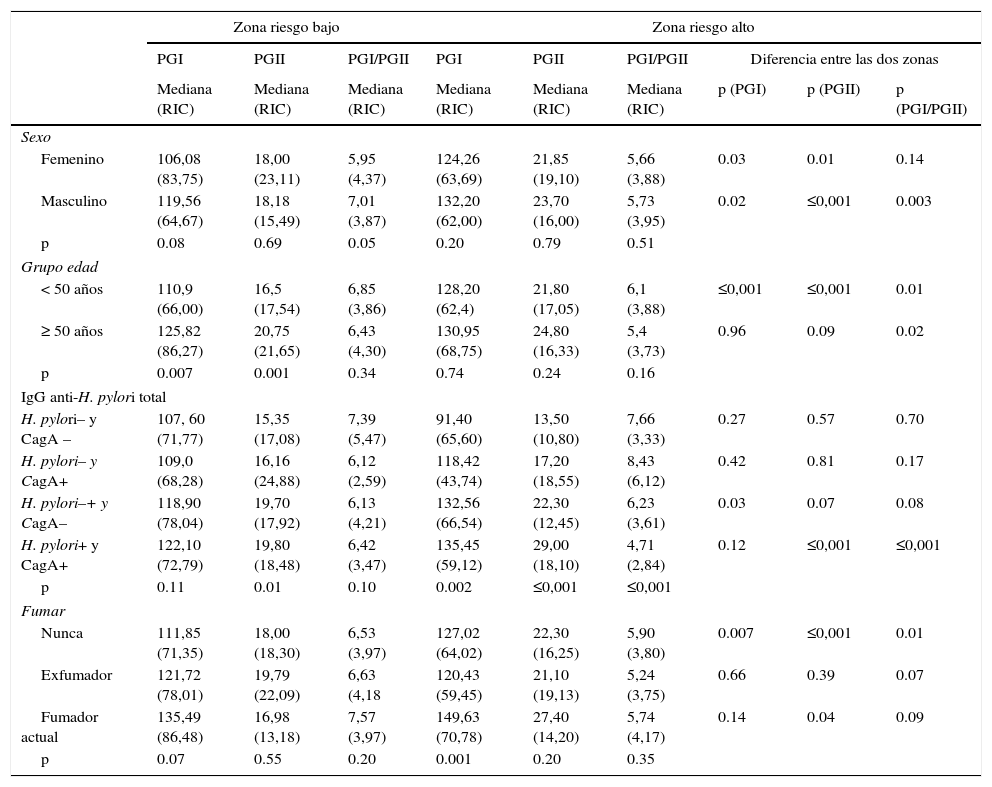
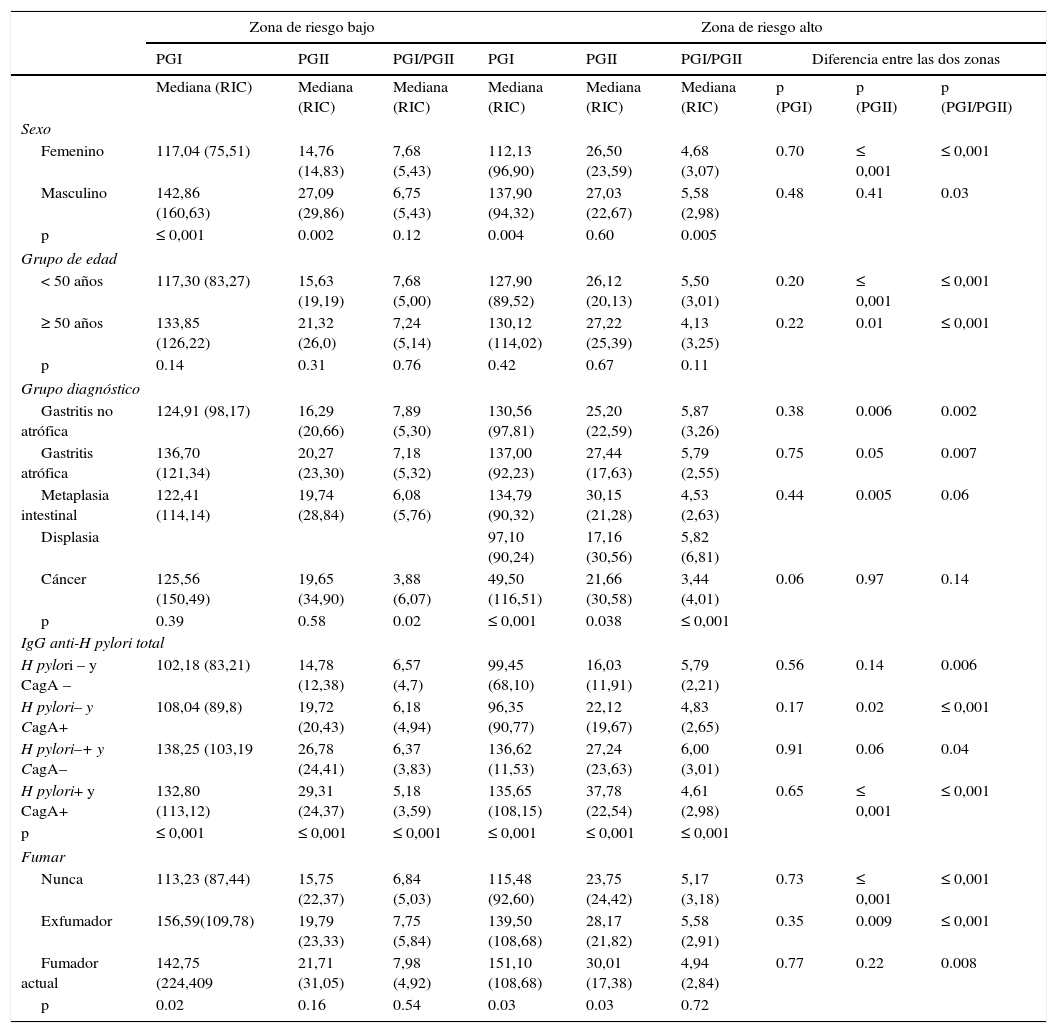
Niveles de PGI, PGII y PGI/PGIIEn la población sin sintomatología gástrica se hallaron diferencias en los niveles de PGI, PGII y PGI/PGII según zona de riesgo. Los hombres y las mujeres, y los sujetos menores de 50 años de edad de la zona de riesgo alto presentaron valores de PGI y PGII mayores y PGI/PGII menores en comparación con los sujetos de la zona de riesgo bajo (p<0,05). En los sujetos mayores de 50 años no hubo diferencias en los niveles de PGI y PGII y la relación PGI/PGII fue menor en los sujetos de la zona de riesgo alto. Los sujetos con serología positiva para H. pylori y CagA de la zona de riesgo alto mostraron valores de PGI y PGII mayores y PGI/PGII menores en relación con los sujetos con serología positiva para H. pylori y CagA de la zona de riesgo bajo; sin embargo, la diferencia en el nivel promedio de PGl no fue significativa (tabla 2a) Con respecto al hábito de fumar se observó que los niveles de PGI, PGII son mayores y la relación PGI/PGII es menor en los no fumadores de la zona de riesgo alto en comparación con los sujetos de la zona de riesgo bajo (tabla 2a).
a. Niveles de pepsinógeno según sexo, grupos de edad, serología H. pylori y hábito de fumar según zona de riesgo en la población sin sintomatología gástrica
| Zona riesgo bajo | Zona riesgo alto | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| PGI | PGII | PGI/PGII | PGI | PGII | PGI/PGII | Diferencia entre las dos zonas | |||
| Mediana (RIC) | Mediana (RIC) | Mediana (RIC) | Mediana (RIC) | Mediana (RIC) | Mediana (RIC) | p (PGI) | p (PGII) | p (PGI/PGII) | |
| Sexo | |||||||||
| Femenino | 106,08 (83,75) | 18,00 (23,11) | 5,95 (4,37) | 124,26 (63,69) | 21,85 (19,10) | 5,66 (3,88) | 0.03 | 0.01 | 0.14 |
| Masculino | 119,56 (64,67) | 18,18 (15,49) | 7,01 (3,87) | 132,20 (62,00) | 23,70 (16,00) | 5,73 (3,95) | 0.02 | ≤0,001 | 0.003 |
| p | 0.08 | 0.69 | 0.05 | 0.20 | 0.79 | 0.51 | |||
| Grupo edad | |||||||||
| < 50 años | 110,9 (66,00) | 16,5 (17,54) | 6,85 (3,86) | 128,20 (62,4) | 21,80 (17,05) | 6,1 (3,88) | ≤0,001 | ≤0,001 | 0.01 |
| ≥ 50 años | 125,82 (86,27) | 20,75 (21,65) | 6,43 (4,30) | 130,95 (68,75) | 24,80 (16,33) | 5,4 (3,73) | 0.96 | 0.09 | 0.02 |
| p | 0.007 | 0.001 | 0.34 | 0.74 | 0.24 | 0.16 | |||
| IgG anti-H. pylori total | |||||||||
| H. pylori– y CagA – | 107, 60 (71,77) | 15,35 (17,08) | 7,39 (5,47) | 91,40 (65,60) | 13,50 (10,80) | 7,66 (3,33) | 0.27 | 0.57 | 0.70 |
| H. pylori– y CagA+ | 109,0 (68,28) | 16,16 (24,88) | 6,12 (2,59) | 118,42 (43,74) | 17,20 (18,55) | 8,43 (6,12) | 0.42 | 0.81 | 0.17 |
| H. pylori–+ y CagA– | 118,90 (78,04) | 19,70 (17,92) | 6,13 (4,21) | 132,56 (66,54) | 22,30 (12,45) | 6,23 (3,61) | 0.03 | 0.07 | 0.08 |
| H. pylori+ y CagA+ | 122,10 (72,79) | 19,80 (18,48) | 6,42 (3,47) | 135,45 (59,12) | 29,00 (18,10) | 4,71 (2,84) | 0.12 | ≤0,001 | ≤0,001 |
| p | 0.11 | 0.01 | 0.10 | 0.002 | ≤0,001 | ≤0,001 | |||
| Fumar | |||||||||
| Nunca | 111,85 (71,35) | 18,00 (18,30) | 6,53 (3,97) | 127,02 (64,02) | 22,30 (16,25) | 5,90 (3,80) | 0.007 | ≤0,001 | 0.01 |
| Exfumador | 121,72 (78,01) | 19,79 (22,09) | 6,63 (4,18 | 120,43 (59,45) | 21,10 (19,13) | 5,24 (3,75) | 0.66 | 0.39 | 0.07 |
| Fumador actual | 135,49 (86,48) | 16,98 (13,18) | 7,57 (3,97) | 149,63 (70,78) | 27,40 (14,20) | 5,74 (4,17) | 0.14 | 0.04 | 0.09 |
| p | 0.07 | 0.55 | 0.20 | 0.001 | 0.20 | 0.35 | |||
p: Kruskal-Wallis, Mann-Whitney.
En el grupo de pacientes las mujeres de la zona de riesgo bajo presentaron niveles menores de PGII y mayores de PGI/PGII en comparación con las mujeres en la zona de riesgo alto, y los hombres de la zona de riesgo bajo niveles mayores de PGI/PGII en comparación con los de la zona de riesgo alto. Los niveles de PGII y PGI/PGII según la edad difieren entre los pacientes de las dos zonas de riesgo. A medida que aumenta la severidad de las lesiones gástricas los niveles de PGI, PGII y PGI/PGII disminuyen de forma significativa en la zona de riesgo alto, y solamente la relación PGI/PGII mostró una disminución en la zona de riesgo bajo. Se observó una diferencia en los niveles de PGII y PGI/PGII en los pacientes con lesiones preneoplásicas entre las dos zonas, excepto para el diagnóstico de cáncer gástrico; y al interior de la zona de riesgo alto se halló una disminución significativa en los niveles de pepsinógeno a medida que aumentan la severidad de las lesiones, y en la zona de riesgo bajo esta diferencia se observó en la relación PGI/PGII. Cuando se compara los niveles de pepsinógeno según la presencia de anticuerpos IgG anti-H. pylori y CagA en cada zona se observa un aumento de los niveles de PGI y PGII y una disminución de PGI/PGII significativos. Los niveles de PGI/PGII en los diferentes estatus de los anticuerpos IgG anti-H. pylori y CagA son menores en la zona de riesgo alto en comparación con los de la zona de riesgo bajo y, los sujetos con anticuerpos IgG anti-CagA positivos de la zona de riesgo alto tienen niveles de PGII mayores comparados con los pacientes de la zona de riesgo bajo. En relación con el hábito de fumar, los niveles de PGI/PGII son menores en los sujetos de la zona de riesgo alto comparados con los de la zona de riesgo bajo (tabla 2b).
b. Niveles de pepsinógeno según sexo, grupos de edad, diagnóstico clínico, serología H pylori y hábito de fumar según zona de riesgo en el grupo de pacientes
| Zona de riesgo bajo | Zona de riesgo alto | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| PGI | PGII | PGI/PGII | PGI | PGII | PGI/PGII | Diferencia entre las dos zonas | |||
| Mediana (RIC) | Mediana (RIC) | Mediana (RIC) | Mediana (RIC) | Mediana (RIC) | Mediana (RIC) | p (PGI) | p (PGII) | p (PGI/PGII) | |
| Sexo | |||||||||
| Femenino | 117,04 (75,51) | 14,76 (14,83) | 7,68 (5,43) | 112,13 (96,90) | 26,50 (23,59) | 4,68 (3,07) | 0.70 | ≤ 0,001 | ≤ 0,001 |
| Masculino | 142,86 (160,63) | 27,09 (29,86) | 6,75 (5,43) | 137,90 (94,32) | 27,03 (22,67) | 5,58 (2,98) | 0.48 | 0.41 | 0.03 |
| p | ≤ 0,001 | 0.002 | 0.12 | 0.004 | 0.60 | 0.005 | |||
| Grupo de edad | |||||||||
| < 50 años | 117,30 (83,27) | 15,63 (19,19) | 7,68 (5,00) | 127,90 (89,52) | 26,12 (20,13) | 5,50 (3,01) | 0.20 | ≤ 0,001 | ≤ 0,001 |
| ≥ 50 años | 133,85 (126,22) | 21,32 (26,0) | 7,24 (5,14) | 130,12 (114,02) | 27,22 (25,39) | 4,13 (3,25) | 0.22 | 0.01 | ≤ 0,001 |
| p | 0.14 | 0.31 | 0.76 | 0.42 | 0.67 | 0.11 | |||
| Grupo diagnóstico | |||||||||
| Gastritis no atrófica | 124,91 (98,17) | 16,29 (20,66) | 7,89 (5,30) | 130,56 (97,81) | 25,20 (22,59) | 5,87 (3,26) | 0.38 | 0.006 | 0.002 |
| Gastritis atrófica | 136,70 (121,34) | 20,27 (23,30) | 7,18 (5,32) | 137,00 (92,23) | 27,44 (17,63) | 5,79 (2,55) | 0.75 | 0.05 | 0.007 |
| Metaplasia intestinal | 122,41 (114,14) | 19,74 (28,84) | 6,08 (5,76) | 134,79 (90,32) | 30,15 (21,28) | 4,53 (2,63) | 0.44 | 0.005 | 0.06 |
| Displasia | 97,10 (90,24) | 17,16 (30,56) | 5,82 (6,81) | ||||||
| Cáncer | 125,56 (150,49) | 19,65 (34,90) | 3,88 (6,07) | 49,50 (116,51) | 21,66 (30,58) | 3,44 (4,01) | 0.06 | 0.97 | 0.14 |
| p | 0.39 | 0.58 | 0.02 | ≤ 0,001 | 0.038 | ≤ 0,001 | |||
| IgG anti-H pylori total | |||||||||
| H pylori – y CagA – | 102,18 (83,21) | 14,78 (12,38) | 6,57 (4,7) | 99,45 (68,10) | 16,03 (11,91) | 5,79 (2,21) | 0.56 | 0.14 | 0.006 |
| H pylori– y CagA+ | 108,04 (89,8) | 19,72 (20,43) | 6,18 (4,94) | 96,35 (90,77) | 22,12 (19,67) | 4,83 (2,65) | 0.17 | 0.02 | ≤ 0,001 |
| H pylori–+ y CagA– | 138,25 (103,19 | 26,78 (24,41) | 6,37 (3,83) | 136,62 (11,53) | 27,24 (23,63) | 6,00 (3,01) | 0.91 | 0.06 | 0.04 |
| H pylori+ y CagA+ | 132,80 (113,12) | 29,31 (24,37) | 5,18 (3,59) | 135,65 (108,15) | 37,78 (22,54) | 4,61 (2,98) | 0.65 | ≤ 0,001 | ≤ 0,001 |
| p | ≤ 0,001 | ≤ 0,001 | ≤ 0,001 | ≤ 0,001 | ≤ 0,001 | ≤ 0,001 | |||
| Fumar | |||||||||
| Nunca | 113,23 (87,44) | 15,75 (22,37) | 6,84 (5,03) | 115,48 (92,60) | 23,75 (24,42) | 5,17 (3,18) | 0.73 | ≤ 0,001 | ≤ 0,001 |
| Exfumador | 156,59(109,78) | 19,79 (23,33) | 7,75 (5,84) | 139,50 (108,68) | 28,17 (21,82) | 5,58 (2,91) | 0.35 | 0.009 | ≤ 0,001 |
| Fumador actual | 142,75 (224,409 | 21,71 (31,05) | 7,98 (4,92) | 151,10 (108,68) | 30,01 (17,38) | 4,94 (2,84) | 0.77 | 0.22 | 0.008 |
| p | 0.02 | 0.16 | 0.54 | 0.03 | 0.03 | 0.72 | |||
p: Kruskal-Wallis, Mann-Whitney.
La atrofia gástrica se documentó en todas las lesiones preneoplásicas, excepto en 8 pacientes con cáncer gástrico, en 5 no se documentó atrofia en las biopsias en la valoración histológica por los diferentes patólogos, y en 3 casos no fue posible tomar biopsias adicionales al tumor por la extensión de la masa.
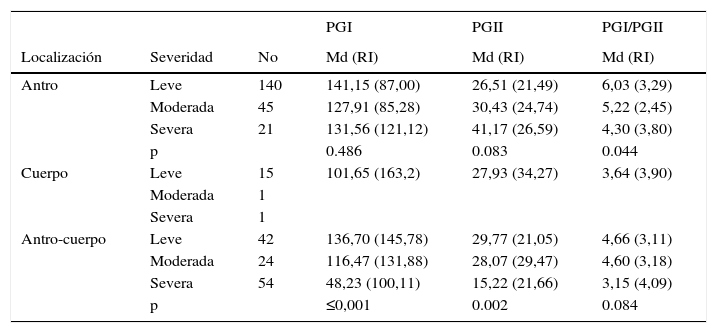
En el antro se localizaron el 60,05% (206) de las atrofias, con una diferencia significativa en la relación PGI/PGII según grado de severidad. En el cuerpo, se localizaron el 4,95% (17) de las atrofias, el 88,23% (15) de estas eran leves. En el antro-cuerpo (multifocal) se localizaron el 34,98% (120) de las atrofias, con niveles de pepsinógeno más bajos en la atrofia severa, pero sin ser significativos en la razón PGI/PGII (tabla 3).
Niveles de pepsinógeno según localización y severidad de la atrofia gástrica
| PGI | PGII | PGI/PGII | |||
|---|---|---|---|---|---|
| Localización | Severidad | No | Md (RI) | Md (RI) | Md (RI) |
| Antro | Leve | 140 | 141,15 (87,00) | 26,51 (21,49) | 6,03 (3,29) |
| Moderada | 45 | 127,91 (85,28) | 30,43 (24,74) | 5,22 (2,45) | |
| Severa | 21 | 131,56 (121,12) | 41,17 (26,59) | 4,30 (3,80) | |
| p | 0.486 | 0.083 | 0.044 | ||
| Cuerpo | Leve | 15 | 101,65 (163,2) | 27,93 (34,27) | 3,64 (3,90) |
| Moderada | 1 | ||||
| Severa | 1 | ||||
| Antro-cuerpo | Leve | 42 | 136,70 (145,78) | 29,77 (21,05) | 4,66 (3,11) |
| Moderada | 24 | 116,47 (131,88) | 28,07 (29,47) | 4,60 (3,18) | |
| Severa | 54 | 48,23 (100,11) | 15,22 (21,66) | 3,15 (4,09) | |
| p | ≤0,001 | 0.002 | 0.084 |
Md: mediana. RI: rango intercuartíleo; p: Kruskall-Wallis.
Según la localización de la atrofia (antro, cuerpo y multifocal) la mediana de los niveles de PGI y PGI/PGII mostraron diferencias significativas (p≤0,001) (PGI: 137,0g/ml; 101,65 ng/ml; 104,0 ng/ml respectivamente y, PGI/PGII: 5,77; 3,31 y 3,94 respectivamente). De los 54 casos de atrofia severa multifocal el 40,72 (22 casos) correspondían a cáncer, el 22,6% (12 casos) a displasia y el 37,03% (20 casos) a MI; y de los 21 casos de atrofia severa en antro el 38,09% (8 casos) eran cáncer, el 23,8% (5 casos) displasias y el 38,09% (8 casos) eran MI.
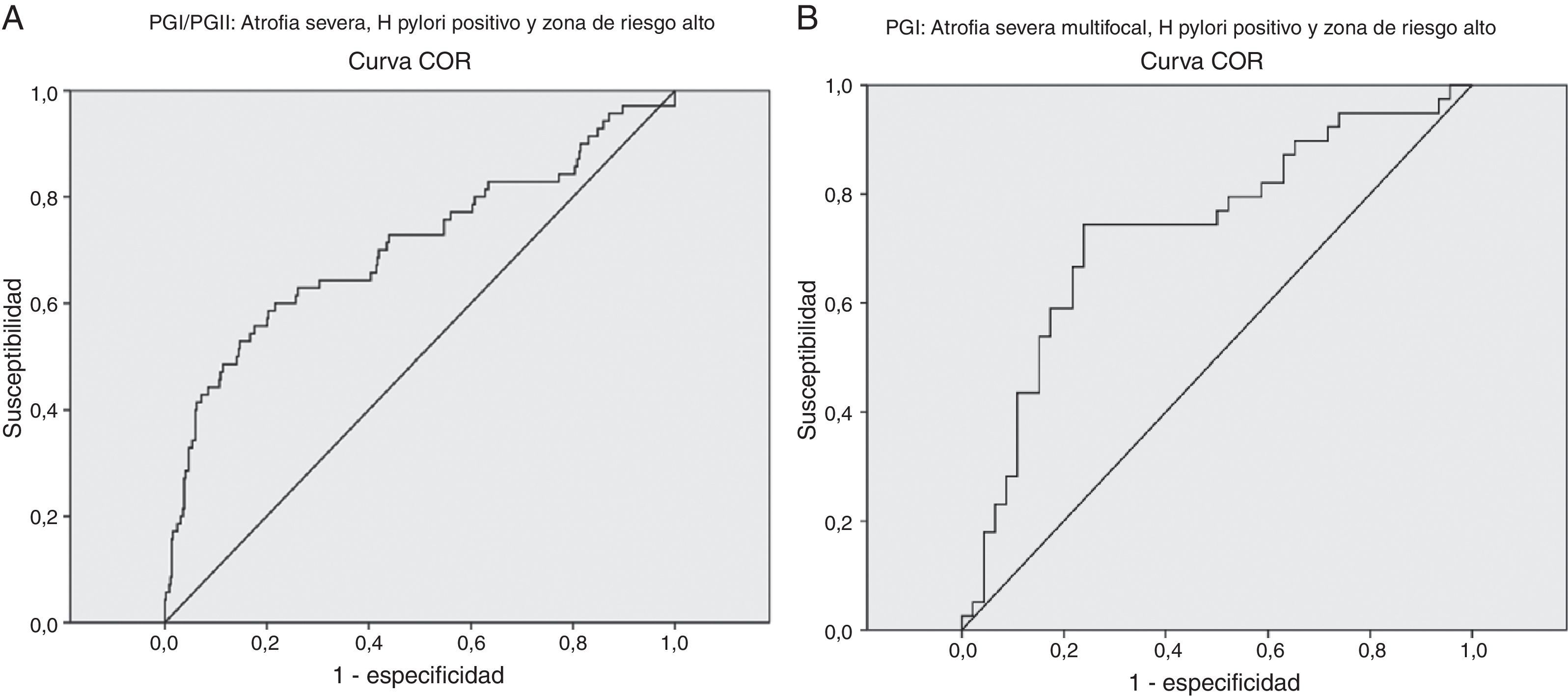
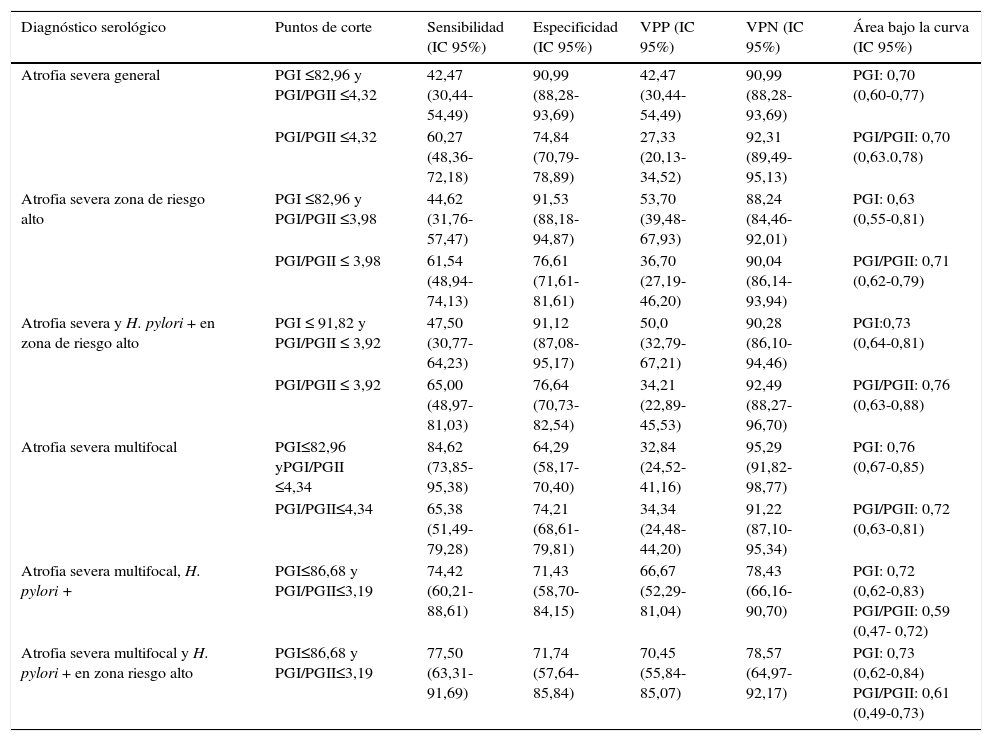
Valores diagnósticos de PGI, PGI/PGII para detección de la atrofiaLos análisis de precisión diagnóstica de PGI y PGI/PGII mostraron resultados positivos para el grado severo de la atrofia, la localización multifocal, la presencia de anticuerpos para H. pylori positivos y la zona de riesgo alto en forma individual y conjunta; no se logró un diagnóstico serológico diferencial para los análisis según edad, sexo, localización y severidad de la atrofia, y presencia de anticuerpos de H pylori en los pacientes de la zona de riesgo alto (datos no mostrados). Con un área bajo la curva de 76%, la relación PGI/PGII ≤ 3,92 detectó pacientes con atrofia severa y anticuerpos IgG anti-H. pylori positivos en la zona de riesgo alto, con una sensibilidad de 65%, especificidad de 76,64%, un 7,02% de falsos negativos, un 19% de falsos positivos, una precisión de 74,70%, e Índice de Youden de 0,43 (0,27-0,59); y con un área bajo la curva de 73%, el PGI≤ 86,68 y PGI/PGII ≤ 3,19 detectó atrofia severa multifocal con anticuerpos IgG anti-H. pylori positivos en la zona de riesgo alto, con una sensibilidad de 77,50%, una especificidad de 71,74%, un 10,5% de falsos negativos, un 15,1% de falsos positivos, una precisión de 70,45%, e Índice de Youden de 0,49 (fig. 2) (tabla 4). En la tabla 4 se presentan los resultados de los análisis de prueba diagnóstica que presentaron un área bajo la curva aceptable.
Valores diagnósticos de PGI y PGI/PGII para detección de atrofia severa
| Diagnóstico serológico | Puntos de corte | Sensibilidad (IC 95%) | Especificidad (IC 95%) | VPP (IC 95%) | VPN (IC 95%) | Área bajo la curva (IC 95%) |
|---|---|---|---|---|---|---|
| Atrofia severa general | PGI ≤82,96 y PGI/PGII ≤4,32 | 42,47 (30,44-54,49) | 90,99 (88,28-93,69) | 42,47 (30,44-54,49) | 90,99 (88,28-93,69) | PGI: 0,70 (0,60-0,77) |
| PGI/PGII ≤4,32 | 60,27 (48,36-72,18) | 74,84 (70,79-78,89) | 27,33 (20,13-34,52) | 92,31 (89,49-95,13) | PGI/PGII: 0,70 (0,63.0,78) | |
| Atrofia severa zona de riesgo alto | PGI ≤82,96 y PGI/PGII ≤3,98 | 44,62 (31,76-57,47) | 91,53 (88,18-94,87) | 53,70 (39,48-67,93) | 88,24 (84,46-92,01) | PGI: 0,63 (0,55-0,81) |
| PGI/PGII ≤ 3,98 | 61,54 (48,94-74,13) | 76,61 (71,61-81,61) | 36,70 (27,19-46,20) | 90,04 (86,14-93,94) | PGI/PGII: 0,71 (0,62-0,79) | |
| Atrofia severa y H. pylori + en zona de riesgo alto | PGI ≤ 91,82 y PGI/PGII ≤ 3,92 | 47,50 (30,77-64,23) | 91,12 (87,08-95,17) | 50,0 (32,79-67,21) | 90,28 (86,10-94,46) | PGI:0,73 (0,64-0,81) |
| PGI/PGII ≤ 3,92 | 65,00 (48,97-81,03) | 76,64 (70,73-82,54) | 34,21 (22,89-45,53) | 92,49 (88,27-96,70) | PGI/PGII: 0,76 (0,63-0,88) | |
| Atrofia severa multifocal | PGI≤82,96 yPGI/PGII ≤4,34 | 84,62 (73,85-95,38) | 64,29 (58,17-70,40) | 32,84 (24,52-41,16) | 95,29 (91,82-98,77) | PGI: 0,76 (0,67-0,85) |
| PGI/PGII≤4,34 | 65,38 (51,49-79,28) | 74,21 (68,61-79,81) | 34,34 (24,48-44,20) | 91,22 (87,10-95,34) | PGI/PGII: 0,72 (0,63-0,81) | |
| Atrofia severa multifocal, H. pylori + | PGI≤86,68 y PGI/PGII≤3,19 | 74,42 (60,21-88,61) | 71,43 (58,70-84,15) | 66,67 (52,29-81,04) | 78,43 (66,16-90,70) | PGI: 0,72 (0,62-0,83) PGI/PGII: 0,59 (0,47- 0,72) |
| Atrofia severa multifocal y H. pylori + en zona riesgo alto | PGI≤86,68 y PGI/PGII≤3,19 | 77,50 (63,31-91,69) | 71,74 (57,64-85,84) | 70,45 (55,84-85,07) | 78,57 (64,97-92,17) | PGI: 0,73 (0,62-0,84) PGI/PGII: 0,61 (0,49-0,73) |
En la población asintomática se identificaron sujetos con los valores diagnósticos de pepsinógeno para atrofia gástrica en los pacientes; el 16,5% (99) de los sujetos mostraron niveles de PGI/PGII ≤3,92, en la zona de riesgo bajo el 42,4% (42) y en la zona de riesgo alto el 57,6% (57) (p=0,002). En esta población, los sujetos con serología H. pylori negativa y valores de PGI≤ 82,96μg/ml y PGI/PGII ≤4,32 (atrofia severa general), se identificó una proporción mayor en la zona de riesgo alto en comparación con la zona de riesgo bajo (p=0,02) (20,0% (7) y 7,1% (8) respectivamente).
DiscusiónLos resultados del presente estudio mostraron una capacidad diagnóstica aceptable del PGI y PGI/PGII conjuntamente en la detección de atrofia gástrica en pacientes colombianos. Los valores de PGI, PGII y PGI/PGII en población sin sintomatología gástrica y en pacientes difieren en algunas de las características entre poblaciones de riesgo opuesto, y el pepsinógeno mostró una capacidad para discriminar la atrofia por severidad y localización, con mayor precisión diagnóstica en pacientes de la zona de riesgo alto y con anticuerpos IgG anti-H. pylori positivos.
Los niveles promedio del pepsinógeno observados mostraron resultados diferentes en relación con: la edad, el género, la zona de riesgo de procedencia, la serología de H. pylori, la localización gástrica de la atrofia, la severidad de la atrofia y algunos estilos de vida, como se ha reportado en otros estudios10,24–27.
El principal factor conocido que afecta la secreción de ácido gástrico es la infección por H. pylori. Autores han reportado que los niveles séricos de PGI y PGI/PGII se correlacionan positivamente con la secreción de ácido26. En el presente estudio se observó el aumento de los valores de PGI y PGII y una disminución de la relación PGI/PGII en sujetos y pacientes H. pylori positivos comparados con los H. pylori negativos, hallazgos consistentes con los reportados en otras publicaciones28–31, lo que indica un proceso inflamatorio en los sujetos asintomáticos y en los pacientes refleja el efecto principal de la infección por H. pylori, independiente de la presencia de las diferentes lesiones preneoplásicas, datos acordes con otras publicaciones26,32. La no diferencia en los niveles de PGI en los sujetos y pacientes con anticuerpos anti-CagA está en concordancia con otras investigaciones que hallaron similar cantidad de secreción de ácido en infecciones con H. pylori CagA positivo y negativo26,28.
A medida que aumenta la edad se observaron cambios en los niveles de pepsinógeno, hallazgo reportado previamente30,33. Se desconoce el mecanismo por el cual se aumenta la secreción de ácido con el envejecimiento en sujetos no infectados por H. pylori34. El incremento significativo en PGII en sujetos H. pylori positivos puede relacionarse con el proceso inflamatorio del estómago35 y la disminución de PGI en sujetos mayores y H. pylori positivos se podría explicar parcialmente por una prevalencia mayor de gastritis corporal severa y atrofia30,34, o por un efecto de cohorte36.
En el grupo de pacientes la disminución significativa en los valores de PGI y PGI/PGII observada con el aumento de la edad se podría deber a la presencia de lesiones gástricas más severas a edades mayores, y a la presencia de infección por H. pylori en los diferentes grupos de edad26 o a la presencia de infección por H. pylori fundamentalmente, como lo plantean otros autores34.
Los niveles de pepsinógeno en los hombres fueron mayores en relación con las mujeres, resultado encontrado en estudios previos26;30. Esta diferencia puede deberse en parte a que los hombres presentan mayor salida de ácido gástrico, porque poseen una masa de células parietales mayor, dada por un área y superficie gástrica mayor en comparación a las mujeres26. Para otros autores, la diferencia podría deberse a factores hormonales: la testosterona y el estradiol tienen efectos diferentes en la secreción de ácido en respuesta a la infección por H. pylori, efecto observado en poblaciones con alta incidencia de cáncer gástrico30,34.
Otro factor que puede afectar los niveles de pepsinógeno es el hábito de fumar. Los fumadores presentaron niveles promedios de PGI y PGII más altos que los no fumadores, hallazgo reportado previamente26. La nicotina estimula la secreción de ácido, y en los fumadores crónicos se estimula el nervio vago, que induce a las células parietales a aumentar la secreción de ácido37.
En el presente estudio, los niveles de pepsinógeno difieren entre sujetos sin sintomatología gástrica según zona de riesgo de procedencia. Los sujetos de la zona de riesgo alto presentaron niveles de PGI y PGII mayores y PGI/PGII menores, significativos en determinados estratos en los análisis por género, edad, y serología positiva para H. pylori y CagA en comparación con los sujetos de la zona de riesgo bajo.
También, se halló una proporción mayor de sujetos de esta zona de riesgo con diagnóstico serológico de atrofia severa y, atrofia severa con serología negativa para H. pylori, según los criterios definidos para atrofia en este estudio. Estos resultados se podrían explicar por la proporción mayor hallada de anticuerpos IgG anti-H. pylori y la presencia de gastritis, y posiblemente por la interacción genética ancestral del hospedero y la bacteria, como recientemente se publicó38, características indicadoras de una población a mayor riesgo de presentar cáncer gástrico.
En un estudio, similar al realizado, en población de la China se reportaron resultados similares. Los autores sugieren que la proporción mayor de sujetos sin infección con PGI y PGI/PGII bajos en la ciudad con mayor mortalidad podía deberse a factores adicionales a la infección: dieta, diferencias genéticas y estilos de vida39, concepto que igualmente aplicaría a la población de este estudio. En otras poblaciones de riesgo opuesto no se observaron estas diferencias debido a la poca prevalencia de lesiones preneoplásicas que anteceden la presencia de cáncer gástrico en la región de riesgo alto33.
En el grupo de pacientes de la zona de riesgo alto los niveles de PGI y PGII fueron mayores y los de PGI/PGII menores en comparación con los de la zona de riesgo bajo, diferencias significativas para PGII y PGI/PGII, en relación con: el género; la edad; el diagnóstico histológico; la presencia de anticuerpos para H. pylori, y el hábito de fumar. En los pacientes con cáncer no se observó diferencias en los niveles de pepsinógeno entre las dos zonas de riesgo. Los niveles de PGI y PGI/PGII fueron más bajos en los pacientes con cáncer, indicadores de daño severo a nivel morfológico y funcional de la mucosa gástrica, resultado reportado previamente40–43. En la atrofia, la disminución de los niveles de pepsinógeno se debe a la pérdida de las células principales las cuales son reemplazadas por las células glandulares pilóricas. Diferentes estudios muestran niveles bajos de PGI y PGI/PGII en atrofia y metaplasia intestinal, según grado de severidad31 o niveles bajos significativos en los pacientes con atrofia en comparación con los de metaplasia y displasia gástrica18. Los resultados presentes mostraron niveles bajos de PGI/PGII en la MI y de PGI en la displasia, indicadores de la presencia de la atrofia severa a partir de la metaplasia intestinal y la asociación positiva de la serología de H. pylori y CagA en los pacientes con MI y displasia, no así para GCA6,44.
En población japonesa y asiática la atrofia está localizada preferentemente en el cuerpo en comparación con población europea34,45, y en poblaciones latinas la localización es mayor en antro, con porcentajes en cuerpo entre 4,7% y 13,9%9,46,47, resultados similares a los del presente estudio.
Los reportes de la literatura indican que la atrofia y la metaplasia intestinal en antro y cuerpo se correlacionan negativamente con la secreción de ácido26; el PGI bajo es un fuerte predictor de atrofia corporal8,10,26, o en conjunto con la relación PGI/PGII baja indican atrofia severa en el cuerpo o multifocal, esta última con valores más extremos y con riesgo mayor de presentar cáncer gástrico29,42,48; y la atrofia severa en el antro se asocia preferentemente con una relación PGI/PGII baja42. Aunque la localización principal de las lesiones se halló en el antro, confirmándose el grado severo con la relación PGI/PGII baja (14,2% de los casos de cáncer, 19,2% de las displasias y 5,1% de las MI), los niveles de PGI, PGII y PGI/PGII bajos se observaron en las atrofias severas con localización multifocal, que correspondió a la mayoría de los casos de las lesiones avanzadas31,42: 39,2% de cáncer, 46,5% de displasia y 12,3% de MI; condiciones que confirman el diagnóstico avanzado en los pacientes con sintomatología gástrica que consultan para un diagnóstico inicial de enfermedad gastroduodenal en estas poblaciones.
En el presente estudio se hallaron niveles altos de pepsinógeno, similares a los de las poblaciones asiáticas (PGI>90ng/ml)36,43, en comparación con las poblaciones occidentales y japonesas (PGI<70ng/ml)36. La evaluación conjunta de PGI y la relación PGI/PGII10,49, o solo la relación PGI/PGII8,15,46 muestran una precisión para el diagnóstico de atrofia, aunque la relación PGI/PGII puede estar afectada por la pangastritis50,51. Otros estudios muestran poca utilidad del pepsinógeno para el diagnóstico de atrofia13,14,33.
En este estudio los niveles de PGI junto con el PGI/PGII identificaron con mayor precisión la atrofia severa, con valores superiores a los reportados para atrofia en general18,50,52 y, para tamizaje de cáncer gástrico y lesiones preneoplásicas en otras poblaciones (PGI≤70,0 ng/mL y PGI/PGII ≤3.0)10–12,53.
La relación PGI/PGII sola también discriminó la atrofia severa en forma global, con valores en el rango de lo reportado8,15, pero su alcance diagnóstico no es bueno. Un aspecto a tener en cuenta es la diferencia en los valores de pepsinógeno según se utilicen estuches japoneses o europeos54.
Los resultados presentes muestran una sensibilidad y especificidad aceptable (área bajo la curva de 0,7), y un valor predictivo negativo bueno para la atrofia severa, presente en lesiones preneoplásicas avanzadas y cáncer gástrico, y no para otros grados de atrofia. Los valores de sensibilidad y especificidad identificados son acordes a los reportados en estudios previos para el diagnóstico de atrofia en pacientes con dispepsia, 53,2%-77,1% y 67,5%-97,2% respectivamente15,18,24,50,51. También hay reportes con valores superiores: sensibilidad de 85% y especificidad de 92%52, o no muestran utilidad para el diagnóstica de atrofia14.
La presencia de anticuerpos IgG anti-H. pylori, la localización gástrica, la severidad de la atrofia, y la zona de riesgo de procedencia son factores a tener en cuenta en la valoración del pepsinógeno como prueba diagnóstica porque mejoran la precisión de la prueba, como se observó en el presente estudio. El no haber detectado niveles de pepsinógeno que permitieran un diagnóstico serológico de atrofia no severa limita su utilidad para la detección de lesiones preneoplásicas tempranas, como lo han demostrado otros autores; quienes concluyen que la prueba de pepsinógeno es poco útil en poblaciones con alta prevalencia de gastritis atrófica e infección por H pylori55.
Uno de los aspectos que puede afectar la utilidad diagnóstica de la serología del pepsinógeno junto con la presencia de anticuerpos IgG anti-H. pylori es que las pruebas serológicas para la detección de H. pylori y CagA pueden ser menos útiles en individuos con lesiones preneoplásicas avanzadas, o en casos de cáncer gástrico. Esto se debe al hecho de que cuando la mucosa gástrica muestra atrofia, la infección por H. pylori decae, posiblemente por los cambios en la histología normal del epitelio gástrico. Como consecuencia la respuesta humoral contra los antígenos de H. pylori disminuyen23.
El tener una prueba serológica de pepsinógeno junto con la serología de H. pylori con una proporción de falsos negativos de 10,5% probablemente está reflejando la situación expuesta, indicando que en la práctica clínica se deben incluir otros biomarcadores y factores de riesgo que contribuyan a identificar los pacientes con mayor riesgo de presentar atrofia severa. De otra parte, aunque se halló una proporción importante de sujetos asintomáticos con valores indicadores de serología positiva para atrofia severa con serología positiva para H. pylori, los valores predictivos positivos bajos probablemente limitan la utilidad de esta prueba para el tamizaje en la zona de riesgo alto, teniendo en cuenta la prevalencia alta de las lesiones preneoplásicas y cáncer gástrico en esta población.
Las limitaciones de este estudio son varias. La inclusión de pacientes con cáncer podría afectar los niveles de pepsinógeno, debido a que las células gástricas neoplásicas producen niveles de pepsinógeno, aunque bajos11, ese no fue el caso en el presente estudio. Teniendo en cuenta que se incluyeron pacientes de la consulta especializada de gastroenterología de las diferentes ciudades participantes, los resultados de la prueba de pepsinógeno podrían estar afectados por el sesgo de espectro. Sin embargo, su efecto sería leve debido a que la prueba incluyó todo el espectro de diagnósticos en pacientes que consultan por sintomatología gástrica, desde gastritis no atrófica hasta cáncer. Los resultados están dirigidos hacia un tamizaje oportunista o clínico, y no son aplicables para un tamizaje poblacional de atrofia gástrica debido a que no se incluyó la población asintomática; se necesita otro estudio que incluya el examen de endoscopia en la población sin sintomatología gástrica.
En conclusión, este estudio mostró la distribución de los niveles de pepsinógeno en población colombiana sin sintomatología gástrica y en pacientes con sintomatología gástrica. Los resultados sugieren que hay diferencia en la capacidad diagnóstica de la prueba de pepsinógeno en relación con la zona de riesgo, confirmando su utilidad en pacientes de la zona de riesgo alto. El PGI y la relación PGI/PGII conjuntamente como prueba diagnóstica serológica de atrofia gástrica mostraron los mejores valores diagnósticos en pacientes de la zona de riesgo alto con atrofia severa multifocal y con anticuerpos H. pylori positivos, por consiguiente, el beneficio de esta prueba estaría en la detección de lesiones avanzadas y no en lesiones tempranas. Se necesitan estudios en otras poblaciones de riesgo alto que permitan verificar los resultados presentes, así como estudios que incluyan el examen de endoscopia en población sin sintomatología gástrica para confirmar la utilidad de la prueba de pepsinógeno.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónInstituto Nacional de Cancerología E.S.E.: Inversión Nación, C401 C41030310-108, 2011
Conflicto de interésLos autores declaramos que no tenemos ningún conflicto de interés.
Los autores agradecemos al grupo de médicos y bacteriólogas Jesús Pérez-García, Raúl García Rangel, Beatriz Espinosa, Mary Ramírez y Gladys Esther Velazco en la ciudad de Barranquilla; Sandra Torres y Rocío del Pilar Mendoza en la ciudad de Tunja; y Angélica Pacheco en la ciudad de Bogotá.
A los directores del Hospital Santa Clara E.S.E. y el Laboratorio Clínico Colcan SAS en la ciudad de Bogotá; del Hospital San Rafael de Tunja y el Laboratorio Meditest en la ciudad de Tunja; y al Laboratorio clínico y Bacteriológico Barranquilla, el Laboratorio clínico IPS Olympus, Laboratorio clínico, Clínica General del Norte y Centro Médico Clínica General del Norte en la ciudad de Barranquilla.
También, al Laboratorio Biohit, Finlandia, y al Laboratorio ANNAR Diagnóstica Import por la facilidad en adquirir los kits de pepsinógeno para investigación.