El linfoma de Hodgkin (LH) tiene en los Estados Unidos una incidencia estandarizada por edad de 5,3 casos por cada 100.000 habitantes y una tasa de curación que supera 90% de los casos. Su pronóstico depende de múltiples factores siendo los más relevantes: etapa, tipo histológico e índices pronósticos. Se decidió caracterizar y evaluar los resultados de supervivencia de pacientes con LH tratados en el Instituto Nacional de Cancerología.
Pacientes y métodosSe realizó una cohorte histórica de pacientes menores de 19 años con diagnóstico de LH entre el 1 de enero de 2000 y 31 de diciembre de 2005, tratados en el Instituto Nacional de Cancerología, con énfasis en sus características demográficas, clínicas, histopatológicas y de laboratorio. Se hizo análisis estadístico descriptivo y de supervivencia de Kaplan-Meier utilizando la prueba Log-rank para comparación de curvas. Se consideró estadísticamente significativo un valor de p < 0,05.
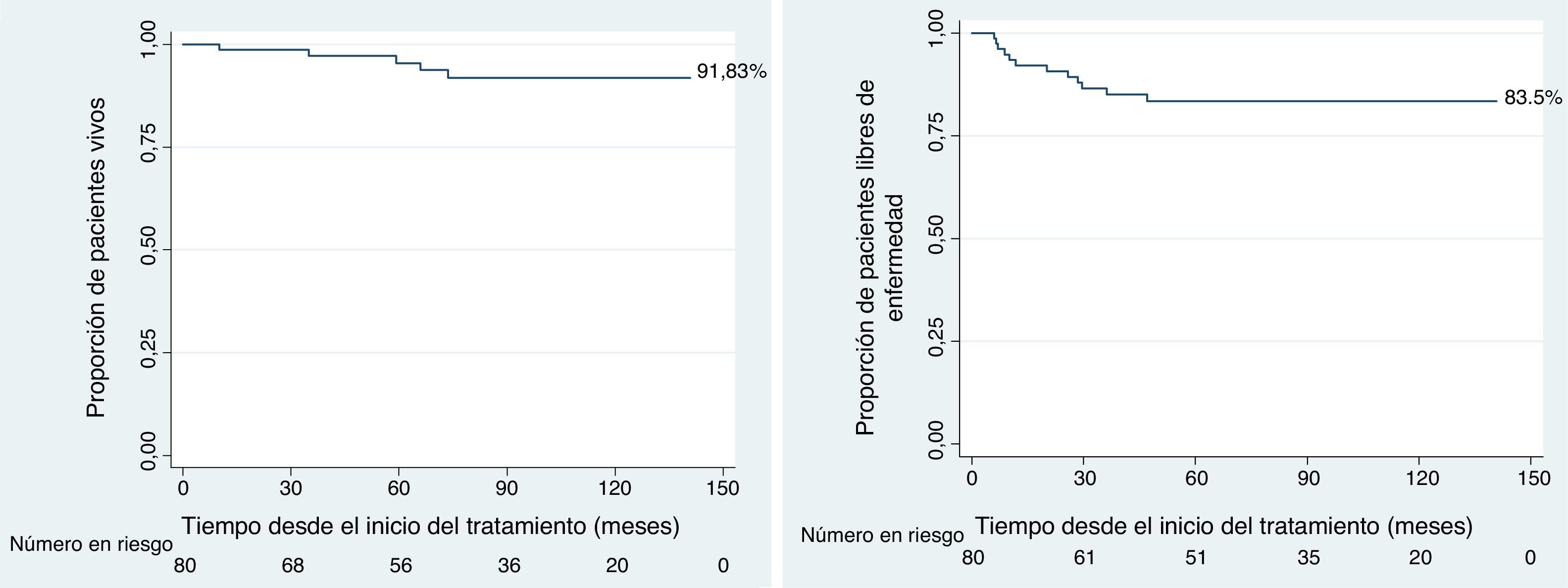
ResultadosLa mediana de seguimiento fue de 5 años (rango: 19 meses – 11,6 años), la supervivencia global y libre de enfermedad a 5 años fue del 95% y 83%, respectivamente.
ConclusiónLa aplicación del protocolo OEPA/COPE en el Instituto Nacional de Cancerología tuvo un buen resultado reflejado en la supervivencia global y libre de enfermedad superior al 80%.
Hodgkin's lymphoma (HL) has an age-standardised incidence of 5.3 cases per 100,000 population, and a cure rate of over 90% of cases. The prognosis depends on multiple factors, the most relevant being: stage, histological type and prognostic indices. It was decided to characterise and evaluate survival outcomes of patients treated with HL in the National Cancer Institute.
Patients and methodsA retrospective analysis was performed on a cohort of patients younger than 19 years diagnosed with HL between January 1, 2000 and December 31, 2005, treated in the National Cancer Institute, with emphasis on their demographic, clinical, histopathological, and laboratory characteristics. A descriptive statistical and survival analysis was performed using the Kaplan-Meier log-rank test. A P<.05 was considered statistically significant.
ResultsThe mean follow-up time was 5 years (range: 19 months – 11.6 years), and overall and disease-free survival was 95% and 83%, respectively, at 5 years.
ConclusionImplementation of an OEPA/COPE treatment protocol in the National Cancer Institute showed good results, as reflected in overall and disease -free survival, exceeding 80%.
Los linfomas malignos (Hodgkin y no Hodgkin) constituyen la tercera causa de cáncer en la edad pediátrica. Estos linfomas ocurren aproximadamente entre el 10 y el 12% de todos los cánceres diagnosticados antes de los 15 años de edad y en un 15% de los diagnosticados antes de los 20 años1. En los Estados Unidos el LH representa 3% de los cánceres en menores de 15 años y 13% en adolescentes entre 15 y 19 años1,2. El Registro Poblacional de la ciudad de Cali (Colombia) en el período 1994 - 2003 muestra que los linfomas son el 14% de todas las neoplasias con una tasa de incidencia para los LH de 6,6 casos por año/millón en menores de 15 años, y con una tasa de mortalidad por linfoma Hodgkin de 0,5 en niños de 0-14 años en el período 2005-2008, según los datos del Departamento Administrativo Nacional de Estadísticas de Colombia (DANE)3.
El tratamiento estándar para niños y adolescentes incluye frecuentemente modalidades de tratamiento al combinar quimioterapia con radioterapia en los campos comprometidos, con lo cual se ha logrado supervivencias entre 85 y 100% para estadios tempranos de la enfermedad y aproximadamente 60% en estadios avanzados4.
En la clínica de oncología pediátrica del Instituto Nacional de Cancerología de Colombia (INC), con el propósito de reducir los efectos secundarios de las altas dosis de radioterapia en campos extensos y de la quimioterapia MOPP (mecloretamina, vincristina, prednisona y procarbazina), se utilizó el protocolo de tratamiento OPPA/COPP (vincristina, prednisona, procarbazina, doxorrubicina, ciclofosfamida) más radioterapia en campos comprometidos entre 1988 y 1998. Este protocolo, aplicado desde 1978 en niños y adolescentes en Alemania y Austria (German Pediatric Oncology Group) en cinco estudios multicentricos consecutivos (HD-78, HD-82, HD-85, HD-87 y HD-90), reportó una supervivencia libre de evento a nueve años de seguimiento de 98% en el grupo de bajo riesgo, 94% en el grupo de riesgo intermedio y 86% en el grupo de alto riesgo5. El estudio HD-90 desde 1990 en un intento de reducir la toxicidad testicular de la procarbazina, la reemplazó por etopósido en los dos primeros ciclos del tratamiento para los niños y adolescentes de sexo masculino (OEPA/COPP)6.
En el año 2000 como consecuencia del desabastecimiento de la procarbazina en el país y con el antecedente del HD-90, que demostró un excelente control de la enfermedad, no hubo diferencias significativas en la supervivencia libre de evento entre los niños que recibieron el esquema OEPA/COPP y las niñas que recibieron el tratamiento con OPPA/COPP. El INC inició un protocolo novedoso (OEPA/COPE) donde se reemplaza la procarbazina por etopósido en todos los ciclos del esquema OPPA/COPP6.
El objetivo del estudio fue caracterizar y evaluar los resultados de supervivencia de los pacientes con LH tratados en el INC con la modificación al esquema tradicional (esquema OPPA/COPP), sustituyendo la procarbazina por etopósido (esquema OEPA/COPE).
Pacientes y métodosPacientesTodos los niños y adolescentes de ambos sexos menores de 18 años de edad que ingresaron a la clínica de oncología pediátrica del INC entre el 1 de enero de 2000 y 31 de diciembre de 2005, sin tratamiento previo y con diagnóstico primario confirmado por patología de linfoma de Hodgkin fueron incluidos en el estudio. Se excluyeron todos los pacientes tratados fuera del instituto independiente del esquema de tratamiento, pacientes con historia clínica incompleta y pacientes del INC que ya estaban en seguimiento.
El instrumento de recolección utilizado fue la historia clínica pediátrica estructurada en su primera parte por los datos demográficos y las fechas de los eventos, recolectadas por los investigadores y revisado por segunda vez por el monitor de investigación. Para el análisis de la información se construyó una base de datos en el programa estadístico SPSS (Inc., Chicago, IL, USA).
Además de la historia clínica de la enfermedad y el examen físico se realizó la siguiente evaluación diagnóstica: radiografía del tórax; ultrasonografía o TAC del sitio comprometido; TAC de tórax, abdomen y pelvis; gammagrafía con galio. Cuando se sospechó compromiso óseo se solicitó radiografía y RMN del hueso sospechoso y gammagrafía ósea con Tc-99. Una biopsia de médula ósea se realizó a los pacientes con estadios IIB, III y IV.
Consideramos enfermedad voluminosa ganglionar a los pacientes con una masa ganglionar periférica mayor de 10cm y enfermedad voluminosa mediastinal la presencia de masa igual o mayor al 33% del diámetro transverso del tórax medido en T6.
El diagnóstico se confirmó en el departamento de patología del INC por el estudio de la histología e inmunohistoquímica en las biopsias de ganglios linfáticos. Los subtipos histológicos fueron denominados de acuerdo a la clasificación de Rye7.
Para la estadificación de la enfermedad se utilizó el sistema de clasificación por estadios de Ann Arbor8. A ningún paciente se le practicó laparotomía exploradora.
Los pacientes fueron clasificados en tres grupos de riesgo de acuerdo al estadio de la enfermedad: estadios tempranos I y IIA, estadios intermedios IIB y IIIA, estadios avanzados IIIB y IV.
El tratamiento consistió en la aplicación de dos ciclos de quimioterapia OEPA para todos los pacientes en estadios tempranos; los pacientes con estadios intermedios recibieron dos ciclos de OEPA seguidos de dos ciclos de COPE, y los estadios avanzados dos ciclos de OEPA y cuatro ciclos de COPE. El esquema de tratamiento con quimioterapia incluyó el régimen OEPA con vincristina 1,5mg/m2 (máximo 2mg) IV el día 1, 8 y 15, etopósido 150mg/m2IV el día 1, 2 y 3, prednisona 40mg/m2 vía oral del día 1 al 14, doxorrubicina 40mg/m2IV el día 1 y 15. El régimen COPE incluyó ciclofosfamida 750mg/m2IV el día 1 y 8, vincristina 1,5mg/m2 (máximo 2mg) IV el día 1 y 8, prednisona 40mg/m2 vía oral del día 1 al 14 y etopósido 150mg/m2IV el día 1, 2 y 3. Al finalizar la quimioterapia se aplicó radioterapia a campos comprometidos 2,0 a 2,4Gy; en los casos donde se observó residuo tumoral ≥ 25% del volumen inicial se aplicó 2,5 a 3,5Gy. Los pacientes menores de seis años de edad no recibieron radioterapia y solo se aplicó quimioterapia (estadio temprano dos ciclos de OEPA y dos COPE, intermedios y avanzados dos OEPA y cuatro COPE).
Métodos estadísticosSe estimaron funciones de supervivencia mediante el método de Kaplan Meier. La supervivencia libre de evento (SLE) fue definida como el tiempo transcurrido desde la fecha de la primera consulta hasta la fecha del primer evento (primera recaída, progresión de la enfermedad o muerte, lo que ocurra primero) o hasta la fecha del último control para los pacientes que no presentarán el evento. La supervivencia global (SG) fue definida como el tiempo transcurrido desde la primera consulta hasta la fecha de muerte por cualquier causa o la fecha del último control. Los pacientes que no presentaron evento a la fecha de la recolección de la información fueron censurados en la fecha del último control.
En las variables nominales y ordinales se resumió la información mediante las distribuciones de frecuencias absolutas y relativas. En las variables numéricas se utilizaron medidas de tendencia central y sus medidas de dispersión.
Se calculó los HR crudos y ajustados mediante el modelo semiparamétrico de riesgos proporcionales de Cox, usando el test de Wald y la razón de verosimilitud. Para el ajuste se incluyó en el modelo las siguientes variables: edad (estratificados en relación con la mediana), sexo, estadio de la enfermedad, presencia de síntomas B, tipo histológico, presencia de enfermedad voluminosa, número de sitios ganglionares comprometidos, compromiso extraganglionar (tabla 1). Las estimaciones temporales se hicieron con el modelo no paramétrico del límite del producto (método de Kaplan-Meier) y sus funciones se compararon mediante la prueba Log-rank. Con el fin de valorar los factores que influyeron sobre los tiempos, se realizó un análisis multivariado con el modelo proporcional de Cox. En todos los casos, el Departamento de Investigación Clínica del INC llevó a cabo un seguimiento de los registros de información, del patrón de recolección de los datos y su calidad, haciendo observaciones continuas para optimizar el número de ítems recolectados. Tras el levantamiento del archivo de documentación se encontró una proporción de datos faltantes inferior al 3%. Se calculó la variable “tiempo de observación” a partir de la fecha del primer tratamiento y la fecha del último contacto o la muerte; para aquellos pacientes que por alguna razón no recibieron tratamiento, esta variable se calculó a partir de la fecha del ingreso al Instituto. Aquellos casos en los que no se logró establecer la fecha o la causa de la defunción, se consideraron como casos censurados a la derecha; en consecuencia, su estado fue el correspondiente al del último contacto. Para aquellos casos en los que no se logró establecer la fecha de inicio del tratamiento, se hizo una imputación probabilística del tiempo transcurrido entre la fecha de inicio del tratamiento y la fecha de ingreso a la institución; este tiempo se adicionó al de la fecha de ingreso a la institución y esta fecha se asumió como la fecha de inicio de tratamiento.
Supervivencia libre de enfermedad regresión de Cox
| Características | HR Crudo (IC 95%) | HR Ajustado (IC 95%) | P* |
|---|---|---|---|
| Edad - años | 1,48 (1,2-1,83) | 1,51 (1,18-1,92) | |
| Sexo masculino | 1,6 (0,35-7,34) | 2,08 (0,32-13,49) | 0,54 |
| Enfermedad voluminosa mediastinal. Sí | 2,57 (0,81-8,11) | 1,08 (0,28-4,08) | 0,095 |
| Clasificación de riesgo | |||
| Estadios tempranos (Riesgo bajo) | 1 | 1 | 0,40 |
| Estadios intermedios (Riesgo intermedio) | 1,29 (0,31-5,41) | 0,54 (0,09-3,05) | |
| Estadios avanzados (Riesgo alto) | 2,4 (0,64-8,97) | 0,9 (0,21-3,89) | |
| Abandono de tratamiento. Sí | 6,03 (1,27-28,62) | 6,53 (1,02-41,93) | 0,010 |
Para el análisis de los datos se usó el programa SPSS, versión 14. Se realizaron análisis univariados para todas las variables del estudio. Para las variables categóricas, se calcularon razones y proporciones, mientras que para las variables cuantitativas se presentaron medidas de tendencia central y dispersión. El análisis de supervivencia global se hizo de forma descriptiva con el método de Kaplan-Meier y se empleó la prueba de rango logarítmico para comparar las funciones de supervivencia de aquellas variables que tenían más de una categoría. El análisis multivariado de factores de pronóstico se realizó con un modelo de regresión de Cox. Se verificaron los supuestos de riesgos proporcionales para cada factor y para el modelo global en el modelo definitivo; también, se verificó el ajuste del modelo, la ausencia de colinearidad y la presencia de valores atípicos influyentes. En el modelado se partió de uno jerárquico bien estructurado y se descartaron variables con el método paso a paso hacia atrás con un criterio de permanencia de 0,05.
Para establecer el estado vital de los pacientes a la fecha de recolección de los datos se contactó telefónicamente a las familias de los pacientes que se encontraban en seguimiento y su último control clínico tuviera un tiempo mayor a un año. Los pacientes con los que se estableció contacto telefónico y se conoció la información sobre su estado actual, se les registró la fecha del contacto como la fecha del último control.
Por tratarse de un estudio observacional, este fue considerado como una investigación sin riesgos éticos para los pacientes. El estudio fue aprobado por el comité de ética en investigación del INC con el código de aprobación INV-P01-F-19.
ResultadosSe revisaron 123 historias clínicas de los pacientes que ingresaron a la Clínica de Oncología Pediátrica del INC entre el 1 de enero del 2000 y el 31 diciembre del 2005. Se excluyeron del estudio a 42 pacientes (treinta y cinco recibieron tratamiento previo con ABVD, cinco por tener datos incompletos en la historia clínica, uno por no haber recibido tratamiento en el INC y solo ingresó para seguimiento, y uno para segundo concepto). La mediana de seguimiento fue de 5 años (mínimo de 1,6 años y máximo de 11,6 años).
La mediana de edad de los 81 pacientes incluidos en el análisis fue de 9,9 años (DE±4,13); la mayoría fueron del sexo masculino (76,5%), y el lugar de residencia estaba situado principalmente en zona urbana (56,8%). El tipo histológico más común fue la esclerosis nodular. La mayoría de los pacientes ingresaron en estadio temprano de la enfermedad (54,3%). Las características clínicas de los pacientes se muestran en la tabla 2.
Características demográficas y clínicas del Protocolo OEPA/COPE
| Características | |
|---|---|
| Edad - años | 9,9±4,13 |
| Sexo masculino - no. (%) | 62 (76,5) |
| Residencia urbana - no. (%) | 46 (59,8) |
| Localización - no. (%) | |
| Cervical | 62 (76,5) |
| Mediastinal | 34 (41,9) |
| Retroperitoneal | 13 (16,0) |
| Supraclavicular | 12 (14,8) |
| Axilar | 5 (6,1) |
| Inguinal | 5 (6,1) |
| Síntomas B - no. (%) | 22 (27,1) |
| Enfermedad voluminosa periférica no. (%) | 18 (22,2) |
| Enfermedad voluminosa mediastinal no. (%) | 18 (22,2) |
| Tipo histológico no. (%) | |
| Esclerosis nodular | 57 (70,3) |
| Celularidad mixta | 11 (13,8) |
| No clasificado | 8 (9,8) |
| Rico en linfocitos | 3 (3,7) |
| Predominio linfocitario | 2 (2,4) |
| Estadio no. (%) | |
| I | 26 (32,1) |
| IIA | 18 (22,2) |
| IIB | 9 (11,1) |
| IIIA | 12 (14,8) |
| IIIB | 10 (12,4) |
| IV | 6 (7,4) |
| Clasificación de riesgo no. (%) | |
| Estadios tempranos (Riesgo bajo) | 44 (54,4) |
| Estadios intermedios (Riesgo intermedio) | 21 (25,9) |
| Estadios avanzados (Riesgo alto) | 16 (19,7) |
| Abandono de tratamiento no. (%) | 7 (8,6) |
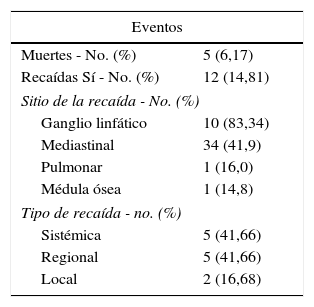
En relación con los eventos, 5 de 81 pacientes murieron (6,17%). No se observaron segundas neoplasias ni progresión de la enfermedad durante el tratamiento y las recaídas fueron del 14,81% (12/81) (tabla 3).
Eventos evaluados durante y posterior al tratamiento OEPA/COPE
| Eventos | |
|---|---|
| Muertes - No. (%) | 5 (6,17) |
| Recaídas Sí - No. (%) | 12 (14,81) |
| Sitio de la recaída - No. (%) | |
| Ganglio linfático | 10 (83,34) |
| Mediastinal | 34 (41,9) |
| Pulmonar | 1 (16,0) |
| Médula ósea | 1 (14,8) |
| Tipo de recaída - no. (%) | |
| Sistémica | 5 (41,66) |
| Regional | 5 (41,66) |
| Local | 2 (16,68) |
Para todo el grupo de pacientes la probabilidad de supervivencia general y supervivencia libre de eventos a 5 años fue de 91,83% y 83,5%, respectivamente (fig. 1).
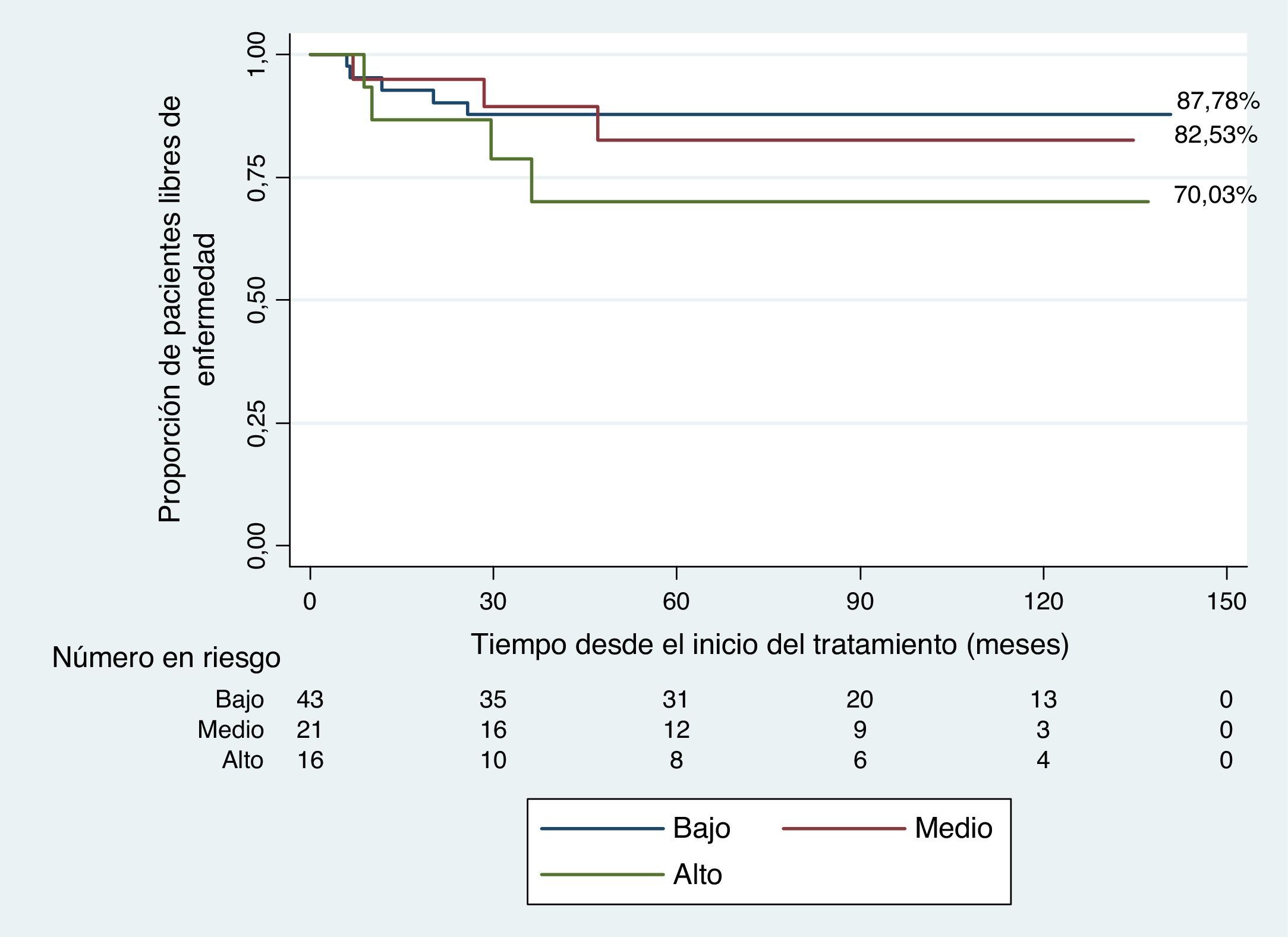
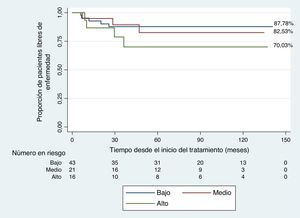
En los pacientes del grupo de riesgo bajo e intermedio se evidenció una mejor supervivencia libre de evento (87,78% y 82,53%) comparada con los pacientes en los grupos de riesgo alto (70%); sin embargo, las diferencias no fueron significativas (p=0,4 prueba de suma de rangos logarítmicos) (fig. 2).
Si bien no fue objetivo del trabajo el análisis de abandono, se tuvo en cuenta dentro de los datos demográficos con un 8,6% de los casos. Aunque no podemos deducir de esta cifra tan significativa si fueron realmente abandonos (suspensión del tratamiento más de cuatro semanas) o traslados de su EPS a otra IPS.
DiscusiónEl tratamiento de los niños con linfoma de Hodgkin en Colombia y en gran parte de América Latina se ha basado en protocolos que combinan quimioterapia y radioterapia adaptados de los protocolos originales de grupos norteamericanos (esquema ABVD) y grupos europeos (esquema DAL-HD) o combinaciones de estos con otros medicamentos9–11. Ambos protocolos en general tienen unas supervivencias global y libre de evento similares, y la diferencia puede radicar en los efectos secundarios a corto y a largo plazo5,6,12.
En el INC entre 1988 y 1998 se adoptó el tratamiento del grupo europeo, OPPA/COPP más radioterapia a campos comprometidos con el objetivo de reducir las secuelas a largo plazo de las altas dosis de irradiación en campos extendidos así como los efectos secundarios a quimioterapia5,13.
Históricamente, los resultados del grupo europeo mostraron en los estudios HD-82, HD-85 y HD-87 que la modalidad combinada es una estrategia altamente efectiva con supervivencias libre de evento y global a 4,5 años para estadios I y IIA de 99% y 100% en el HD-82; 85% y 98% en el HD-85, y 88% y 100% en el HD-87. Mientras los pacientes con estadios avanzados IIIB y IV las supervivencias fueron 88% y 90% en HD-82, 100% en HD-85 y 91% y 95% en HD-87.
En el análisis de la cohorte de 1988 a 1998 en el INC, 117 pacientes tratados con OPPA/COPP mostró una supervivencia libre de evento y general a 6,7 años de 86 y 88,6%, respectivamente14; sin embargo, los pacientes con riesgo bajo e intermedio lograron supervivencia libre de evento de 92% y 91% y una supervivencia general de 96% y 91%, respectivamente; mientras los de alto riesgo tuvieron en ambas probabilidad de supervivencia de 71%. A pesar de que estos resultados eran comparables a lo publicado por el grupo europeo y con la evidencia publicada del estudio DAL-906 fue necesario cambiar en el INC el esquema de quimioterapia OPPA/COPP por OEPA/COPE ante la falta del medicamento procarbazina en el país.
La modificación al tratamiento con un esquema de quimioterapia sin procarbazina en ambos sexos no produjo una disminución en la probabilidad de supervivencia libre de eventos (83,5%) ni en la supervivencia general (91,83%), respectivamente. Se encontró una diferencia que es clínicamente importante entre los pacientes de riesgo bajo e intermedio (enfermedad localizada) y los pacientes de riesgo alto (sin diferencia estadísticamente significante).
Como ya fue informado los niños y adolescentes con LH en estadios tempranos de la enfermedad tratados con modalidades combinadas de quimioterapia y radioterapia tienen un mejor pronóstico con supervivencias libre de enfermedad que oscilan entre 85 y 100%, mientras que los pacientes con enfermedad avanzada tienen aproximadamente 60%4,6.
Los pacientes tratados con el protocolo OEPA/COPE con radioterapia a campos comprometidos en estadios I – IIA y IIB - IIIA tuvieron supervivencia libre de evento de 87,78% y 82,53%, respectivamente, y los pacientes en estadio IIIB y IV de 70%.
Consideramos que a pesar de la sustitución del medicamento procarbazina, no se produjo un deterioro de las supervivencias de los pacientes y que el esquema OEPA/COPE es una alternativa satisfactoria para pacientes con grupos de riesgo bajo e intermedio; sin embargo, será necesario el replanteamiento de la estrategia en los pacientes de alto riesgo, quienes muestran un menor beneficio del esquema actual15.
Debido al reducido número de pacientes que conformaron la cohorte no fue posible establecer la asociación entre los tipos histológicos de la enfermedad y la supervivencia.
Una de las preocupaciones con el uso del esquema OEPA/COPE siempre ha sido el desarrollo de segundas neoplasias, secundarias al uso del etopósido. En el estudio del DAL-HD 906 en 667 pacientes tratados con OEPA/COPP la incidencia acumulada de leucemias secundarias y síndromes mielodisplásicos fue de 0,7% y 1,1% luego de 10 y 15 años de seguimiento, respectivamente. Lo que se había reportado con una frecuencia de 2% a 6% en pacientes quienes recibieron tratamiento de quimioterapia basados en esquema MOPP16–19. Con el tiempo de seguimiento de esta cohorte aún no se han encontrado casos de segunda neoplasia o síndromes mielodisplásicos.
Se registró la toxicidad aguda en las historias clínicas, como mielosupresión, leucopenia, trombocitopenia, anemia en la mayoría de los casos, y dos casos de hipotensión durante la infusión de etopósido, no se registraron casos de insuficiencia hepática, renal ni de segundas neoplasias. Sin embargo, una falencia de nuestra serie es el no haber evaluado la toxicidad que nos permitiera conocer la morbilidad aguda y su asociación con las muertes presentadas. De igual manera no fue evaluado el impacto de este protocolo sobre la fertilidad, para medir la toxicidad gonadal que fue uno de los objetivos del estudio original OEPA/COPP.
Por último, si bien no es el objetivo del trabajo, los resultados plantean realizar a futuro una estrategia terapéutica para el manejo de los pacientes de alto riesgo, como la intensificación del protocolo actual con esquemas basados en OEPA/COPDAC (vincritina, etopósido, prednisona, adriamicina, ciclofosfamida, dacarbacina), o la intensificación con esquemas híbridos con ABVD (adriamicina, bleomicina, vincristina y dacarbacina).
Nuestra contribución consiste en ser este el primer trabajo que muestra el etopósido como opción para reemplazar la procarbazina en aquellos países donde no se importa, con supervivencias global equiparables al protocolo original.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.