El tratamiento convencional de la ascitis maligna refractaria es un reto oncológico pues provee mejoría sintomática poco duradera. La terapia intraperitoneal ha sido evaluada principalmente en reportes y series de casos, y en algunos ensayos clínicos, estudiados principalmente en la ascitis por cáncer ovárico y gastrointestinal. Esta terapia incluye: isótopos radioactivos, quimioterapia con hipertermia y sin esta, terapia inmunológica, biológica y otras. Los tratamientos más exitosos con respuestas variables, y aunque la comparación directa no es posible, son: la quimioterapia intraperitoneal hipertérmica (respuesta global entre 85,7% y 100%) y el catumaxomab, que frente a la paracentesis demostró una supervivencia libre de punción de 46 vs 11 días (HR 0,254) y una mediana a la próxima paracentesis de 77 vs 13 días (HR 0,169), con impacto positivo en la calidad de vida, principal fin en el escenario paliativo. La investigación en este campo continúa buscando resultados más duraderos, seguros y costo-efectivos.
Conventional treatment of refractory malignant ascites is an oncological challenge since it provides little lasting symptomatic improvement. Intraperitoneal therapy, evaluated mainly through series and case reports, and some clinical trials include the use of radioisotopes, chemotherapy, with and without hyperthermia, immunological and biological therapy and others. It has been studied mainly in ascites from ovarian and gastrointestinal cancer. With variable response rates, and although direct comparison is not possible, the most successfully treatments are hyperthermic intraperitoneal chemotherapy (overall response rate between 85.7% and 100%), and catumaxomab, which compared to paracentesis, demonstrated a puncture-free survival of 46 vs. 11 days (HR 0.254) and a median time to next paracentesis of 77 vs. 13 days (HR 0.169). This had a positive impact on quality of life, which is the main goal in the palliative setting. Research in this field continues looking for more lasting, safe, and cost-effective results.
La ascitis maligna es una condición en la que hay acumulación anormal de líquido intraabdominal de origen tumoral, comprende el 10% de todas la causas de ascitis y se caracteriza por ser muy sintomática (distensión abdominal, dolor, anorexia, náuseas, vómito, fatiga, edema, disnea), afectando la calidad de vida del paciente. Principalmente se debe al aumento de la producción de células mesoteliales y tumorales. La neovascularización, la permeabilidad vascular aumentada y la obstrucción linfática, son secundarios a estadios tardíos de carcinomatosis peritoneal (53 a 63%) como resultado de metástasis, recurrencia o progresión de ciertos cánceres1–5. Las neoplasias más comúnmente asociadas son de ovario (37,7%), pancreato-biliar (21%), gástrica (18,3%), y colorrectal (3,7%), y extra-abdominales (esofágica (4%), mamaria (3%), pulmonar y linfoma).
El primario de origen desconocido es causante hasta en un 8,1% y en más de la mitad de los casos la ascitis representa el primer signo de malignidad. En el 95% de los pacientes cursa concomitantemente con enfermedad metastásica4,6–9. La ascitis maligna es un factor de mal pronóstico independiente según el estudio EVOCAPE (Evolution of Peritoneal Carcinomatosis). Las medianas de supervivencia varían entre 5 y 20 semanas y solo el 11% sobrevive más allá de 6 meses, exceptuando al cáncer de ovario1,4,8,10.
En estadios avanzados de cáncer o recurrencia sin opción curativa, es fundamental proporcionar manejo paliativo enfocado en la calidad de vida4. El tratamiento de primera línea es la paracentesis, aunque no hay consenso ni límite de seguridad establecido para la cantidad de líquido drenado por sesión; algunos consideran segura la extracción de hasta 5 litros.
La infusión de albúmina posterior a la misma no está estandarizada, pues no se ha demostrado diferencia en términos de mortalidad4,7,11,12. No obstante, independientemente del volumen extraído, generalmente se requieren paracentesis a repetición con un intervalo medio libre de punción de 7 a 11 días, lo que implica admisiones hospitalarias y riesgo de complicaciones4,8,13. En muchas ocasiones se usan complementariamente los diuréticos, que aunque son principalmente efectivos en ascitis por hipertensión portal no maligna, tienen una respuesta global del 44% en estudios no controlados, perdiendo su eficacia con el tiempo4,7–9,11–15. También se ha considerado el uso de catéteres permanentes de autodrenaje, tunelizados y no tunelizados; estos últimos son una estrategia costo-efectiva cuando un paciente requiere entre 9 y 10 paracentesis puesto que tienen menores tasas de complicación y una mediana de oclusión de 24,7 días, aunque otras series indican una mayor vida útil4,7,9,16–18.
Aunque la definición de ascitis maligna refractaria (AMR) no se encuentra ampliamente difundida, se considera que es aquella que persiste, recurre tempranamente y no puede ser prevenida tras las terapias de primera línea mencionadas19–21. Como alternativa se usan las derivaciones peritoneovenosas, con mayor respuesta al 50% en cáncer de mama y ovario y solo del 10 al 15% en gastrointestinal, con permeabilidad de 10 a 12 semanas, aunque con citología peritoneal positiva puede durar solo 3 o 4 semanas. Sin embargo, es un procedimiento con alta morbimortalidad lo que limita su uso1,4,17,22. El beneficio de la quimioterapia sistémica para AMR se encuentra alrededor de un 30%23,24.
Teniendo en cuenta la supervivencia limitada de la AMR, el tratamiento ideal debe ser sencillo, mínimamente invasivo, ambulatorio o permitiendo el alta temprana, con bajo riesgo de complicaciones y proveer alivio sintomático a un costo razonable17. Uno de los abordajes terapéuticos que intenta cumplir con estas condiciones es la administración de medicamentos intraperitoneales que permite mayores concentraciones, lo que evitaría efectos adversos sistémicos6. Esta revisión se enfoca en el manejo intraperitoneal de la AMR exclusivamente en el escenario paliativo, donde los pacientes no pueden tolerar regímenes terapéuticos agresivos (cirugía citorreductora) y el objetivo primordial es la mejoría en la calidad de vida.
MétodosSe realizó una búsqueda en las bases de datos de Pubmed y Lilacs con los términos MeSH y DeCS referidos. Se utilizaron artículos de revisión, reporte y serie de casos y ensayos clínicos. La búsqueda se limitó a artículos publicados en inglés, español y francés. No hubo restricción en cuanto al año de publicación de los artículos. Se realizó una búsqueda manual de las referencias citadas tanto en artículos originales como de revisión.
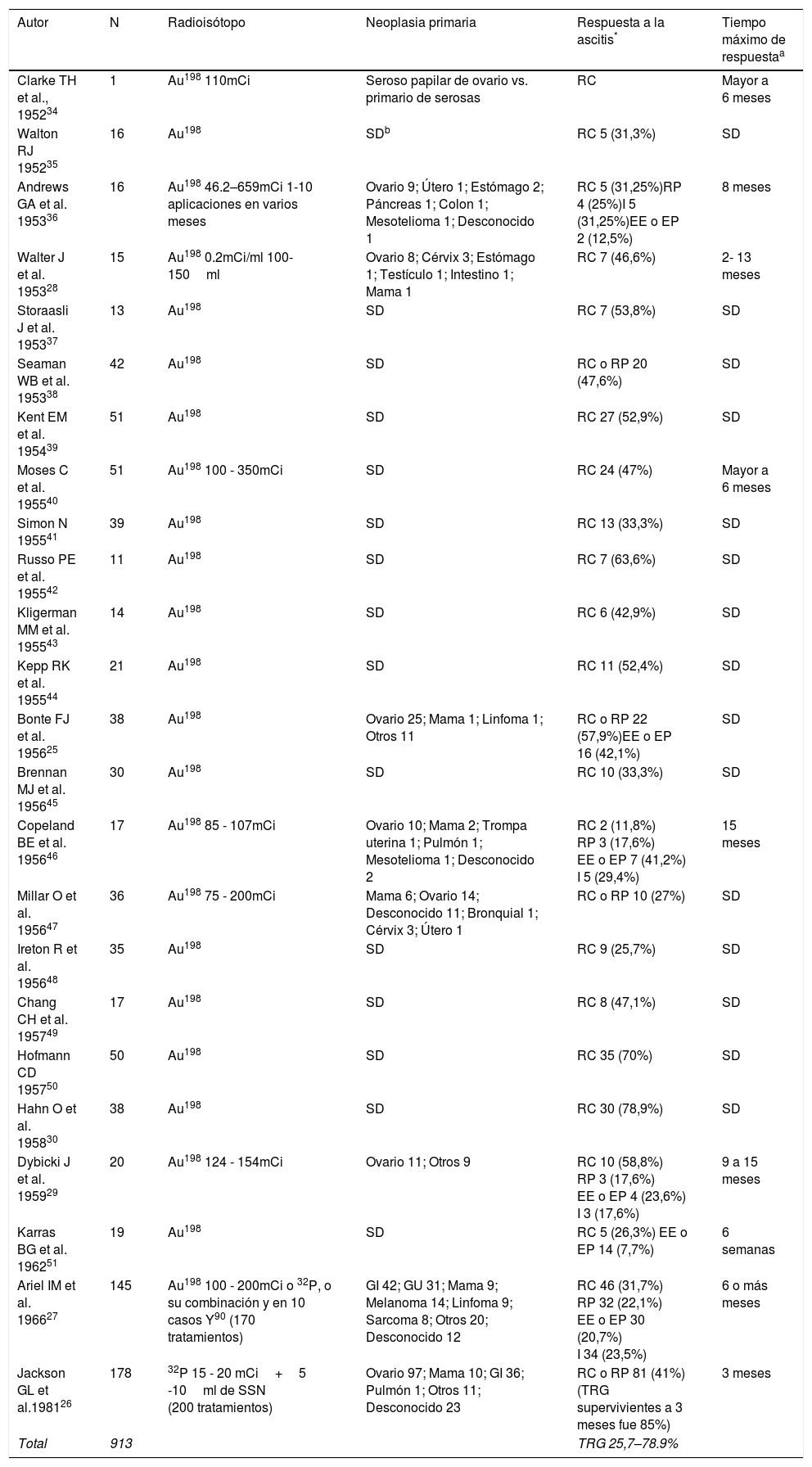
Terapia intraperitonealRadioisótoposLos isotopos radioactivos introducidos en 1945 para terapia intraperitoneal tienen efectos letales sobre las células por mecanismos directos e indirectos sobre el ADN, generando fibrosis y obliteración de vasos pequeños en la superficie mesotelial. El oro coloidal radioactivo (Au198), usado por primera vez en 1947, tiene buena distribución por su naturaleza, emite rayos gamma y beta; estos últimos con mayor efecto terapéutico (90%), penetrancia de 3,8mm en el tejido y vida media de 2,7 días. Alternativamente el fosfato crómico (32P) tiene una mayor vida media (14,3 días), sus partículas beta puras son más energéticas y tiene mayor penetrancia a los tejidos (7mm)25–29.
El radioisótopo más empleado en esta terapia es el Au198, con una casuística total en reporte y serie de casos de más de 900 pacientes tratados. La mejor tasa de respuesta completa (RC) es de 78,9%. Sin embargo, Ariel et al. encontraron en 145 pacientes con el uso de P32 en terapia única o combinada una paliación de hasta el 54%, que aumentaba hasta un 85% en el subgrupo de patología ovárica; esto lo comprobarían más tarde Jackson et al. con un grupo mayor de pacientes (tabla 1)26,27,30.
Reporte y serie de casos con uso de radioisótopos intraperitoneales para el tratamiento de AMR
| Autor | N | Radioisótopo | Neoplasia primaria | Respuesta a la ascitis* | Tiempo máximo de respuestaa |
|---|---|---|---|---|---|
| Clarke TH et al., 195234 | 1 | Au198 110mCi | Seroso papilar de ovario vs. primario de serosas | RC | Mayor a 6 meses |
| Walton RJ 195235 | 16 | Au198 | SDb | RC 5 (31,3%) | SD |
| Andrews GA et al. 195336 | 16 | Au198 46.2–659mCi 1-10 aplicaciones en varios meses | Ovario 9; Útero 1; Estómago 2; Páncreas 1; Colon 1; Mesotelioma 1; Desconocido 1 | RC 5 (31,25%)RP 4 (25%)I 5 (31,25%)EE o EP 2 (12,5%) | 8 meses |
| Walter J et al. 195328 | 15 | Au198 0.2mCi/ml 100-150ml | Ovario 8; Cérvix 3; Estómago 1; Testículo 1; Intestino 1; Mama 1 | RC 7 (46,6%) | 2- 13 meses |
| Storaasli J et al. 195337 | 13 | Au198 | SD | RC 7 (53,8%) | SD |
| Seaman WB et al. 195338 | 42 | Au198 | SD | RC o RP 20 (47,6%) | SD |
| Kent EM et al. 195439 | 51 | Au198 | SD | RC 27 (52,9%) | SD |
| Moses C et al. 195540 | 51 | Au198 100 - 350mCi | SD | RC 24 (47%) | Mayor a 6 meses |
| Simon N 195541 | 39 | Au198 | SD | RC 13 (33,3%) | SD |
| Russo PE et al. 195542 | 11 | Au198 | SD | RC 7 (63,6%) | SD |
| Kligerman MM et al. 195543 | 14 | Au198 | SD | RC 6 (42,9%) | SD |
| Kepp RK et al. 195544 | 21 | Au198 | SD | RC 11 (52,4%) | SD |
| Bonte FJ et al. 195625 | 38 | Au198 | Ovario 25; Mama 1; Linfoma 1; Otros 11 | RC o RP 22 (57,9%)EE o EP 16 (42,1%) | SD |
| Brennan MJ et al. 195645 | 30 | Au198 | SD | RC 10 (33,3%) | SD |
| Copeland BE et al. 195646 | 17 | Au198 85 - 107mCi | Ovario 10; Mama 2; Trompa uterina 1; Pulmón 1; Mesotelioma 1; Desconocido 2 | RC 2 (11,8%) RP 3 (17,6%) EE o EP 7 (41,2%) I 5 (29,4%) | 15 meses |
| Millar O et al. 195647 | 36 | Au198 75 - 200mCi | Mama 6; Ovario 14; Desconocido 11; Bronquial 1; Cérvix 3; Útero 1 | RC o RP 10 (27%) | SD |
| Ireton R et al. 195648 | 35 | Au198 | SD | RC 9 (25,7%) | SD |
| Chang CH et al. 195749 | 17 | Au198 | SD | RC 8 (47,1%) | SD |
| Hofmann CD 195750 | 50 | Au198 | SD | RC 35 (70%) | SD |
| Hahn O et al. 195830 | 38 | Au198 | SD | RC 30 (78,9%) | SD |
| Dybicki J et al. 195929 | 20 | Au198 124 - 154mCi | Ovario 11; Otros 9 | RC 10 (58,8%) RP 3 (17,6%) EE o EP 4 (23,6%) I 3 (17,6%) | 9 a 15 meses |
| Karras BG et al. 196251 | 19 | Au198 | SD | RC 5 (26,3%) EE o EP 14 (7,7%) | 6 semanas |
| Ariel IM et al. 196627 | 145 | Au198 100 - 200mCi o 32P, o su combinación y en 10 casos Y90 (170 tratamientos) | GI 42; GU 31; Mama 9; Melanoma 14; Linfoma 9; Sarcoma 8; Otros 20; Desconocido 12 | RC 46 (31,7%) RP 32 (22,1%) EE o EP 30 (20,7%) I 34 (23,5%) | 6 o más meses |
| Jackson GL et al.198126 | 178 | 32P 15 - 20 mCi+5 -10ml de SSN (200 tratamientos) | Ovario 97; Mama 10; GI 36; Pulmón 1; Otros 11; Desconocido 23 | RC o RP 81 (41%) (TRG supervivientes a 3 meses fue 85%) | 3 meses |
| Total | 913 | TRG 25,7–78.9% |
Au198: Oro coloidal radioactivo, 32P: Fosfato Crómico, Y90: Itrio, mCi: milicuries, SSN: solución salina normal, GI: gastrointestinal, GU: genitourinario
Respuesta a la ascitis según criterios de la Organización Mundial de la Salud (OMS): remisión completa (RC): desaparición de la ascitis persistiendo por lo menos 4 semanas; remisión parcial (RP): disminución del volumen de ascitis ≥ 50%, persistiendo por lo menos 4 semanas; enfermedad estable (EE): volumen de ascitis ha disminuido ≤50% o aumento menor al 25% a las 4 semanas de la inyección intraperitoneal; enfermedad en Progresión (EP): volumen de ascitis aumenta ≥25%; Indeterminada (I): muerte por enfermedad avanzada muy temprano para evaluación o mejoría explicada por otro tratamiento. La tasa de respuesta global (TRG) es calculada con la sumatoria de RC y RP.
Los efectos adversos más frecuentes son náusea, vómito, diarrea, fiebre (20-50%), dolor abdominal, peritonitis, anemia y leucopenia (20%). Se ha descrito el riesgo de necrosis intestinal y de obstrucción intestinal (7%) y en más del 50% de los casos se requiere manejo quirúrgico. Su uso se ha descontinuado debido al perfil de seguridad, la exposición a radiación y a la compleja logística que esta terapia acarrea4,7,27,29,31–33.
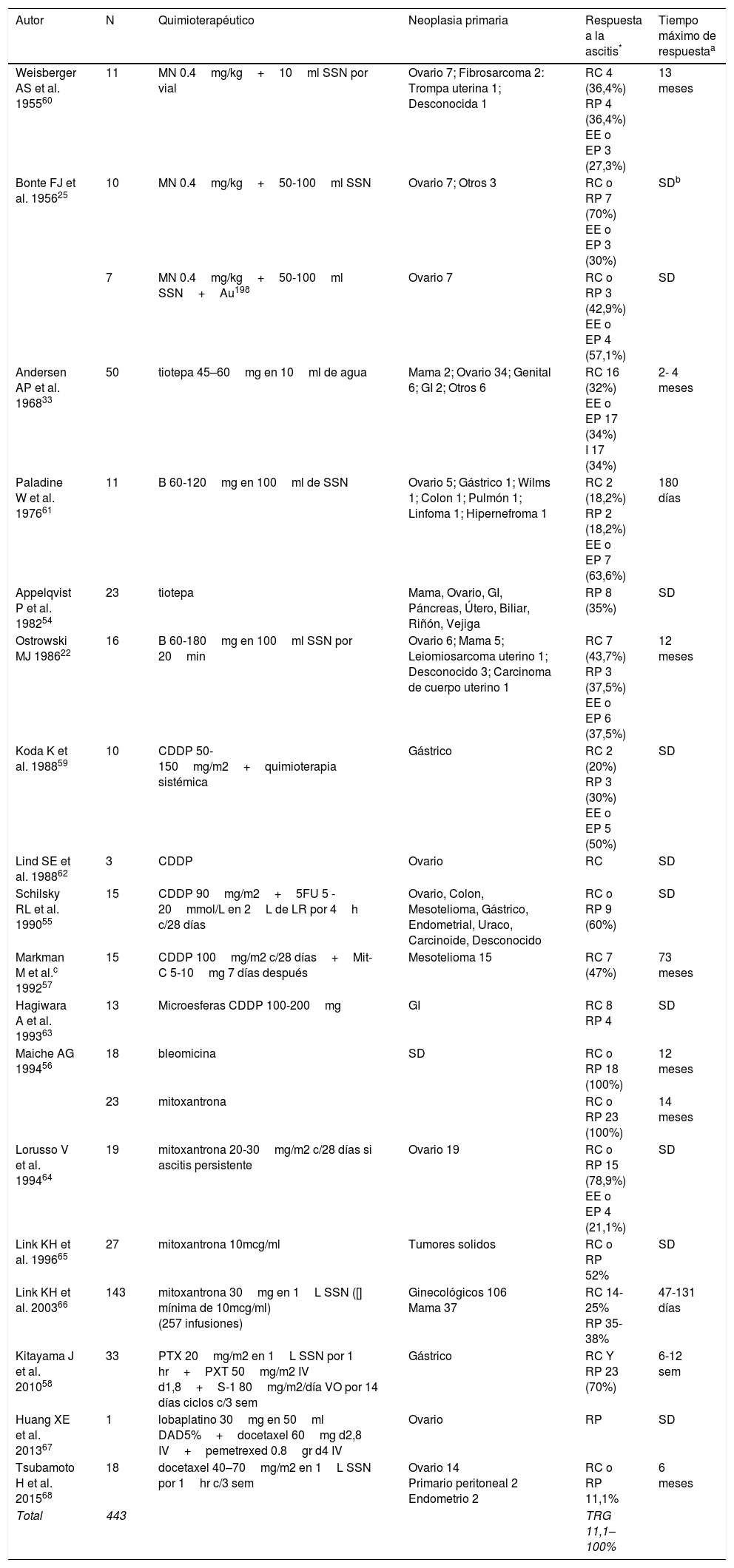
Quimioterapia intraperitonealCasi simultáneamente al uso de radioisótopos, los quimioterapéuticos intraperitoneales mecloretamina y tiotepa, mostraron resultados similares al Au198 con mayor facilidad técnica, menor costo y ausencia de toxicidad por radiación25. El elevado peso molecular evita la reabsorción a la circulación y las concentraciones intraabdominales elevadas del antineoplásico (intraperitoneal/plasma 18–1.000 veces) generan un mayor tiempo de exposición citotóxica minimizando la toxicidad sistémica. En la enfermedad peritoneal extensa no citorreducible se previene la recurrencia de la ascitis por erradicación de las células tumorales sobrenadantes, acción citostática y esclerosis extensa tras la destrucción de células malignas sobre la superficie mesotelial1,4,7,52,53.
La RC y respuesta parcial (RP) con los quimioterapéuticos iniciales en monoterapia o en combinación con radioisótopos oscilaba entre 30 y 70%, pero dejaron de utilizarse 30 años atrás porque generaban irritación peritoneal y adherencias con obstrucciones intestinales masivas (22% en autopsias). Los medicamentos más utilizados actualmente, tanto en monoterapia como en combinación, son: cisplatino, 5-fluoracilo, carboplatino, paclitaxel, mitomicina C, mitoxantrona, bleomicina, docetaxel, entre otros4,6,7,54.
El número acumulado de pacientes tratados con quimioterapia intraperitoneal es menos de la mitad de los reportados para isótopos radioactivos (tabla 2). La tasa de respuesta global (TRG) es de 11,1 a 100%, llamando la atención la respuesta reportada por Maiche con el uso de mitoxantrona y bleomicina, así como el tiempo máximo de respuesta de 73 meses reportado por Markman et al.55–57. La respuesta es más efectiva en pacientes que respondieron previamente a la terapia sistémica, e incluso algunos investigadores han propuesto la combinación de las dos vías4,7,52,58,59. Los principales efectos adversos son: irritación peritoneal severa, leucopenia, anemia y trombocitopenia4,6.
Reporte y serie de casos con uso de quimioterapia intraperitoneal para el tratamiento de AMR
| Autor | N | Quimioterapéutico | Neoplasia primaria | Respuesta a la ascitis* | Tiempo máximo de respuestaa |
|---|---|---|---|---|---|
| Weisberger AS et al. 195560 | 11 | MN 0.4mg/kg+10ml SSN por vial | Ovario 7; Fibrosarcoma 2: Trompa uterina 1; Desconocida 1 | RC 4 (36,4%) RP 4 (36,4%) EE o EP 3 (27,3%) | 13 meses |
| Bonte FJ et al. 195625 | 10 | MN 0.4mg/kg+50-100ml SSN | Ovario 7; Otros 3 | RC o RP 7 (70%) EE o EP 3 (30%) | SDb |
| 7 | MN 0.4mg/kg+50-100ml SSN+Au198 | Ovario 7 | RC o RP 3 (42,9%) EE o EP 4 (57,1%) | SD | |
| Andersen AP et al. 196833 | 50 | tiotepa 45–60mg en 10ml de agua | Mama 2; Ovario 34; Genital 6; GI 2; Otros 6 | RC 16 (32%) EE o EP 17 (34%) I 17 (34%) | 2- 4 meses |
| Paladine W et al. 197661 | 11 | B 60-120mg en 100ml de SSN | Ovario 5; Gástrico 1; Wilms 1; Colon 1; Pulmón 1; Linfoma 1; Hipernefroma 1 | RC 2 (18,2%) RP 2 (18,2%) EE o EP 7 (63,6%) | 180 días |
| Appelqvist P et al. 198254 | 23 | tiotepa | Mama, Ovario, GI, Páncreas, Útero, Biliar, Riñón, Vejiga | RP 8 (35%) | SD |
| Ostrowski MJ 198622 | 16 | B 60-180mg en 100ml SSN por 20min | Ovario 6; Mama 5; Leiomiosarcoma uterino 1; Desconocido 3; Carcinoma de cuerpo uterino 1 | RC 7 (43,7%) RP 3 (37,5%) EE o EP 6 (37,5%) | 12 meses |
| Koda K et al. 198859 | 10 | CDDP 50-150mg/m2+quimioterapia sistémica | Gástrico | RC 2 (20%) RP 3 (30%) EE o EP 5 (50%) | SD |
| Lind SE et al. 198862 | 3 | CDDP | Ovario | RC | SD |
| Schilsky RL et al. 199055 | 15 | CDDP 90mg/m2+5FU 5 - 20mmol/L en 2L de LR por 4h c/28 días | Ovario, Colon, Mesotelioma, Gástrico, Endometrial, Uraco, Carcinoide, Desconocido | RC o RP 9 (60%) | SD |
| Markman M et al.c 199257 | 15 | CDDP 100mg/m2 c/28 días+Mit-C 5-10mg 7 días después | Mesotelioma 15 | RC 7 (47%) | 73 meses |
| Hagiwara A et al. 199363 | 13 | Microesferas CDDP 100-200mg | GI | RC 8 RP 4 | SD |
| Maiche AG 199456 | 18 | bleomicina | SD | RC o RP 18 (100%) | 12 meses |
| 23 | mitoxantrona | RC o RP 23 (100%) | 14 meses | ||
| Lorusso V et al. 199464 | 19 | mitoxantrona 20-30mg/m2 c/28 días si ascitis persistente | Ovario 19 | RC o RP 15 (78,9%) EE o EP 4 (21,1%) | SD |
| Link KH et al. 199665 | 27 | mitoxantrona 10mcg/ml | Tumores solidos | RC o RP 52% | SD |
| Link KH et al. 200366 | 143 | mitoxantrona 30mg en 1L SSN ([] mínima de 10mcg/ml) (257 infusiones) | Ginecológicos 106 Mama 37 | RC 14-25% RP 35-38% | 47-131 días |
| Kitayama J et al. 201058 | 33 | PTX 20mg/m2 en 1L SSN por 1 hr+PXT 50mg/m2 IV d1,8+S-1 80mg/m2/día VO por 14 días ciclos c/3 sem | Gástrico | RC Y RP 23 (70%) | 6-12 sem |
| Huang XE et al. 201367 | 1 | lobaplatino 30mg en 50ml DAD5%+docetaxel 60mg d2,8 IV+pemetrexed 0.8gr d4 IV | Ovario | RP | SD |
| Tsubamoto H et al. 201568 | 18 | docetaxel 40–70mg/m2 en 1L SSN por 1hr c/3 sem | Ovario 14 Primario peritoneal 2 Endometrio 2 | RC o RP 11,1% | 6 meses |
| Total | 443 | TRG 11,1–100% |
CDDP: cisplatino, MN: mostaza nitrogenada, B: bleomicina, 5FU: 5- fluoracilo, Mit-C: mitomicina C, PTX: paclitaxel, min: minutos, sem: semanas, LR: lactato de ringer, []: concentración, DAD: dextrosa en agua destilada, d: día, h: horas, GI: gastrointestinal
Respuesta a la ascitis: remisión RC (RC): desaparición de la ascitis persistiendo por lo menos 4 semanas; remisión RP (RP): disminución del volumen de ascitis ≥ 50%, persistiendo por lo menos 4 semanas; enfermedad estable (EE): volumen de ascitis ha disminuido ≤50% o aumento menor al 25% a las 4 semanas de la inyección intraperitoneal; enfermedad en Progresión (EP): volumen de ascitis aumenta ≥25%; Indeterminada (I): muerte por enfermedad avanzada muy temprano para evaluación o mejoría explicada por otro tratamiento. La tasa de respuesta global (TRG) es calculada con la sumatoria de RC y RP.
La HIPEC surgió dado que la hipertermia (41-43°C) ejerce un efecto sinérgico con antineoplásicos seleccionados, generando mayor penetración, fibrosis y reducción de quimio-resistencia. Además, ofrece actividad citotóxica per se y promueve una respuesta inmune mixta y un barrido mecánico de las células tumorales gracias a la tecnología de perfusión1,6,8,14,53,69. En 1992 Gilly et al. fueron los primeros en publicar su experiencia, con resultados alentadores, encontrando varios trabajos publicados a la fecha (tabla 3)52,70.
Estudios con uso de HIPEC para el tratamiento de AMR
| Autor | N | Quimioterapéutico | Técnica °C | Neoplasia primaria | Respuesta a la ascitis* | Tiempo máximo de respuestaa |
|---|---|---|---|---|---|---|
| Reporte y serie de casos | ||||||
| Gilly FN et al. 199270 | 12c | Mit-C 10mg/L o CDDP 15-25mg/L en 6L de dializado peritoneal | Laparotomía técnica cerrada 46-49°C (influjo) | Digestiva 2; Ovárica 10 | RC 11 (91,7%) | SDb |
| Kusano H et al. 199374 | 5 | CDDP+E por 40 a 50min | Laparotomía 41.5–42°C | Gástrico 10; Colon 1 | RC 4 (80%) | 12 meses |
| François Y et al. 199775 | 12c | Mit-C 10m/L por 90min | Laparotomía 46-49°C (influjo) | Gástrico | RC o RP 8 (66,7%) | 2 meses |
| Chang E et al. 200176 | 2 | CDDP 250mg/m2 | Laparoscopia 40°C | Mama 1; Mesotelioma 1 | RC 1 (50%) EE o EP1 (50%) | > 12 meses |
| Hager ED et al. 200153 | 17 | CDDP 100mg o carboplatino 450mg o mitoxantrona 30mg en 3-4L SSN a 190-220ml/min por 60min c/5 a 7 días por 2 a 3 ciclos | Por catéter vía aguja de Veress 42-43°C | Ovario | RC o RP numero no especificado tras 3-5 ciclos (1,4 promedio) | SD |
| Garofalo A et al. 200614 | 14 | doxorrubicina 15mg/m2+CDDP 50mg/m2 en 2L dializado peritoneal por 90min | Laparoscopia 39.5 - 42°C | Ovario 3; Mama 2; Mesotelioma 1 | RC 6 (100%) | 21-667 días |
| Mit-C 12,5mg/m2 en 2L dializado peritoneal por 90min | Colorrectal 3; Gástrico 5 | RC 8 (100%) | ||||
| Patriti A et al. 200881 | 1 | doxorrubicina 7mg/m2/L+CDDP 25mg/m2/L en DAD5% a 800ml/min por 60min | Laparoscopia 42 -43°C | Mesotelioma | RC | 6 meses |
| Facchiano E et al. 200882 | 5 | Mit-C 120mg/m2+CDDP 200mg/m2 en 6L de solucion neutral por 60 a 90min | Laparoscopia 41-43°C | Gástrico | RC 5 (100%) | 33-144 días |
| Graziosi L et al. 200983 | 1 | doxorrubicina 7mg/m2/L+CDDP 25mg/m2/L en DAD5% a 800ml/min por 60min | Laparoscopia 42-43°C | Mesotelioma | RC | 11 meses |
| Valle M et al. 200978 | 52 | CDDP 50mg/m2+doxorrubicina 15mg/m2 2L DAD1,5% por 90min | Laparoscopia 42°C | Ovario 13; Mama 8; Mesotelioma 4 | RC 49 (94,2%) | 21-796 días |
| Mit-C 12.5mg/m2 en 2L DAD1.5% por 90min ** En 10 pacientes del total, se uso doxorrubicina 20mg/m2 independientemente del primario | Gástrico 15; Colon 11; Melanoma 1 | |||||
| Ba MC et al. 201077 | 16 | 5-FU 1500mg+oxaliplatino 200mg en DAD5% 4,5-6L por 90min a 400-600ml/min d1 (Salas de cirugía) d2 y 3 (UCI) | Laparoscopia 43±0.2°C | Gástrico | RC 14 (90.5%) RP 2 (9.5%) | Mínimo 4 semanas |
| De Mestier L et al. 201280 | 2 | Mit-C 75mg+CDDP 184- 250mg por 20-30min | Laparoscopia 43°C | Gástrico; Ovario | RC 2 (100%) | 3-5 meses |
| Di Giorgio 2013 (Datos no publicados, referenciados por Sibio S et al.)8 | 13 | Mit-C+5-FU+oxaliplatino CDDP por 60min | Laparoscopia SD | GI 4; Pseudomixoma peritoneal 1; Ovario 8 | RC 92.3% | SD |
| van den Houten MM et al. 201584 | 1 | Mit-C 35mg/m2 por 90min | Laparoscopia 41-42°C | Rectal | RC | 8 meses |
| Valle SJ et al. 201585 | 12 | CDDP 21mg-200mg+Mit-C 13mg-100mg o CDDP 100-120mg o CDDP 75mg+doxorrubicina 22mg o Mit-C 25mg o oxaliplatino 120-500mg en 2L por 30 a 90min | Laparoscópica 41-43°C | Gástrico 2; Colorrectal 2; Ovárico 1; Apéndice 1; Biliar 1; Mesotelioma 5 | RC 10 (83%) | 124-283 días |
| Wu Y et al. 20165 | 36 | 5-FU 1500mg+3,5-6L de SSN a 400-600ml/min por 90min ** En el tercer ciclo se adiciona carboplatino 80mg (GIST y ovario), Mit-C 10mg (hígado, gástrico, colon y páncreas) d1 (Salas de cirugía) d2 y 3 (Sala solo bajo premedicacion) | Guiada por ultrasonido 43±0.2°C | Gástrico 12; Ovario 12; Colon 8; Páncreas 2; Hepático 1; GIST 1 | RC 26 (72,2%) RP 8 (22,2%) EE o EP2 (5,6%) | Mínimo 4 semanas |
| Total | 201 | TRG 50-100% | ||||
| Ensayos clínicos aleatorizados | ||||||
| Ba MC et al. 201373 Cui S et al. 201272 | 32 | 1. Cáncer ovario: CDDP 50mg/m2+doxorrubicina 50mg/m2 en 3-6L SSN por 90min a 450-600ml/min d1 (Salas de cirugía) d2 y 3 (UCI) Otros: Mit-C 12.5mg/m2 en 3-6L SSN por 90min a 450-600ml/min d1 (Salas de cirugía) d2 y 3 (UCI) | Guiada por ultrasonido 41,5-42,5 ¿C | Gástrico 19; Ovario 20; Colorrectal 20; Pancreático 3 | RC 27 (84,38%) RP 3 (9,38%) EE o EP 2 (6,25%) | Mínimo 4 semanas |
| 30 | Laparoscopia 41,5-42,5 ¿C | RC 26 (86,67%) RP 2 (6,67%) EE o EP 2 (6,67%) | ||||
| Lu C et al. 201687 | 48 | HIPEC+quimioterapia sistémica | Guiada por ultrasonido SD | Gástrico | RC o RP 85,7% | 12 meses |
| Quimioterapia sistémica | RC o RP 30% | |||||
| Ba MC et al. 201686 | 13 | Ra 3mg/m2 d1 (salas de cirugía)+oxaliplatino 125mg/m2 d2 y 3 (UCI) en 4.5-6L DAD5% a 450-600ml/min | Laparoscopia 41-42°C | Gástrico | RC 13 (100%) | 4 semanas |
| 13 | Ra 3mg/m2 d1 (salas de cirugía)+CDDP 75mg/m2 d2 y 3 (UCI) en 4,5-6L SSN a 450-600ml/min | RC 9 (69,2%) RP 4 (30,8%) | ||||
| 12 | Ra 3mg/m2 d1 (salas de cirugía)+Mit-C 6mg/m2 d2 y 3 (UCI) en 4,5-6L SSN a 450-600ml/min ** Todos los pacientes recibieron FOLFOX4 IV a partir 2nda sem HIPEC (1-6 ciclos) | RC 9 (75%) RP 3 (25%) | ||||
| Total | 148 | TRG 85,7% - 100% | ||||
MIT-C: mitomicina C, CDDP: cisplatino, E: etoposido, 5FU: 5- fluoracilo, Ra: raltitrexed, FOLFOX4: Acido folinico, fluoracilo y oxaliplatino, SSN: solución salina normal, min: minutos, DAD: dextrosa en agua destilada, UCI: unidad de cuidados intensivos, d: día, GI: gastrointestinal
Respuesta a la ascitis: remisión RC (RC): desaparición de la ascitis persistiendo por lo menos 4 semanas; remisión RP (RP): disminución del volumen de ascitis ≥ 50%, persistiendo por lo menos 4 semanas; enfermedad estable (EE): volumen de ascitis ha disminuido ≤50% o aumento menor al 25% a las 4 semanas de la inyección intraperitonea; enfermedad en progresión (EP): volumen de ascitis aumenta ≥25%; Indeterminada (I): muerte por enfermedad avanzada muy temprano para evaluación o mejoría explicada por otro tratamiento. La tasa de respuesta global (TRG) es calculada con la sumatoria de RC y RP.
Originalmente descrita por laparotomía, se divide en: técnica abierta que genera una distribución más homogénea y técnica cerrada que evita la exposición a quimioterapéuticos durante el procedimiento. No hay estudios prospectivos que comparen las diferentes técnicas y algunos las han modificado para combinar los beneficios teóricos de cada una69,71–73. En las pocas series de casos la TRG oscila entre 66,7 y 91,7%70,74,75.
Desde el 2001 y hasta la actualidad, la HIPEC es más utilizada por cirugía mínimamente invasiva dado que en estos pacientes el objetivo no es realizar resección quirúrgica76. El número y posicionamiento de los trocares en la laparoscopia es variable, pero genera: menor trauma, menor dolor, una rápida recuperación, la posibilidad de adhesiolisis para mejorar la distribución farmacológica y una profundidad de penetración mayor por la presión intraabdominal77–79. Además ha demostrado efectividad incluso en la paliación de ascitis maligna hemorrágica permitiendo el cese de terapia transfusional, pese a que la TRG en reporte y serie de casos es variable (50 a 100%)8,14,33,53,76–78,80–85. No obstante, los pocos ensayos clínicos aleatorizados documentan respuesta completa de 81,6%, TRG entre 93,3 y 100%, y mejoría estadísticamente significativa en el estado funcional con aumento en el índice de Karnofsky (KPS) entre 10 y 40 puntos, demostrando la alta efectividad de esta técnica8,77,85,86.
En los últimos años se ha adoptado la técnica guiada por ultrasonido modo B. Un estudio reciente fase III que incluyó 48 pacientes, comparó quimioterapia sistémica con y sin HIPEC por esta técnica, favoreciendo al grupo experimental con una respuesta de 85,7% vs 30% (p 0,05), mejorando su calidad de vida al brindar una diferencia de 6 meses en la supervivencia libre de enfermedad y una mayor supervivencia global al año (89,3% vs 36,4%)87; dichos datos concuerdan con la serie más grande de HIPEC guiada por ultrasonografía publicada por Wu et al., que obtuvo TRG de 94,4%5. Al compararse aleatoriamente la vía laparoscópica y la ultrasonografica, no hay diferencias estadísticamente significativas en eficacia, pero sí en tiempo del procedimiento (85 vs 35min) y costo, favoreciendo la vía ecográfica, aunque más tarde estos mismos autores publicaron otro trabajo con más pacientes donde el tiempo medio de laparoscopia fue de 45 minutos, señalando la importancia de la curva de aprendizaje en la técnica quirúrgica73,86.
Los efectos secundarios más comunes son: la fiebre, la hiperglicemia, la supresión de medula ósea, la distensión y el dolor abdominal. Adicionalmente se deben tener en cuenta los riesgos asociados a la intervención quirúrgica, sin datos contundentes de la incidencia de estas complicaciones por el reciente uso de la HIPEC en este escenario; aunque es razonable presumir que son menores que aquellas descritas en cirugía más HIPEC. Otra preocupación es el riesgo de siembras malignas en los puertos de laparoscopia que se creía podía ser minimizado usando ultrasonido. Sin embargo, hasta el momento los datos no muestran diferencias significativas (10%-15,78% vs 9,375%)5,7,72,77,86,88.
Citoquinas y otras inmunoterapiasAlgunas citoquinas poseen actividad inmunomoduladora, antiangiogénica y antitumoral, usadas en el tratamiento de AMR, siendo el caso del interferón alfa y beta (INFα-β), este último menos utilizado pero con la ventaja farmacocinética de mayor permanencia tras inoculación. Los pocos estudios disponibles han mostrado TRG entre 38,5 y 65,9% a 101 días7,89–93. En cambio, el factor de necrosis tumoral alfa (TNFα) comparado frente a paracentesis demostró mayores efectos adversos leves a moderados sin beneficio terapéutico. La inmunoterapia puede producir síntomas constitucionales como: fiebre, fatiga, emesis, dolor, peritonitis, anemia y obstrucción intestinal94–96.
También se ha propuesto promover la inmunidad celular mediada por microorganismos como Corynebacterium parvum, polvo liofilizado de Streptococco pyogenes (OK-432) o el uso de plásmidos de ADN que codifican la cadena A de la toxina diftérica, con efecto citostático y citotóxico, demostrando que la respuesta clínica para AMR es dependiente de la expresión de TLR4 (toll like receptor), por lo menos para OK-43297. La disminución y la resolución de la ascitis fluctúa entre 40 a 100%98–102. Los efectos adversos fueron similares a los de la inmunoterapia99. Se ha estudiado el papel de la perfusión intraperitoneal de células asesinas inducidas por citoquinas (CIK) solas o en combinación, pero la TRG es menor que la lograda en otras inmunoterapias con beneficio mayor frente a la quimioterapia sistémica para estado funcional, tiempo a próxima punción (4 vs 2,5 meses p=0,001) y sobrevida (11 vs 6 meses p=0,006) (tabla 4)103,104.
Estudios con inmunoterapia para el tratamiento de AMR
| Autor | N | Inmunoterapia | Neoplasia primaria | Respuesta a la ascitis* | Tiempo máximo de respuestaa |
|---|---|---|---|---|---|
| Serie de casos | |||||
| Webb HE et al. 197899 | 5 | Corynebacterium parvum sepa CN 6134 (batch EZ 174) 7mg de peso seco/ml suspendidos en 0,01 tiomersalate de 0,5ml a 2ml | Ovario 4; Ovario vs Útero 1 | RC 2 (40%) RP 2 (40%) I 1 (20%) | 2 meses |
| Currie JL et al. 198398 | 15c | Corynebacterium parvum | Ovario 13; Endometrio 2 | RC o RP 6 (40%) I 3 (20%) EE o EP 6 (40%) | 3 meses |
| Katano M et al. 1983100 | 12 | Preparación de Streptoccoco OK-432 | Gástrico | RC 12 (100%) | SDb |
| Torisu M et al. 1983101 | 134 | Preparación de Streptococcus pyogenes OK-432 | GI | RC 76 (56,7%) RP 8 (6%) EE o EP 50 (37,3%) | 36 meses |
| Rambaldi A et al. 198589 | 7 | INFβ 3×106u dos veces por sem en 500ml de SSN por 30min | Ovario | RC 4 (57,1%) EE o EP 3 (42,9%) | 15 meses |
| Bezwoda WR et al. 198990 | 13 | INFα 5M UI/m2 en 200ml de dializado peritoneal en 20 a 40min c/15 días con escalamiento de dosis en 4 sem a 15M UI/m2 | Ovario | RC 1 (7,7%) RP 4 (30,8%) EE o EP 8 (61,5%) | 7,2 meses (mediana) |
| Kaufmann M et al. 1990105 | 23 | 0,08-0,14mg TNF/m2. | Ovario | RC 20 (87%) EE o EP 3 (13%);2/3 ascitis mucinosa | Mínimo 4 semanas |
| Räth U et al. 199195 | 29 | rhTNF-α 40-350mcg/m2 semanal por 2 meses | Ovario, GI, Útero, Hepático, Mama | RC 16 (55,2%) RP 6 (20,7%) EE o EP 6 (20,7%) I 1 (3,4%) | SD |
| Räth U et al. 199196 | 20 | rhTNF-α 0,08mg/m2 | Ovario | RC o RP 20 (100%) | SD |
| Stuart GCE et al. 199391 | 10 | INFα 10M UI/m2 en 500ml de SSN por 20min cada 2 sem por 2 a 4 ciclos | Ovario | RC 2 (20%) RP 3 (30%) EE o EP 5 (50%) | 6-13 semanas |
| Gebbia N et al. 199492 | 14 | INFα-2B | Mama, Gástrico, Ovario, Pulmonar Colorrectal, | RC o RP 6 (43%) | 4 semanas |
| Yamaguchi Y et al. 1995106 | 22 | 10 KE de OK-432+200,000 u.Jurkat de IL-2 | Gástrico | RP 18 (81%) | SD |
| Sartori S et al., 200193 | 41 | INFα 6-9M UI por 6 horas cada 4 días por 6 ciclos | Ovario, Gástrico, Hígado, Renal, Páncreas, Colon | RC 12 (29,3%) RP 15 (36,6%) EE o EP 14 (41,1%) | 101 días (promedio) |
| Hironaka K et al. 200697 | 12 | OK-432 d1 y d8 si no había rta | Gástrico | RC 8 (67%) EE o EP 4 (33%) | Mínimo 4 semanas |
| Yamaguchi Y et al. 2003102 | 16c | OK-432 0,2-5KE en 10ml SSN (n=11) | Colorrectal | RC 7 (64%) RP 2 (18%) EE o EP 2 (18%) | 1-16 meses |
| OK-432 0,2-5KE en 10ml SSN+100000IU interleukina-2 (n=5) | RC 4 (80%) RP 1 (20%) | 3 a 16 meses | |||
| Ai YQ et al. 2014104 | 22 | Células dendríticas+CIK | Colon 6; Ovario 3; Gástrico 1; Células claras 1; Hepático 2; Biliar 1; Páncreas 2; Endometrio 1; Cérvix 1; Recto 3; Sarcoma uterino 1 | RC 2 (9%) RP 7 (31,8%) EE 8 (36,4%) EP 5 (22,7%) | Mínimo 4 semanas |
| Total | 395 | TRG 38,5–100% | |||
| Ensayo clínico no aleatorizado | |||||
| Wang ZM et al. 2013103 | 20 | capecitabina IV+oxaliplatino IV+perfusión intraperitoneal de CIK | Gástrico | – | Tiempo de progresión 4,0 vs. 2,5 meses (P=0.001) |
| 22 | capecitabina IV+oxaliplatino IV | ||||
| Ensayo clínico aleatorizado | |||||
| Hirte HW et al. 199794 | 18 | rhTNF-α 60 mcg/m2 en 1L SSN+0,5% (i.e.25ml de 20%) de albumina sérica humana en infusión por 2 horas semanal hasta 3 ciclos+paracentesis | Ovario | EE o EP 17 (94,4%) I 1 (5,6%) | 4 semanas |
| 21 | Paracentesis sola | EE o EP 17 (81%) I 4 (19%) | |||
INFβ: interferón beta, INFα: interferón alfa, TNFα: factor de necrosis tumoral alfa, rhTNF-α: TNFα recombinante humano, CIK: células asesinas inducidas por citoquinas, sem: semanas, SSN: solución salina normal, min: minutos, GI: gastrointestinal
Respuesta a la ascitis: remisión RC (RC): desaparición de la ascitis persistiendo por lo menos 4 semanas; remisión RP (RP): disminución del volumen de ascitis ≥ 50%, persistiendo por lo menos 4 semanas; enfermedad estable (EE): volumen de ascitis ha disminuido ≤50% o aumento menor al 25% a las 4 semanas de la inyección intraperitonea; enfermedad en progresión (EP): volumen de ascitis aumenta ≥25%; Indeterminada (I): muerte por enfermedad avanzada muy temprano para evaluación o mejoría explicada por otro tratamiento. La tasa de respuesta global (TRG) es calculada con la sumatoria de RC y RP.
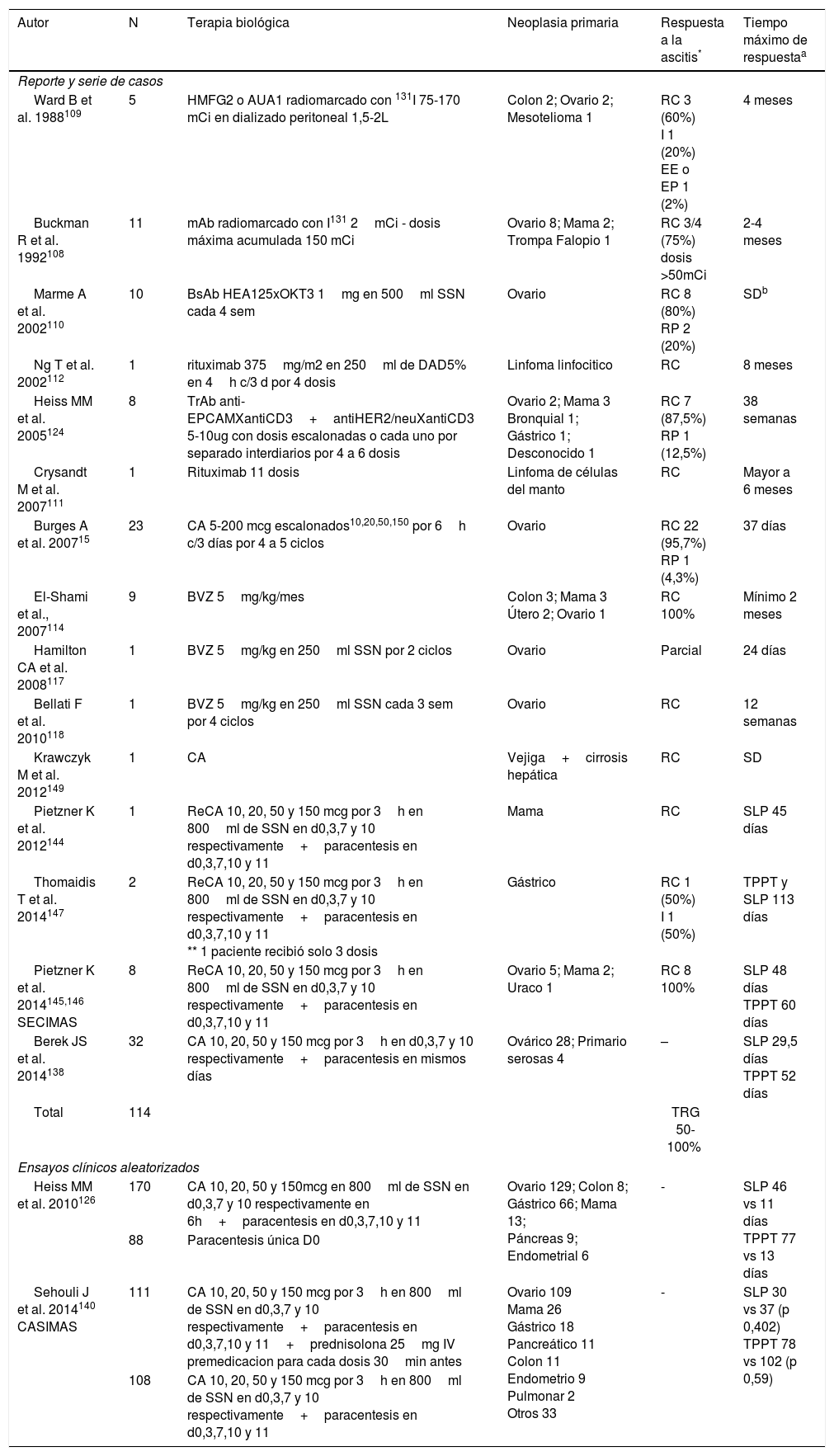
En 1975 los anticuerpos monoclonales fueron desarrollados por Köhler y Milstein. Estos y otros anticuerpos biespecíficos (BsAb) han mostrado algunos resultados dosis dependientes en el tratamiento intraperitoneal de la AMR (tabla 5)7,107–112. El bevacizumab (BVZ), un anticuerpo monoclonal importante por su papel antiangiogénico que está dirigido contra el factor de crecimiento endotelial vascular (VEGF), ha demostrado ser efectivo en reportes de caso después de administración parenteral. Debido a que las concentraciones del VEGF en efusiones malignas superan por mucho las séricas, se consideró que la instilación intraperitoneal podría ser una vía más adecuada, comprobándolo en experimentos preclínicos en modelos animales. En humanos ha sido utilizado con una respuesta hasta de 3 meses113–118. Estudios diseñados rigurosamente se encuentran en curso para establecer el verdadero papel del BVZ intraperitoneal en la AMR119–123.
Estudios con terapia biológica para el tratamiento de AMR
| Autor | N | Terapia biológica | Neoplasia primaria | Respuesta a la ascitis* | Tiempo máximo de respuestaa |
|---|---|---|---|---|---|
| Reporte y serie de casos | |||||
| Ward B et al. 1988109 | 5 | HMFG2 o AUA1 radiomarcado con 131I 75-170 mCi en dializado peritoneal 1,5-2L | Colon 2; Ovario 2; Mesotelioma 1 | RC 3 (60%) I 1 (20%) EE o EP 1 (2%) | 4 meses |
| Buckman R et al. 1992108 | 11 | mAb radiomarcado con I131 2mCi - dosis máxima acumulada 150 mCi | Ovario 8; Mama 2; Trompa Falopio 1 | RC 3/4 (75%) dosis >50mCi | 2-4 meses |
| Marme A et al. 2002110 | 10 | BsAb HEA125xOKT3 1mg en 500ml SSN cada 4 sem | Ovario | RC 8 (80%) RP 2 (20%) | SDb |
| Ng T et al. 2002112 | 1 | rituximab 375mg/m2 en 250ml de DAD5% en 4h c/3 d por 4 dosis | Linfoma linfocitico | RC | 8 meses |
| Heiss MM et al. 2005124 | 8 | TrAb anti-EPCAMXantiCD3+antiHER2/neuXantiCD3 5-10ug con dosis escalonadas o cada uno por separado interdiarios por 4 a 6 dosis | Ovario 2; Mama 3 Bronquial 1; Gástrico 1; Desconocido 1 | RC 7 (87,5%) RP 1 (12,5%) | 38 semanas |
| Crysandt M et al. 2007111 | 1 | Rituximab 11 dosis | Linfoma de células del manto | RC | Mayor a 6 meses |
| Burges A et al. 200715 | 23 | CA 5-200 mcg escalonados10,20,50,150 por 6h c/3 días por 4 a 5 ciclos | Ovario | RC 22 (95,7%) RP 1 (4,3%) | 37 días |
| El-Shami et al., 2007114 | 9 | BVZ 5mg/kg/mes | Colon 3; Mama 3 Útero 2; Ovario 1 | RC 100% | Mínimo 2 meses |
| Hamilton CA et al. 2008117 | 1 | BVZ 5mg/kg en 250ml SSN por 2 ciclos | Ovario | Parcial | 24 días |
| Bellati F et al. 2010118 | 1 | BVZ 5mg/kg en 250ml SSN cada 3 sem por 4 ciclos | Ovario | RC | 12 semanas |
| Krawczyk M et al. 2012149 | 1 | CA | Vejiga+cirrosis hepática | RC | SD |
| Pietzner K et al. 2012144 | 1 | ReCA 10, 20, 50 y 150 mcg por 3h en 800ml de SSN en d0,3,7 y 10 respectivamente+paracentesis en d0,3,7,10 y 11 | Mama | RC | SLP 45 días |
| Thomaidis T et al. 2014147 | 2 | ReCA 10, 20, 50 y 150 mcg por 3h en 800ml de SSN en d0,3,7 y 10 respectivamente+paracentesis en d0,3,7,10 y 11 ** 1 paciente recibió solo 3 dosis | Gástrico | RC 1 (50%) I 1 (50%) | TPPT y SLP 113 días |
| Pietzner K et al. 2014145,146 SECIMAS | 8 | ReCA 10, 20, 50 y 150 mcg por 3h en 800ml de SSN en d0,3,7 y 10 respectivamente+paracentesis en d0,3,7,10 y 11 | Ovario 5; Mama 2; Uraco 1 | RC 8 100% | SLP 48 días TPPT 60 días |
| Berek JS et al. 2014138 | 32 | CA 10, 20, 50 y 150 mcg por 3h en d0,3,7 y 10 respectivamente+paracentesis en mismos días | Ovárico 28; Primario serosas 4 | – | SLP 29,5 días TPPT 52 días |
| Total | 114 | TRG 50-100% | |||
| Ensayos clínicos aleatorizados | |||||
| Heiss MM et al. 2010126 | 170 | CA 10, 20, 50 y 150mcg en 800ml de SSN en d0,3,7 y 10 respectivamente en 6h+paracentesis en d0,3,7,10 y 11 | Ovario 129; Colon 8; Gástrico 66; Mama 13; Páncreas 9; Endometrial 6 | - | SLP 46 vs 11 días TPPT 77 vs 13 días |
| 88 | Paracentesis única D0 | ||||
| Sehouli J et al. 2014140 CASIMAS | 111 | CA 10, 20, 50 y 150 mcg por 3h en 800ml de SSN en d0,3,7 y 10 respectivamente+paracentesis en d0,3,7,10 y 11+prednisolona 25mg IV premedicacion para cada dosis 30min antes | Ovario 109 Mama 26 Gástrico 18 Pancreático 11 Colon 11 Endometrio 9 Pulmonar 2 Otros 33 | - | SLP 30 vs 37 (p 0,402) TPPT 78 vs 102 (p 0,59) |
| 108 | CA 10, 20, 50 y 150 mcg por 3h en 800ml de SSN en d0,3,7 y 10 respectivamente+paracentesis en d0,3,7,10 y 11 | ||||
HMFG2: Anticuerpo monoclonal murino IgG1, AUA1: Antígeno glicoproteico expresado en adenocarcinomas de ovario e intestino, 131I: Isotopo sintético del yodo, mAb: Anticuerpo monoclonal anti-mucina 2G3, BsAb HEA125xOKT3: Anticuerpo monoclonal biespecifico contra antígeno glicoproteico de superficie epitelial, TrAb: anticuerpo trifuncional, BVZ: bevacizumab, CA: catumaxomab, ReCA: re exposición a catumaxomab, TPPT: mediana tiempo a próxima paracentesis terapéutica, mCi: milicuries, SSN: solución salina normal, sem: semanas, d: días, h: horas, min: minutos, SLP: mediana supervivencia libre de punción que es definida como el tiempo desde el retiro del catéter hasta la primera paracentesis terapéutica o muerte, la que ocurriera primero
Respuesta a la ascitis: remisión RC (RC): desaparición de la ascitis persistiendo por lo menos 4 semanas; remisión RP (RP): disminución del volumen de ascitis ≥ 50%, persistiendo por lo menos 4 semanas; enfermedad estable (EE): volumen de ascitis ha disminuido ≤50% o aumento menor al 25% a las 4 semanas de la inyección intraperitoneal; enfermedad en progresión (EP): volumen de ascitis aumenta ≥25%; Indeterminada (I): muerte por enfermedad avanzada muy temprano para evaluación o mejoría explicada por otro tratamiento. La tasa de respuesta global (TRG) es calculada con la sumatoria de RC y RP.
Una nueva clase de BsAb no solo crea enlaces con las células tumorales, sino que genera activación simultanea de: células T, macrófagos, granulocitos, células dendríticas y natural killers. Los BsAb se consideran anticuerpos trifuncionales (TrAb) capaces de activar citotoxicidad inducida por el complejo mayor de histocompatibilidad no restringido sin requerir preactivación o coestimulación6,15,124,125.
El TrAb más estudiado es el catumaxomab (CA), derivado híbrido dirigido contra la molécula de adhesión de las células epiteliales (EpCAM). La EpCAM es indispensable para procesos de proliferación, diferenciación y adhesión, encontrándose sobreexpresada entre el 70 y 100% de las células tumorales en AMR, pero no se expresa en células mesoteliales normales, por lo que la administración intraperitoneal del CA ofrece la ventaja de una terapia locorregional específica sobre células tumorales EpCAM+ en la cavidad peritoneal. Además se une al CD3 de los linfocitos T por la IgG2b proveniente de la rata, uniendo y activando los receptores Fcγ tipo I y III de las células accesorias por medio de la porción hibrida de la región Fc6,15,107,126.
Las dosis empleadas surgieron de estudios con CA en carcinomatosis peritoneal cuyo objetivo no fue evaluar la respuesta a la AMR, pero que comprobaron que las dosis altas escalonadas conferían mayor actividad antitumoral sin comprometer el perfil de seguridad en contraposicion a las dosis bajas constantes13,127,128. En AMR su uso fue publicado por primera vez en el 2005, donde este y otro estudio fase I/II mostraron TRG del 100% y disminución en el 99,9% de las células tumorales EpCAM+15,107,124,125.
En el 2010 un ensayo clínico aleatorizado multicéntrico (75 centros de 13 países) en pacientes con AMR por distintos cánceres epiteliales126. La asignación fue 2:1 para comparar paracentesis con o sin infusión intraperitoneal de CA con un seguimiento a 7 meses. Como desenlace primario se encontró una mediana de supervivencia libre de punción (SLP) de 46 vs 11 días para toda la cohorte (HR 0,254; IC95% 0,185-0,350 correspondiente a una reducción del riesgo de punción o muerte del 75%). Una SLP de 52 vs 11 días (p 0<001) para cáncer de ovario y de 37 vs 14 días (p<0,001) para otros cánceres, siendo también significativos los resultados al evaluar el subgrupo de cáncer gástrico (44 vs 15 días, HR 0,289; IC95% 0,151-0,554). La mediana del tiempo a la próxima paracentesis terapéutica (TPPT) fue significativamente mayor para el grupo de CA (77 vs 13 días; HR 0,169 IC95% 0,114-0,251), indicando que el CA evita la necesidad de aproximadamente 5 punciones. En el análisis estratificado por cánceres, se observó la mayor diferencia en TPPT para el cáncer gástrico (118 vs 15 días; HR 0,143 IC95% 0,057-0,359). La mediana de supervivencia global (SG) fue solo estadísticamente significativa para cáncer gástrico (71 vs 4 días; p 0,0313)126,129–135. Utilizando el cuestionario validado EORTC QLQ-C30 (European Organization for Research and Treatment of Cancer Quality of Life Questionnaire-Core 30 items) se evidenció un deterioro más rápido en los puntajes de calidad de vida para el grupo control vs CA con un tiempo al primer deterioro de 19 a 26 días vs 47 a 49 días (HR entre 0,08-0,24)136,137. El impacto positivo en la calidad de vida concuerda con los resultados encontrados más tarde por Berek et al. en un estudio fase II específico para cáncer de ovario o primario de serosas platino refractario, donde hubo mejoría sintomática en 9 de 13 categorías al aplicar la escala FACIT-AI (Functional Assessment of Chronic Illness Therapy-Ascites Index)138,139.
Más del 80% de los pacientes reciben el esquema completo de CA reflejando aceptable tolerabilidad. Los efectos adversos se presentan generalmente el día de la infusión secundarios al mecanismo de acción inmunológico, siendo leves a moderados en el 85% (fiebre, náuseas, vómito, linfopenia, dolor abdominal) y severos en un 15% (elevación de enzimas hepáticas, infecciones en piel y catéter, extravasación, gastritis erosiva hemorrágica, obstrucción intestinal, rash e íleo)9,15,126.
Con el objetivo de reducir los efectos secundarios asociados a la liberación de citoquinas por medio de corticoides, se desarrolló el ensayo clínico multicéntrico CASIMAS (Catumaxomab Safety with Intraperitoneal infusion in Malignant Ascites), que empleó aleatorizadamente el CA con prednisolona y sin esta, aunque no demostró inferioridad en la resolución de ascitis y falló en demostrar reducción e intensidad de los efectos adversos140.
Por el potencial inmunogénico del CA se ha comprobado el desarrollo de anticuerpos antidroga (anticuerpos anti-ratón humanos: HAMA) con la preocupación teórica no solo de inhibición de la actividad citotóxica hacia las células tumorales, sino de reacciones alérgicas graves como choque anafiláctico. No obstante, lo anterior no ha sido evidenciado en los diferentes estudios a pesar de una seroconversión a HAMA+ del 95% de los pacientes que reciben todas las dosis de CA. De hecho parece que estos anticuerpos potenciaran la respuesta inmune antitumoral, pues en un análisis post hoc el beneficio clínico fue incluso mayor para pacientes HAMA+ vs HAMA- con una SLP de 64 vs 27 días (HR 0,330; p<0,0001), TPPT de 104 vs 46 días (HR 0,307; p=0,0002) y una SG de 129 vs 64 días (HR 0,433; p=0,0003)110,126,141.
Basados en el estudio esencial, desde abril de 2009 el CA fue aprobado por la Agencia de Medicina Europea para tratamiento intraperitoneal de AMR en pacientes EpCAM+ cuando el tratamiento estándar no está disponible o no es posible, convirtiéndola en la única droga aprobada para esta entidad. Generalmente es ofrecida a pacientes con expectativa de vida mayor a 3 meses17,107,142. En la actualidad no está disponible para Colombia.
Posteriormente surgió la pregunta si un segundo ciclo de CA era factible y efectivo para pacientes que se beneficiaron de la primera aplicación pero que eventualmente recurrieron con la ascitis, siendo la preocupación principal si los HAMA interferirían con la eficacia y seguridad. Los resultados alentadores de un reporte de caso motivaron la realización del estudio fase I/II SECIMAS (Safety Study of Second Intraperitoneal Infusion Cycle of Catumaxomab in Patients With Malignant Ascites) que re-exponía a CA pacientes del estudio CASIMAS. En total, 8 mujeres fueron analizadas, encontrando SLP de 48 días, TPPT de 60 días y una SG de 407 días. La calidad de vida y el puntaje de los síntomas de ascitis (FACIT-AI) permanecieron estables. Todas presentaron algún evento adverso pero ninguna reacción alérgica139,143–147.
Otro antiangiogénico que probablemente pueda ser usado intraperitonealmente en el futuro es el aflibercept, de uso endovenoso pero que hasta el momento ha mostrado resultados positivos para resolución de ascitis maligna en modelos murinos tras aplicación intraperitoneal11,125,148.
Terapia intraperitoneal combinadaLo estudios piloto en los cuales se combinó quimioterapia e inmunoterapia o terapia biológica no mostraron superioridad al compararse con los resultados en monoterapia (tabla 6)19,150,151. Vale la pena resaltar los resultados de dos ensayos clínicos aleatorizados que favorecieron las combinaciones sin aumentar efectos secundarios; el primero evaluó quimioterapia más interleuquina 2 con o sin verapamilo intraperitoneal, teniendo en cuenta que este último revierte el efecto de resistencia multidroga en células tumorales in vitro a dosis que no pueden ser usadas por vía endovenosa por el riesgo de efectos cardíacos. Mostró TRG de 85% vs 9,7% (p<0,05), mejoría significativa en la calidad de vida (83,5% vs 13,7%) por incremento en KPS ≥ 10 y supervivencia aumentada a los 3,6,9 y 12 meses152. El segundo evaluó quimioterapia sistémica más intraperitoneal con o sin BVZ en cáncer de ovario, demostrando TRG de 90,32% vs 59,26% (p=0,0143) y mejoría en el KPS ≥ 10 (93,55% vs 48,15%), aunque se debe puntualizar que el 22,5% de los pacientes no se encontraban en manejo paliativo153.
Estudios con terapia IP combinada para el tratamiento de AMR
| Autor | N | Combinación IP | Neoplasia primaria | Respuesta a la ascitis* | Tiempo máximo de respuestaa |
|---|---|---|---|---|---|
| Serie de Casos | |||||
| Mäenpää J et al. 1994151 | 19 | INFα2b 20-50mU+mitoxantrone 20-50mg | Ovario | RC 1 (5,3%) RP 7 (36,8%) EE 4 (21,1%) EP 7 (36,8%) | 1-12 meses (5 meses) |
| Xue SL et al. 201319 | 18 | 5FU 600mg/m2 d1-3 en 500ml SSN+CDDP 30mg/m2 d1-3 en 500ml SSN+endostar 60mg d4 en 250ml SSN previa inyección de 10mg dexametasona i.p. en 100ml SSN dejado en cavidad hasta próxima infusión c/3 sem por 4 ciclos | Gástrico 9; Colorrectal 8; Páncreas 1 | RC 4 (22,2%) RP 6 (33,3%) EE 4 (22,2%) EP 4 (22,2%) | Mínimo 4 semanas |
| Zhao J et al. 2014150 | 23 | PTX 100mg/m2 por 3h en 1L de DAD5% d1+5FU 600mg/m2 d1 a 3 en 500ml SSN+endostar 60mg en 250ml de SSN d4 previa administración de 10mg de dexametasona i.p. c/4 sem hasta 4 ciclos, toxicidad o progresión | Ovario | RC 6 (26,1%) RP 8 (34,8%) EE 5 (21,7%) | Mínimo 4 semanas |
| Ensayo clínico aleatorizado | |||||
| Jia W et al. 2013152 | 41 | 1. Cáncer colorrectal: oxaliplatino 150-200mg IV+2hrs después verapamilo 5mg en 50ml SSN+5-FU i.p. 1-1.5gr en 150ml SSN Otros: verapamilo 25mg en 50ml SSN por 5min+CDDP 70-90mg i.p.+5FU 1gr i.p. en 150ml SSN+IL-2 | Gástrico 20; Mama 2; Colorrectal 5; Vejiga 1; Páncreas 7; Biliar 1; Esofago 2; Vesícula 1; Desconocido 3 | RC 13 (31,7%) RP 22 (53,6%) EE 4 (9,8%) EP 2 (4,9%) | 4 semanas |
| 31 | 1. Cáncer colorrectal: oxaliplatino 150-200mg IV+5-FU i.p. 1-1.5gr en 150ml SSN Otros: CDDP 70-90mg i.p.+5FU 1gr i.p. en 150ml SSN+IL-2 | Gástrico 20; Laringe 1; Colorrectal 4; Esófago 2; Páncreas 1; Desconocido 3 | RC 1 (3,2%) RP 2 (6,5%) EE 16 (51,6%) EP 12 (38,7%) | ||
| Zhao H et al. 2015153 | 31 | (n=31) CDDP 40mg/m2+BVZ 300mg en 20ml SSN cada 2 semanas ** | Ovario | RC 18 (58,0%) RP10 (32,3%) EE o EP3 (9,7%) | Mayor a 6 semanas |
| 27 | cisplatino (n= 27) 40mg/m2 cada 2 semanas** ** Todos los pacientes reciben PTX 135mg/m2 d1+carboplatino 5 AUC d1 IV | RC 11 (40,7%) RP 5 (18,5%) EE 8 (29,6%) EP 3 (11,1%) | |||
IP: intraperitoneal, INFα2b: Interferón alfa 2b, 5FU: 5 fluoracilo, CDDP: cisplatino, endostar: endostatina humana recombinante, PTX: paclitaxel, BVZ: bevacizumab, SSN: solución salina normal, DAD: dextrosa en agua destilada
Respuesta a la ascitis: remisión RC (RC): desaparición de la ascitis persistiendo por lo menos 4 semanas; remisión RP (RP): disminución del volumen de ascitis ≥ 50%, persistiendo por lo menos 4 semanas; enfermedad estable (EE): volumen de ascitis ha disminuido ≤50% o aumento menor al 25% a las 4 semanas de la inyección intraperitoneal; enfermedad en progresión (EP): volumen de ascitis aumenta ≥25%; Indeterminada (I): muerte por enfermedad avanzada muy temprano para evaluación o mejoría explicada por otro tratamiento. La tasa de respuesta global (TRG) es calculada con la sumatoria de RC y RP.
Las metaloproteinasas comprenden un grupo de enzimas usadas por el tumor para degradación y remodelación de matrices tisulares durante la diseminación metastásica, las cuales pueden ser inhibidas por el inhibidor de matriz de metaloproteinasas (MMPIs) batimastat (BB94), que además bloquea la angiogénesis, convirtiéndose en opción terapéutica3. Dos estudios fase I y II con 32 pacientes con diferentes neoplasias evaluados en conjunto evidenciaron TRG de 65,6%, donde el 15,6% de los pacientes no presentó reacumulación de líquido hasta por 112 días. Los efectos adversos reportados fueron leves a moderados en las primeras 24 horas6,154,155.
Los corticosteroides han demostrado regulación a la baja del VEGF, explicando la respuesta a la triamcinolona intraperitoneal en pacientes con ascitis refractaria secundaria a enfermedad renal terminal. Basado en esto, se estudió el acetónido de triamcinolona en AMR mediante dos estudios piloto que consideraban a 41 pacientes. Aunque la mayoría experimentó recurrencia de la ascitis, hubo prolongación del TPPT estadísticamente significativo entre 7 y 8 días y mejoría sintomática. Concordantemente ocurrió respuesta a la AMR por linfoma no-Hodgkin en un reporte de caso. Los efectos adversos reportados son: dolor abdominal, astenia, herpes zóster, peritonitis bacteriana y cuatro casos de perforaciones intestinales sin poderse confirmar o descartar como secundario al medicamento. Se requieren más estudios, ya que esta podría ser una terapia más costo efectiva que otras156–158.
La terapia fotodinámica (PTD) intraperitoneal utiliza un fotosensibilizador que captura la energía de la luz y la transfieren al oxígeno, generando especies reactivas que conllevan a necrosis o apoptosis celular, daño vascular y estimulación de inmunidad antitumoral. Se ha encontrado respuesta para ascitis en modelos murinos y, aunque los estudios disponibles en humanos no han tenido como objetivo primario el manejo paliativo de la ascitis, si se ha evidenciado disminución en el requerimiento de paracentesis en carcinomatosis peritoneal6,159,160.
ConclusiónLa AMR continúa siendo un problema clínico difícil de afrontar, donde las terapias convencionales proporcionan alivio sintomático temporal, con supervivencias que van desde 1 a 6 meses. Varios investigadores han enfocado su atención en la terapia intraperitoneal utilizando diversas técnicas para la infusión de medicamentos dentro de la cavidad abdominal luego del drenaje del líquido ascítico. Este tipo de técnicas han evolucionando a través del tiempo, desde punciones guiadas por puntos anatómicos, métodos quirúrgicos abiertos y laparoscópicos, así como la colocación de los catéteres por vía ultrasonográfica, haciendo de esta una excelente alternativa para los pacientes en escenario paliativo teniendo en cuenta que es un manejo local que disminuye los efectos adversos sistémicos. Múltiples fármacos han sido utilizados y aunque el abordaje no está estandarizado y la comparación directa no es posible, los tratamientos más prometedores por sus tasas de éxito (principalmente en cáncer de ovario y GI) y los estudios epidemiológicos más solidos comprenden la HIPEC y el uso de CA, siendo este ultimo el único medicamento aprobado para esta indicación por una entidad reguladora. Pese a que este no está disponible en Colombia, aun así debe continuarse la investigación en este campo con el fin de lograr resultados más duraderos, seguros y costo-efectivos enfocados en la calidad de vida.
Conflicto de interésLos autores declaran no tener conflicto de interés.