Describir la experiencia en el manejo de los pacientes con diagnóstico de neuroblastoma de alto riesgo manejados con trasplante autólogo de células madre hematopoyéticas en la Fundación Valle de Lili.
Pacientes y métodosEstudio descriptivo, tipo serie de casos de pacientes con diagnóstico de neuroblastoma de alto riesgo que recibieron trasplante autólogo de células madre hematopoyéticas entre 2001 y 2015. Los desenlaces de este estudio fueron: supervivencia global; supervivencia libre de evento; tiempo de injerto de plaquetas y neutrófilos, e incidencia acumulada de enfermedad venooclusiva. Se realizó un análisis estadístico descriptivo para todas las variables consideradas en el análisis y para subgrupos seleccionados. El análisis de supervivencia se hizo con el método Kaplan-Meier.
ResultadosEntre 2001 y 2015 quince pacientes con diagnóstico de neuroblastoma recibieron trasplante autólogo de células madre hematopoyéticas. La supervivencia global a 3 y 5 años fue del 55% y la supervivencia libre de evento fue del 47%, donde 14 pacientes injertaron neutrófilos entre el día 8 y 19 postrasplante e injerto de plaquetas entre los 9 y 91 días y 2 pacientes desarrollaron enfermedad venooclusiva hepatica como toxicidad a los fármacos quimioterapéuticos de acondicionamiento. Al momento del último seguimiento 10 pacientes permanecen vivos, de los cuales 8 no presentan evidencia clínica y/o paraclínica de la enfermedad. De los 5 pacientes que fallecieron, 2 fue por toxicidad al trasplante en los primeros 100 días y 3 por progresión de la enfermedad.
ConclusiónEl trasplante autólogo de células madre hematopoyéticas es una alternativa factible como tratamiento en nuestro medio para pacientes con diagnóstico de neuroblastoma de alto riesgo, el cual ha contribuido a mejorar la supervivencia en este grupo de pacientes.
Describe the experience in the management of patients diagnosed with high-risk neuroblastoma treated with autologous haematopoietic stem cell transplantation at the Valle de Lili Foundation Hospital.
Patients and MethodsA series of cases of patients with a diagnosis of high-risk neuroblastoma who received an autologous haematopoietic stem cell transplantation between 2001 and 2015. The endpoints of this study were: overall survival, event-free survival, platelet and neutrophil graft time and the cumulative incidence of venous-occlusive disease. A descriptive statistical analysis was performed for all the variables considered in the analysis and for the selected subgroups. Survival analysis was performed using the Kaplan-Meier method.
ResultsA total of 15 patients diagnosed with high risk neuroblastoma received an autologous haematopoietic stem cell transplantation between 2001 and 2015. Overall survival at 3 and 5 years was 55%, and the event-free survival was 47%. 14/15 patients grafted Neutrophils grafted between day 8 and 19 post-transplant in 14/15 patients, with platelet graft between days 9 and 91 days. Hepatic venous-occlusive disease was observed in 2/15 patients as toxicity to conditioning chemotherapeutic drugs. At the time of the last follow-up, 10/15 patients remained alive, 8 of whom had no clinical and/or para-clinical evidence of the disease. Of the 5/15 patients that died, 2 were due to transplant toxicity in the first 100 days, and 3 due to disease progression.
ConclusionWe conclude that autologous haematopoietic stem cell transplantation is a viable alternative as a treatment in our setting for patients with high-risk neuroblastoma, and has contributed to improve survival in this group of patients.
El neuroblastoma es el tumor extra craneal solido más frecuente en pediatría1. El tumor se origina de las células primordiales de la cresta neural y en el 90% de los casos se diagnostica antes de los 10 años2. En los países desarrollados representa el 7% de todas las malignidades en la infancia, con una incidencia anual de 1 por cada 7.000 nacidos vivos2.
Según el Sistema de Vigilancia de Cáncer Infantil (Vigicancer) entre 2009 a 2015 para la ciudad de Cali, de un total de 1516 neoplasias en pacientes menores de 15 años, se diagnosticaron 36 casos de tumores entre neuroblastoma y otros tumores de origen en nervio periférico; un 2% de los canceres pediátricos diagnosticados en la ciudad de Cali durante ese periodo de tiempo. En este mismo grupo de tumores se encontró que el 45% tenían una supervivencia libre de evento a los 20 meses3.
Con base a la determinación de algunas características biológicas y clínicas de la enfermedad, el Childrens Oncology Group (COG) desarrolló una estadificación en la que se asigna un grupo de riesgo permitiendo determinar el tratamiento y el pronóstico de los pacientes4. Según esta clasificación, los pacientes se agrupan en riesgo bajo, intermedio y alto. El 50% de los pacientes con el diagnóstico de neuroblastoma se clasifican como de alto riesgo y su manejo consiste en una terapia integral basada en tres pasos: quimioterapia de inducción; trasplante autólogo de células madres hematopoyéticas (TCMH), y una consolidación postrasplante para la enfermedad mínima residual, incluyendo radioterapia al tumor primario o los sitio comprometidos y terapia con retinoides5,6. Se ha evidenciado que los retinoides disminuyen la proliferación e inducen a la diferenciación de las líneas celulares previniendo la aparición de tumores refractarios y teniendo un efecto contra las células tumorales resistentes a los agentes citotóxicos6. Con el tratamiento estándar la supervivencia en los países desarrollados es alrededor del 45% a largo plazo2.
La Fundación Valle del Lili es una institución de cuarto nivel localizada en la ciudad de Cali, Colombia. Desde hace 20 años cuenta con Unidad de Trasplante de Medula Ósea para pacientes adultos y pediátricos. Desde el 2001 hasta el 2015 se han realizado 252 trasplantes de células madre hematopoyéticas en pacientes pediátricos, de los cuales 32 corresponden a tumores sólidos tales como: tumor de Wilms, sarcoma de Ewing, meduloblastoma y neuroblastoma. De esos 32 trasplantes, 15 corresponden a pacientes con neuroblastoma, representando el 6% del total de los trasplantes de células madre hematopoyéticas en la institución, y el 47% de trasplantes de tumores sólidos. En este periodo de tiempo se han presentado algunos cambios en el tratamiento en relación con el protocolo de acondicionamiento y el tiempo de recolección de los progenitores hematopoyéticos durante la quimioterapia de inducción. Inicialmente la recolección se realizaba al final del protocolo de inducción, mientras que en años recientes se viene haciendo entre el segundo y el cuarto ciclo de inducción. Igualmente, en el último periodo se adicionó al tratamiento dosis altas de Ifosfamida Carboplatino y Etopósido (ICE) con o sin rescate de células progenitoras en pacientes considerados de mala respuesta al tratamiento de primera línea7.
ObjetivoDescribir la experiencia en el manejo de los pacientes con diagnóstico de neuroblastoma de alto riesgo manejados con trasplante autólogo de células madre hematopoyéticas en la Fundación Valle de Lili.
MétodosPacientesLos pacientes incluidos en el estudio fueron pacientes pediátricos menores de 18 años con diagnóstico clínico, paraclínico e histológico de neuroblastoma de alto riesgo llevados a trasplante autólogo de células madre hematopoyéticas. En algunos pacientes la fase de diagnóstico se realizó intra institucionalmente, mientras que en otros los pacientes fueron remitidos a la institución con el diagnostico ya realizado (extra institucionalmente). Todos los pacientes fueron clasificados con neuroblastoma de alto riesgo según los criterios y los recursos disponibles, teniendo en cuenta la clasificación de riesgo del sistema de estadificación internacional de neuroblastoma (INSS) (tabla 1)2.
Sistema Internacional de Clasificación de Neuroblastoma INSS2
| Estadio | Hallazgos |
|---|---|
| 1 | Tumor localizado con resección macroscópica completa, con o sin enfermedad residual microscópica; ganglios linfáticos ipsilaterales representativos, negativos para el tumor microscópicamente (los nódulos adheridos al tumor primario y que fueron extirpados junto con este, pueden ser positivos). |
| 2A | Tumor localizado con resección macroscópica incompleta; ganglios linfáticos ipsilaterales representativos, negativos para el tumor microscópicamente. |
| 2B | Tumor localizado con o sin resección macroscópica completa; ganglios linfáticos ipsilaterales no adherentes, positivos para el tumor. Los ganglios linfáticos contralaterales agrandados deben ser negativos microscópicamente. |
| 3 | Tumor irresecable unilateral, infiltrante más allá de la línea media, con o sin afectación de los ganglios linfáticos regionales; o tumor unilateral localizado con compromiso de los ganglios linfáticos regionales contralaterales; o tumor en la línea media con extensión bilateral por infiltración (irresecable) o por afectación del ganglio linfático. La línea media está determinada por la columna vertebral. Los tumores que se originan en un lado y cruzan la línea media deben infiltrase sobre esta, o hacia el lado opuesto de la columna vertebral. |
| 4 | Cualquier tumor primario con diseminación a los ganglios linfáticos distantes, huesos, medula ósea, hígado, piel u otros órganos (excepto los definidos para la etapa 4S). |
| 4S | Tumor primario localizado (como se define en etapa 1, 2A o 2B), con diseminación limitada a piel, hígado o medula ósea (circunscrito a lactantes menores de un año). La afectación medular debe ser mínima (o sea <10% de células nucleadas totales identificadas como malignas por biopsia de hueso o por aspirado de medula ósea). Una afectación más extensa de la medula ósea se consideraría como enfermedad en etapa IV. Los resultados de la gammagrafía con metayodobencilguanidina (MBIG) en caso de que se efectué, deben ser negativos para la enfermedad en la médula ósea. |
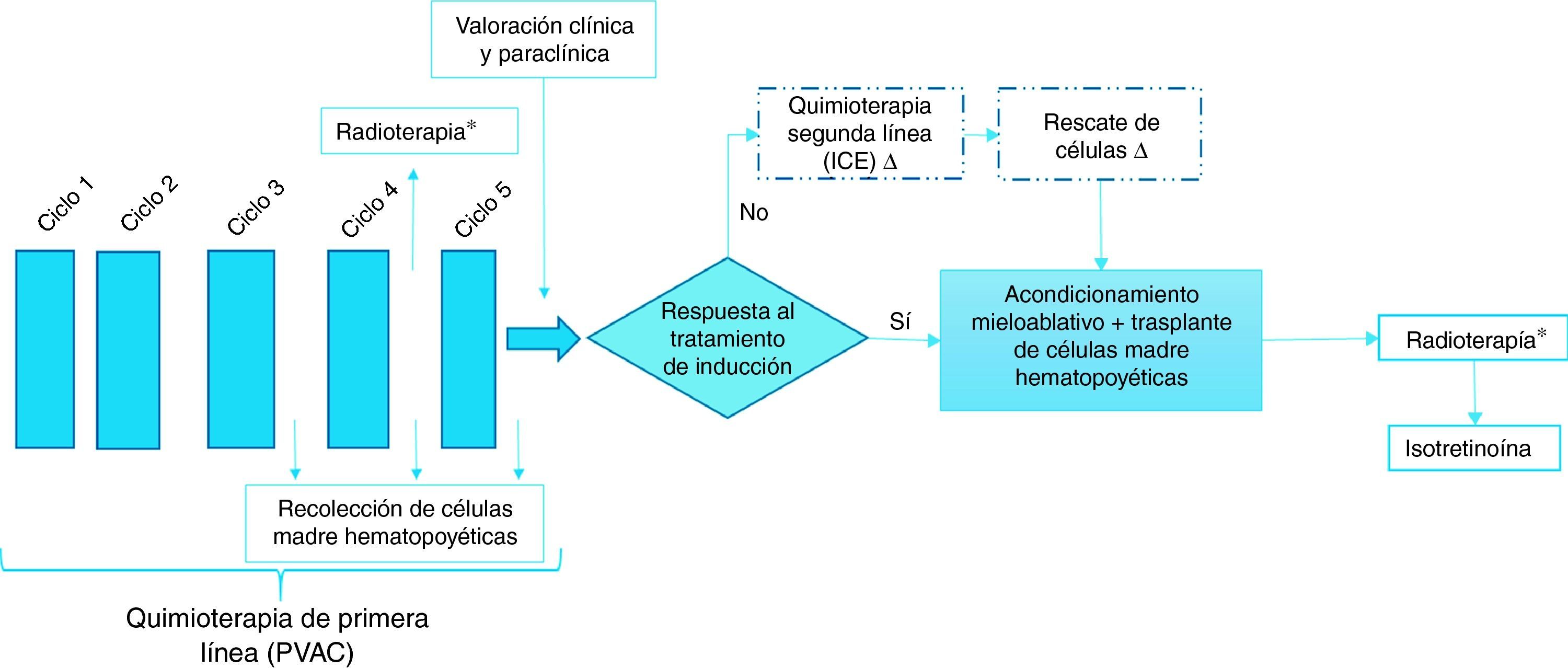
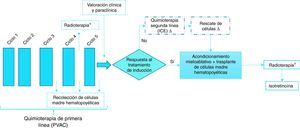
La figura 1 describe el flujograma de los regímenes de tratamiento en pacientes con diagnóstico de neuroblastoma de alto riesgo.
Regímenes de tratamiento
* Las dosis de radioterapia pueden ser previas o posterior al trasplante de médula ósea (no ambas).
Δ Como quimioterapia de segunda línea se utiliza el protocolo ICE con o sin rescate de células en pacientes con mala respuesta al tratamiento de inducción. Se realiza rescate de células en pacientes en quienes se les haya recolectado un buen número de células madre hematopoyéticas.
A continuación se especifican los regímenes de quimioterapia de primera y segunda línea y los protocolos de acondicionamiento incluidos en el flujograma.
Regímenes quimioterapéuticos- •
PVAC: Cisplatino (60mg/m2 IV durante 6 horas, día 0), Doxorubicina (30mg/m2 IV día 2), Etopósido (100mg/m2 IV días 2 y 5) y Ciclofosfamida (1000mg/m2 IV días 3 y 4)6.
- •
ICE: Ifosfamida 2000mg/m2 (2 horas de infusión) día −1 a −5; Carboplatino 500mg/m2 (1 hora de infusión) días −1 y −2; Etopósido 100mg/m2 (1 hora de infusión) días −1 a −57.
- •
ICE+rescate de células: administración de protocolo ICE con posterior infusión de células madre hematopoyéticas previamente recolectadas y crio preservadas7.
- •
BUMEL: Busulfan (Dosis/peso según edad día, IV en infusión para 3 horas/día por 4 dosis total los días −6, −5, −4 y −3) y Melfalan (140mg/m2 IV en mínima dilución en SSN en infusión de 15 minutos el día −2)8,9.
- ∘
Dosis Busulfan según peso10
- •
Peso inferior a 9kg: 4mg/kg/día.
- •
Peso igual o superior a 9kg e inferior a 16kg: 4,8mg/kg/día.
- •
Peso igual o superior a 16kg e inferior a 23kg: 4,4mg/kg/día.
- •
Peso igual o superior a 23kg e inferior a 34kg: 3,8mg/kg/día.
- •
Peso superior a 34kg se emplearán 3,2mg/kg/día.
- •
- ∘
En algunos pacientes se utilizo Busulfan via oral, 4mg/kg por 4 dias.
- •
CEM: Carboplatino (1000mg/m2), Etoposido (640mg/m2) administrado durante infusión continua durante 96 horas el día −8, y Melfalan una dosis de 140mg/m2 IV en bolo el día −7 y una dosis de 70mg/m2 IV en bolo el día −66.
- ∘
En todos los pacientes se administró: factor estimulante de colonias granulociticas (G-CSF) hasta obtener una recuperación de los neutrófilos; profilaxis antimicótica con Fluconazol; profilaxis antibiótica con Ciprofloxacina; profilaxis contra Pneumocystis carinii con Trimetropin/Sulfametoxazol, y profilaxis antiviral con Aciclovir. En algunos pacientes se administró ácido ursodeoxicolico como profilaxis para la enfermedad veno-oclusiva hepática.
Recolección y criopreservación de células madre hematopoyéticasA todos los pacientes se les realizo movilización con filgrastim y recolección de progenitores de sangre periférica con catéter de alto flujo en diferentes fases del protocolo de inducción. Una vez finalizada la recolección, en algunos pacientes el producto se separó en alícuotas por si eran necesarias como terapia de rescate de células. Posteriormente se inició proceso de criopreservación y congelación de células a una temperatura de – 84°G.
DefinicionesInjerto de neutrófilos y plaquetas: se definió como conteo absoluto de neutrófilos mayor de 500 c/μL por 3 días consecutivos y conteo absoluto de plaquetas mayores a 20.000 c/μL durante 3 días consecutivos sin transfusiones previas.
Fallo de injerto primario de neutrófilos: se definió como contento absoluto de neutrófilos menor de 500 c/μL al día+28.
Falla de injerto secundario: se definió como injerto inicial documentado con posterior pérdida de la función del injerto con hematopoyesis disminuida.
En la Unidad de Trasplante de Medula Ósea de la Fundación Valle del Lili, se lleva a cabo el registro de la información de los pacientes llevados a trasplante de células madre hematopoyéticas. Este empezó en 2012 e incluye de forma retrospectiva los pacientes trasplantados desde 2001 y a partir del 2013 se registra la información de manera prospectiva. Para este estudio se seleccionaron los pacientes con diagnóstico de neuroblastoma y se creó una base de datos adicional para la recolección de información específica que no contiene el registro.
Las variables incluidas en el registro conforman un manual con los códigos asignados que permite identificarlas apropiadamente para el análisis. Se realizó control de calidad de la información recolectada. Se verificó con exactitud las anotaciones en la base de datos y se revisaron todos los registros, los cuales se confrontaron con las historias clínicas.
Análisis estadísticoSe realizó un análisis estadístico descriptivo para todas las variables consideradas en el análisis y para subgrupos seleccionados. Las variables categóricas se resumen en proporciones. Las variables continuas se expresan como mediana con su rango intercuartil (RIC) o promedios±desviación estándar (DE). Los desenlaces primarios del estudio fueron: la supervivencia global (SG), la supervivencia libre de evento (SLE), el injerto de plaquetas y neutrófilos y la incidencia acumulada de enfermedad veno-oclusiva hepática (VOD). Los análisis se realizaron con el método Kaplan-Meier en el software estadístico STATA 12.
Este proyecto de investigación fue aprobado por el comité de ética de la Fundación Valle del Lili.
ResultadosPacientesEntre 2001 y 2015 se trasplantaron en la Fundación Valle del Lili un total de 15 pacientes con diagnóstico de neuroblastoma de alto riesgo (1 estadio clínico IIB y 14 estadio clínico IV según la clasificación del INSS). El rango de edad en el momento del trasplante estuvo entre los 18 meses y 7 años (promedio 3±1.8); 8 pacientes fueron de sexo femenino y 7 masculino. De los 15 pacientes a 8 se les hizo un diagnostico institucional y 7 tenían un diagnostico extra institucional. A todos los pacientes se les documentó diagnóstico histológico, y solo en dos se encontró reporte de clasificación patológica internacional la cual fue desfavorable (Internacional Neuroblastoma Pathology Classification-INPC)11. Al paciente con neuroblastoma estadio IIB se le realizó NMYC con un resultado positivo. La tabla 2 muestra las características de los pacientes.
Características demográficas y clínicas de los pacientes con neuroblastoma y trasplante de células madre hematopoyéticas en la Fundación Valle del Lili, 2001 – 2015
| Características | Valor (n=15) |
|---|---|
| Edad, años | |
| Promedio±DE | 3±1,8 |
| Rango | 18 meses – 7 años |
| Género masculino/femenino, n | 7/8 |
| Al momento del diagnóstico | |
| Metástasis óseas | 10 |
| LDH | |
| <750 | 10 |
| >750 | 2 |
| SD | 3 |
| NMYC | |
| Amplificado | 1 |
| No realizado | 14 |
| Estadio clínico | |
| IIB | 1 |
| IV | 14 |
| Tratamiento pretrasplante | |
| PVAC | 9 |
| Otros | 6 |
| Protocolo de segunda línea | |
| ICE | 2 |
| ICE+Rescate de células | 3 |
| Ninguno | 10 |
| Radioterapia | 1 |
| Evidencia de tumor previo al trasplante | 9 |
| Acondicionamiento | |
| BUMEL | 10 |
| CEM | 5 |
| Tratamiento postrasplante | |
| Isotretinoina | 13 |
| Radioterapia | 8 |
| No radioterapia | 6 |
De los quince pacientes llevados a trasplante, nueve recibieron terapia inicial con PVAC y seis recibieron otros protocolos de quimioterapia de inducción. Cinco pacientes no tuvieron una respuesta completa con la terapia de inducción, por lo que 2 recibieron quimioterapia de segunda línea con ICE y 3 recibieron ICE más rescate de células progenitoras. A todos los pacientes se les realizó gammagrafía, niveles de catecolaminas y biopsia histológica al momento del diagnóstico y dentro de los 30 días previos al trasplante. De los quince pacientes, nueve tuvieron evidencia clínica y/o paraclínica de tumor dentro de los 30 días previos al trasplante. Como terapia de consolidación: nueve pacientes recibieron radioterapia, un paciente previo al trasplante y los otros ocho posterior al trasplante; 13 pacientes recibieron tratamiento farmacológico con retinoides (isotretinoina), y 2 pacientes no recibieron ya que fallecieron dentro de los primeros 100 días postrasplante.
Regímenes de acondicionamientoCon respecto a los protocolos de acondicionamiento en este estudio de quince pacientes, diez recibieron el protocolo BUMEL y cinco recibieron el protocolo CEM. De los diez pacientes que recibieron el protocolo BUMEL, a la fecha de censura tres fallecieron de los cuales, uno fue por toxicidad al trasplante (choque séptico) y dos por recaída postrasplante. Por otro lado, de los cinco pacientes que recibieron el protocolo CEM, a la fecha de censura dos fallecieron, uno por toxicidad al trasplante (choque séptico) y el otro por recaída postrasplante.
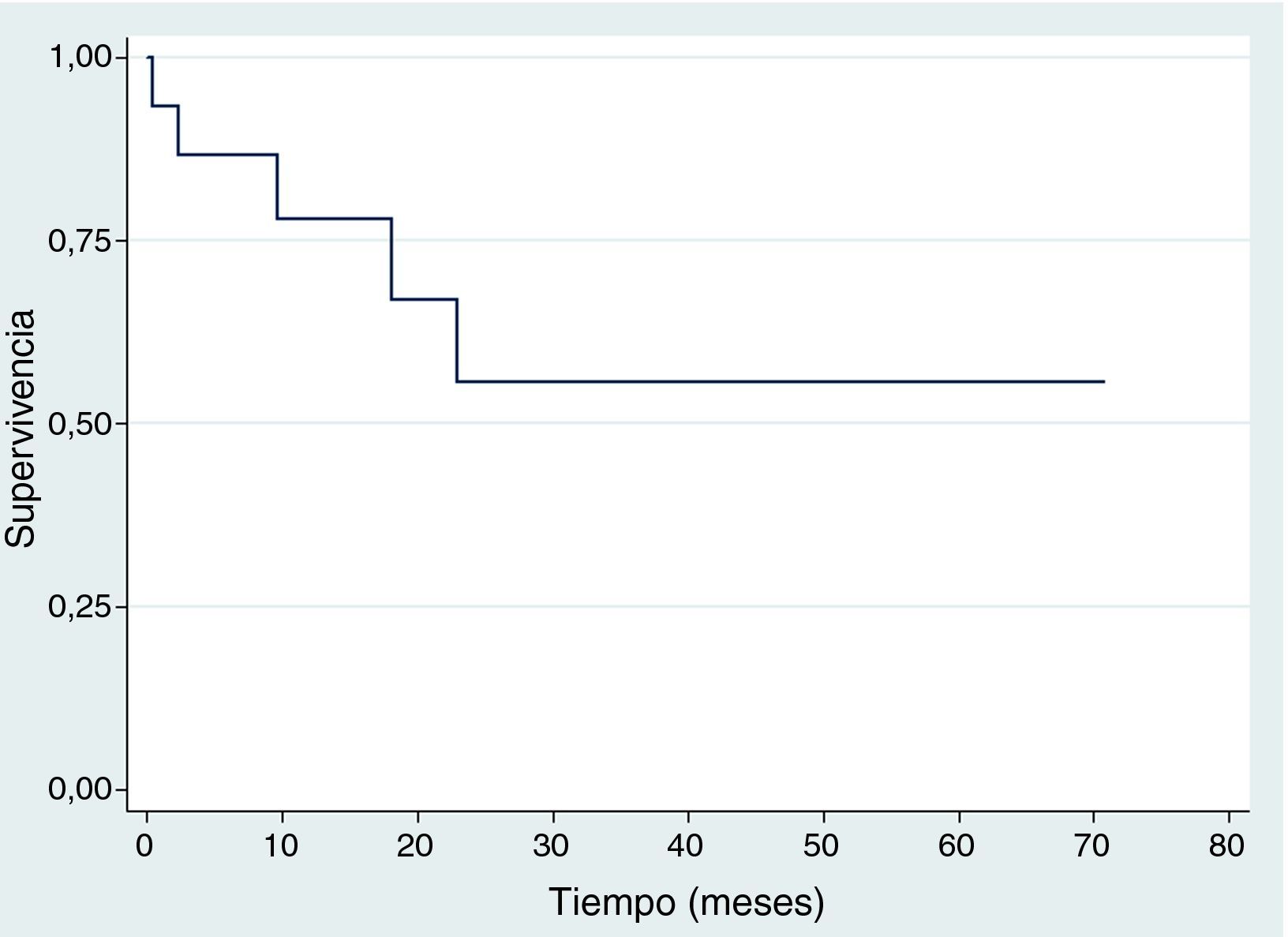
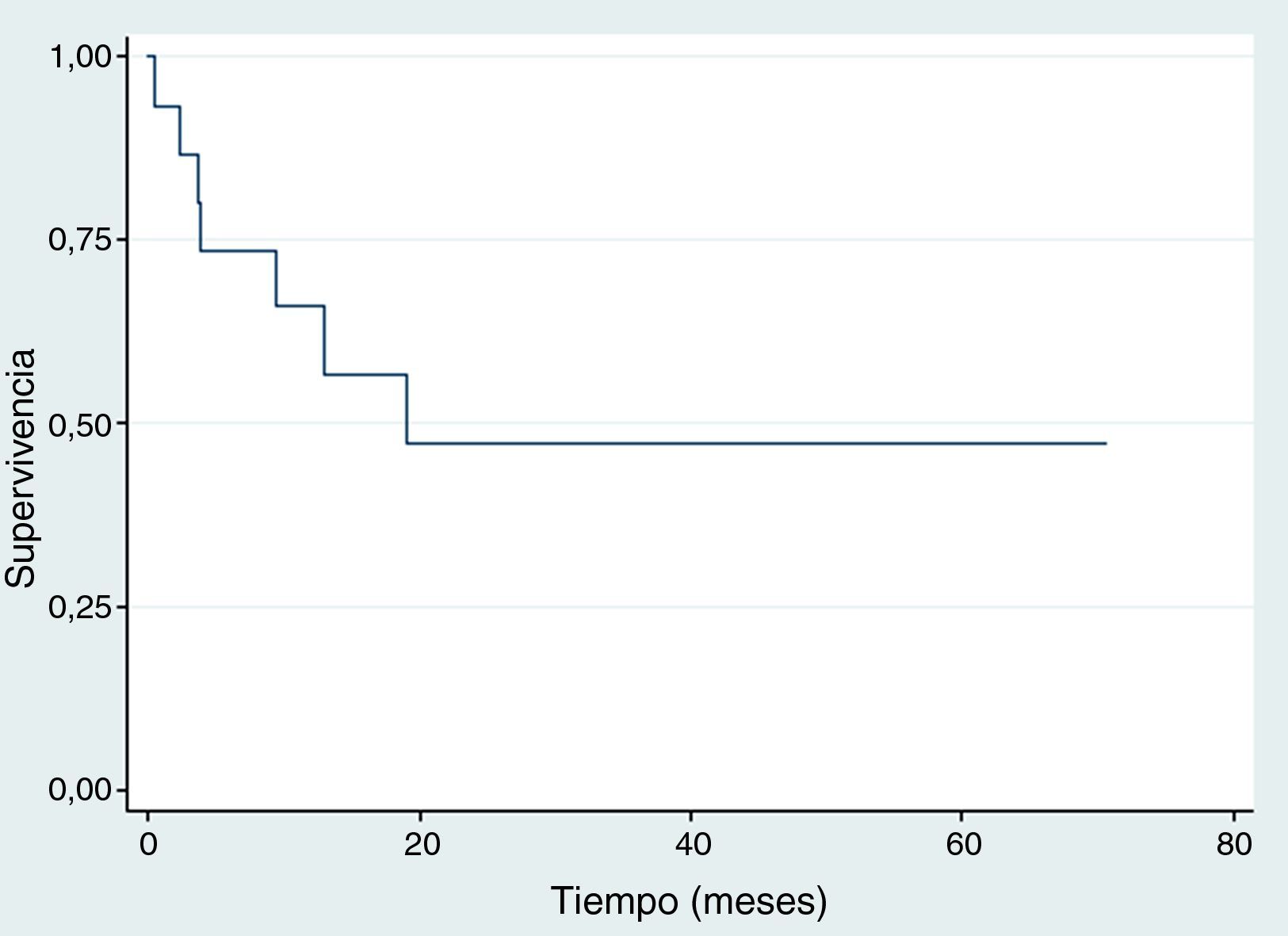
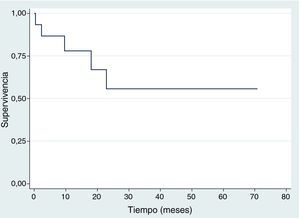
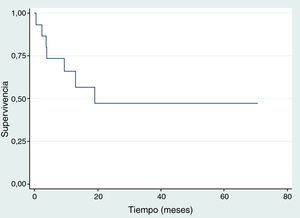
SupervivenciaDiez de los quince pacientes llevados a trasplante se encuentran vivos, ocho no tienen evidencia clínica ni paraclínica de la enfermedad hasta la fecha de censura; Dos pacientes fallecieron por toxicidad (choque séptico) durante los primeros 100 días postrasplante, uno por adenovirus y el otro por neumonía causada por Aeromonas hydrophila, una bacteria Gram negativa. Estos dos pacientes fallecieron entre 2001 y 2010. Durante 2001 y 2015 no se registró ninguna mortalidad relacionada al trasplante; en la figura 2 se muestra la supervivencia global. En cuanto a la supervivencia libre de evento (fig. 3), cinco pacientes presentaron recaída documentada entre el día 107 y el mes 19 postrasplante, de los cuales tres fallecieron intra institucionalmente y dos pacientes tuvieron pérdida del seguimiento y fueron censurados a la fecha del último control en la institución. En la tabla 3 se describen los desenlaces clínicos de los pacientes con neuroblastoma de alto riesgo y trasplante de células madre hematopoyéticas.
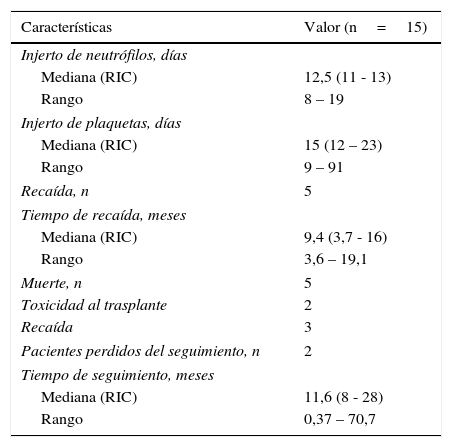
Desenlaces clínicos de los pacientes con neuroblastoma y trasplante de células madre hematopoyéticas en la Fundación Valle del Lili, 2001 – 2015
| Características | Valor (n=15) |
|---|---|
| Injerto de neutrófilos, días | |
| Mediana (RIC) | 12,5 (11 - 13) |
| Rango | 8 – 19 |
| Injerto de plaquetas, días | |
| Mediana (RIC) | 15 (12 – 23) |
| Rango | 9 – 91 |
| Recaída, n | 5 |
| Tiempo de recaída, meses | |
| Mediana (RIC) | 9,4 (3,7 - 16) |
| Rango | 3,6 – 19,1 |
| Muerte, n | 5 |
| Toxicidad al trasplante | 2 |
| Recaída | 3 |
| Pacientes perdidos del seguimiento, n | 2 |
| Tiempo de seguimiento, meses | |
| Mediana (RIC) | 11,6 (8 - 28) |
| Rango | 0,37 – 70,7 |
Con respecto a la fase de injerto, se observó que en el injerto de neutrófilos el primer evento se registro a los 8 días y el ultimo evento a los 19 días postrasplante, con un 92% de injerto entre los días 8 y 15. De manera muy similar en el injerto de plaquetas, el evento más temprano ocurrió al día 9; sin embargo el evento más tardío fue a los 91 días postrasplante, lo que podría indicar que tiene un comportamiento diferente e independiente al injerto de neutrófilos (tabla 3). El 92% de los pacientes injertaron plaquetas entre los 9 y 33 días postrasplante. Uno de los quince pacientes falleció a los 11 días postrasplante sin haberse documentado injerto de neutrófilos ni plaquetas.
Enfermedad veno-oclusiva hepaticaDurante el estudio se observó que 2/15 pacientes (13%), desarrollaron enfermedad veno-oclusiva hepática, los cuales habían recibido acondicionamiento con el protocolo BUMEL. En ambos casos hubo mejoría posterior a las medidas de soporte y tratamiento médico.
DiscusiónEn Colombia los estudios requeridos para la estadificación del riesgo son muy limitados, por lo que algunos autores han propuesto guías para una clasificación adaptada a países con economías emergentes en la que se excluyen parámetros limitantes como la determinación del NMYC o la realización de estudios citogenéticas para identificar la presencia de ploidias; los cuales son remplazados por métodos más sencillos y asequibles, como lo son la medición de LDH y ferritina al momento del diagnóstico12. En nuestra serie de casos se identificaron pacientes pediátricos con una distribución de edad 18 meses y 7 años (promedio 3±1,8) al momento del trasplante. La mayoría de los pacientes fueron diagnosticados intra-institucionalmente, y en menor proporción remitidos para trasplante. Por consiguiente no estuvo disponible para todos los pacientes los resultados de los estudios de estadificación inicial de NMYC, ferritina y LDH al momento del diagnóstico. Teniendo en cuenta la clasificación del INSS, 14 pacientes tenían neuroblastoma estadio IV y 1 estadio IIB con NMYC positivo considerándose de alto riesgo.
En este estudio 10/15 pacientes permanecen vivos, de los cuales ocho no tienen evidencia clínica y/o paraclínica de enfermedad hasta la fecha de censura. Con un seguimiento de 70 meses (5 años), la supervivencia global y libre de evento en nuestra población fue del 55% y 47% respectivamente. Cifra mayor a la reportada por Susan G Kreissman et al. en un estudio realizado en el Children's Hospital, Alemania, donde la supervivencia global y libre de evento fue del 50% y 36% respectivamente13; y semejantes con un estudio realizado por Gómez S et al., en el Hospital de Niños de la Plata, Argentina, donde la supervivencia global y libre de evento fue del 50% y 47% respectivamente14. Según una publicación del Hospital de Pediatría Garrahan de Buenos Aires, Argentina en el año 2014, la tasa de supervivencia libre de evento a los 3 años fue del 35%, y la supervivencia global a los 5 años fue del 25%15; resultados inferiores comparados con los de este estudio, donde la supervivencia libre de evento a 3 años fue del 47% y del 55% a los 5 años.
Los resultados de este estudio, al mismo tiempo son mayores a los reportados en un estudio por parte del instituto de investigación en cáncer, Gustave Roussy, en Francia, donde Proust-Houdemont y colaboradores realizaron un estudio de cohorte prospectiva durante 30 años, donde fueron incluidos 39 pacientes con diagnóstico de neuroblastoma de alto riesgo, y fueron llevados a trasplante autólogo de células madre hematopoyéticas posterior a un acondicionamiento BUMEL; donde la supervivencia global y libre de evento a 5 años fue del 40 y 35% respectivamente16. No obstante a pesar de que nuestros resultados son superiores o semejantes a los de estos estudios, no son resultados comparables.
La enfermedad veno-oclusiva hepática (VOD), también conocido como síndrome de obstrucción sinusoidal (SOS), es una patología la cual se desarrolla como consecuencia de la toxicidad relacionada al régimen de acondicionamiento, el cual se caracteriza por ictericia, retención de líquidos y hepatomegalia dolorosa durante los primeros 40 días postrasplante15. Durante el estudio se observó que 2/15 pacientes (13%) desarrollaron SOS, los cuales habían recibido acondicionamiento con BUMEL. Estos resultados son inferiores a los reportados por Proust-Houdemont y colaboradores, en el Instituto Gustave Roussy, Francia, donde la incidencia acumulada de SOS fue del 39%; y son resultados superiores a los reportados por Sandeep Soni, en el Nationwide Children's Hospital, Estados Unidos, donde la incidencia acumulada de SOS fue del 7%.
En este estudio, 2/15 pacientes tuvieron una mortalidad relacionada al trasplante en los primeros 100 días. Ambos pacientes fallecieron por choque séptico de etiología viral y bacteriana, con una incidencia acumulada del 13,3%. Estos resultados difieren a los reportados por un estudio realizado por Susan G Kreissman et al., en el Children's Hospital, Alemania, donde la mortalidad relacionada al trasplante fue del 3,3%13. Como también difieren de los resultados reportados por Gómez S et al., en el Hospital de Niños de la Plata, Argentina, donde la mortalidad relacionada al trasplante fue del 7,1%14. No obstante, nuestros resultados son inferiores a los reportados por Proust-Houdemont y colaboradores, en el Instituto Gustave Roussy, Francia, donde la mortalidad relacionada al trasplante fue del 20%, del cual un 62% fue por enfermedad veno-oclusiva hepática, 25% por sepsis y 12% por sangrado17. Como también son inferiores a los reportados por Cassiavillano et al., en el Hospital de Peditría Garrahan, Argentina, donde la mortalidad relacionada al trasplante fue del 25% asociado a infecciones oportunistas15. No obstante, cabe anotar que los dos pacientes que fallecieron por toxicidad al trasplante en nuestro estudio fueron trasplantados entre los años 2001-2010, por consiguiente en los últimos 4 años (2011-2015) la mortalidad relacionada al trasplante en nuestra institución tiene una tendencia a la disminución.
A pesar de que ha sido publicada la mejoría en la supervivencia libre de evento a 3 años utilizando regímenes de quimioterapia intensivo, combinado con altas dosis de terapia de diferenciación, hay algunos autores que ponen en discusión la utilización del trasplante autólogo de células madre hematopoyéticas como terapia de consolidación en neuroblastoma de alto riesgo, el estudio publicado por Park et al. muestra el efecto del trasplante autólogo mieloablativo en tándem con una supervivencia global y libre de evento a tres años de 73,8%y 61,8%, en nuestro caso la supervivencia a 3 años fue 55% y 47%, lo que sugiere un beneficio de mejoría de la supervivencia al utilizar el trasplante en tándem, opción terapéutica que aún no se ha implementado en nuestro centro18–20. No obstante esta sigue siendo terapia estándar hoy en día, en especial en países en desarrollo como el nuestro, donde no contamos con acceso a anticuerpos monoclonales12.
Cabe destacar la importancia del seguimiento a largo plazo de los pacientes, el cual juega un papel crucial en el desarrollo de estrategias y evaluación de resultados. Así como también la importancia de implementar y mejorar las técnicas para la estadificación del riesgo, la realización de NMYC, la capacitación de médicos patólogos en el área de neuroblastoma para realizar una clasificación patológica (INPC) en todos los pacientes, y finalmente la implementación del MIBG (metayodobenzilgunidina) para la valoración del estado de enfermedad y metástasis para el diagnóstico, estadificación y seguimiento de todos los pacientes.
LimitacionesLa búsqueda de información retrospectiva a partir de historias clínicas dificultó el acceso a alguna información. En 14 años se han implementado cambios en el acceso a recursos de diagnóstico y de seguimiento, la baja incidencia de la patología y la atención del pacientes por diferentes profesionales de diferentes instituciones donde se manejan historias clínicas independientes no nos permitió homogeneidad en algunos procedimientos.
El seguimiento de los pacientes con esta patologia debe ser de alrededor de 10 años. En el presente estudio se obtuvo un seguimiento de 5 años y en algunos pacientes solo de 1 o 2 años. Se requiere de un mayor tiempo de seguimiento para evaluar el impacto del trasplante de células madre hematopoyéticas sobre estos pacientes.
No hay estudios en América Latina que permitan comparar los resultados obtenidos. Se encontró literatura en países como Argentina, Estados Unidos y países europeos, donde los sistemas de salud y los avances en la tecnología no son comparables con los de nuestro medio. A pesar de ello, se puede afirmar que los resultados en este estudio son semejantes más no comparables a los resultados publicados en los países antes mencionados.
A pesar de las dificultades que se encontraron durante la realización de este estudio, los resultados permiten tener una visión de la incidencia, el manejo y el impacto de la patología implementado el trasplante de células madre hematopoyéticas como tratamiento de consolidación, el cual se ha venido implementado en Colombia.
Por lo anterior, podemos concluir que el trasplante autólogo de células madre hematopoyéticas es una alternativa factible como tratamiento en nuestro medio para pacientes con diagnóstico de neuroblastoma de alto riesgo, el cual ha contribuido a mejorar la supervivencia en este grupo de pacientes. Sin embargo, se requieren de más estudios para seguir evaluando la incidencia, el manejo y el tratamiento del neuroblastoma en nuestro país.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes
Conflicto de interesesTodos los autores declaran que no existe ningún tipo conflicto de intereses.